Содержание
1. Выведение ядов из
организма. Экскреторные системы организма. 3
2. Химико-токсикологический анализ биологических
объектов при отравлении цианидами. Их метаболиты.. 4
3. Изолирование, обнаружение и количественное
определение при отравлении соединениями мышьяка. Судебно-химическая оценка
результатов анализа. Токсикологическое значение. 8
4. Краткая характеристика «металлических ядов». 10
5. Методы расчета концентрации исследуемого
вещества при его анализе методом ГЖХ. Метод внутреннего стандарта. 15
Список литературы.. 18
1. Выведение
ядов из организма. Экскреторные системы организма
Форсированный диурез -
основан на использовании мочегонных средств (мочевина, маннитол,
лазикс, фуросемид) и др.
методов, которые способствуют повышенному выделению мочи. Метод используют при
большинстве интоксикации, когда выведение токсических веществ осуществляется преимущественно
почками.
Водная нагрузка
создается обильным питьем щелочных вод (до 3-5 л в сутки) в сочетании с
мочегонными средствами. Больным в коматозном состоянии или с выраженными
диспепсическими расстройствами делают подкожное или внутривенное введение
раствора хлористого натрия или раствора глюкозы. Противопоказания к проведению
водной нагрузки - острая сердечно-сосудистая недостаточность (отек легких) или
почечная недостаточность.
Алкалинизация
мочи создается внутривенным капельным введением раствора бикарбоната натрия до
1,5-2 л в
сутки под контролем определения щелочной реакции мочи и резервной щелочности
крови. При отсутствии диспепсических расстройств можно давать бикарбонат натрия
(питьевую соду) внутрь по 4-5 г
каждые 15 минут в течение часа, в дальнейшем по 2 г каждые 2 часа. Алкалинизация мочи является более активным диуретическим
средством, чем водная нагрузка, и широко применяется при острых отравлениях
барбитуратами, салицилатами, алкоголем и его
суррогатами. Противопоказания те же, что и при водной нагрузке.
Осмотический диурез
создается при помощи внутривенного введения осмотически
активных диуретических препаратов, значительно усиливающих процесс обратного
всасывания в почках, что позволяет добиться выделения с мочой значительного
количества яда, циркулирующего в крови. Наиболее известными препаратами этой
группы являются: гипертонический раствор глюкозы, раствор мочевины, маннитола.
Выделительная система
– экскреторная система – совокупность органов, выводящих из организма человека
избыток воды, конечные продукты обмена, соли, а также ядовитые вещества,
введённые в организм или образовавшиеся в нём.
В организме имеется
четыре органа для выведения конечных продуктов обмена. Кожа выделяет воду и
минеральные соли, легкие удаляют углекислый газ и воду, из кишечника
выбрасываются непереваренные остатки, а почки –
выделительный орган мочевой системы – удаляют в растворенном виде конечные
продукты белкового обмена (азотистые шлаки), токсины, минеральные соли и воду.
Мочевыделительная
система состоит из двух почек, мочеточников (по одному от каждой почки),
мочевого пузыря и мочеиспускательного канала. Почки расположены в поясничной
области, книзу от уровня самого нижнего ребра. В каждой почке имеется от одного
до четырех миллионов почечных канальцев, расположенных упорядоченным, но очень
сложным образом. В начале каждого канальца находится т.н. мальпигиево
тельце – расширенный участок канальца (капсула) с клубочком кровеносных
капилляров. У почек очень богатое кровоснабжение. Почечные канальцы выстланы
несколькими типами эпителиальных клеток. Высокое давление в капиллярах мальпигиевых телец обеспечивает профильтровывание
таких низкомолекулярных веществ, как вода, мочевая кислота, мочевина, некоторые
соли.
2. Химико-токсикологический
анализ биологических объектов при отравлении цианидами. Их метаболиты
Различают
неорганические цианиды (синильная кислота, цианиды натрия и калия, хлорциан,
бромциан и др.) и органические цианиды (эфиры цианмуравьиной
и циануксусной кислот, нитрилы и т.д.). Широко используются
в промышленности, в том числе фармацевтической, в сельском хозяйстве,
фотографии и пр. В организм цианиды проникают через органы дыхания,
пищеварения, редко через кожу.
Основные направления
химико-токсикологического анализа: Судебно-химическая экспертиза; Аналитическая
диагностика наркоманией и токсикоманий; Аналитическая диагностика острых
отравлений.
Химико-токсикологическое
исследование биологических проб позволяет: установить точный диагноз; провести
количественное определение яда в организме; помочь врачу в определении тактики
лечения; повлиять на выбор и дозировку антидота.
Для обнаружения
ядовитых веществ, выделенных из биологических объектов используют методы хроматографического скрининга и газожидкостную
хроматографию.
В специализированных
стационарах (отделения реанимации и интенсивной терапии) прежде всего оценивают
клинические признаки: наличие ингаляционной травмы (копоть в верхних
дыхательных путях, ожоги лица, осиплость голоса, опаленные волосы); признаки
нарушения функции дыхательной системы при невыраженном цианозе, неврологическая
симптоматика (заторможенность, угнетение сознания, клонико-тонические
судороги). Однако в условиях пожара при получении комбинированных травм,
включая возможные обширные ожоги, шок, специфические симптомы отравлениями цианидов
могут быть неманифестирующими. Лабораторная диагностика включает: определение концетрации цианидов в сыворотке крови
(при норме 0,03 мг/мл содержание их повышается от 0,11 до 2,79 мг/мл при
тяжелых отравлениях); карбоксигемоглобин (из-за высокой частоты сочетанных
отравлений на пожарах СО и цианидами, концентрация его может колебаться от 1,2
до 41,6% при норме 2,9%); уровень газов крови и сдвиг кислотно-основного состояния;
степень лактоацидоза. Описаны методики определения тиоцианатов крови. Важное значение имеет также определение
концентрации в сыворотке крови гормонов щитовидной железы.
Многие ксенобиотики,
попав в организм, подвергаются биотрансформации и
выделяются в виде метаболитов. В основе биотрансформации
по большей части лежат энзиматические преобразования
молекул. Биологический смысл явления - превращение химического вещества в
форму, удобную для выведения из организма, и тем самым, сокращение времени его
действия.
В ходе первой фазы
окислительно-восстановительного или гидролитического превращения молекула
вещества обогащается полярными функциональными группами, что делает ее
реакционно-способной и более растворимой в воде. Во второй фазе проходят
синтетические процессы конъюгации промежуточных продуктов метаболизма с
эндогенными молекулами, в результате чего образуются полярные соединения,
которые выводятся из организма с помощью специальных механизмов экскреции.
Разнообразие
каталитических свойств энзимов биотрансформации
и их низкая субстратная специфичность позволяет организму метаболизировать
вещества самого разного строения. Вместе с тем, у животных разных видов и
человека метаболизм ксенобиотиков проходит далеко не
одинаково, поскольку энзимы, участвующие в превращениях чужеродных веществ,
часто видоспецифичны.
Метаболизм многих ксенобиотиков сопровождается образованием продуктов
существенно уступающих по токсичности исходным веществам. Так, роданиды,
образующиеся в процессе биопревращения цианидов, в
несколько сот раз менее токсичны, чем исходные ксенобиотики. Гидролитическое
отщепление от молекул зарина, зомана, диизопропилфторфосфата
иона фтора, приводит к утрате этими веществами способности угнетать активность ацетилхолинэстеразы и существенному понижению их
токсичности. Процесс утраты токсикантом токсичности в
результате биотрансформации обозначается как
"метаболическая детоксикация".
В процессе метаболизма
других веществ образуются более токсичные соединения. Примером такого рода
превращений является, в частности, образование в организме фторуксусной кислоты
при интоксикации фторэтанолом.
Процесс образования
токсичных продуктов метаболизма называется "токсификация",
а продукты биотрансформации, обладающие высокой
токсичностью - токсичными метаболитами. Во многих случаях токсичный метаболит
является не стабильным продуктом, подвергающимся дальнейшим превращениям. В
этом случае он также называется промежуточным или реактивным метаболитом.
Реактивные метаболиты это как раз те вещества, которые часто и вызывают
повреждение биосистем на молекулярном уровне. Общим свойством практически всех
реактивных метаболитов является их электродефицитное
состояние, т.е. высокая электрофильность. Эти
вещества вступают во взаимодействие с богатыми электронами (нуклеофильными)
молекулами, повреждая их. К числу последних относятся макромолекулы клеток, в
структуру которых входят в большом количестве атомы кислорода, азота, серы.
Это, прежде всего, белки и нуклеиновые кислоты. Реактивные метаболиты либо
присоединяются к нуклеофильным молекулам, образуя с ними ковалентные связи,
либо вызывают их окисление. В обоих случаях структура макромолекул нарушается,
следовательно, нарушаются и их функции.
Биоактивация
далеко не всегда сопровождается повреждением биосубстрата,
поскольку одновременно в организме протекают процессы детоксикации
и репарации. Интенсивность этих процессов может быть достаточной для
компенсации ущерба, связанного с образованием реактивных метаболитов. Тем не
менее, при введении высоких доз токсиканта, повторном
воздействии защитные механизмы могут оказаться несостоятельными, что и приведет
к развитию токсического процесса[1].
3.
Изолирование, обнаружение и количественное определение при отравлении
соединениями мышьяка. Судебно-химическая оценка результатов анализа.
Токсикологическое значение
Мышьяк и его соединения (мышьяковистый
ангидрид, мышьяковистая кислота и её соли, мышьяковистый водород, сальварсан, осарсол, гербициды, парижская
зелень, пестициды) вызывают отравление, попадая в организм при
вдыхании, всасываясь из ЖКТ и с поверхности кожи. Отравление мышьяком может
быть острым или хроническим. В производственных условиях (химическая,
кожевенная, меховая промышленности; протравливание зерна, применение
пестицидов) наблюдают в основном хронические формы интоксикации, обычно в виде
сенсорных (реже смешанных) форм полиневропатий.
Клиническая картина:
1.
Острое отравление: артериальная гипотёнзия, повышение
проницаемости капилляров, мышечные спазмы, головокружение, гемолиз с развитием
гемоглобинурии, желтухи, гемолитической анемии, острой почечно-печёночной недостаточности
2.
При приёме внутрь - жжение в горле, металлический привкус во
рту, рвота (рвотные массы зеленоватого цвета), сильная боль в животе. Профузная диарея, напоминающий рисовый отвар, иногда с
кровью. Резкое обезвоживание организма с хлорпеническими
судорогами
3.
При ингаляции мышьяковистого водорода - спазм гортани, бронхоспазм, возможен отёк лёгких, метгемоглобинемия
(цианоз), очень быстро развивается тяжёлый гемолиз, острая почечно-печёночная
недостаточность (на 2-3 сут.)
4.
В тяжёлых случаях (паралитическая форма отравления) - сопор,
судороги, потеря сознания, паралич дыхания, кома, коллапс.
5. Хроническое отравление:
стойкое расширение капилляров, недомогание, повышенная утомляемость, анемия;
возможны энцефалопатия, периферические невриты с потерей чувствительности;
характерны жгучая боль, парестезии, реже слабость в конечностях, возможна
гипотрофия мелких мышц; гиперкератозы, выпадение волос; на ногтях пальцев рук и
ног появляются белые поперечные полосы (полоски Маеса); токсический гепатит. К мышьяку может развиться
толерантность.
Марша метод (J. Marsh, 1794-1846, англ. химик; синоним Марша - Либиха -
Берцелиуса метод) - метод обнаружения мышьяка, основанный на его восстановлении
свободным водородом до мышьяковистого водорода, наличие которого устанавливается
качественными реакциями; применяется в судебной медицине.
При восстановлении
растворимых в кислотах соединений мышьяка водородом в момент выделения
образуется смесь мышьяковистый водород с
водородом, например:
As2O3 + 6Zn + 6H2SO4
= 2AsH3 + 6ZnSO4 + 3H2O.
Если эту смесь
пропускать через стеклянную трубку, нагретую до 400—500°C мышьяковистый
водород разлагается на водород и мышьяк,
который образует на холодных частях трубки чёрный налёт с зеркальным блеском;
описанный способ служит для обнаружения мышьяка. Эту пробу разработал в 1836
английский химик Дж. Марш (J. Marsh, 1794—1846). Мышьяковистый
водород — один из наиболее токсичных
промышленных ядов. Отравления носят преимущественно острый характер, протекают
тяжело.
В судебно-медицинской
практике чаще встречаются отравления именно мышьяковистым ангидридом. Другие
соединения мышьяка тоже ядовиты в той или иной степени.
Выделяют две основных
формы отравления, которые могут приводить к смерти. Первая - паралитическая,
развивается при приеме больших доз соединений мышьяка.
В связи со сгущением
крови возникают тяжелые нарушения в сердечно-сосудистой системе и в центральной
нервной системе. Смерть наступает от сердечной недостаточности. В зависимости
от интенсивности развития интоксикации продолжительность жизни после
смертельного отравления может быть от нескольких часов до нескольких дней.
На вскрытии судебные
медики обнаруживают: отек и полнокровие головного мозга: отдельные
кровоизлияния в вещество мозга; в желудке отек и частичное разрушение слизистой
оболочки; в миокарде, почках и печени дистрофические нарушения. Возможны и
другие проявления токсического действия.
Большое значение имеют при таких
отравлениях судебно-химические исследования. Мышьяк обнаруживается в промывных
водах, рвотных массах, в крови, в моче, практически во всех внутренних органах.
Мышьяк длительное время сохраняется в тканях трупа и может быть обнаружен в них
спустя много лет. Особенно хорошо накапливается мышьяк в коже и ее производных
- волосах и ногтях. Его содержание в этих тканях обычно превышает концентрацию
во внутренних органах в десятки раз.
В практической
деятельности могут иметь место случаи отравления другими ядами, дающими сходную
с описанной выше картину. Дифференциация ядов этой группы легко может быть
осуществлена судебно-химическими исследования с использованием современной
аналитической техники[2].
4. Краткая
характеристика «металлических ядов»
Большинство
аналитических реакций недостаточно специфично и дает сходный эффект с
несколькими ионами. Поэтому в процессе анализа приходится прибегать к отделению
ионов друг от друга. Таким образом, открытие ионов проводится в определенной
последовательности. Последовательное разделение ионов и их открытие носит
название систематического хода анализа.
Систематический ход
анализа основан на том, что сначала с помощью групповых реактивов разделяют
смесь ионов на группы и подгруппы, а затем уже в пределах этих подгрупп
обнаруживают каждый ион характерными реакциями. Групповыми реагентами действуют
на смесь ионов последовательно и в строго определенном порядке.
В ряде случаев
прибегают не к систематическому разделению ионов, а к дробному методу анализа.
Этот метод основан на открытии ионов специфическими реакциями, проводимыми в
отдельных порциях исследуемого раствора. Так, например, ион Fe
2+ можно открыть при помощи реактива Кз[Fе(СN)6] в присутствии любых ионов.
Так как специфических
реакций немного, то в ряде случаев мешающее влияние посторонних ионов устраняют
маскирующими средствами. Например, ион Zn2+ можно открыть в присутствии Fe2+
при помощи реактива (NH4)2[Hg(SCN)4], связывая
мешающие ионы Fe2+ гидротартратом натрия в бесцветный
комплекс.
Дробный анализ имеет
ряд преимуществ перед систематическим ходом анализа: возможность обнаруживать
ионы в отдельных порциях в любой последовательности, а также экономия времени и
реактивов.
Но так как специфических реакций немного и мешающее влияние многих ионов нельзя
устранить маскирующими средствами, в случае присутствия в растворе многих
катионов из разных групп прибегают к систематическому ходу анализа, открывая
лишь некоторые ионы дробным методом.
Металлические
яды:
1.
Сурьма и ее соли.
Сурьма стабильна при
комнатной температуре, однако при нагревании ярко загорается, выделяя плотный
белый дым оксида сурьмы 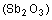 ,
обладающий запахом, сходным с запахом чеснока. Сурьма химически тесно связана с
мышьяком. Она легко образует сплавы с мышьяком, свинцом, оловом, цинком,
железом и висмутом.
,
обладающий запахом, сходным с запахом чеснока. Сурьма химически тесно связана с
мышьяком. Она легко образует сплавы с мышьяком, свинцом, оловом, цинком,
железом и висмутом.
Поскольку по своим
химическим и метаболическим свойствам сурьма сходна с мышьяком, а также эти два
элемента зачастую встречаются вместе, действие сурьмы может быть приписано
мышьяку, особенно у работников литейных цехов. Однако, эксперименты,
поставленные с использованием высокоочищенной металлической сурьмы, показали,
что этот металл обладает совершенно независимой токсикологией; разные авторы
отмечают среднюю летальную дозу между 10 и 11,2 мг/100 г.
2.
Стибин
Сурмянистый водород, SbH3,
бесцветный легковоспламеняющийся газ с неприятным запахом; tкип
-18 °С, tпл -88 °С; получают
действием атомарного водорода на соединения сурьмы или при действии кислот на
антимониды магния или цинка.
3.
Арсин.
Арсин и стибин представляют собой бесцветные, очень ядовитые газы с
чесночным (AsH3) или похожим на сероводородный (SbH3) запахом. Они довольно
хорошо растворимы в воде, но химически с ней не взаимодействуют. Характерные
для аммиака реакции присоединения не наблюдаются у арсина и стибина.
Оба они являются очень сильными восстановителями, например, при нагревании
легко разлагаются на элементы, а будучи подожжены на воздухе, сгорают с
образованием воды и соответствующих оксидов.
4. Мышьяк и
его соли.
Arsenicum,
As, химический элемент V группы периодической системы
Менделеева, атомный номер 33, атомная масса 74,9216; кристаллы серо-стального
цвета. Чистый мышьяк не ядовит, но все его соединения, растворимые в воде или
могущие перейти в раствор под действием желудочного сока, чрезвычайно ядовиты;
особенно опасен мышьяковистый водород.
Мышьяковистый водород
является одним из сильнейших неорганических ядов. Отравление им может иметь
место, в частности, при всех случаях получения больших количеств водорода
взаимодействием цинка или железа с кислотами, если исходные продукты содержат
примесь мышьяка (что бывает очень часто) и работа ведётся без соблюдения
достаточных мер предосторожности. Опасность усугубляется тем, что первые
признаки отравления (озноб, рвота и др.) проявляются обычно лишь спустя
несколько часов после вдыхания AsH3.
5.
Кадмий и его соли.
Cadmium
- химический элемент II группы периодической системы Д.И.Менделеева, атомный
номер 48, атомная масса 112.41, состоит из смеси 8 стабильных изотопов.
Серебристо-белый мягкий металл с синеватым отливом, ковкий, тягучий,
легкоплавкий (tплав. 321,1 = oС), плотность 8,65 г/см3 (что
позволяет отнести кадмий к тяжелым металлам). Химически подобен цинку, но менее
активен.
Кадмий - один из самых
токсичных тяжелых металлов и поэтому Российским СанПиНом
он отнесен ко 2-му классу опасности - "высокоопасные
вещества". Некоторые источники даже называют кадмий "наиболее опрасным экотоксикантом на рубеже
тысячелетий".
6.
Хром и его соли.
Chromium - химический элемент
VI группы периодической системы. Назван от греч. chrōma —
цвет, краска (из-за яркой окраски соединений). Голубовато-серебристый металл;
плотность 7,19 г/см3, tпл 1890°C. На воздухе не
окисляется. Главные минералы — хромшпинелиды.
Хром — обязательный компонент нержавеющих, кислотоупорных, жаростойких
сталей и большого числа других сплавов (нихромы, хромали, стеллит). Применяется
для хромирования. Соединения хрома — окислители, неорганические пигменты,
дубители.
7.
Ртуть и ее соли.
Hydrargyrum
- химический элемент II группы периодической системы. Серебристый жидкий
металл (отсюда латинское название; от греческого hýdōr —
вода и árgyros — серебро). Плотность при 20°C 13,546 г/см3
(тяжелее всех известных жидкостей), tпл –38,87°C,
tкип 356,58°C. Пары ртути при высокой
температуре и при электрическом разряде излучают голубовато-зелёный свет,
богатый ультрафиолетовыми лучами. Химически стойка. Основной минерал —
киноварь HgS; встречается также ртуть самородная.
Используется при изготовлении термометров, манометров, газоразрядных приборов,
в производстве хлора и гидроксида натрия (как катод).
Сплавы ртути с металлами — амальгамы. Ртуть и многие её соединения
ядовиты.
8.
Метилртуть.
Ртуть превращается в метилртуть в воде под действием микрофлоры; она липофильна и концентрируется в морских организмах.
Превращение в метилртуть может происходить также в
желудочно-кишечном тракте у человека.
Метилртуть переносится
эритроцитами (95%), небольшая часть поглощенного количества связывается белками
плазмы. Распределение метилртути по различным тканям
организма происходит достаточно медленно, и до достижения равновесия проходит
около четырех дней. Метилртуть концентрируется в центральной нервной системе,
особенно в сером веществе мозга. Около 10% груза ртути в организме обнаружено в
тканях мозга. Наиболее высокая концентрация ртути - в затылочной части коры и в
мозжечке. У беременных женщин метилртуть проходит
через плацентарный барьер в ткани эмбриона и избирательно откладывается в мозге
эмбриона[3].
9.
Свинец и его соли.
Plumbum – химический элемент
IV группы периодической системы. Синевато-серый металл, тяжёлый, мягкий,
ковкий; плотность 11,34 г/см3, tпл 327,5°C.
На воздухе покрывается оксидной плёнкой, стойкой к химическим воздействиям.
Используют для изготовления пластин для аккумуляторов (около 30% выплавляемого
свинца), оболочек электрических кабелей, защиты от гамма-излучения (стенки из
свинцовых кирпичей), как компонент типографских и антифрикционных сплавов,
полупроводниковых материалов.
10. Тетраэтилсвинец и другие
металлоорганические соединения тяжелых металлов[4].
Бесцветная,
маслянистая, летучая жидкость; имеет плотность 1,65 г/см3,
кипит при температуре 195 °С с разложением. Получают Т. при взаимодействии
хлористого этила C2H5Cl и сплава свинца с натрием PbNa (около 10% Na).
Отравления возможны
при получении тетраэтилсвинца
и этиловой жидкости, транспортировке и хранении этиловой жидкости и
этилированного бензина, ремонте и эксплуатации двигателей внутреннего сгорания.
Тетраэтилсвинец
проникает в организм через дыхательные пути, неповрежденную кожу,
желудочно-кишечный тракт. Выделяется из организма с мочой и калом. Депонируется
в паренхиматозных органах (печень, почки) и головном мозге. При остром
отравлении скрытый период — от нескольких часов до нескольких суток
5. Методы расчета концентрации исследуемого вещества при
его анализе методом ГЖХ. Метод внутреннего стандарта
Применение метода ГЖХ
для качественного определения лекарственных смесей является первым этапом
фармацевтического анализа.
Наибольшее применение
метод ГЖХ получил в количественном анализе лекарственных смесей жаропонижающего
действия. Методом ГЖХ были исследованы готовые лекарственные формы, содержащие
основания и соли органических оснований. Количественную оценку осуществляли по
способу внутреннего стандарта. Разработаны методики анализа следующих сложных
лекарственных форм: наружная жидкость меновазин, таблетки теофедрина
(эфедрин, фенобарбитал, парацетамол, кофеин,
теофиллин), а также одно- и двухкомпонентного состава: микронора
таблетки (норэтистерон), валидола таблетки, оксадола таблетки (нефопам), фезама капсулы (тирамем), стрепсилса таблетки, элдеприла
таблетки (селгин), кетотифена
сироп (сорбит).
ГЖХ становится одним
из основных контрольных методов в анализе аэрозольных лекарственных форм. Так,
разработана методика определения аэрозольного препарата каметон,
содержащего камфору, хлорбутанолгидрат
и ментол, на колонке с ПЭГ 20 М.
Внутренний стандарт - нафталин.
Известна методика
анализа аэрозольного препарата ингалипта, содержащего
ментол, камфору, метилсалицилат,
а также аэрозолей лиоксазоль (2-аллилоксиэтанол) и пропосол.
Метод ГЖХ успешно
используется в фармацевтическом анализе мазей, кремов и наружных жидкостей
(мазь бутадионовая, крем клотримазол).
Описано определение фенола, хлорксиленола и лидокаина в антисептических кремах на колонке с OV-225 в
условиях программирования температуры. Экстракцию веществ из крема осуществляли
с помощью диметилсульфоксида. Внутренние стандарты -
n-крезол, 4-хлорфенол и 2-аминофенилтиазол. Относительные ошибки определений не
превышали ±2%.
Благодаря высокой
чувствительности и специфичности метод ГЖХ включен во многие НД для определения
остаточных растворителей: метанола, этанола, пропанола,
изопропанола, циклогексана, бензола, ацетона, метиленхлорида (ампициллина
натриевая соль - субстанция, акмарина - субстанция, климадинона - таблетки и капли, рибофлавина - субстанция, оксадола - таблетки, клотримазола
- крем и др.).
В последние годы метод
ГЖХ используют при определении бензилового спирта,
входящего в состав многих лекарственных форм (модитен-депо
- инъекции, кеналог - крем, кандибене
- 1% крем, клотримазола - крем, омеза
- капсулы и др.). Даже по этим кратким сведениям о роли ГЖХ в современном
фармацевтическом анализе можно сделать вывод о необходимости более широкого
внедрения указанного метода в аналитическую практику, что будет способствовать
дальнейшему повышению качества лекарств[5].
Метод внутреннего
стандарта характеризуется отсутствием процедуры ввода вещества внутреннего
стандарта (ВС) в пробу. Как следствие, на основе предлагаемого метода можно
существенно упростить процедуру выполнения хроматографических
измерений по многим государственным и международным стандартам, предполагающим
использование ВС.
В хроматографии
довольно часто приходится иметь дело с анализом смесей, представляющих собой
одно основное вещество (растворитель) и сопутствующие примеси. Задача хроматографического анализа заключается в установлении
концентрации основного вещества и концентраций регламентируемых примесей.
Определение концентраций примесей проводят, по возможности, методом добавки
вещества ВС. Однако процедура введения ВС сопряжена с определенными
трудностями. Во-первых, необходимо быть заранее уверенным, что вещество,
вводимое в качестве ВС, не присутствует изначально в анализируемой смеси.
Во-вторых, регламентирующие документы предусматривают, чтобы количество
вводимой добавки было по порядку величины сравнимо с искомыми примесями. Но во
многих случаях концентрации определяемых примесей составляют тысячные и менее
доли процента.
Применение метода ВС
позволяет повысить метрологические параметры и существенно упростить процедуру хроматографических измерений, например, следующих
стандартов:
— ISO 6974-84
«Natural gas — Determination of hydrogen, inert gases and hydrocarbons up to C8
— Gas chromatographic method». В данном случае возможно отказаться от
применения многокомпонентных калибровочных смесей. Метан как ВС.
— ИСО, ASTM и ГОСТ. Определение примесей в капролактаме,
аноне, аноле, метаноле,
этаноле, водке, пропаноле и т.д.
— ГОСТ 2706.2-74 «Углеводороды ароматические бензольного
ряда. Хроматографический метод определения основного
вещества и примесей в бензоле, толуоле и ксилоле».
Список
литературы
1. Дементьева
Н. Газожидкостная хроматография на страже качества лекарств. //
Фармацевтический вестник. – 1998. - №19 (110). - 21-30 сентября
2. Домашний
Доктор. / Сост. В.Ф. Тулянкин, Т.И. Тулянкина. - АОЗТ «Паритет», 1997.
3. Корсаков
С.А. Судебная медицина (курс лекций). – М: Медицина, 2003.
4. Кузубова
Л.И., Шуваева О.В., Аношин Г.Н. Метилруть в
окружающей среде (распространение, образование в природе, методы определения).
- Новосибирск, 2000. – 82с.
5. Куценко С.А. Основы токсикологии. –
СПб.: Питер, 2004.
6. Швайков
М.Д.Токсикологическая химия. – М., 1975.
[1] Куценко С.А. Основы
токсикологии. – СПб.: Питер, 2004.
[2] Корсаков С.А. Судебная
медицина (курс лекций). – М: Медицина, 2003.
[3] Кузубова Л.И., Шуваева О.В., Аношин Г.Н. Метилруть
в окружающей среде (распространение, образование в природе, методы определения).
- Новосибирск, 2000. – 82с.
[4] Швайков М.Д.Токсикологическая химия. – М., 1975.
[5] Дементьева Н. Газожидкостная хроматография на страже
качества лекарств. // Фармацевтический вестник. – 1998. - №19 (110). - 21-30 сентября