Содержание
Введение............................................................................................................ 3
1. Характерные особенности механистической картины мира............. 4
2. Информация – как мера организованности системы.................................. 6
3. Квантовая теория и ее роль в развитии учения о
строении вещественной материи............................................................................................................................. 9
3.1.
Квантовая механика............................................................................... 9
3.2.
Квантовая статистика........................................................................... 11
3.3.
Квантовая теория поля........................................................................ 11
4. …… 6s2 6p1................................................................................................. 12
5. Донорно-акцепторная связь и механизм ее образования......................... 12
6. Отличие веществ в жидком и газообразном состоянии............................ 13
6.1.
Определение агрегатного состояния вещества................................... 13
6.2.
Жидкое состояние................................................................................ 13
6.3.
Газообразное состояние...................................................................... 14
Задание 71. Двухосновные предельные карбоновые
кислоты, общая характеристика, способы получения............................................................... 15
Свойства
моносахаридов........................................................................... 20
7. Основные принципы функционирования биосферы:
целостность, гармония, закон бережливости.................................................................................................... 24
7.1.
Целостность биосферы........................................................................ 24
7.2.
Гармония биосферы............................................................................ 25
7.3.
Закон бережливости биосферы........................................................... 26
Заключение..................................................................................................... 30
Литература...................................................................................................... 31
Введение
Обусловленная современным
развитием методологической рефлексии проблема рациональности стала
предметом пристального внимания
многих философов.
Каждая эпоха предъявляет
к знаниям и
формам познания свои требования научности, которые выступают
по отношению к знанию двояко:
как социокультурные
(внешние) и логико-гносеологические (внутренние) требования.
В ХVII-XIX веках - эта
эпоха становления науки
в буквальном смысле этого слова.
Проблема возникновения науки - проблема дискуссионная.
По крайней мере, можно выделить две точки зрения по данному
вопросу: одни считают, что наука
возникла с возникновением самой философии,
если еще не раньше, т.е. формирование пифагорейской
школы в V - IV вв. до н.э.
- это начало возникновения
подлинных научных знаний.
Именно ту точку зрения
можно найти в учебно-методической литературе.
Альтернативная точка зрения предполагает рассматривать
науку как явление
более позднего периода развития цивилизации.
Многие цивилизации, вплоть
до Нового времени,
обходились без научных знаний
и не нуждались
в них. Невостребованность элементов зарождающегося научного
знания в античный
период есть результат неразвитости материального
производства, но удовлетворенности
производством и применением вненаучного знания.
Можно сказать, что,
безусловно, зачатки научных знаний начали возникать в высоко
развитых в культурном отношении странах: Вавилонии, Греции, Китае, Индии.
В рамках каждой исторической эпохи,
с учетом уровня
культурного развития, вырабатываются
конкретно - исторические
формы познания мира,
общества.
1. Характерные
особенности механистической картины мира
К совершенству стремились в XVII-XIX веках именно
частные науки, которые только-только начинали обретать
статус самостоятельности и науки.
Это был период прорыва
их к новым
горизонтам истин. Классическая механика выработала иные представления о
мире, материи, пространстве
и времени, движении и развитии,
отмеченные от прежних
и создала новые
категории мышления - вещь, свойство,
отношение, элемент, часть,
целое, причина, следствие,
система - сквозь призму которых сама
стала смотреть на
мир, описывать и объяснять его.
Новые представления об устройстве мира привели к созданию и Новой Картины мира -
механистической, в основе
которой лежали представления о
вселенной как замкнутой системе,
уподобляемой механическим часам,
которые состоят из незаменимых,
подчиненных друг другу элементов,
ход которых строго
подчиняется законам классической
механики.
Законам механики
подчиняются все и
вся, входящие в
состав вселенной, а, следовательно, законам
этим приписываются универсальность. Как
и в механических часах, в
которых ход одного
элемента строго подчинен
ходу другого, так и во вселенной,
согласно механистической картине
мира, все процессы и
явления строго причинно
связаны между собой
нет места случайности и все
предопределено.
В механистической
картине мира задаются
мировоззренческие ориентации и методологические принципы познания. Механицизм,
детерминизм, редукционизм образуют систему
принципов, регулирующих исследовательскую деятельность человека[1].
Открывая законы, описывающие
природные явления и
процессы, человек противопоставляет себя природе, возвышает себя
до уровня хозяина природы. Так человек ставит свою
деятельность на научную основу,
ибо он, исходя из механистической
картины мира, уверился в возможность
с помощью научного мышления
выявить универсальные законы
функционирования мира.
Эта деятельность оформляется в рационалистическую. Безусловно,
предполагается, что такая деятельность целиком должна основываться на
целевых установках, принципах,
нормах, методах познания объекта.
Поступки (научные)
и действия исследователя,
основанные на предписаниях методического
характера обретают черты устойчивого
образа деятельности.
В
рассматриваемый период исследовательская деятельность
в астрономии, механике,
физике была достаточно
рационализирована, а сами эти науки занимали лидирующее место
в естествознании.
Физика как наиболее разработанная область естествоиспытания, задавала
фон для развития других отраслей науки. Последние же
тяготели к рационально-методологическим принципам и
понятиям физики, механики. Как это
на самом деле происходило можно
проследить на историко-научном материале
биологии XVII - начало XIX вв. - то период господства механической картины
мира.
Законы механики рассматриваются как
универсальные и единые
для всех отраслей естествознания. Эмпирические факты
биологии, являющиеся фиксацией наблюдаемых в
периоде единичных явлений,
редуцируются к механическим закономерностям,
Иными словами, способ
формирования фактов в
биологии строится на механистических представлениях о мире. Например,
такие факты, как: "Птица,
которую потребность влечет к воде,
чтобы найти здесь
себе жизненное пропитание, раздвигает пальцы на ногах, готовясь грести
и плыть по водной
поверхности"; "Кожа, соединяющая пальцы при основании,
привыкает растягиваться
благодаря этим беспрестанно повторяющимся раздвиганиям пальцев.
Так, со временем образовались те широкие перепонки между
пальцами уток, грей, какие
видим сейчас", целиком
детерминированы идеями механистического детерминизма.
Это однозначно видно
из интерпретации указанных
фактов. "Частое пользование органом,
обратившееся в привычку, увеличивает способность того
органа, развивает его самого и
сообщает ему размеры и силу
действия";
"Неупотребление органа, сделавшееся
постоянным вследствие усвоенных привычек, постепенно ослабляет этот
орган и,
в конце концов, приводит
его к исчезновению
и даже к
полному уничтожению".
Механистический подход к
системе адаптации "животный организм - окружающая среда" дает
соответствующий эмпирический материал.
2. Информация – как мера организованности системы
Классическая термодинамика занималась только консервативными
(изолированными) системами. В таких системах при самопроизвольных процессах
энтропия увеличивается до тех пор, пока не достигнет максимального значения в
состоянии равновесия.
Неравновесная термодинамика, сформированная в середине XX
века учеными: Пригожин и Хакен. Аппарат классической термодинамики – линейные
уравнения, дающие всего одно решение. Аппарат неравновесной термодинамики – это
нелинейные уравнения, которые дают несколько альтернативных решений, потому что
неравновесная термодинамика описывает реальные процессы в природе, живых
организмах, социальном обществе. Открытые системы стремятся к большей
организованности, так как энтропия у них не увеличивается. Чем больше
информации поступает в систему, тем система более организована, и тем меньше её
энтропия. 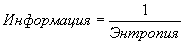 (Шеннон)
(Шеннон)
Информация – это мера организованности системы. Фотокатод
ЭЛТ (Электронно-Лучевой Трубки) телевизора содержит примерно 106
микрофотоэлементов – это число микросостояний. Белый шум – помехи на экране при
отсутствии сигнала из телецентра – это увеличение хаотического теплового
движения элементов, и энтропия максимальна, это состояние хаоса. При
поступлении сигнала (информации) энтропия резко уменьшается, а информация
увеличивается.
Кибернетика (Роберт Винер) – связана с управлением открытыми
системами, но только теми, у которых есть обратная связь. Положительная
обратная связь – поведение системы усиливает внешние воздействия (например,
лавина). Отрицательная связь – это поведение системы, при котором внешние
воздействия ослабляются. Такая связь стабилизирует процессы в системе
(холодильник, термостат и все современные информационные устройства).
Гомеостатическая связь – когда внешнее воздействие сводится системой к нулю
(Гомеостаз – поддержание постоянной температуры тела).
Роберт Винер в 50-60-х гг. определил кибернетику как науку
об управлении связей в машинах и биологических системах. Поведение открытых
систем с обратной связью описывается как организованное целенаправленное
поведение, которое приводит к уменьшению энтропии. К 60-м годам выяснилось, что
для реальных систем мало учитывать эффективное управление системой, а нужно
учитывать самоорганизацию системы, то есть, необходимо было найти связь между
эффективным управлением системой и спецификой развития реальной системы.
В основном рассматриваются биологические и социальные
системы. Теорию самоорганизации разработали на основе неравновесной
термодинамики Пригожин и Хакен. Самоорганизация – это коллективное
взаимодействие частиц в открытой системе, которое в дальнейшем может привести к
возникновению нового порядка в расположении этих частиц в системе.
Самоорганизация наблюдается в открытых реальных системах с большим коллективом
частиц (эволюция вселенной, деление клеток, функционирование мозга, образование
речи и языков, формирование общественного мнения, естественный отбор). Система
является самоорганизующейся, если:
Это большой коллектив частиц.
Система является открытой.
Она находится далеко от точки равновесия, следовательно,
энтропия системы не является максимальной.
Синергетика – наука, изучающая самоорганизующиеся системы
(Пригожин, Хакен). Объект изучения – открытые реальные системы. Она изучает
механизм образования, развития и разрушения самоорганизующихся систем. Этот
механизм связан с коллективными явлениями, которые способствуют развитию
системы. В системе устанавливается новый порядок.
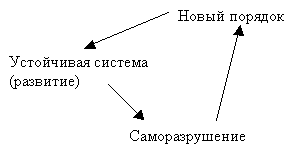

Такой порядок самоорганизации наблюдается у всех открытых
самоорганизующихся систем. Новый порядок связан с появлением и накоплением
флуктуаций в системе. В дальнейшем они нарастают и способствуют появлению хаоса
в системе. Флуктуации ведут к возрастанию энтропии. Новый порядок всегда
восстанавливается через хаос. Флуктуации расшатывают систему, она становится
неустойчивой, и любое незначительное воздействие толкнет ее к саморазрушению, а
дальше – к выбору пути. Любая революция есть выбор пути социальной системы.
Система приходит к так называемой точки бифуркации (выбора), где существует
несколько альтернатив дальнейшего развития.
Бифуркация – выбор системой дальнейшего пути развития из
нескольких альтернативных решений. Такой выбор может пойти и в сторону хаоса и
в сторону организации. После выбора нового порядка система приходит в
устойчивое состояние, которое называется аттрактор.
Классическая равновесная термодинамика даёт обратимость во
времени, даёт единственный путь развития замкнутой системы: система приходит в
равновесие. Неравновесная термодинамика даёт несколько нелинейных уравнений,
которые приводят к нескольким решениям. В неравновесной термодинамике
случайность и вероятность становятся объективными свойствами системы.
Синергетика даёт новый образ развития мира: мир открытый, он
развивается по нелинейным законам, поэтому в таких системах могут быть самые
неожиданные, непредсказуемые повороты системы, связанные с дальнейшим выбором
ее развития.
Вселенная является самоорганизующейся системой и развивается
по законам синергетики:
Она – сложная система, состоящая из большого коллектива
частиц.
Все время происходит эволюция системы, то есть, в ней образуются
и распадаются крупномасштабные структуры. Это говорит о том, что вселенная
находится далеко от равновесия.
3. Квантовая теория и ее роль в развитии учения о
строении вещественной материи
Квантовая теория объединяет квантовую механику, квантовую
статистику и квантовую теорию поля.
3.1. Квантовая механика
Квантовая механика (волновая механика), теория,
устанавливающая способ описания и законы движения микрочастиц в заданных
внешних полях; один из основных разделов квантовой теории. Квантовая механика впервые
позволила описать структуру атомов и понять их спектры, установить природу
химической связи, объяснить периодическую систему элементов и т. д.
Т. к. свойства макроскопических тел определяются движением и
взаимодействием образующих их частиц, законы квантовой механики лежат в основе
понимания большинства макроскопических явлений. Так, квантовая механика
позволила понять многие свойства твердых тел, объяснить явления
сверхпроводимости, ферромагнетизма, сверхтекучести и многое др.;
квантовомеханические законы лежат в основе ядерной энергетики, квантовой
электроники и т. д.
В отличие от классической теории, все частицы выступают в
квантовой механике как носители и корпускулярных, и волновых свойств, которые
не исключают, а дополняют друг друга. Волновая природа электронов, протонов и
других «частиц» подтверждена опытами по дифракции частиц.
Корпускулярно-волновой дуализм материи потребовал нового
подхода к описанию состояния физических систем и их изменения со временем.
Состояние квантовой системы описывается волновой функцией, квадрат модуля
которой определяет вероятность данного состояния и, следовательно, вероятности
для значений физических величин, его характеризующих; из квантовой механики
вытекает, что не все физические величины могут одновременно иметь точные
значения (см. Неопределенности принцип). Волновая функция подчиняется
суперпозиции принципу, что и объясняет, в частности, дифракцию частиц.
Отличительная черта квантовой теории — дискретность
возможных значений для ряда физических величин: энергии электронов в атомах,
момента количества движения и его проекции на произвольное направление и т. д.;
в классической теории все эти величины могут изменяться лишь непрерывно[2].
Фундаментальную роль в квантовой механике играет Планка
постоянная ћ — один из основных масштабов природы, разграничивающий области
явлений, которые можно описывать классической физикой (в этих случаях можно
считать j=0), от областей, для правильного истолкования которых необходима
квантовая теория. Нерелятивистская (относящаяся к малым скоростям движения
частиц по сравнению со скоростью света) квантовая механика — законченная,
логически непротиворечивая теория, полностью согласующаяся с опытом для того
круга явлений и процессов, в которых не происходит рождения, уничтожения или
взаимопревращения частиц.
3.2. Квантовая статистика
Квантовая статистика, статистическая физика квантовых
систем, состоящих из большого числа частиц; для частиц с целым спином это —Бозе
Эйнштейна статистика, с полуцелым — —Ферми Дирака статистика[3].
3.3. Квантовая теория поля
Квантовая теория поля (полей) (КТП), область современной
физики, описывающая основные свойства и процессы взаимодействия элементарных
частиц, из которых построены все физические объекты мира.
Основные положения этой теории были сформулированы в
середине 20 в.
В ней произошло объединение релятивистских представлений,
развитых А. Эйнштейном в теории относительности, и квантовых идей, появившихся
в физике с рождением теории атома, созданной Н. Бором, В. Гейзенбергом, Э.
Шредингером и П. Дираком в 20-х годах прошлого века.
В основе КТП лежит представление о существовании
элементарных частиц, свойства которых описываются теорией относительности, и
которые в физических процессах, происходящих в микромире, рождаются и
уничтожаются как целое, при этом величины их физических характеристик строго
фиксированы, квантованы[4].
4. …… 6s2 6p1
Таллий 6s26p1
5. Донорно-акцепторная связь и механизм ее
образования
Донорно-акцепторная связь, координационная связь, термин,
обозначающий один из способов образования химической ковалентной связи. Обычная
ковалентная связь между двумя атомами обусловлена взаимодействием двух
электронов — по одному от каждого атома. Донорно-акцепторная связь
осуществляется за счёт пары электронов одного атома (донора) и свободной
(незаполненной) орбитали другого (акцептора). Схематически это различие можно
выразить так[5]:

В обоих случаях электроны становятся общими для двух атомов.
Типичным примером является образование иона аммония при реакции аммиака с ионом
водорода (протоном):
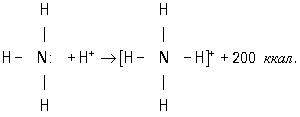
В молекуле аммиака азот имеет неподелённую пару электронов,
у иона водорода 1s-орбиталь свободна. При достаточном сближении молекулы NH3 и
иона Н+ двухэлектронное облако азота попадает в сферу притяжения иона водорода
и становится общим и для атома азота, и для атома водорода, т. е. возникает четвёртая
ковалентная связь N — Н. Все связи N — Н в этом ионе становятся равноценными и
неразличимыми. Ещё один важный пример — образование иона оксония:
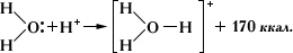
В данном случае молекула воды — донор, протон — акцептор.
Этот способ образования ковалентной связи играет большую
роль в химии комплексных соединений.
6. Отличие веществ в жидком и газообразном
состоянии
6.1. Определение агрегатного состояния вещества
Агрегатные состояния вещества, состояния (фазы) одного и
того же вещества (напр., воды, железа, серы), переходы между которыми
сопровождаются скачкообразным изменением ряда физических свойств (плотности,
энтропии и др.).
Обычно рассматривают газообразное, жидкое и твердое
агрегатные состояния (иногда еще плазменное). Существование у вещества
нескольких агрегатных состояний обусловлено различиями в тепловом движении его
молекул (атомов) и в их взаимодействии[6].
6.2. Жидкое состояние
Жидкость, агрегатное состояние вещества, сочетающее в себе
черты твердого состояния (сохранение объема, определенная прочность на разрыв)
и газообразного (изменчивость формы).
Для жидкости характерны ближний порядок в расположении
частиц (молекул, атомов) и малое различие в кинетической энергии теплового
движения молекул и их потенциальной энергии взаимодействия.
Тепловое движение молекул жидкости состоит из колебаний
около положений равновесия и сравнительно редких перескоков из одного
равновесного положения в другое, с этим связана текучесть жидкости.
6.3. Газообразное состояние
Газ (франц. gaz, от греч. chaos — хаос), агрегатное
состояние вещества, в котором составляющие его атомы и молекулы почти свободно
и хаотически движутся в промежутках между столкновениями, во время которых
происходит резкое изменение характера их движения.
Газообразное состояние вещества является самым
распространенным состоянием вещества Вселенной. Солнце, звезды, облака
межзвездного вещества, туманности, атмосферы планет и т. д. состоят из газов,
или нейтральных, или ионизованных (плазмы). Газы широко распространены в
природе: они образуют атмосферу Земли, в значительных количествах содержатся в
твердых земных породах, растворены в воде океанов, морей и рек. Встречающиеся в
природных условиях газы представляют собой, как правило, смеси химически
индивидуальных газов[7].
Газы равномерно заполняют доступное для них пространство, и
в отличие от жидкостей и твердых тел, не образуют свободной поверхности. Они
оказывают давление на ограничивающую заполняемое ими пространство оболочку.
Плотность газов при нормальном давлении на насколько порядков меньше плотности
жидкостей. В отличие от твердых тел и жидкостей, объем газов существенно
зависит от давления и температуры.
Задание 71. Двухосновные предельные карбоновые
кислоты, общая характеристика, способы получения
Карбоновыми кислотами
называются соединения, содержащие карбоксильную группу
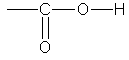
Классификация.
По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, или
одноосновные (одна группа -СООН), дикарбоновые, или двухосновные (две группы
-СООН) и т.д. В зависимости от строения углеводородного радикала, с которым
связана карбоксильная группа, карбоновые кислоты бывают алифатическими
(например, уксусная или акриловая), алициклическими (например,
циклогексанкарбоновая) или ароматическими (бензойная, фталевая). В таблице
указаны некоторые представители карбоновых кислот.
|
Формула
|
Систематическое
Название
|
Тривиальное
Название
|
|
Монокарбоновые кислоты
|
|
HCOOH
|
метановая
|
муравьиная
|
|
CH3COOH
|
этановая
|
уксусная
|
|
C2H5COOH
|
пропановая
|
пропионовая
|
|
C6H5COOH
|
бензойная
|
-
|
|
CH3(CH2)16COOH
|
октадециловая
|
стеариновая
|
|
CH2=CH-COOH
|
пропеновая
|
акриловая
|
|
Дикарбоновые кислоты
|
|
HOOC-COOH
|
этандиовая
|
щавелевая
|
|
HOOC-CH2-COOH
|
пропандиовая
|
малоновая
|
|
HOOC-CH2CH2-COOH
|
бутандиовая
|
янтарная
|
|
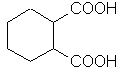
|
бензол-1,2-
дикарбоновая
|
фталевая
|
|

|
бензол-1,4-
дикарбоновая
|
терефталевая
|
Если в углеводородном радикале карбоновых кислот атом
(атомы) водорода замещен на другие функциональные группы, то такие кислоты
называются гетерофункционапьными. Среди них различают галогенкарбоновые
(например, CH2Cl—COOH), нитрокислоты (например, NO2—С6Н4СООН),
аминокислоты, оксикислоты (например, молочная СН3—СН(ОН)—СООН) и др.
Карбоновые кислоты с числом атомов углерода выше 6 называют
высшими (жирными) кислотами. Название "жирные"
эти кислоты получили потому, что большинство из них могут быть выделены из
жиров.
1. Окисление альдегидов и первичных спиртов — общий способ
получения карбоновых кислот. В качестве окислителей применяются KМnО4
и K2Сr2О7.
|
|
[O]
|
|
[O]
|
|
|
R-CH2-OH
|
→
|
R-CH=O
|
→
|
R-CO-OH
|
|
спирт
|
альдегид
|
кислота
|
2. Другой
общий способ — гидролиз галогензамещенных углеводородов, содержащих, три атома
галогена у одного атома углерода. При этом образуются спирты, содержащие группы
ОН у одного атома углерода — такие спирты неустойчивы и отщепляют воду с
образованием карбоновой кислоты:
|
|
ЗNаОН
|
|
|
|
|
R-CCl3
|
→
|
[R-C(OH)3]
|
→
|
R-COOH + Н2О
|
|
|
-3NaCl
|
|
|
|
3. Получение
карбоновых кислот из цианидов (нитрилов) — это важный способ, позволяющий
наращивать углеродную цепь при получении исходного цианида. Дополнительный атом
углерода вводят в состав молекулы, используя реакцию замещения галогена в
молекуле галогенуглеводорода цианидом натрия, например:
СН3-Вr + NaCN → CH3 - CN + NaBr.
Образующийся нитрил уксусной кислоты (метилцианид) при
нагревании легко гидролизуется с образованием ацетата аммония:
CH3CN + 2Н2О → CH3COONH4.
При подкислении раствора выделяется кислота:
CH3COONH4 + HCl → СН3СООН
+ NH4Cl.
4.
Использование реактива Гриньяра
по схеме:
Н2О
R-MgBr + СО2 → R-COO-MgBr → R-COOH + Mg(OH)Br
5. Гидролиз
сложных эфиров:
R-COOR1 + КОН → R-COOK + R'OH ,
R-COOK +
HCl → R-COOH + KCl .
6. Гидролиз ангидридов
кислот:
(RCO)2O + Н2О → 2RCOOH.
7. Для
отдельных кислот существуют специфические способы получения.
Муравьиную кислоту получают нагреванием оксида углерода (II)
с порошкообразным гидроксидом натрия под давлением и обработкой полученного
формиата натрия сильной кислотой:
|
|
200 °С, Р
|
|
H2SO4
|
|
|
NaOH + СО
|
→
|
HCOONa
|
→
|
НСООН
|
Уксусную кислоту получают каталитическим окислением
бутана кислородом воздуха:
2С4Н10 + 5O2 →
4СН3СООН + 2Н2О.
Для получения бензойной кислоты можно использовать окисление
монозамешенных гомологов бензола кислым раствором перманганата калия:
5С6Н5-СН3 + 6KMnO4
+ 9H2SO4 = 5С6Н5СООН + 3K2SO4
+ 6MnSO4 + 14H2O.
Кроме того, бензойную кислоту можно получить из
бензальдегида с помощью реакции Канниццаро. В этой реакции бензальдегид обрабатывают
40—60%-ным раствором гидроксида натрия при комнатной температуре. Одновременное
окисление и восстановление приводит к образованию бензойной кислоты и
соответственно фенилметанола (бензилового спирта).
Химические свойства.
Карбоновые кислоты — более сильные кислоты, чем спирты, поскольку атом водорода
в карбоксильной группе обладает повышенной подвижностью благодаря влиянию
группы СО. В водном растворе карбоновые кислоты диссоциируют:
RCOOH  RCOO-
+ Н+
RCOO-
+ Н+
Тем не менее из-за ковалентного характера молекул карбоновых
кислот указанное выше равновесие диссоциации достаточно сильно сдвинуто влево.
Таким образом, карбоновые кислоты — это, как правило, слабые кислоты. Например,
этановая (уксусная) кислота характеризуется константой диссоциации Ка
= 1,7*10-5.
Заместители, присутствующие в молекуле карбоновой кислоты,
сильно влияют на ее кислотность вследствие оказываемого ими индуктивного
эффекта. Такие заместители, как хлор или фенильный радикал оттягивают на себя
электронную плотность и, следовательно, вызывают отрицательный индуктивный
эффект (-/). Оттягивание электронной плотности от карбоксильного атома водорода
приводит к повышению кислотности карбоновой кислоты. В отличие от этого такие
заместители, как алкильные группы, обладают электронодонорными свойствами и
создают положительный индуктивный эффект, +I. Они понижают кислотность. Влияние
заместителей на кислотность карбоновых кислот наглядно проявляется в значениях
констант диссоциации Ka для ряда кислот. Кроме того, на силу кислоты
оказывает влияние наличие сопряженной кратной связи.
|
Карбоновые
кислоты
Формула
Ka
|
|
Пропионовая
CH3CH2COOH
1,3*10-5
|
|
Масляная
CH3CH2CH2COOH
1,5*10-5
|
|
Уксусная
CH3COOH
1,7*10-5
|
|
Кротоновая
CH3-CH=CH-COOH
2,0*10-5
|
|
Винилуксусная
CH2=CH-CH2COOH
3,8*10-5
|
|
Акриловая
CH2=CH-COOH
5,6*10-5
|
|
Муравьиная
HCOOH
6,1*10-4
|
|
Бензойная
C6H5COOH
1,4*10-4
|
|
Хлоруксусная
CH2ClCOOH
2,2*10-3
|
|
Тетроновая
CH3-C≡C-COOH
1,3*10-3
|
|
Дихлоруксусная
CHCl2COOH
5,6*10-2
|
|
Щавелевая
HOOC-COOH
5,9*10-2
|
|
Трихлоруксусная
CCl3COOH
2,2*10-1
|
Взаимное влияние атомов в молекулах дикарбоновых кислот
приводит к тому, что они являются более сильными, чем одноосновные.
Образование солей. Карбоновые кислоты обладают всеми
свойствами обычных кислот. Они реагируют с активными металлами, основными
оксидами, основаниями и солями слабых кислот:
2RCOOH + Мg → (RCOO)2Mg + Н2,
2RCOOH + СаО → (RCOO)2Ca + Н2О,
RCOOH + NaOH → RCOONa + Н2О,
RCOOH + NaHCO3→ RCOONa + Н2О +
СО2↑.
Карбоновые кислоты — слабые, поэтому сильные минеральные
кислоты вытесняют их из соответствующих солей:
CH3COONa + HCl → СН3СООН + NaCl.
Соли карбоновых кислот в водных растворах гидролизованы:
СН3СООК + Н2О  СН3СООН
+ КОН.
СН3СООН
+ КОН.
Отличие карбоновых кислот от минеральных заключается в
возможности образования ряда функциональных производных.
Образование функциональных производных карбоновых кислот.
При замещении группы ОН в карбоновых кислотах различными группами (X)
образуются функциональные производные кислот, имеющие общую формулу R—СО—X;
здесь R означает алкильную либо арильную
группу. Хотя нитрилы имеют другую общую формулу (R—CN),
обычно их также рассматривают как производные карбоновых кислот, поскольку они
могут быть получены из этих кислот.
Свойства моносахаридов
Физические свойства.
Моносахариды – твердые вещества, легко растворимые в воде, плохо – в
спирте и совсем нерастворимые в эфире. Водные растворы имеют нейтральную
реакцию на лакмус. Большинство моносахаридов обладают сладким вкусом, однако
меньшим, чем свекловичный сахар.
Химические свойства.
Моносахариды проявляют свойства спиртов и карбонильных соединений.
I. Реакции по карбонильной группе
1. Окисление.
a) Как и у всех альдегидов, окисление моносахаридов приводит
к соответствующим кислотам. Так, при окислении глюкозы аммиачным раствором
гидрата окиси серебра образуется глюконовая кислота (реакция "серебряного
зеркала").
|
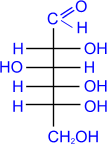 D- глюкоза
D- глюкоза
|
+ 2[Ag(NH3)2]OH ®
|
 аммониевая соль
D- глюконовой
кислоты
аммониевая соль
D- глюконовой
кислоты
|
+ 2AgЇ + 3NH3 + H2O
|
b) Реакция моносахаридов с гидроксидом меди при нагревании
так же приводит к альдоновым кислотам.
|
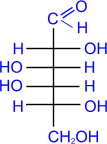 D- галактоза
D- галактоза
|
+ 2Cu(OH)2 ®
|
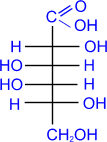 D- галактоновая
кислота
D- галактоновая
кислота
|
+ Cu2OЇ + 2H2O
|
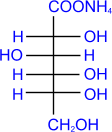
c) Более сильные окислительные средства окисляют в
карбоксильную группу не только альдегидную, но и первичную спиртовую группы,
приводя к двухосновным сахарным (альдаровым) кислотам. Обычно для такого
окисления используют концентрированную азотную кислоту.
|
 D- глюкоза
D- глюкоза
|
HNO3(конц.)
–––––––®
|
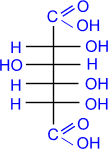 сахарная
(D- глюкаровая)
кислота
сахарная
(D- глюкаровая)
кислота
|
2. Восстановление.
Восстановление сахаров приводит к многоатомным спиртам. В
качестве восстановителя используют водород в присутствии никеля, алюмогидрид
лития и др.
|
 D- глюкоза
D- глюкоза
|
LiAlH4
––––®
|
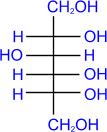 D- сорбит
D- сорбит
|
3. Несмотря на схожесть химических свойств моносахаридов с
альдегидами, глюкоза не вступает в реакцию с гидросульфитом натрия (NaHSO3).
II. Реакции по гидроксильным группам
Реакции по гидроксильным группам моносахаридов
осуществляются, как правило, в полуацетальной (циклической) форме.
1. Алкилирование (образование простых эфиров).
При действии метилового спирта в присутствии газообразного
хлористого водорода атом водорода гликозидного гидроксила замещается на
метильную группу.
|
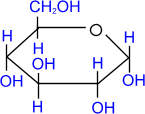 a, D- глюкопираноза
a, D- глюкопираноза
|
+ СH3ОН
|
HCl(газ)
––––®
|
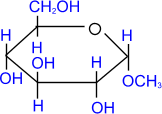 метил- a,
D- глюкопиранозид
метил- a,
D- глюкопиранозид
|
+ H2О
|
|
При использовании более сильных алкилирующих средств,
каковыми являются, например, йодистый метил или диметилсульфат, подобное
превращение затрагивает все гидроксильные группы моносахарида.

|
СH3I
––––®
NaOH
|
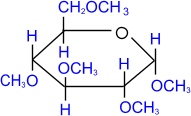 пентаметил- a,
D- глюкопираноза
пентаметил- a,
D- глюкопираноза
|
|
|
|
|
|
|
|
|
2. Ацилирование (образование сложных эфиров).
|
При действии на глюкозу уксусного ангидрида образуется
сложный эфир – пентаацетилглюкоза.

|
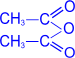
––––––––®
|
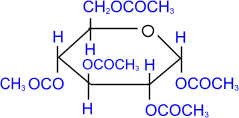 пентаацетил- a,D- глюкопираноза
пентаацетил- a,D- глюкопираноза
|
3. Как и все многоатомные спирты, глюкоза с гидроксидом меди
(II) дает интенсивное синее окрашивание (качественная реакция).
III. Специфические реакции
Кроме приведенных выше, глюкоза характеризуется и некоторыми
специфическими свойствами - процессами брожения. Брожением называется
расщепление молекул сахаров под воздействием ферментов (энзимов). Брожению
подвергаются сахара с числом углеродных атомов, кратным трем. Существует много
видов брожения, среди которых наиболее известны следующие:
a) спиртовое брожение
b) молочнокислое брожение
c) маслянокислое брожение
Упомянутые виды брожения, вызываемые микроорганизмами, имеют
широкое практическое значение. Например, спиртовое – для получения этилового
спирта, в виноделии, пивоварении и т.д., а молочнокислое – для получения
молочной кислоты и кисломолочных продуктов.
7. Основные принципы функционирования биосферы:
целостность, гармония, закон бережливости
7.1. Целостность биосферы
Термин “биосфера”
впервые был использован
в 1875 г.
Австрийским геологом Э. Зюссом. Под биосферой понимается вся
совокупность всех живых организмов вместе со средой их
обитания, в которую
входят: вода, нижняя часть атмосферы и верхняя часть земной
коры, населенная микроорганизмами.
Два главных компонента биосферы - живые организмы и среда
их обитания - непрерывно взаимодействуют
между собой и находятся в тесном,
органическом единстве, образуя целостную динамическую систему. Биосфера
как глобальная суперсистема в
свою очередь состоит из ряда подсистем.
Многообразие живых систем поражает воображение. За все
время эволюции жизни на Земле
существовало колоссальное количество
различных видов живых организмов (всего около 500 млн). В
настоящее время насчитывается около 1,2
млн Видов животных и 0,5 млн видов растений. Минеральных же
видов неживой материи (так
называемое “косное вещество”) насчитывается лишь около 10 тыс. видов.
Отдельные живые организмы не существуют изолированно. В
процессе своей жизнедеятельности
они соединяются в
различные системы (сообщества), например, в популяции. В ходе
эволюции образуется другой, качественно
новый уровень живых систем, так
называемые биоценозы - совокупность растений, животных и микроорганизмов в
локальной среде обитания.
7.2. Гармония биосферы
Взаимоотношения природы общества нельзя рассматривать вне
противоречий, неизбежно возникающих и существующих между ними. История
совместного существования человека и природы представляет собой единство двух
тенденций. Во-первых, с развитием общества и его производительных сил постоянно
и стремительно расширяется господство человека над природой. Сегодня это
проявляется уже в планетарном масштабе. Во-вторых, постоянно углубляются
противоречия, дисгармония между человеком и природой.
Природа, несмотря на все бесчисленное многообразие своих
составных частей, есть единое целое. Именно поэтому воздействие человека на
отдельные части внешне покорной и мирной природы одновременно оказывает
влияние, причем независимо от воли людей, и на другие ее составляющие.
Результаты ответной реакции часто бывают непредсказуемы, они плохо поддаются
прогнозированию. Человек распахивает землю, помогая росту полезных ему
растений, но из-за ошибок в земледелии смывается плодородный слой. Вырубка
лесов под сельхозугодья лишает почву достаточного количества влаги, и в
результате поля вскоре делаются бесплодными. Уничтожение хищников снижает
сопротивляемость травоядных и ухудшает их генофонд. Подобный «черный список»
локальных воздействий человека и ответной реакции природы можно продолжать
бесконечно[8].
Игнорирование человеком целостного диалектического характера
природы приводит к отрицательным последствиям как для нее, так и для общества.
Об этом в свое время прозорливо писал Ф. Энгельс: «Не будем, однако, слишком
обольщаться нашими победами над природой. За каждую такую победу она нам мстит.
Каждая из этих побед имеет, правда, в первую очередь те последствия, на которые
мы рассчитывали, но во вторую и третью очередь совсем другие, непредвиденные
последствия, которые очень часто уничтожают последствия первых». Пробелы в
общем уровне культуры, игнорирование поколениями людей закономерностей и
особенностей живого мира, к сожалению, печальная реальность и сегодняшнего дня.
Горьким свидетельством тому, как упорно человечество не желает учиться на
собственных ошибках, могут служить обмелевшие после вырубки лесов реки,
засоленные в результате неграмотного орошения и ставшие непригодными для земледелия
поля, высохшие моря (Аральское) и т. п.
Отрицательным как для природы, так и для общества становится
бесцеремонное вмешательство человека в окружающую среду в наши дни, ибо
последствия его из-за высокого уровня развития производительных сил зачастую
носят уже глобальный характер и порождают глобальные экологические проблемы.
7.3. Закон бережливости биосферы
Биомасса живущих на Земле организмов достигает 2.4×1012
т.
Ежегодная продукция живого вещества составляет примерно
10 % от его массы, т. е. 2.4×1011 т и, как полагают, остается
неизменной в течение последнего миллиарда лет. За это время в биосфере
синтезировано живое вещество массой 2.4×1011 т/год´109 лет = 2.4×1020
т.
С другой стороны, масса земной коры равняется примерно 2×1019
т, т. е. на порядок меньше общей массы существовавших когда бы то ни было
организмов. Эти численные оценки ведут к двум важным выводам.
Во-первых, земная кора в ее нынешнем виде сформировалась
под активным влиянием живых организмов.
Во-вторых, вещество, входившее в состав организмов, после
их смерти не покидает, в основном, пределов биосферы, а после соответствующих
трансформаций со временем вновь попадает в состав организмов[9].
В экологии известен «закон бережливости», образную формулировку
которого дал В. И. Вернадский: «Атомы, вошедшие в какую-нибудь форму
живого вещества, захваченные единичным жизненным вихрем, с трудом возвращаются,
а может быть и не возвращаются назад, в косную материю биосферы». «Закон
бережливости» – выражение того факта, что химические элементы (реже химические
соединения) в биосфере участвуют в непрерывных биотических круговоротах
вещества.
Важнейший биоэлемент – углерод, круговорот которого
начинается с фиксации углекислого газа растениями в процессе фотосинтеза (на
суше около 60 млрд. т углерода в год). Часть углерода (48 млрд. т) сразу же
возвращается в атмосферу в виде углекислого газа в процессе дыхания, еще
около 1 млрд. т углерода переходит,
благодаря реакциям углекислого газа с горными породами, в литосферу. Какова же
судьба оставшихся 10 млрд. т углерода? Растительный опад, продукты метаболизма
и останки животных становятся пищей для разнообразных организмов, обитающих в
почве. Одна часть отмершей биоты (50–75%) минерализуется, а другая (25–50%)
подвергается биохимическим ферментативным процессам разложения и
окисления – гумифицируется. В ходе гумификации происходит синтез сложных
органических соединений, в почве накапливается гумус, «природное тело,
образующееся в природе везде, где только растительные и животные останки
подвергаются разложению».
В гумусе доминируют вещества кислотной природы – гумусовые
кислоты (рис. 1). В среднем на каждый квадратный километр поверхности суши
ежегодно поступает 33–168 т гумусовых кислот[10].
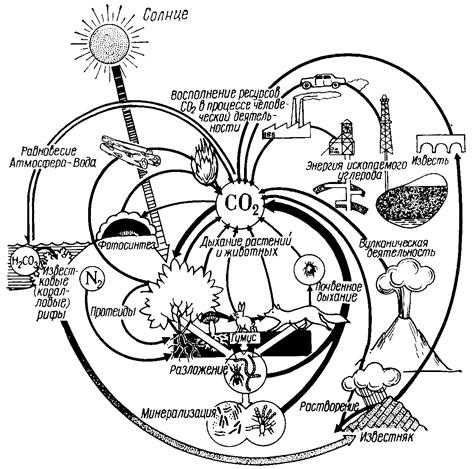
Рис.1. Круговорот углерода
Процесс гумификации происходит и в Мировом океане: при
продукции биомассы ~45 млрд. т около 10% от этого количества поступает в виде
планктонного гумуса в фазу раствора и во взвесь океанических вод, а в
океанические и морские осадки попадает ежегодно до 50 млн. т гумусовых кислот.
Со временем гумусовые вещества преобразуются, окисляясь, в
конечном итоге, до углекислого газа и воды. Вместе с тем это процесс весьма
длительный, вещества гумусовой природы демонстрируют высокую устойчивость к
биохимической и термической деструкции. Гумусовые вещества в растворах не претерпевают заметных изменений в течение
нескольких лет, а микроорганизмам требуется больше месяца, чтобы уменьшить
вдвое их концентрацию.
Даже в жестких гидротермальных условиях – при нагревании до
200 о С – за 10 дней разложению подвергается максимум 90%
исходного количества гумусовых веществ.
Как результат, они способны довольно долго сохраняться и
накапливаться в естественных условиях. Так, данные радиоуглеродного анализа,
свидетельствуют, что возраст гумусовых кислот в почвах колеблется от 500 до
5000 лет, а во взвесях речных осадков – от 1500 до 6500 лет, а их доля в
органическом веществе почв и поверхностных вод составляет 60–90%.
Важно отметить, что путь преобразования отмершей
биоты – минерализация или гумификация – зависит преимущественно от
почвенно-климатических условий. В теплом и влажном климате процессы окисления
происходят очень быстро и почти весь растительный опад минерализуется, а гумус
в почве не накапливается. В холодном климате трансформация опада замедлена, да
и количество его невелико, и содержание гумуса в почве мало. Оптимальные условия для гумификации и
сохранения гумусовых веществ в почвах – умеренный климат без переувлажнения.
Именно таковы климатические условия, почвы которой наиболее богаты гумусом.
Гумификация – процесс, который происходит всюду, где есть
органические остатки и микроорганизмы;
ежегодная продукция гумусовых кислот достигает миллиардов
тонн;
гумусовые кислоты в высоких концентрациях присутствуют в
природных водах и почвах.
Итак, одна из причин, по которой химики пристально изучают
эти вещества, – их вездесущность.
Заключение
Дальнейшие шаги рационализации научной
деятельности приводят к ее
усовершенствованию, путем уточнения,
конкретизации существующих средств познания и
одновременно вводом новых,
эффективных, наиболее адекватно отражаемых особенности
изучаемого объекта.
Становление
рациональности и обрамление
ею познавательной деятельности выглядит на первый взгляд просто.
Но то не совсем
так. Рационализация
исследовательской деятельности не происходит однобоко, под влиянием
только научных представлений и идей: этот процесс достаточно сложный,
выключающий в себя и
подсознательные, волевые элементы
сознания исследователя, и характер взаимодействия общества с
природой, и мировоззренческие установки эпохи, и собственно-научные
компоненты.
Рациональность не носит
законченный характер, она находится в постоянном развитии в историческом
измерении.
Исторические этапы ее развития - это и периоды
совершенствования познавательных средств и методов, и этапы
становления разнообразных форм объективной истины,
и формирование несоизмеримых типов
научной рациональности.
Литература
Алексеенко В.А. Жизнедеятельность и биосфера. Издательство
«Логос», 2005, 232 с.
Ацюковский В.А. Философия и методология современного
естествознания. Издательство «Петит», 2005, 144 с.
Бриллюэн Л. Квантовая статистика. Издательство «Едиториал
УРСС», 2004, 512 с.
Вайнберг С. Квантовая теория поля. Том 1. Общая теория.
Издательство «ФИЗМАТЛИТ», 2003, 648 с.
Вернадский. Биосфера и ноосфера. Издательство «Айрис-пресс»,
2002, 576 с.
Гурьянова Е. Н., Гольдштейн И. П., Ромм И. П.
Донорно-акцепторная связь, М., «Химия», 1973. 400 с.;
Гумилев Л.Н. Этногенез и биосфера Земли. Издательство
«Айрис-пресс», 2005, 560 с.
Игнатова В.А. Естествознание. Издательство «Академкнига»,
2002, 253 с.
Тарасов В.Е. Квантовая механика. Лекции по основам теории.
Издательство «Вузовская книга», 2005, 328 с.
Торосян В.Г.
Концепции современного естествознания. Издательство «Высшая школа», 2003, 208
с.
[1]
Ацюковский В.А. Философия и методология современного естествознания.
Издательство «Петит», 2005, стр. 41
[2]
Тарасов В.Е. Квантовая механика. Лекции по основам теории. Издательство
«Вузовская книга», 2005, стр. 63
[3]
Бриллюэн Л. Квантовая статистика. Издательство «Едиториал УРСС», 2004, стр. 5
[4]
Вайнберг С. Квантовая теория поля. Том 1. Общая теория. Издательство
«ФИЗМАТЛИТ», 2003, стр. 25
[5] Гурьянова
Е. Н., Гольдштейн И. П., Ромм И. П. Донорно-акцепторная связь, М., «Химия»,
1973. стр. 31
[6]
Игнатова В.А. Естествознание. Издательство «Академкнига», 2002, стр. 87
[7]
Торосян В.Г. Концепции современного естествознания. Издательство «Высшая
школа», 2003, стр. 136
[8]
Гумилев Л.Н. Этногенез и биосфера Земли. Издательство «Айрис-пресс», 2005, стр.
311
[9]
Вернадский. Биосфера и ноосфера. Издательство «Айрис-пресс», 2002, стр. 61
[10]
Алексеенко В.А. Жизнедеятельность и биосфера. Издательство «Логос», 2005, стр.
51