Задание 1
П. 7.
|
n = 4
|
|
n = 3
|
|
|
n = 2
|
|
|
|
n = 1
|
|
|
|
|
l = 0
|
l = 1
|
l = 2
|
l = 3
|
|
m = 0
|
m = -1
m = 0
m = +1
|
m = -2
m = -1
m = 0
m = +1
m = +2
|
m = -3
m = -2
m = -1
m = 0
m = +1
m = +2
m = +3
|
|
одна s-орбиталь
|
три p-орбитали
|
пять d-орбиталей
|
семь f-орбиталей
|
|
сферическая форма

|
гантелеобразные
рх, рy, pz
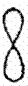
|
dxy, dxz, dyz

d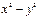
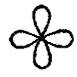
d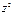

|
очень ассиметричные
|
П. 9.
Задание 2
Физические свойства карбоната цинка: белый порошок, tпл = 3000
С, плохо растворим в воде.
Химические свойства:
1. Взаимодействует с кислотами:
ZnCO3
+ 2HCl = ZnCl2 + CO2 +
H2O
2.
Разлагается при нагревании:
t0
ZnCO3
= ZnO + CO2
Способы получения:
1. ZnO + CO2
= ZnCO3
2. Образуется при взаимодействии растворимых солей цинка и растворимых
карбонатов.
ZnCl2
+ K2CO3 = ZnCO3 + 2KCl
Задание 3
HNO3 → Fe(NO3)2
→ Al(NO3)3 → NaAlO2 → Al(NO3)3
азотная нитрат нитрат алюминат
кислота железа алюминия натрия
+5 0
+2 -3
1. 9HNO3 (раз.) + 4Fe = 4Fe(NO3)2 + NH3 + 3H2O
 восстановитель 4 Fe0 - 2ē = Fe2+ процесс окисления
восстановитель 4 Fe0 - 2ē = Fe2+ процесс окисления
окислитель
1 N5+ + 8ē = N3- процесс восстановления
+2 0
+3 0
2.
3Fe(NO3)2
+ 2Al = 2Al(NO3)3 + 3Fe
 восстановитель 2 Al0 - 3ē = Al3+ процесс окисления
восстановитель 2 Al0 - 3ē = Al3+ процесс окисления
окислитель
3 Fe2+ + 2ē = Fe0 процесс восстановления
+5 -2
t0 +4 0
3. 4Al(NO3)3 = 2Al2O3
+ 12NO2 + 3O2
 восстановитель 4 2O2- - 4ē = O20 процесс окисления
восстановитель 4 2O2- - 4ē = O20 процесс окисления
окислитель
3 3N5+ + 3ē = 3N4+ процесс восстановления
Al2O3 + 2NaOH =
2NaAlO2 + H2O
4. NaAlO2 + 4HNO3
= Al(NO3)3 + NaNO3 + 2H2O
Задание 4
а) [Cu(NH3)4](NO3)2
+ 2KCN = [Cu(NH3)4](CN)2 + 2KNO3
[Cu(NH3)4]2+
+ 2CN- = [Cu(NH3)4](CN)2
б) K[Ag(NO2)2]
+ NH4OH = не идет