СОДЕРЖАНИЕ
СОДЕРЖАНИЕ................................................................................................... 2
ЗАДАЧА № 15.................................................................................................... 4
Условие............................................................................................................ 4
Решение............................................................................................................ 4
ЗАДАЧА № 39.................................................................................................... 4
Условие............................................................................................................ 4
Решение............................................................................................................ 5
ЗАДАЧА № 58.................................................................................................... 5
Условие............................................................................................................ 5
Решение............................................................................................................ 5
ЗАДАЧА № 81.................................................................................................... 6
Условие............................................................................................................ 6
Решение............................................................................................................ 6
ЗАДАЧА № 103.................................................................................................. 6
Условие............................................................................................................ 6
Решение............................................................................................................ 6
ЗАДАЧА № 124.................................................................................................. 7
Условие............................................................................................................ 7
Решение............................................................................................................ 7
ЗАДАЧА № 162.................................................................................................. 8
Условие............................................................................................................ 8
Решение............................................................................................................ 8
ЗАДАЧА № 206.................................................................................................. 8
Условие............................................................................................................ 8
Решение............................................................................................................ 8
ЗАДАЧА № 237.................................................................................................. 9
Условие............................................................................................................ 9
Решение............................................................................................................ 9
ЗАДАЧА № 258................................................................................................ 10
Условие.......................................................................................................... 10
Решение.......................................................................................................... 10
Список литературы........................................................................................... 11
ЗАДАЧА № 15
Условие
Определите факторы эквивалентности (z) и молярные массы эквивалентов солей, вступающих в следующие реакции:
NaHCO3 + HCl = NaCl + H2O + CO2
CaCO3 + 2HCl = CaCl2 + H2О + CO2
Решение
Эквивалентом называют условные частицы вещества в целое число раз меньшие, чем соответствующие им формульные единицы.
В обменных реакциях эквивалентное число вещества (z) определяют по стехиометрии реакции.
Для реакции
NaHCO3 + HCl = NaCl + H2O + CO2
на 1 формульную единицу (ФЕ) гидрокарбоната натрия приходится 1 ФЕ соляной кислоты, следовательно, z(NaHCO3) = 1; в реакции
CaCO3 + 2HCl = CaCl2 + H2О + CO2
на 1 ФЕ CaCO3 требуется 2 ФЕ соляной кислоты, следовательно, z(CaCO3) = 2.
Зная число эквивалентов, содержащихся в 1 моле вещества, находим молярную массу эквивалента вещества (Мэкв.).
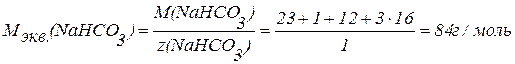
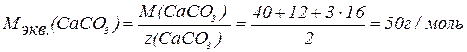
Ответ: фактор эквивалентности NaHCO3 = 1, фактор эквивалентности CaCO3 = 2; молярная масса эквивалента NaHCO3 = 84 г/моль, молярная масса эквивалента CaCO3 = 50 г/моль.
ЗАДАЧА № 39
Условие
Сколько
протонов и нейтронов содержат изотопы ![]() и
и ![]() ? Составить электронную формулу данного атома, подчеркнуть
валентные электроны. Распределить электроны этого атома по квантовым ячейкам. К
какому электронному семейству относится этот элемент?
? Составить электронную формулу данного атома, подчеркнуть
валентные электроны. Распределить электроны этого атома по квантовым ячейкам. К
какому электронному семейству относится этот элемент?
Решение
![]() p = ē = 13, n = Аr – p = 27 – 13 = 14.
p = ē = 13, n = Аr – p = 27 – 13 = 14.
![]() p
= ē = 13, n = Аr – p = 26 – 13 = 13.
p
= ē = 13, n = Аr – p = 26 – 13 = 13.
1s22s22p63s23p1
|
|
s |
p |
d |
||||||
|
3 |
¯ |
¯ |
|||||||
|
2 |
¯ |
¯ |
¯ |
¯ |
|||||
|
1 |
¯ |
Данный элемент относится к р-семейству.
ЗАДАЧА № 58
Условие
У какого из элементов – титана или германия – сильнее выражены металлические свойства? Ответ мотивируйте строением атомов титана и германия. Какой из этих элементов образует газообразное соединение с водородом?
Решение
![]() ē = 22, заряд атома +22, число электронных оболочек – 4. 3d24s2
ē = 22, заряд атома +22, число электронных оболочек – 4. 3d24s2
![]() ē = 32, заряд атома +32, число электронных оболочек – 4. 4p2
ē = 32, заряд атома +32, число электронных оболочек – 4. 4p2
Металлические свойства определяются способностью атомов отдавать электроны, т.е. металлы являются сильными восстановителями.
На фоне равного количества электронных оболочек атомов у обоих элементов, у германия заряд ядра больше, следовательно, электроны сильнее притягиваются к ядру, прочнее удерживаются возле ядра, труднее отдаются, а значит, германий обладает менее выраженными металлическими свойствами в сравнении с титаном.
Газообразное соединение с водородом образует германий.
ЗАДАЧА № 81
Условие
Значение энтальпии растворения в воде Na2CO3 (DН1) и Na2CO3×10Н2О (DН2) составляют соответственно – 25,10 и 66,94 кДж/моль. Вычислите энтальпию гидратации Na2CO3 (DН3).
Решение
Согласно закону Гесса
DНрастворения безводной соли = DНобразования кристаллогидрата + DНрастворения кристаллогидрата,
следовательно
DНрастворения кристаллогидрата = DНрастворения безводной соли - DНобразования кристаллогидрата.
DН3 = DН1 - DН2 = 25,10 кДж/моль – 66,94 кДж/моль = -41,84 кДж/моль.
Ответ: энтальпию гидратации Na2CO3 равна -41,84 кДж/моль.
ЗАДАЧА № 103
Условие
В каких единицах измеряется скорость химической реакции? Каким законом выражается зависимость скорости реакции от концентрации реагирующих веществ? Во сколько раз возрастает скорость химической реакции при повышении температуры с 20 до 40оС? Температурный коэффициент реакции g = 3.
Решение
Скорость химической реакции для гомогенных реакций измеряется в моль/(л×мин), для гетерогенных реакций – моль/(л×мин) или моль/(г×мин).
Зависимость скорости реакции (V) от концентрации реагирующих веществ выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Для реакции А + В2 = АВ2,
V = k[A][B2],
где k – константа скорости химической реакции, значение которой зависит от природы реагирующих веществ.
Dt = 40оС – 20оС = 20оС
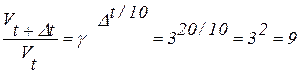
Скорость химической реакции увеличится в 9 раз.
ЗАДАЧА № 124
Условие
Напишите выражения для констант равновесия реакций
2SO2 + O2 « 2SO3
CH4 + CO2 « 2CО + 2Н2
В каком направлении произойдет смещение равновесия при понижении давления?
Решение
2SO2 + O2 « 2SO3
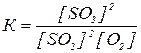
CH4 + CO2 « 2CО + 2Н2
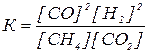
Согласно принципу Ле-Шателье: если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, то равновесие сместится в таком направлении, что оказанное воздействие будет ослаблено.
Протекание реакции 2SO2 + O2 « 2SO3 в прямом направлении приводит к уменьшению общего числа молей (3 моль ® 2 моль), т.е. к уменьшению давления в системе. Поэтому, согласно принципу Ле-Шателье, уменьшение давления вызывает смещение равновесия в сторону обратной реакции.
Протекание реакции CH4 + CO2 « 2CО + 2Н2 в прямом направлении приводит к увеличению общего числа молей (2 моль ® 4 моль), т.е. к увеличению давления в системе. Поэтому, согласно принципу Ле-Шателье, уменьшение давления вызывает смещение равновесия в сторону прямой реакции.
ЗАДАЧА № 162
Условие
Составьте молекулярные и ионно-молекулярные уравнения реакций, протекающих при смешивании растворов: Са(ОН)2 и FeCl3; СН3СООН и КОН; СаСО3 и НСl; CrCl3 и избыток КОН.
Решение
3Са(ОН)2 + 2FeCl3 = 3СаCl2 + 2Fe(ОН)3¯ (молекулярное уравнение)
3Са2+ + 6ОН- + 2Fe3+ + 6Cl- = 3Са2+ + 6Cl- + 2Fe(ОН)3¯ (полное ионное уравнение)
6ОН- + 2Fe3+ = 2Fe(ОН)3¯ (сокращенное ионное уравнение)
СН3СООН + КОН = СН3СООК + Н2О (молекулярное уравнение)
СН3СОО- + Н+ + К+ + ОН- = СН3СОО- + К+ + Н2О (полное ионное уравнение)
Н+ + ОН- = Н2О (сокращенное ионное уравнение)
CrCl3 + 3KOH = 3КCl + Cr(ОН)3¯ (молекулярное уравнение)
Cr3+ + 3Cl- + 3К+ + 3ОН- = 3К++ 3Cl-+ Cr(ОН)3¯ (полное ионное уравнение)
Cr3++ 3ОН- = Cr(ОН)3¯ (сокращенное ионное уравнение)
Cr(ОН)3¯ + 3KOH = K3[Cr(OH)6] (молекулярное уравнение)
Cr(ОН)3¯ + 3К+ + 3ОН- = 3К+ + [Cr(OH)6]3- (полное ионное уравнение)
Cr(ОН)3¯ + 3ОН- = [Cr(OH)6]3- (сокращенное ионное уравнение)
ЗАДАЧА № 206
Условие
КMnO4 + KOH + K2SO3 ® К2MnO4 + H2O + K2SO4
S + HNO3 ® H2SO4 + NO
Решение
Расставляем степени окисления над всеми элементами.
+1 +7 -2 +1 -2 +1 +1 +4 -2 +1 +6 -2 +1 -2 +1 +6 -2
КMnO4 + KOH + K2SO3 ® К2MnO4 + H2O + K2SO4
Выбираем элементы, которые в ходе реакции меняют степень окисления.
+7 +6
![]()
![]() Mn + ē ® Mn 2 восстановление, окислитель
Mn + ē ® Mn 2 восстановление, окислитель
+4 +6 2
S – 2 ē ® S 1 окисление, восстановитель
Выбираем наименьшее общее кратное для числа отданных и принятых электронов, делим его на число отданных и принятых электронов и получаем коэффициенты, которые необходимо поставить перед формулами, содержащими данные элементы в левой части уравнения.
2КMnO4 + KOH + K2SO3 ® К2MnO4 + H2O + K2SO4
Расставляем степени окисления над всеми элементами.
0 +1 +5 -2 +1 +6 -2 +2 -2
S + HNO3 ® H2SO4 + NO
Выбираем элементы, которые в ходе реакции меняют степень окисления.
+5 +2
![]()
![]() N + 3ē ® N 2 восстановление,
окислитель
N + 3ē ® N 2 восстановление,
окислитель
0 +6 6
S – 6ē ® S 1 окисление, восстановитель
Выбираем наименьшее общее кратное для числа отданных и принятых электронов, делим его на число отданных и принятых электронов и получаем коэффициенты, которые необходимо поставить перед формулами, содержащими данные элементы в левой части уравнения.
S + 2HNO3 ® H2SO4 + 2NO
ЗАДАЧА № 237
Условие
В какой пробирке происходит реакция при внесении свинцовых пластинок в растворы сульфата цинка и нитрата меди (II)?
Решение
При внесении свинцовых пластинок в растворы сульфата цинка и нитрата меди (II) реакция будет протекать в пробирке с раствором нитрата меди, в растворе сульфата цинка реакция протекать не будет, что связано с малой растворимостью образующегося сульфата свинца, закрывающего поверхность растворяющегося металла.
ЗАДАЧА № 258
Условие
В раствор соляной кислоты опустили кусочек чистого железа и железа, частично покрытого оловом. Масса железа в обоих случаях одинакова. В каком случае железо растворится быстрее? Написать электронные уравнения анодного и катодного процессов коррозии железа.
Решение
Железо растворится быстрее в первом случае (чистое железо), поскольку разбавленная соляная кислота действует на олово очень медленно, что объясняется большим перенапряжением выделения водорода на этом металле.
Анодный процесс:
0 3+
Fe - 3ē ® Fe j Fe ½Fe3+ = -0,04 В
Катодный процесс: т.к. раствор содержит ионы Н+, т.е. имеет кислую среду, будет протекать реакция восстановления ионов водорода.
2Н+ - 2ē ® Н2 jН2½2Н+ = 0 В
Список литературы
1. Семенов О.Д. Общая химия: учебник для ВУЗов. – М.: Дело, 2000.
2. Хомченко Г.П. Пособие по химии для поступающих в ВУЗы. – М.: Новая волна, 2002.