КОНТРОЛЬНАЯ
РАБОТА ПО
ПО АНАЛИТИЧЕСКОЙ ХИМИИ
СОДЕРЖАНИЕ
ЗАДАЧА № 303 (вариант 9)............................................................................... 3
Условие............................................................................................................ 3
Решение............................................................................................................ 3
ЗАДАЧА № 319.................................................................................................. 4
Условие............................................................................................................ 4
Решение............................................................................................................ 4
ЗАДАЧА № 342.................................................................................................. 5
Условие............................................................................................................ 5
Решение............................................................................................................ 5
ЗАДАЧА № 476.................................................................................................. 6
Условие............................................................................................................ 6
Решение............................................................................................................ 6
ЗАДАЧА № 616.................................................................................................. 7
Условие............................................................................................................ 7
Решение............................................................................................................ 7
ЗАДАЧА № 303 (вариант 9)
Условие
Вычислить фактор пересчета, если определяемым веществом
является FeSO4, а весовой формой – Fe2O3.
Решение
Фактор
пересчета (f) представляет собой отношение
молярной массы определяемого вещества (Мопр) к молярной массе весовой формы (Мвзв)
вещества:
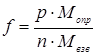 ,
,
где p, n стехиометрические
коэффициенты.
Фактор
пересчета используется для вычисления массы определяемого вещества по формуле:
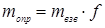 ,
,
где mопр – масса
определяемого вещества (г), mвзв – масса
весовой формы определяемого вещества (г).
Fe2O3
→ 2FeSO4
Рассчитываем
молярную массу данных веществ (М), которая равна молекулярной массе (Мr):
М(Fe2O3) = Мr(Fe2O3)
= Ar(Fe)∙2 + Ar(О)∙3 = 56∙2 + 16∙3= 160 г/моль;
М(FeSO4) = Мr(FeSO4) = Ar(Fe) + Ar(S)
+ Ar(О)∙4 = 56 + 32 + 64 = 152 г/моль.
Так как из
одного моля Fe2O3 образуется 2 моля FeSO4, то
из 160 г Fe2O3 будет образовываться 152г∙2 = 304г
FeSO4.
Рассчитываем
фактор пересчета:
304г/160г = 1,9.
Ответ:
фактор пересчета для определяемого вещества FeSO4 при
весовой форме Fe2O3 равняется 1,9.
ЗАДАЧА № 319
Условие
Технический
хлорид бария содержит около 97 % ВаCl2∙2Н2О. Какую
навеску следует взять для получения 0,3 г осадка ВаSO4?
Решение
х 0,3
г
ВаCl2 + Н2SO4 = ВаSO4
+ 2НCl
208 г/моль 233 г/моль
М(ВаCl2) = Мr(ВаCl2) = Ar(Ва) +
Ar(Cl)∙2 = 137 + 35,5∙2 = 208 г/моль;
М(ВаSO4) = Мr(ВаSO4) = Ar(Ва) + Ar(S)
+ Ar(О)∙4 = 137+32 + 16∙4 = 233 г/моль.
По уравнению
реакции видим, что из 1 моля ВаCl2 образуется 1 моль ВаSO4,
тогда
из 208 г ВаCl2 образуется 233 г ВаSO4,
а
из х г ВаCl2 - 0,3 г ВаSO4.

М(ВаSO4∙2Н2О) = Мr(ВаSO4)
+∙Мr(Н2О)∙2 = Ar(Ва) + Ar(S) + Ar(О)∙4 +
(Ar(Н)∙2 + Ar(О))∙2 = 137+32 + 16∙4 + (1∙2 +
16)∙2 = 244 г/моль.
По формуле ВаSO4∙2Н2О видим, что
в одном моле данного вещества содержится 1 моль ВаSO4, тогда
в 244 г ВаSO4∙2Н2О содержится
208 г ВаSO4, а
в х г ВаSO4∙2Н2О - 0,268 г ВаSO4.
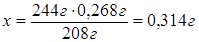
По условию задачи 0,314 г ВаSO4∙2Н2О
составляют 97 %, тогда
х г ВаSO4∙2Н2О - 100 %.
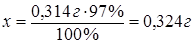
Ответ:
для получения 0,3 г осадка ВаSO4 необходимо взять навеску
технического 97 % ВаSO4∙2Н2О массой 0,324 г.
ЗАДАЧА № 342
Условие
Сколько миллилитров 25%-ного NH3
нужно добавить к 150 мл промывной жидкости, чтобы при промывании осадка MgNH4PO4
потери за счет растворимости составили не более 0,0001 г MgO?
Решение
Записываем уравнение диссоциации:
MgNH4PO4 « Mg2+ + NH4+
+ PO43-
Рассчитываем молярную массу
веществ.
М(MgO) = Мr(MgO) = Ar(Mg) + Ar(О) = 24 + 16 = 40 г/моль.
М(NH4+) = Мr(NH4+)
= Ar(N) + Ar(H)∙4 = 14 + 1×4 = 18 г/моль.
По условию
задачи масса потерь должна не превышать 0,0001 г MgO. Рассчитываем сколько из
0,0001 г будет приходится на Mg:
в 40 г MgO содержится 24 г Mg, тогда
в 0,0001 г MgO будет содержаться х г Mg.
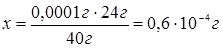
Выражаем массу
Mg в молях, учитывая,
что 24 г данного вещества весит 1 моль,
то 0,6×10-4 г составят х моль.
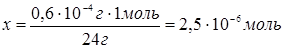
Тогда, исходя из
уравнения диссоциации, количество NH4+ тоже должно
составлять 2,5×10-6
моль или 2,5×10-6
моль ×18 г/моль = 4,5×10-5
г.
4,5×10-5
г NH3 составляет 25 %, тогда
х г
раствора - 100 %.
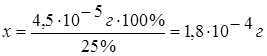
Плотность 25 %
раствора NH3 равна 0,91 г/мл (справочные данные), тогда 1,8×10-4
г раствора будет содержаться в 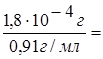 1,978×10-4
мл.
1,978×10-4
мл.
Ответ:
к промывной жидкости необходимо добавить 1,978×10-4 мл
25 % раствора NH3.
ЗАДАЧА № 476
Условие
Какую навеску
наштыря, содержащего около 30 % NH3, взяли для анализа, если после
добавления к ней 50,00 мл 0,1000 н. NaOH и нагревания до полного удаления
аммиака, избыток NaOH оттитровали 25,00 мл 0,1000 н. НCl?
Решение
Если на
титрование избытка NaOH пошло 25 мл 0,1 н НCl, то можно утверждать, что
оттитровали 25 мл 0,1 н NaOH. Тогда на реакцию с наштырем пошло 50 мл – 25 мл =
25 мл 0,1 н NaOH.
0,1 н NaOH
означает, что в 1 л раствора содержится 0,1 эквивалента, тогда в 25 мл (0,025л)
раствора будет содержаться 2,5∙10-3 эквивалента NaOH.
Эквивалентная масса NaOH равна:
Мэкв. = Мr(NaOH) = Ar(Na) + Ar(О) + Ar(Н) = 23 +
16 +1 = 40 г
Если масса 1 эквивалента NaOH равна 40 г, то масса
2,5∙10-3 эквивалентов будет равна 40 г∙2,5∙10-3
= 0,1 г. Следовательно, масса прореагировавшего NaOH равна 0,1 г.
М(NH3) = Мr(NH3) = Ar(N) +
Ar(Н)∙3 = 14 + 3 = 17 г/моль;
М(NaOH) = Мr(NaOH) = 40 г/моль.
Так как 1 моль NaOH соответствует 1 молю NH3, то
40 г NaOH прореагирует с 17 г NH3, а
0,1 г NaOH
- с х г NH3.
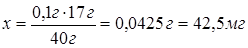
По условию
задачи 42,5 мг NH3 составляют 30 %, тогда
х
мг NH3 - 100 %.
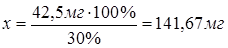
Ответ:
для анализа взяли навеску наштыря, массой 141,67 мг.
ЗАДАЧА № 616
Условие
Рассчитать
навеску вещества (г), содержащего 0,3 % серы, чтобы на титрование полученного
из нее Н2S потребовалось 10,00 мл 0,05000 н. I2.
Решение
10 мл 0,05 н.
I2 пойдут на титрование 10 мл 0,05 н. Н2S.
0,05 н. Н2S означает,
что в 1 л данного раствора содержится 0,05 эквивалентов Н2S.
Мэкв.(Н2S) = Мr(Н2S)∙2
= (Ar(Н)∙2 + Ar(S))/2 = (1∙2 + 32)/2 = 17 г
Если 1 эквивалент Н2S весит 17г,
то 0,05 эквивалентов Н2S – х г.
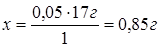
Если в 1 л раствора содержится 0,85 г Н2S, то в
0,01 л (10 мл) раствора будет содержаться 0,0085 г Н2S.
М(Н2S) = Мr(Н2S) = Ar(Н)∙2 +
Ar(S) = 1∙2 + 32 = 34 г/моль;
М(S) = Ar(S) = 32 г/моль.
Так как для образования 1 моля Н2S расходуется 1
моль S, то
для образования 34 г Н2S расходуется 32 г S, а
для образования 0,0085 г Н2S - х г S.
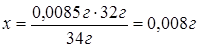
По условию
задачи 0,008 г S составляют 0,3 %, тогда
х г S - 100 %.
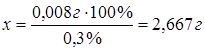
Ответ:
навеска вещества составляет 2,667 г.