СОДЕРЖАНИЕ
ВОПРОС № 6...................................................................................................... 2
ВОПРОС № 16.................................................................................................... 4
ВОПРОС № 26.................................................................................................... 7
ВОПРОС № 36.................................................................................................... 8
ВОПРОС № 46.................................................................................................. 10
ВОПРОС № 56.................................................................................................. 12
ВОПРОС № 6
Электролитическая диссоциация. Механизм электролитической диссоциации.
Теория электролитической диссоциации была сформулирована в 1887 г. шведским ученым С. Аррениусом. Современное содержание этой теории можно свести к следующим трем положениям.
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные и отрицательные.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома – это простые ионы (Na+, Mg2+, Al3+ и др.) – или из нескольких атомов – это сложные ионы (NO3-, SO42-, PO43- и др.). Само название «ион» в переводе с греческого означает «странствующий». В растворе ионы беспорядочно передвигаются в различных направлениях.
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные – к аноду. Поэтому первые называются катионами, вторые – анионами.
Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
3. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости («).
Теория электролитической диссоциации является одной из основных теорий в неорганической химии и полностью согласуется с атомно-молекулярным учением и теорией строения атома.
Механизм электролитической диссоциации можно представить следующим образом. Легче всего диссоциируют вещества с ионной связью. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При этом образуются гидратированные ионы, т.е. ионы, химически связанные с молекулами воды.
Аналогично диссоциируют и электролиты, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества также ориентируются диполи воды, которые своими отрицательными полюсами притягиваются к положительному полюсу молекулы, а положительными полюсами – к отрицательному полюсу. В результате этого взаимодействия связующее электронное облако (электронная пара) полностью смещается к атому с большей электроотрицательностью, полярная молекула превращается в ионную и затем легко образуются гидратированные ионы. Диссоциация полярных молекул может быть полной или частичной.
Таким образом, электролитами являются соединения с ионной или полярной связью – соли, кислоты и основания, способные диссоциировать на ионы в полярных растворителях.
Гидратированные ионы содержат как постоянное, так и переменное число молекул воды. Гидрат постоянного состава образует ион водорода Н+, удерживающий одну молекулу воды, - это гидратированный протон Н+(Н2О), или Н3О+, или ОН3+, который называют ионом гидроксония. Для простоты ион гидроксония условно обозначают символом Н+.
Большинство других ионов образуют гидраты переменного состава, при изображении которых также условно опускают молекулы воды.
С точки зрения теории электролитической диссоциации кислотами называют электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода; основаниями называют электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы; солями называют электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония NH4+) и анионы кислотных остатков.
Растворы электролитов характеризуются степенью диссоциации (a), показывающей отношение числа распавшихся на ионы молекул N¢ к общему числу молекул N.
ВОПРОС № 16
Фосфор, строение, свойства.
Строение. Фосфор входит в главную подгруппу V группы, в третий период. Порядковый номер – 15. Строение атома:
15Р 15 р, 15 ![]() , 31-15=16 n
, 31-15=16 n
![]()
![]()
![]()
 1S22S22p63S23p3
1S22S22p63S23p3
![]()
![]()
![]()
2 8 5 s p d
|
3 |
¯ |
¯ |
¯ |
¯ |
|||||
|
2 |
¯ |
¯ |
¯ |
¯ |
|||||
|
1 |
¯ |
Валентные электроны – 3S23p3. Энергия ионизации – 10,5 эВ. Относительная электроотрицательность – 2,1. Степень окисления в соединениях: +5, +4, +3, +1, -3, -2. Радиус атома – 0,13 нм.
Физические свойства. Фосфор имеет несколько аллотропных модификаций: белый фосфор (бесцветное и очень ядовитое вещество; образуется в результате кондесации паров фосфора; не растворяется в воде, но хорошо растворяется в сероуглероде; при длительном слабом нагревании переходит в красный фосфор), красный фосфор (порошок красно-бурого цвета, не ядовит; нерастворим в воде и сероуглероде; представляет собой смесь нескольких аллотропных модификаций, которые отличаются друг от друга цветом (от алого до фиолетового) и некоторыми другими свойствами; свойства красного фосфора во многом зависят от его получения), черный фосфор (по внешнему виду похож на графит, жирный на ощупь, обладает полупроводниковыми свойствами; образуется в результате длительного нагревания белого фосфора при очень высоком давлении (200 оС и 1200 МПа)). Свойства аллотропных модификаций фосфора объясняются их строением. Более подробно изучено строение белого фосфора. Он имеет молекулярную кристаллическую решетку. Его молекулы четырехатомны и имеют форму правильной трехгранной пирамиды. Каждый атом фосфора находится в одной из вершин пирамиды и связан тремя s-связями с другими тремя атомами. Как все вещества с молекулярной решеткой, белый фосфор легко плавится и летуч, хорошо растворяется в органических растворителях.
В отличие от белого фосфора красный и черный фосфоры имеют атомную кристаллическую решетку. Поэтому они нерастворимы почти во всех растворителях, не летучи и, как уже отмечалось, не ядовиты.
Химические свойства. Белый фосфор легко окисляется и самовоспламеняется на воздухе, поэтому его хранят под водой. Красный фосфор не воспламеняется на воздухе, но воспламеняется при нагревании свыше 240 оС. При окислении белый фосфор светится в темноте – происходит непосредственное превращение химической энергии в световую.
В жидком и растворенном состоянии, а также в парах при температуре ниже 800 оС фосфор состоит из молекул Р4. При нагревании выше 800 оС молекулы диссоциируют: Р4 « 2Р2. Последние при температуре выше 2000 оС распадаются на атомы: Р2 « 2Р. Атомы фосфора могут объединяться в молекулы Р2, Р4 и полимерные вещества. Очевидно, молекула Р4, где атомы связаны между собой тремя s-связями, прочнее молекулы Р2, в которой атомы связаны одной s- и двумя p-связями.
Фосфор соединяется со многими простыми веществами – кислородом, галогенами, серой и некоторыми металлами, проявляя окислительные и восстановительные свойства. Например,
2Р + 3S = Р2S3 2Р + 3Са = Са3Р2
окисляется, восстанавливается,
восстановитель окислитель
Реакции с белым фосфором идут легче, чем с красным.
Соединения металлов с фосфором называются фосфидами; они легко разлагаются водой с образованием фосфина РН3 – очень ядовитого газа с чесночным запахом:
Са3Р2 + 6Н2О = 3Са(ОН)2 + 2РН3.
фосфид
кальция
ВОПРОС № 26
Металлы II группы, характеристика и их свойства, соединения кальция.
В главную подгруппу II группы входят элементы бериллий Ве, магний Mg, кальций Са, стронций Sr, барий Ва и радий Ra. Четыре элемента Са, Sr, Ва, Ra имеют групповое название щелочноземельные металлы.
На валентном уровне данных элементов два электрона (общая электронная конфигурация ns2), характерная степень окисления +2. Электроотрицательность элементов в этой группе различна; она довольно высока для Ве (c =1,47), что обуславливает его амфотерные свойства, и типично металлическая у остальных элементов. Химическая активность увеличивается с ростом порядкового номера. Так, Ве и Mg устойчивы по отношению к воде, тогда как щелочноземельные металлы реагируют с ней, образуя соответствующие гидроксиды: Ме + 2Н2О = Ме(ОН)2 + Н2 (Ме = Са- Ra). Наблюдается увеличение восстановительных свойств от Ве к Ra.
Все из металлов данной подгруппы обладают большим сродством к неметаллам; с кислородом они образуют оксиды МеО (Ме = Ве-Ra), с водородом – гидриды МеН2, с азотом – нитриды Ме3N2, с галогенами – галогениды, например хлориды МеCl2, с углеродом – карбиды (ацетилениды) МеС2, с серой – сульфиды МеS и т.д.
МеО и Ме(ОН)2 элементов второй группы главной подгруппы (кроме бериллия) проявляют основные свойства; растворимость в воде гидроксидов Sr(ОН)2 и Ва(ОН)2 достаточно велика и их относят к щелочам.
Соли (карбонаты МеСО3, сульфиты МеSO3, сульфаты МеSO4 и др.) легче и при более низких температурах, чем соли щелочных металлов, разлагаются на соответствующие оксиды. Растворимость данных солей в воде различна: хорошо растворимые соли – хлориды, бромиды, иодиды, сульфиды (Са-Ra), нитраты, нитриты (Mg-Ra), малорастворимые и практически нерастворимые соли – фториды (Mg-Ra), сульфаты (Са-Ra), ортофосфаты, карбонаты, силикаты. Растворимые в воде соли щелочноземельных металлов гидролизу по катиону не подвергаются. Катионы этих металлов окрашивают пламя в различные цвета: Са2+ - в оранжевый, Sr2+ - темно-красный, Ва2+ - светло-зеленый.
Растворимые в воде соли магния в небольшой степени подвергаются гидролизу по катиону: МgCl2 = Mg2+ + 2Cl-, Mg2+ + Н2О « МgОН- + Н+.
Гидролиз солей Ве протекает в такой высокой степени, что нередко образуется осадок малорастворимых основных солей, например:
Ве(NO3)2 + Н2О = Ве(NO3)ОН¯ + НNO3,
Поэтому для удержания катионов Ве2+ в растворе добавляют сильную кислоту (в данном примере – азотную). ВеО и Ве(ОН)2 – типично амфотерные соединения.
Оксид кальция СаО (техническое название – негашеная известь) – белый тугоплавкий порошок. Реагирует с водой с высоким экзо-эффектом (гашение извести): СаО + Н2О = Са(ОН)2. СаО – важнейшее промышленное сырье, производится в промышленности обжигом (прокаливанием на воздухе) известняка: СаСО3 « СаО + СО2. Гидроксид кальция Са(ОН)2 (гашеная известь) – белый порошок, малорастворимый в воде (0,16 г/100 г Н2О); водный раствор – сильнощелочной (в насыщенном растворе рН = 12). При пропускании СО2 через известковую воду вначале появляется осадок карбоната: Са(ОН)2 + СО2 = СаСО3¯ + Н2О, который затем полностью исчезает, поскольку кислая соль – гидрокарбонат кальция Са(НСО3)2 хорошо растворим в воде: СаСО3 + Н2О + СО2 = Са2+ + 2НСО3-. Карбонат кальция СаСО3 – распространенное природное вещество, главная составная часть осадочной горной породы – известняка (и его разновидностей – мел, мрамор, изсвестковый туф, мергель), чистый СаСО3 в природе – это минерал кальцит. СаСО3 – белое вещество, очень мало растворимое в воде. При прокаливании разлагается: СаСО3 = СаО + СО2. Сульфат кальция СаSO4 – белый кристаллический порошок, малорастворимый в воде, растворимость его уменьшается при нагревании. Природный СаSO4 встречается в природе в виде очень распространенного минерала – гипса СаSO4×2Н2О. при 130оС гипс теряет часть воды и переходит в жженый гипс 2СаSO4×Н2О.
ВОПРОС № 36
Циклоалканы.
![]()
![]() Строение.
Циклоалканы (циклопарафины, нафтены, цикланы, полиметилены) – предельные
углеводороды с замкнутой (циклической) цепью. Примеры таких соединений:
Строение.
Циклоалканы (циклопарафины, нафтены, цикланы, полиметилены) – предельные
углеводороды с замкнутой (циклической) цепью. Примеры таких соединений:
циклопентан метилциклопентан
Молекулы циклоалканов содержат на два атома водорода меньше, чем соответствующие алканы (за счет отщепления замыкается углеродное кольцо). Поэтому общая формула циклоалканов СnН2n.
Виды изомерии:
1) изомерия углеродного скелета (начиная с С4Н8);
2) цис-транс-изомерия (начиная с С5Н10);
3) межклассовая изомерия с алкенами.
Физические свойства. При обычных условиях циклопропан и циклобутан – газы, пяти-шестнадцатиуглеродные циклоалканы – жидкости, начиная с С17 – твердые вещества. Температура кипения циклоалканов выше, чем у соответствующих алканов.
Получение. Циклоалканы были выделены из бакинской нефти и подробно изучены В.В. Марковниковым. В лаборатории циклоалканы получают по реакции Вюрца – действием натрия на галогенпроизводные углеводородов, например:
СН2СН2СН2СН2СН2 + 2Na =
½ ½ циклопентан
Вr Br
1,5-дибромпентан
Химические свойства. Химические свойства циклоалканов зависят от размера цикла. Малые циклы (трех-, четырехуглеродные) склонны к реакциям присоединения с раскрытием цикла, обычные (пяти- – семиуглеродные) и большие (восьмиуглеродные и выше) циклы вступают в реакции замещения подобно алканам: горючи, химически малоактивны, атомы водорода замещаются галогенами.
С4Н8 + 6О2 = 4СО2 + 4Н2О,
циклобутан
С5Н10 + 5Cl2 = C5Cl10 + 8НCl.
циклопентан
Простейший циклоалкан – циклопропан (С3Н6), для которого характерна sp3-гибридизация атомов углерода, s-связи С – С и С – Н, углы между связями С – С 60о. Цикл – плоский, сильно напряженный, что обуславливает высокую реакционную способность циклопропана. По физическим свойствам циклопропан – бесцветный газ без запаха с tпл = -127оС и tкип = -33оС. Получают циклопропан дегалогенированием:
![]() Циклопропан
присоединяет водород, бром и иодоводород с раскрытием цикла:
Циклопропан
присоединяет водород, бром и иодоводород с раскрытием цикла:
![]() Для
циклогексана (С6Н6)
характерна sp3-гибридизация атомов углерода, s-связи
С – С и С – Н; цикл – неплоский, устойчивый, может существовать в двух
конформациях – кресла и ванны, из которых более устойчива конформация кресла.
По физическим свойствам циклогексан – бесцветная жидкость, не растворимая в
воде с tпл = 6,5 оС и tкип = 81оС, r =
0,78 г/см3. Получают циклогексан гидрированием бензола:
Для
циклогексана (С6Н6)
характерна sp3-гибридизация атомов углерода, s-связи
С – С и С – Н; цикл – неплоский, устойчивый, может существовать в двух
конформациях – кресла и ванны, из которых более устойчива конформация кресла.
По физическим свойствам циклогексан – бесцветная жидкость, не растворимая в
воде с tпл = 6,5 оС и tкип = 81оС, r =
0,78 г/см3. Получают циклогексан гидрированием бензола:
![]()
![]() Из
химических свойств циклобензола можно выделить важную реакцию дегидрогенизации
циклогексана (отщепление водорода) с образованием бензола:
Из
химических свойств циклобензола можно выделить важную реакцию дегидрогенизации
циклогексана (отщепление водорода) с образованием бензола:
+ 3Н2.
циклогексан бензол
ВОПРОС № 46
Сложные эфиры, строение, свойства, применение.
Сложные эфиры – это производные карбоновых кислот, у которых атом водорода в карбоксильной группе замещен на углеводородный радикал.
Общая формула: R – CО О – R¢, где R и R¢ - углеводородные радикалы.
Номенклатура. Чаще всего названия сложных эфиров производят от названий кислот и спиртов, остатка которых входят в их состав, с добавлением слова эфир, их также образуют по типу названий солей.
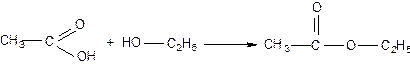 Получение.
Получают сложные эфиры при взаимодействии карбоновых кислот со спиртами.
Например, из уксусной кислоты и этилового спирта в присутствии катализатора
(концентрированной серной или соляной кислоты) получают сложный эфир
этилацетат:
Получение.
Получают сложные эфиры при взаимодействии карбоновых кислот со спиртами.
Например, из уксусной кислоты и этилового спирта в присутствии катализатора
(концентрированной серной или соляной кислоты) получают сложный эфир
этилацетат:
Реакция образования сложного эфира из кислоты и спирта называются реакцией этерификации («этер» – эфир).
Реакции этерификации характерны не только для карбоновых, но и для минеральных кислот. Например, при взаимодействии этилового спирта с серной кислотой образуется сложный эфир – диэтилсульфат:
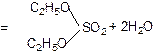 |
|||
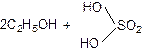 |
диэтилсульфат
Из азотной кислоты и спирта образуется этилнитрат:
![]() С2Н5ОН
+ НО – NO2 = С2Н5 – О – NO2 + Н2О.
С2Н5ОН
+ НО – NO2 = С2Н5 – О – NO2 + Н2О.
этилнитрат
Физические свойства. Многие сложные эфиры карбоновых кислот – жидкости, мало растворимые в воде, но хорошо растворимые в спирте. Особое строение молекул сложных эфиров (у них нет, например, гидроксильных групп) приводит к отсутствию водородных связей, а значит, и к отсутствию ассоциированных молекул, характерных для спиртов и кислот. Поэтому сложные эфиры кипят при более низких температурах, чем соответствующие им кислоты.
Многие сложные эфиры обладают приятным фруктовым запахом. Так, муравьиноамиловый эфир обладает запахом вишни, муравьиноэтиловый – рома, уксусноамиловый – бананов, масляноэтиловый – абрикосов, маслянобутиловый – ананасов, изовалерианоэтиловый – запахом яблок.
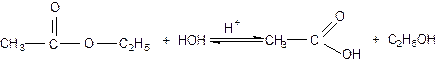 Химические
свойства. Сложный эфир, взаимодействуя с водой, снова превращается в
кислоту и спирт. Например:
Химические
свойства. Сложный эфир, взаимодействуя с водой, снова превращается в
кислоту и спирт. Например:
Реакция взаимодействия сложного эфира с водой, приводящая к образованию спирта и кислоты, называется омылением или гидролизом. Она обратна реакции этирификации.
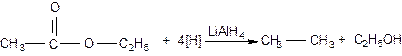 Катализатор – ионы водорода
(минеральные кислоты) – одинаково ускоряет прямую и обратную реакции
(этерификации и гидролиза), т.е. ускоряет достижение равновесия. Чтобы сместить
последнее в сторону образования эфира, исходные кислоту и спирт берут в
избытке, либо удаляют один из продуктов реакции из сферы взаимодействия
(отгоняют эфир или связывают воду водоотнимающими веществами). Ионы ОН-
усиливают гидролиз сложных эфиров: равновесие смещается в сторону кислоты и
спирта, и реакция становится практически необратимой, так как образующаяся
карбоновая кислота, взаимодействуя с щелочью образует соль:
Катализатор – ионы водорода
(минеральные кислоты) – одинаково ускоряет прямую и обратную реакции
(этерификации и гидролиза), т.е. ускоряет достижение равновесия. Чтобы сместить
последнее в сторону образования эфира, исходные кислоту и спирт берут в
избытке, либо удаляют один из продуктов реакции из сферы взаимодействия
(отгоняют эфир или связывают воду водоотнимающими веществами). Ионы ОН-
усиливают гидролиз сложных эфиров: равновесие смещается в сторону кислоты и
спирта, и реакция становится практически необратимой, так как образующаяся
карбоновая кислота, взаимодействуя с щелочью образует соль:
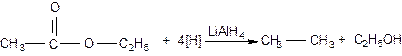 Сложные эфиры подвергаются
восстановлению:
Сложные эфиры подвергаются
восстановлению:
Применение. Многие сложные эфиры находят применение как хорошие растворители органических веществ. Их широко применяют для приготовления фруктовых эссенций. Некоторые сложные эфиры используются в медицине: изоамилнитрит ослабляет приступы при стенокардии, этилнитрит расширяет периферические кровеносные сосуды.
ВОПРОС № 56
Свойства белков и их применение.
Белки – полимерные органические соединения, построенные из остатков 20 аминокислот. Молекулярная масса растительных белков – от прим. 5000 до многих миллионов. Растительные белки можно подразделить на две группы: протеины (простые белки) и протеиды (сложные белки). Первые состоят только из остатков аминокислот, вторые содержат небелковый компонент, например, соединение белка и углевода (гликопротеиды), белка с жироподобным веществом (липопротеиды).
Структура белков. Отдельные аминокислоты соединяются друг с другом в молекуле белка с помощью пептидной связи -СО-NH-. Так создается первичная структура белка, которая определяется:
- природой входящих в молекулу аминокислот;
- относительным количеством каждой аминокислоты;
- строго определенной аминокислотной последовательностью полипептидной цепи.
Именно состав аминокислот и их последовательность обуславливают не только химические свойства, но и высшие уровни структуры каждой молекулы.
В полипептидной цепи вокруг связей, соединяющих a-углеродные атомы, происходит свободное вращение, в то время как вращение вокруг оси С-N (более жесткая пептидная связь) затруднено. В результате этого аминокислотная цепь закручивается в правую спираль, так называемую a-структуру. Каждый ее виток составляет 3,6 аминокислотного остатка. Таким образом, возникает вторичная структура. Она стабилизируется стабильными водородными связями: каждая карбонильная группа -СО пептидной связи взаимодействует с группой -NH, входящей в четвертую от -СО пептидную связь. Только в тех местах, где присутствует пролин, a-спираль имеет характерные изгибы, так как в пептидных связях, образованных этой аминокислотой, отсутствует водород (-СО-N-) и в этих местах водородная связь образоваться не может. В образовании вторичной структуры принимают участие все карбонильные и аминные группы. Это определяет однообразность и неспецифичность самых разнообразных белков. a-спираль наиболее характерна для глобулярных белков. Вторичная структура может быть и другого, складчатого типа (b-структура). В этом случае межмолекулярные водородные связи возникают между двумя или бóльшим числом параллельных цепей. Так образуются главным образом фибриллярные белки.
Специфическая деятельность разнообразных белков в живой растительной клетке осуществляется ими лишь в состоянии нативной (прижизненной) структуры, которая является трехмерной – третичной или четвертичной. Наличие в белковой молекуле множества разнообразных боковых цепей, стремящихся к взаимодействию друг с другом, определяет оригинальную укладку спирали в пространстве. Большую роль в организации третичных структур играют дисульфидные мостики между остатками цистеина (-S-S-). В стабилизации складок, поворотов, изгибов глобулярного белка принимают участие слабые связи следующих типов: ионные (NH3+…COO-), водородные (ОН…NН2), гидрофобные (СН3…СН3). Гидрофобные группировки локализуются в основном внутри глобулы, вдали от гидрофильной среды; полярные группы сосредоточены снаружи, что определяет растворимость многих белков в воде.
Наиболее сложные и специфические функции в клетке выполняются белками, имеющими четвертичную структуру. Несколько глобул, субъединиц или олигомеров, агрегируются за счет слабых связей – водородных, ионных, гидрофобных (ван-дер-ваальсовых). Преимущество четвертичной структуры, прежде всего в том, что сочетание нескольких одинаковых олигомерных молекул значительно повышает интенсивность осуществляемого ими процесса. С другой стороны, объединение различных по свойствам субъединиц позволяет возникшему комплексу осуществлять гораздо более сложные интегрированные реакции. Наконец, на уровне четвертичной структуры облегчается регуляция активности белка за счет некоторых изменений взаиморасположения отдельных глобул. Кроме того, замена каждой отдельной субъединицы при ее повреждении обходиться клетке дешевле, чем синтез заново большой полипептидной цепи, обладающей всеми достоинствами четвертичного белка.
Нативная конформация глобулярного белка обладает высокой лабильностью (подвижностью) вследствие участия в ее поддержании слабых связей. Под влиянием внешних воздействий (температуры, рН, механического усилия) структура глобулы может меняться. Эти изменения не затрагивают аминокислотной последовательности. Потеря нативной конформации может быть временной или окончательной (обратимая и необратимая денатурация).
В кислом или щелочном растворах происходит гидролиз белков – разрушение первичной структуры с образованием аминокислот.
Применение. Белки применяют в медицине (входят в состав лекарств), сельском хозяйстве (используют в качестве биодобавок в животноводстве), химическом синтезе (многие белки являются ферментами).