КОНТРОЛЬНАЯ РАБОТА
ПО ХИМИИ
СОДЕРЖАНИЕ
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ............................................... 8
Задача № 10..................................................................................................... 8
Условие........................................................................................................ 8
Решение........................................................................................................ 8
СТРОЕНИЕ АТОМА.......................................................................................... 8
Задача № 20..................................................................................................... 8
Условие........................................................................................................ 8
Решение........................................................................................................ 8
ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ............................................... 8
Задача № 30..................................................................................................... 8
Условие........................................................................................................ 8
Решение........................................................................................................ 8
ХИМИЧЕСКОЕ СРОДСТВО............................................................................. 8
Задача № 40..................................................................................................... 8
Условие........................................................................................................ 8
Решение........................................................................................................ 8
ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ............................................. 8
Задача № 50..................................................................................................... 8
Условие........................................................................................................ 8
Решение........................................................................................................ 8
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРА.......................... 8
Задача № 60..................................................................................................... 8
Условие........................................................................................................ 8
Решение........................................................................................................ 8
СВОЙСТВА РАСТВОРОВ................................................................................ 8
Задача № 70..................................................................................................... 8
Условие........................................................................................................ 8
Решение........................................................................................................ 8
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ............................ 8
Задача № 80..................................................................................................... 8
Условие........................................................................................................ 8
Решение........................................................................................................ 8
ЛИТЕРАТУРА.................................................................................................... 8
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
Задача № 10
Условие
Сколько атомов кислорода содержится: а) в кислороде массой 32 г; б) в оксиде углерода (IV) массой 66 г; в) в оксиде серы (IV) массой 64 г.
Решение
а) Рассчитываем молярную массу О2 (массу 1-го моля):
М(О2) = Мr(О2) = Аr(О)×2 = 16×2 = 32 г/моль.
Таким образом, в 32 г О2 содержится количество вещества, равное 1 моль.
Согласно химической формуле в 1 моле О2 содержится два моля О.
Так как 1 моль любого вещества содержит 6,02×1023 атомов (число Авагадро), определяем, то 2 моль кислорода будут содержать 6,02×1023×2 = 12,04×1023 атомов.
б) Рассчитываем, сколько молей СО2 содержится в 66 г.
М(СО2) = Мr(СО2) = Аr(С) + Аr(О)×2 = 12 + 16×2 = 44 г/моль
Если в 44 г СО2 содержится 1 моль, то
в 66 г СО2 - х моль.
![]()
Согласно химической формуле в 1 моле СО2 содержится два моля кислорода, тогда в 1,5 моля СО2 будет содержаться в 1,5 раза больше, т.е. 3 моля.
Так как 1 моль любого вещества содержит 6,02×1023 атомов (число Авагадро), то 3 моль кислорода будут содержать 6,02×1023×3 = 18,06×1023 атомов.
в) Рассчитываем, сколько молей SО2 содержится в 64 г.
М(SО2) = Мr(SО2) = Аr(S) + Аr(О)×2 = 32 + 16×2 = 64 г/моль
Таким образом, в 64 г SО2 составляет 1 моль.
Согласно химической формуле в 1 моле SО2 содержится два моля кислорода.
Так как 1 моль любого вещества содержит 6,02×1023 атомов (число Авагадро), то 2 моль кислорода будут содержать 6,02×1023×2 = 12,04×1023 атомов.
Ответ: а) 12,04×1023; б) 18,06×1023; в) 12,04×1023.
СТРОЕНИЕ АТОМА
Задача № 20
Условие
Значения какого квантового числа определяют число s-, р-, d-, f-орбиталей на энергетическом уровне? Сколько всего s-, р-, d-электронов в атоме кобальта?
Решение
Число орбиталей на энергетическом уровне равно квадрату главного квантового числа – n2.
Записываем электронную формулу для Со:
27Со 1s22s22p63s23p63d74s2.
Подсчитываем число электронов на каждом из уровней:
число s-электронов = 4×2 = 8;
число р-электронов = 2×6 = 12;
число d-электронов = 7.
Ответ: число орбиталей на энергетическом уровне равно квадрату главного квантового числа – n2; 8 s-электронов, 12 р-электронов, 7 d-электронов.
ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
Задача № 30
Условие
Напишите термохимическое уравнение реакции горения 1 моль этилового спирта, в результате которой образуются пары воды и оксид углерода (IV). Вычислите теплоту образования С2Н5ОН (ж), если известно, что при сгорании 11,5 г его выделилось 308,71 кДж теплоты.
Решение
С2Н5ОН(ж) + О2(г) = 3Н2О(г) + 2СО2(г)
Рассчитываем молярную массу С2Н5ОН:
М(С2Н5ОН) = Мr(С2Н5ОН) = Аr(С)×2 + Аr(Н)×6 + Аr(О) = 12×2 + 1×6 + 16 = 46 г/моль.
Если при сгорании 11,5 г С2Н5ОН выделилось 308,71 кДж теплоты, то
при сгорании 46 г С2Н5ОН выделится х кДж теплоты.
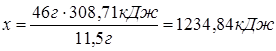
Процесс горения С2Н5ОН обратен процессу его образования. Следовательно, в результате синтеза С2Н5ОН будет поглощаться 1234,84 кДж теплоты, т.е. DН = +1234,85 кДж.
Тогда термохимическое уравнение реакции будет иметь вид:
С2Н5ОН(ж) + О2(г) = 3Н2О(г) + 2СО2(г), DН = +1234,85 кДж
Ответ: С2Н5ОН(ж) + О2(г) = 3Н2О(г) + 2СО2(г), DН = +1234,85 кДж
ХИМИЧЕСКОЕ СРОДСТВО
Задача № 40
Условие
На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите DG0298 реакции, протекающей по уравнению: СО(г) + 3Н2(г) = СН4(г) + Н2О(ж). Возможна ли эта реакция при стандартных условиях?
Решение
DG0298 = DН - ТDS
DН = Нкон-Нисх = (Н(СН4(г)) + Н(Н2О(ж))) – (Н(СО(г)) + Н(Н2(г))×3) = (-74,85 кДж/моль + (-285,84 кДж/моль)) – (-110,52 кДж/моль + 0 кДж/моль×3) = -74,85 кДж/моль – 285,84 кДж/моль + 110,52 кДж/моль = -250,17 кДж/моль
DS = S кон- S исх = (S(СН4(г)) + S(Н2О(ж))) – (S(СО(г)) + S(Н2(г))×3) = (186,19 Дж/моль×К + 69,94 Дж/моль×К) – (-137,27 Дж/моль×К + 130,5 Дж/моль×К×3) = 186,19 Дж/моль×К + 69,94 Дж/моль×К + 137,27 Дж/моль×К - 130,5 Дж/моль×К×3 = +1,9 Дж/моль×К
DG0298 = -250,17×103 Дж/моль – 298 К×1,9 Дж/моль×К = -816,37×103 Дж/моль = -816,37 кДж/моль
DG = Gкон-Gисх = (G(СН4(г)) + G(Н2О(ж))) – (G(СО(г)) + G(Н2(г))×3) = (-50,79 кДж/моль + (-237,19 кДж/моль)) – (-137,27 кДж/моль + 0 кДж/моль×3) = -50,79 кДж/моль - 237,19 кДж/моль + 137,27 кДж/моль = -150,71 кДж/моль.
Так как DG отрицательная величина, то в стандартных условия данная реакция протекать будет.
Ответ: DG0298 = -816,37 кДж/моль; в стандартных условия данная реакция протекать будет.
ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
Задача № 50
Условие
Напишите выражение для константы равновесия гомогенной системы СН4 + СО2 « 2СО + 2Н2. Как следует изменить температуру и давление, чтобы повысить выход водорода? Реакция образования водорода эндотермическая.
Решение
При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
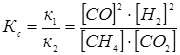
СН4 + СО2 « 2СО + 2Н2
Так как реакция эндотермическая, то для того чтобы повысить выход водорода необходимо повысить температуру.
Поскольку в ходе реакции из двух объемов газа образуется 4, т.е. происходит увеличение объема, то для повышения выхода водорода необходимо уменьшить давление.
Ответ: 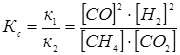 ; для увеличения выхода водорода необходимо повысить
температуру и уменьшить давление.
; для увеличения выхода водорода необходимо повысить
температуру и уменьшить давление.
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРА
Задача № 60
Условие
Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, красталлизуется при 5,2960С. Температура кристаллизации бензола 5,50С. Криоскопическая константа 5,1 град. Вычислите мольную массу растворенного вещества.
Решение
Определяем насколько изменилась температура кристаллизации раствора после растворения в бензине неэлектролита: 5,296 0С – 5,5 0С = 0,296 0С, т.е. температура повысилась.
По закону Рауля повышение температуры кристаллизации раствора по сравнению с температурой кристаллизации растворителя выражается уравнением:
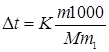 ,
,
где К – криоскопическая константа, m и M – соответственно масса растворенного вещества и его мольная масса; m1 – масса растворителя.
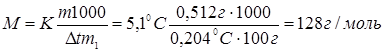
Ответ: мольная масса растворенного вещества равна 128 г/моль.
СВОЙСТВА РАСТВОРОВ
Задача № 70
Условие
Вычислите температуру кристаллизации 2%-ного раствора этилового спирта С2Н5ОН, зная, что криоскопическая константа воды 1,86 0С.
Решение
По закону Рауля понижение температуры кристаллизации раствора по сравнению с температурой кристаллизации растворителя выражается уравнением:
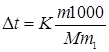
Концентрация С2Н5ОН равна 2 %. Это означает, что в 98 г воды растворено 2 г С2Н5ОН.
Мольная масса С2Н5ОН равна:
М(С2Н5ОН) = Мr(С2Н5ОН) = Аr(С)×2 + Аr(Н)×6 + Аr(О) = 12×2 + 1×6 + 16 = 46 г/моль.
![]()
Вода кристаллизуется при 00С, следовательно, температура кристаллизации раствора равна 0 0С -0,825 0С = -0,825 0С.
Ответ: температура кристаллизации 2% раствора С2Н5ОН равна -0,825 0С.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Задача № 80
Условие
Реакции выражаются схемами:
HCl + CrO3 ![]() Cl2
+ CrCl3 + H2O
Cl2
+ CrCl3 + H2O
Cd + KMnO4 + H2SO4 ![]() CdSO4
+ K2SO4 + MnSO4 + H2O
CdSO4
+ K2SO4 + MnSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое - восстановителем; какое вещество окисляется, какое - восстанавливается.
Решение
Расставляем степени окисления элементов в каждом из веществ.
+1 -1 +6 -2 0 +3 -1 +1 -2
HCl + CrO3 ![]() Cl2
+ CrCl3 + H2O
Cl2
+ CrCl3 + H2O
Определяем, какой из элементов изменил степень окисления.
+6 +3
![]()
![]() Cr
+ 3
Cr
+ 3![]() ®
Cr сстонавливается, окислитель 2
®
Cr сстонавливается, окислитель 2
-1 0 6
2Cl - 2![]() ® Cl2 окисляется, восстановитель 3
® Cl2 окисляется, восстановитель 3
Находим наименьшее общее кратное для числа отданных и принятых электронов. Делим наименьшее общее кратное вначале на число принятых, затем – число отданных электронов. Полученные значения являются коэффициентами в уравнения, остальные коэффициенты подбираем сами.
+1 -1 +6 -2 0 +3 -1 +1 -2
12HCl + 2CrO3 ![]() 3Cl2 + 2CrCl3 + 6H2O
3Cl2 + 2CrCl3 + 6H2O
0 +1 +7 -2 +1 +6 –2 +2 +6 -2 +1 +6 –2 +2 +6 -2 +1 -2
Cd + KMnO4 + H2SO4 ![]() CdSO4
+ K2SO4 + MnSO4 + H2O
CdSO4
+ K2SO4 + MnSO4 + H2O
Определяем, какой из элементов изменил степень окисления.
+7 +2
![]()
![]() Mn
+ 5
Mn
+ 5![]() ®
Mn сстанавливается, окислитель 2
®
Mn сстанавливается, окислитель 2
0 +2 10
Cd - 2![]() ® Cd
окисляется, восстановитель
5
® Cd
окисляется, восстановитель
5
Находим наименьшее общее кратное для числа отданных и принятых электронов. Делим наименьшее общее кратное вначале на число принятых, затем – число отданных электронов. Полученные значения являются коэффициентами в уравнения, остальные коэффициенты подбираем сами.
0 +1 +7 -2 +1 +6 –2 +2 +6 -2 +1 +6 –2 +2 +6 -2 +1 -2
5Cd + 2KMnO4 + 8H2SO4 ![]() 5CdSO4 + K2SO4
+ 2MnSO4 + 8H2O
5CdSO4 + K2SO4
+ 2MnSO4 + 8H2O
ЛИТЕРАТУРА
1. Глинка Н.Л. Общая химия. – М., 2000.
2. Вовченко Г.Д., Третьяков Ю.Д. Общая химия. – М., 1980.
3. Зайцев О.С. Задачи, упражнения и вопросы по химии. – М., 1996.
4. Зайцев О.С. Химия. – М., 1997.
5. Глазов В.М. Основы физической химии. – М., 1981.