КОНТРОЛЬНАЯ РАБОТА
ПО БИОТЕХНОЛОГИИ
Биотехнологические процессы для решения проблем окружающей среды
СОДЕРЖАНИЕ
ВВЕДЕНИЕ......................................................................................................... 3
ГЛАВА 1. Биодеградация органических веществ...................... 3
ГЛАВА 2. Биотехнологическая очистка....................................... 13
окружающей среды от соединений тяжелых металлов... 13
ГЛАВА 3. БИООТРАНСФОРМАЦИЯ КСЕНОБИОТИКОВ........................ 14
ГЛАВА 4. БИОКОНВЕРСИЯ.......................................................................... 18
ЗАКЛЮЧЕНИЕ................................................................................................. 20
ЛИТЕРАТУРА.................................................................................................. 20
ВВЕДЕНИЕ
Специфическое применение биотехнологических процессов для решения проблем окружающей среды является предметом изучения экологической биотехнологии.
Экологическая биотехнология – это новейший подход к охране и сохранению окружающей среды при совместном использовании достижений биохимии, микробиологии, генной инженерии и химических технологий.
Экологическая биотехнология решает широкий спектр экологических проблем – от разработки и совершенствования методологии комплексного химико-биологического исследования экосистем вблизи источников загрязнения до разработки технологий и рекомендаций по рекультивации почвы, биологической очистке воды и воздуха, биосинтезу препаратов, компенсирующих вредное влияние изменения окружающей среды в результате действия антропогенных факторов. На сегодняшний день в литературе накопилось большое количество экспериментального материала по использованию биотехнологических процессов в целях улучшения экологической обстановки. В связи с этим, особо актуальным представляется осуществление критического обзора литературных сведений по данному вопросу.
Цель работы: осуществить критический обзор литературы по вопросу использования биотехнологических процессов для решения проблем окружающей среды.
Полученные данные помогут систематизировать, накопившийся за последнее время, фактический материал.
ГЛАВА 1. Биодеградация органических веществ
Биодеградация – это разложение (утилизация) веществ с использованием биологических систем [1, с. 16]. В настоящее время биодеградация веществ осуществляется преимущественно с помощью микроорганизмов.
Микробиологическая трансформация является естественным свойством микроорганизмов, широко распространенным в природе.
В настоящее время существуют следующие методы микробиологической трансформации органических соединений [2,3].
I. Использование ферментативных свойств интактных клеток
1. трансформация растущей культурой в периодических условиях;
2. использование ферментативной активности определенных фаз развития:
· трансформация суспензиями не размножающихся клеток;
· трансформация спорами;
· непрерывные процессы;
3. кометаболизм.
II. Методы, основанные на дезорганизации обменных процессов клетки:
1. применение в различной степени поврежденных и дезинтегрированных клеток;
2. ингибирование определенных участков метаболических путей;
3. применение мутантов с блокированным синтезом определенных ферментов.
III. Конструирование штаммов с повышенной способностью к трансформации органических соединений.
IV. Использование ферментных препаратов, иммобилизованных ферментов и клеток.
V. Политрансформации.
Современная методология микробиологической трансформации позволяет использовать для осуществления того или иного химического превращения любой микроорганизм, имеющий соответствующие ферменты.
Требования, предъявляемые к микробному штамму, пригодному для использования в биодеградации органических веществ, следующие [1]:
1. микроорганизм должен развиваться на сравнительно простых (по способу приготовления) и дешевых средах;
2. активность фермента или ферментной системы, ответственных за трансформацию, должна быть достаточно высокой;
3. накопление продукта трансформации в среде должно быть достигнуто наиболее простыми методами;
4. перечисленные выше условия должны обеспечивать экономическую рентабельность процесса.
В соответствии с этими требованиями для микробиологической трансформации органических соединений используются обычно сапрофитные микроорганизмы, способные расти на обычных микробиологических средах и отличающиеся интенсивным обменом веществ.
Попытки многих исследователей установить видовую и родовую специфичность различных трансформаций не всегда являлись успешными. Однако можно утверждать, что, например, для окисления алкильных заместителей ароматических соединений следует использовать активные штаммы в группе rhodochrous рода Rhodococcus, для окисления оксигрупп полиолов – уксуснокислые бактерии, для изомеризации альдоз – стрептомицеты бурой группы, артробактеры, лактобациллы и т.д. Более подробно таксоноспецифичность некоторых микробиологических трансформаций представлена в таблице 1.
Таблица 1
Таксоноспецифичность некоторых микробиологических трансформаций [4,5]
|
Тип процесса |
Организм |
|
1 |
2 |
|
Гидроксилирование стероидов |
Грибы |
|
Восстановление стероидов |
Род Mycobacterium |
|
Восстановление различных соединений |
Факультативные анаэробные бактерии, дрожжи |
|
Изомеризация альдоз |
Стрептомицеты, артробактеры, бациллы, лактобациллы |
|
Окисление различных углеводородов |
Псевдомонады |
|
Окисление полиолов |
Уксуснокислые бактерии |
|
Продолжение таблицы 1 |
|
|
1 |
2 |
|
Окисление н-алканов |
Нокардии, псевдомоданы, дрожжи рода Candida |
|
Гидроксилирование алкильных заместителей циклических соединений |
Родококки группы rhodochrous |
|
Гидроксилирование кольца ароматических соединений |
Артробактеры |
|
Окисление аминогруппы |
Стрептомицеты |
|
Дезаминирование |
Дрожжи |
|
Образование рибозидов и нуклеотидов из предшественников |
Бревибактерии |
|
Трансформации, связанные с расщеплением ароматического кольца |
Псевдомонады |
Существуют некоторые таксоны – роды или даже виды, известные своей способностью проводить разнообразные превращения органических веществ с накоплением продуктов трансформации. Среди них особого значение имеет Acetobacter suboxydans, осуществляющий десятки различных окислительных превращений углеводов и родственных соединений; Aspergillus niger, который наряду с окислением углеводов используется также для их восстановления; Brevibacterium ammoniagenes, который синтезирует рибозиды и нуклеотиды из предшественников и аминирует органические кислоты. Очень часто упоминаются в литературе представители родов Arthrobacter, Corynebacterium, Pseudomonas.
В качестве примера использования микробиологической трансформации органических соединений в промышленном масштабе можно привести получение амино- и органических кислот с использованием иммобилизованных в полиакриламидном или каррагинановом геле микроорганизмов [4]. Клетки E. coli, иммобилизованные в каррагинан, осуществляют превращение фумаровой кислоты в аспарагиновую.

![]()
![]() + NH3
+ NH3
фумаровая кислота L-аспарагиновая кислота
Одна из сложнейших проблем – утилизация целлюлозы. На планете ежегодно синтезируется 4×1010 т целлюлозы в результате фотосинтеза, т.е. в ней аккумулирована значительная часть солнечной энергии, поступающей на землю. Мировые ресурсы целлюлозы составляют 7×1011 т. Это линейный полимер из мономеров целлобиозы, основу которой составляет глюкоза. Полное расщепление целлюлозы до глюкозы могло бы решить множество проблем – получение большого количества углеводов и очистку среды от отбросов лесов и сельскохозяйственного производства, бумажной и текстильной промышленности. Расщепить целлюлозу не просто, так как она состоит из нерастворимых волокон, ассоциированных с другими полисахаридами – гемицеллюлозой, пектином, и окружена лигнином, закрывающим целлюлозу от ферментов. Животные не переваривают целлюлозу.
Многие бактерии и грибы способны расщеплять целлюлозу благодаря совместному действию нескольких ферментов, называемых целлюлазами.
У некоторых микроорганизмов они входят в состав целлюлосомы – белкового комплекса, находящегося на клеточной поверхности. Эти ферменты следующие [5]:
• эндоглюканаза, которая гидролизует b-1,4-связи между соседними остатками глюкозы в неплотно упакованных областях целлюлозы, образуя разрывы в середине цепи;
• экзоглюканаза, которая расщепляет разорванные целлюлозные цепи с нередуцирующих концов с образованием глюкозы, целлобиозы (два остатка глюкозы) и целлотриозы (три остатка глюкозы);
• целлобиогидролаза, которая часто присутствует в целлюлолитических грибах и является разновидностью экзоглюканазы, отщепляющей фрагменты из 10 и большего числа остатков глюкозы с нередуцирующих концов молекул целлюлозы;
• b-глюкозидаза, или целлобиаза, которая катализирует превращение целлобиозы и целлотриозы в глюкозу.
Расщепление целлюлозы с помощью целлюлолитических микроорганизмов происходит медленно и часто не до конца. Поэтому были предприняты попытки создать с помощью генной инженерии микроорганизмы, обладающие более высокой целлюлазной активностью. Для этого выделили про- и эукариотические гены, кодирующие отдельные ферменты целлюлазного комплекса.
Прокариотические эндоглюканазные гены клонировали и идентифицировали с помощью следующего простого, но эффективного подхода [3-5].
1. Клонированием в Е. coli создали банк ДНК-клонов целлюлолитического прокариотического организма и выращивали рекомбинантные клетки в течение 12 ч на твердой среде, содержащей селективный антибиотик.
2. Образовавшиеся колонии покрыли слоем агара, содержащего карбоксиметилцеллюлозу (КМК), растворимое производное целлюлозы, и инкубировали при 37°С еще несколько часов. За это время произошло частичное расщепление молекул КМК, находящихся вблизи колоний, которые синтезируют и секретируют эндоглюканазу. Трансформированные клетки, синтезирующие, но не секретирующие эндоглюканазу, не способны расщеплять данный субстрат, молекулы которого из-за большого размера не проникают в клетку.
3. Те области, где произошел гидролиз КМК, выявляли с помощью не токсичного для бактерий красителя конго красного и раствора хлорида натрия. Конго красный избирательно связывается с целлюлозой, окрашивая ее в красный цвет, и слабо связывается с низкомолекулярными сахаридами, окрашивая их в желтоватый цвет. Обработка хлоридом натрия стабилизирует цвет. Колонии, продуцирующие секретируемую эндоглюканазу, были окружены желтым гало, а фон, создаваемый нерасщепленной КМК, имел красный цвет.
С помощью этого подхода были выделены гены эндоглюканазы из Streptomyces, Clostridium, Thermoanaerobacter, Thermomonospora, Erwinia, Pseudomonas, Cellvibrio, Ruminococcus, Cellulomonas, Fibrobacter и Bacillus.
Для выявления рекомбинантных клонов, синтезирующих экзоглюканазу, использовали иммунный скрининг, позволяющий идентифицировать белок-мишень с помощью специфичных к нему антител; секреция белка при этом необязательна. Рекомбинантные клетки лизировали in situ (парами хлороформа), перенесли цитоплазматические белки на найлоновый или нитроцеллюлозный фильтр и провели иммунологический тест. Использованный при этом метод реплик позволил сохранить жизнеспособные клетки для дальнейших исследований.
Прокариотические b-глюкозидазные гены выделяли с помощью трансформации Е. coli банком ДНК-клонов, полученным из продуцирующего данный фермент микроорганизма, и отбора трансформантов, способных расти на минимальной среде с целлобиозой в качестве единственного источника углерода. Клоны, проявляющие b-глюкозидазную активность, можно также выявлять с помощью среды, содержащей хромогенный субстрат (например, 5-бром-4-хлор-3-индол-b-D-глюкопиранозид), или целлобиозного агара Мак-Конки; в этих условиях колонии окрашиваются в красный цвет.
Скрининг кДНК- или геномных библиотек с помощью гибридизации с гетерологичным зондом не очень эффективен при идентификации целлюлазных генов, поскольку их нуклеотидные последовательности довольно сильно различаются у разных организмов. Поэтому нужны новые подходы для выделения мРНК целлюлолитических ферментов из грибов или растений. К сожалению, эти мРНК составляют лишь небольшую часть суммарной мРНК, поэтому приходится обогащать библиотеки этими мРНК или кДНК и элиминировать кДНК-клоны, не несущие последовательности-мишени. Для выделения некоторых генов эукариотических целлюлаз использовали метод «дифференциальной гибридизации», суть которого состоит в следующем.
1. Выделяют мРНК из клеток, выращенных на среде без целлюлозы (неиндуцированных клеток), и клеток, которые для увеличения продукции целлюлаз были выращены в присутствии целлюлозы или ее производных (индуцированных клеток).
2. Каждую популяцию мРНК фракционируют в градиенте плотности сахарозы. Проводят трансляцию мРНК каждой фракции в бесклеточной системе на основе ретикулоцитов кролика или зародышей пшеницы. Определяют мол. массу соответствующих белков и проводят иммунологический тест, с тем чтобы идентифицировать фракцию (или фракции), содержащую мРНК целлюлазы. Разделяют продукты трансляции в полиакрил амидном геле и выявляют полосы, происходящие от индуцированных клеток и отсутствующие для неиндуцированных; материал этих полос и представляет собой белки, синтез которых был индуцирован целлюлозой.
3. мРНК-фракции индуцированных клеток, детерминирующие синтез целлюлаз, и их «партнеры» в градиенте плотности сахарозы мРНК неиндуцированных клеток по отдельности используют в качестве матриц для синтеза кДНК.
4. кДНК индуцированных клеток клонируют в плазмидном или фаговом векторе, вводят в Е. coli, высевают на чашки, делают реплики и проводят скрининг, используя в качестве гибридизационных зондов радиоактивно меченную кДНК фракций из индуцированных и неиндуцированных клеток. Клоны, гибридизующиеся с кДНК индуцированных и не гибридизующиеся с кДНК неиндуцированных клеток, могут содержать целлюлазные гены, поэтому проводят их дальнейшее изучение.
5. Чтобы доказать, что позитивные кДНК-клоны действительно кодируют целлюлазы, их ДНК гибридизуют с суммарной мРНК индуцированных клеток, проводят трансляцию гибридизовавшейся мРНК in vitro в бесклеточной системе и идентифицируют полученные продукты с помощью антител, специфичных к ферментам целлюлазного комплекса.
6. Определяют нуклеотидную последовательность каждого позитивного кДНК-клона и устанавливают, какие клоны кодируют одинаковые, а какие — разные белки целлюлазного комплекса.
Эту схему можно использовать для выделения любых индуцибельных эукариотических генов.
Клонированные целлюлазные гены можно использовать в разных целях: для облегчения очистки рекомбинантных белков с помощью связывающего целлюлозу домена; для получения коммерческих продуктов (например, этанола) из целлюлозных отходов с помощью микроорганизмов, в которые встроены целлюлазные гены.
Молекула целлюлазы обычно состоит из трех доменов: каталитического, шарнирного, часто обогащенного остатками пролина, серина и треонина, и связывающего целлюлозу. Каталитический и связывающий домены функционируют независимо друг от друга. Такое разделение функций можно использовать, включив нуклеотидную последовательность связывающего целлюлозу домена в состав химерного гена, другая часть которого кодирует представляющий коммерческий интерес белок. Чтобы очистить полученный белок, его экстракт пропускают через колонку, набитую целлюлозой. С целлюлозой связывается только гибридный белок; его элюируют и удаляют «целлюлозный» домен протеолизом. Эта система сходна с иммуноаффинной хроматографией, но обходится дешевле.
Большинство целлюлазных генов исходно клонировали и экспрессировали в Е. coli, но их можно ввести в другие микроорганизмы и получить новые штаммы с полезными свойствами. Так, S. cerevisiae и Z. mobilis, эффективно преобразующие в этанол простые сахара (например, глюкозу) после введения им целлюлазных генов, могли бы превращать целлюлозу непосредственно в этанол. Для проверки этой гипотезы провели ряд исследований.
В одной из серий экспериментов гены эндо- и экзоглюканазы бактерии Cellulomonas fimi, каждый из которых находился под контролем промотора и сигнальной последовательности S. cerevisiae, субклонировали в плазмидном векторе и ввели в S. cerevisiae. Некоторые трансформанты секретировали оба фермента в культуральную среду с эффективностью примерно 70% и частично расщепляли целлюлозу, входящую в состав фильтровальной бумаги и предварительно обработанных древесных стружек. Скорость и степень гидролиза этих субстратов возрастала при добавлении в смесь b-глюкозидазы, расщепляющей целлобиозу до глюкозы, но полного гидролиза целлюлозы не происходило. Это связано с существованием двух регуляторных механизмов, действующих по принципу обратной связи: накапливающаяся целлобиоза ингибирует гидролиз целлюлозы, а глюкоза ингибирует расщепление целлобиозы. Ген b-глюкозидазы выделили из грибов Trichoderma reesei, клонировали в мультикопийной плазмиде и вновь ввели в Т. reesei. Трансформированный штамм продуцировал b-глюкозидазу в 5,5-кратном избытке и расщеплял производное целлюлозы авицел (Avicel) на 33% быстрее, чем нетрансформированный штамм. Это подтверждает данные о том, что b-глюкозидаза облегчает ферментативное расщепление целлюлозы, и позволяет предположить, что для создания более эффективных целлюлолитических микроорганизмов нужно встроить в уже существующие штаммы гены b-глюкозидазы.
Эндоглюканазные гены можно использовать не только для получения из целлюлозных отходов полезных веществ, но и для других целей. Если ввести ген эндоглюканазы, находящийся под контролем конститутивного промотора актинового гена дрожжей, в винные дрожжи, можно усилить аромат получаемого вина. Это связано с повышением содержания в нем как минимум 12 летучих соединений, в том числе этилпропионата, 2-бутанола, изоамилацетата, изоамилонового спирта и изомасляной кислоты. С помощью такой генетической модификации можно стабилизировать процесс ферментации и создать такие штаммы дрожжей, которые будут производить вина с определенными свойствами.
Исследовалась также возможность использования целлюлаз при промышленной биопереработке бумажных отходов в этанол. Для этого отходы частично расщепляли целлюлазами при 45°С, а затем, не удаляя целлюлаз, проводили ферментацию высвободившейся глюкозы с помощью S. cerevisiae при 37°С. Основываясь на полученных результатах, рассчитали, что этот подход позволит получить 400 л этанола из 1 т бумажных отходов.
Аэробные и анаэробные микроорганизмы уже давно и широко используются для очищения от органических материалов воды. В бактериях рода Pseudomonas имеются оксиредуктазы, или гидроксилазы, способные разлагать углеводороды и высокотоксичные для окружающей среды ароматические вещества (бензол, толуол, ксилол). Гены, кодирующие в бактериях эти ферменты, локализованы в плазмидах. С помощью генной инженерии и генетических методов получен штамм Pseudomonas putida, который способен расти на неочищенной нефти и весьма эффективно очищать от нее сточные воды.
Бактерии родов Rhodococcus и Nocardia sp. используют для эмульгирования и сорбции углеводородов нефти из водной среды. Они способны разделять водную и нефтяную фазы, концентрировать нефть, очищать сточные воды от примесей нефти. Обещают стать ценными очистителями среды галобактерии. Некоторые из штаммов этих бактерий уже с успехом применяют для удаления мазута с песчаных пляжей.
ГЛАВА 2. Биотехнологическая очистка
окружающей среды от соединений тяжелых металлов
Очистка сточных вод от металлов часто основана на поглощении их микроорганизмами. Так, на практике используют нитчатые грибы, которые способны в больших количествах поглощать торий. Также перспективными в этом отношении являются штаммы Citrobacter sp. и Zoogloea, способные накапливать уран, медь, кобальт. Получены мутанты Citrobacter sp. с высоким уровнем фермента фосфатазы. Такие сверхпродуценты в 2,5 раза быстрее накапливают уран, чем родительский штамм [2]. Это связано с осаждением металла на поверхности клеток в результате энзиматического освобождения неорганического фосфата.
ГЛАВА 3. БИООТРАНСФОРМАЦИЯ КСЕНОБИОТИКОВ
Проблема утилизации ксенобиотиков сейчас стоит очень остро. В 1985 г. мировое производство лишь одного из загрязняющих окружающую среду химических веществ, пентахлорфенола, составило более 50000 т. Раньше токсичные вещества разрушали, сжигая их или обрабатывая другими химикатами, однако это тоже приводило к загрязнению окружающей среды, а кроме того, обходилось очень дорого. В середине 1960-х гг. были обнаружены почвенные микроорганизмы, способные к деградации ксенобиотиков: гербицидов, пестицидов, хладагентов, растворителей и т. д. Это открытие подтвердило правильность предположения о том, что микроорганизмы можно использовать для экономичного и эффективного разрушения токсичных химических отходов.
Основную группу почвенных микроорганизмов, разрушающих ксенобиотики, составляют бактерии рода Pseudomonas. Биохимические исследования показали, что разные штаммы Pseudomonas способны расщеплять более 100 органических соединений. Нередко один штамм использует в качестве источника углерода несколько родственных соединений.
В биодеградации сложной органической молекулы обычно участвуют несколько разных ферментов. Кодирующие их гены могут иметь хромосомную локализацию, но чаще входят в состав крупных (50-200 т.п.н.) плазмид, а иногда обнаруживаются как в хромосомной, так и в плазмидной ДНК.
Бактерии, разрушающие негалогенированные ароматические соединения, как правило, превращают их в катехол или протокатехоат, а затем, в ходе нескольких реакций окислительного расщепления, – в ацетил-СоА и сукцинат или пируват и ацетальдегид [5]. Эти последние соединения метаболизируются практически всеми микроорганизмами. Галогенированные ароматические соединения, основные компоненты большинства пестицидов и гербицидов, с помощью тех же ферментов разрушаются до катехола, протокатехоата, гидрохинона или их галогенированных производных, причем скорость их деградации обратно пропорциональна числу атомов галогена в исходном соединении. Дегалогенирование (отщепление замещающего атома галогена от органической молекулы), необходимое для детоксикации соединения, часто осуществляется в ходе неспецифической диоксигеназной реакции, путем замещения галогена в бензольном кольце на гидроксильную группу. Эта реакция может происходить как в ходе биодеградации исходного галогенированного соединения, так и потом.
Некоторые микроорганизмы обладают природной способностью к деградации различных ксенобиотиков, однако следует иметь в виду, что [1,5]:
1) ни один из них не может разрушать все органические соединения;
2) некоторые органические соединения в высокой концентрации подавляют функционирование или рост деградирующих их микроорганизмов;
3) большинство очагов загрязнения содержит смесь химикатов, и микроорганизм, способный разрушать один или несколько ее компонентов, может инактивироваться другими компонентами;
4) многие неполярные соединения адсорбируются частицами почвы и становятся менее доступными;
5) биодеградация органических соединений часто происходит довольно медленно.
Часть этих проблем можно решить, осуществив конъюгационный перенос плазмид, которые кодируют ферменты разных катаболических путей, в один реципиентный штамм.
Если две плазмиды содержат гомологичные участки, то между ними может произойти рекомбинация с образованием гибридной плазмиды, которая имеет больший размер и обладает свойствами исходных плазмид. Если же две плазмиды не содержат гомологичных участков и относятся к разным группам несовместимости, то они могут сосуществовать в одной бактерии.
В 1970-х гг. Чакрабарти и его коллегами был создан первый бактериальный штамм, обладающий более широкими катаболическими возможностями. Он расщеплял большинство углеводородов нефти и был назван «супербациллой». Для его получения использовали плазмиды, каждая из которых кодировала фермент, расщепляющий определенный класс углеводородов: плазмида САМ детерминировала деградацию камфары, ОСТ – октана, NAH – нафталина, XYL - ксилола (рис. 1).
Сначала путем конъюгации перенесли плазмиду САМ в штамм, несущий плазмиду ОСТ. Эти две плазмиды несовместимы (не могут существовать в одной клетке в виде отдельных плазмид), но в результате происходящей между ними рекомбинации образуется одна плазмида, объединяющая их функции. Затем аналогичным путем плазмиду NAH перенесли в штамм, несущий плазмиду XYL. Эти плазмиды совместимы и могут сосуществовать в одной клетке-хозяине. И наконец, гибридную плазмиду перенесли в штамм, несущий плазмиды NAH и XYL. В результате всех этих манипуляций получили штамм, который растет на неочищенной нефти лучше исходных штаммов, взятых по отдельности или вместе.
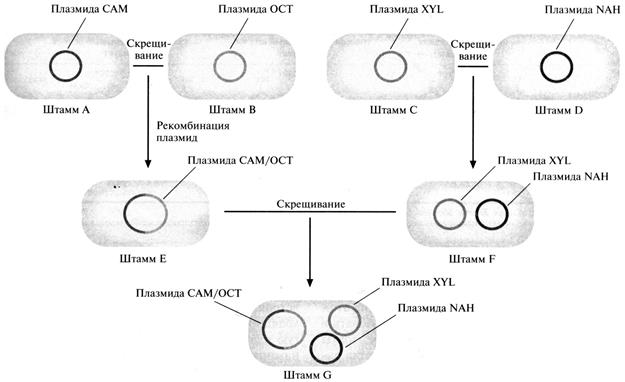
Рис. 1. Создание бактериального штамма, способного разрушать камфару, октан, ксилол и нафталин [5, с. 30]
Объединение разных метаболических путей в одном микроорганизме с помощью конъюгации – это лишь один из способов создания бактерий с новыми свойствами. Расширить их катаболические возможности можно и другим путем, модифицируя гены, кодирующие ферменты того или иного метаболического пути.
Одним из наиболее распространенных веществ, загрязняющих почву и воду, является трихлорэтилен, широко использующийся в качестве растворителя и обезжиривающего средства. Он длительное время остается в окружающей среде и считается канцерогеном. Кроме того, анаэробные почвенные бактерии могут дегалогенировать его, превращая в еще более токсичное соединение винилхлорид.
Было показано, что некоторые штаммы P. putida, разрушающие ароматические соединения, такие как толуол, разрушают и трихлорэтилен. С помощью проведенных генетических исследований удалось установить, что для полной детоксикации трихлорэтилена не нужны все ферменты мета-расщепления ксилола и толуола, достаточно лишь толуолдиоксигеназы, которая в норме катализирует реакцию окисления толуола до цис-толуолдигидродиола.
Образование функциональной толуолдиоксигеназы кодируется четырьмя генами. Их выделили и экспрессировали в Е. coli под контролем сильного индуцибельного tac-промотора, который активируется изопропил-b-D-тиогалактопиранозидом (ИПТГ), в результате чего трихлорэтилен разлагается до безвредных соединений. Исходная скорость деградации трихлорэтилена в Е. coli ниже, чем в P. putida, но она сохраняется в Е. coli дольше. С этим различием может быть связана меньшая, чем у P. putida, чувствительность Е. coli к повреждающему действию трихлорэтилена.
ГЛАВА 4. БИОКОНВЕРСИЯ
Биоконверсия - это превращение ненужного (как правило, экологически вредного) сырья в полезные продукты с помощью биологических систем.
Примером биоконверсии может служить синтез биогаза [1] (смесь из 65 % метана, 30 % СО2, 1% Н2S и незначительные примесей азота, кислорода, водорода и угарного газа) – биометаногенез. Биометаногенез – это сложный микробиологический процесс, в котором органическое вещество разлагается до оксида углерода (IV) и метана в анаэробных условиях. В процессе биометаногенеза микробиологическому анаэробному разложению поддаются практически все соединения природного происхождения, а также значительная часть ксенобиотиков органической природы. Для получения биогаза можно использовать отходы животноводства, зерноводства, полеводства, хлопководства, пищевой, легкой, микробиологической, лесной и др. отраслей, стоки крахмалперерабатывающих предприятий, жидкие отходы сахарных заводов, бытовые отходы, сточные воды.
В процессе биометаногенеза выделяют 3 последовательные стадии, в которых учавствуют свыше 190 различных микроорганизмов.
На первой стадии под влиянием экстрацеллюлярных ферментов осуществляется гидролиз сложных многоуглеродных соединений – белков, липидов и полисахаридов. На данной стадии функционируют гидролитические бактерии, а также бродильщики, катализирующие расщепление моносахаридов и органических кислот.
На второй стадии (ацидогенез) в процессе ферментации учавствуют 2 группы микроорганизмов: ацетогенные и гомоацетатные. Ацетогенные Н2-продуцирующие микроорганизмы ферментируют расщепление моносахаридов, спиртов и органических кислот с образованием Н2, СО2, низших жирных кислот, в основном ацетата, спиртов и некоторых других низкомолекулярных соединений. Деградация бутирата, пропионата, лактата происходит при совместном действии ацетогенных Н2-продуцирующих и Н2-утилизирующих бактерий. Гомоацетатные микроорганизмы усваивают Н2 и СО2, а также некоторые одноуглеродные соединения через стадию образования ацетил-КоА и превращения его в низкомолекулярные кислоты, в основном ацетат.
На заключительной третьей стадии анаэробного разложения отходов образуется метан. Он может синтезироваться через стадию восстановления СО2 молекулярным водородом, а также из метильной группы ацетата. Некоторые метановые бактерии способны использовать в качестве субстрата формиат, СО2, метанол, метиламин и ароматические соединения:
4Н2 + СО2 = СН4 + 2Н2О
3Н2 + СО = СН4 + Н2О
2Н2О + 4СО = СН4 + 3СО2
4НСООН = СН4 + 3СО2 + 2Н2О
3СН3ОН = 3СН4 + СО2 + 2Н2О
СН3СООН = СН4 + СО2
90-95 % используемого углерода метанообразующие бактерии превращают в метан и лишь 5-10 % углерода превращается в биомассу, что свидетельствует о высокой производительности и экономичности биометаногенеза.
ЗАКЛЮЧЕНИЕ
Осуществленный критический анализ литературных данных свидетельствует о том, что использование биотехнологических процессов для решения проблем окружающей среды позволяет существенно улучшить экологическую обстановку. Последнее достигается за счет микробиологического разрушения загрязняющих веществ. Использование генномодифицированных организмов позволяет значительно увеличить скорость разложения токсикантов, а также осуществлять трансформацию ксенобиотиков (не подвергающихся ферментации природными микроорганизмами) с образованием нетоксичных соединений.
В настоящее время микробная биодеградация и биоконверсия служат основой для создания многих безотходных экологически чистых производств в сельском хозяйстве и промышленности. Все большее распространение получают биотехнологические цепочки, в которых отходы и побочные продукты одного биотехнологического процесса используются в качестве сырья для другого.
ЛИТЕРАТУРА
1. Егорова Т.А., Клунова С.М., Живухина Е.А. Основы биотехнологии. – М.: Академия, 2003. – 208 с.
2. Скрябин Г., Головлева Л. Биотехнология защиты окружающей среды от ксенобиотиков // Изв. АН СССР Сер. «Биотехнология». – М., 1986. - № 6.- С. 805-813.
3. Телитченко М., Остроумов С. Введение в проблемы биохимической экологии. Биотехнология, охрана среды. – М.: Наука, 1999. – 380 с.
4. Елинов Н.П. Основы биотехнологии. – СПб.: Академия, 2004. – 300 с.
5. Шабарова З.А., Богданов А.А., Золотухин А.С. Химические основы генной инженерии. – М.: Просвещение, 1994. – 410 с.