КОНТРОЛЬНАЯ РАБОТА
ПО ХИМИИ
СОДЕРЖАНИЕ
ЧАСТЬ I............................................................................................................... 4
ЗАДАЧА № 303 (вариант 10)......................................................................... 4
Условие........................................................................................................ 4
Решение........................................................................................................ 4
ЗАДАЧА № 320............................................................................................... 4
Условие........................................................................................................ 4
Решение........................................................................................................ 4
ЗАДАЧА № 343............................................................................................... 5
Условие........................................................................................................ 5
Решение........................................................................................................ 5
ЗАДАЧА № 477............................................................................................... 6
Условие........................................................................................................ 6
Решение........................................................................................................ 6
ЗАДАЧА № 617............................................................................................... 7
Условие........................................................................................................ 7
Решение........................................................................................................ 8
ЧАСТЬ II.............................................................................................................. 8
ЗАДАЧА № 667............................................................................................... 8
Условие........................................................................................................ 8
Решение........................................................................................................ 9
ЗАДАЧА № 719 (вариант 3)........................................................................... 9
Условие........................................................................................................ 9
Решение...................................................................................................... 10
ЗАДАЧА № 753 (вариант 4)......................................................................... 10
Условие...................................................................................................... 10
Решение.......................................................................................................... 10
ЗАДАЧА № 757 (вариант 5)......................................................................... 11
Условие...................................................................................................... 11
Решение...................................................................................................... 12
ЗАДАЧА № 773 (вариант 5)......................................................................... 13
Условие...................................................................................................... 13
Решение...................................................................................................... 13
ЗАДАЧА № 784............................................................................................. 14
Условие...................................................................................................... 14
Решение...................................................................................................... 15
ЧАСТЬ I
ЗАДАЧА № 303 (вариант 10)
Условие
Вычислить
фактор пересчета, если определяемым веществом является Н3РО4,
а весовой формой – Mg2P2O7.
Решение
Mg2P2O7
→ 2Н3РО4
Рассчитываем
молярную массу данных веществ (М), которая равна молекулярной массе (Мr):
М(Mg2P2O7) = Мr(Mg2P2O7)
= Ar(Mg)∙2 + Ar(Р)∙2 + Ar(О)∙7 = 24∙2 + 31∙2 +
16∙7 = 222 г/моль;
М(Н3РО4) = Мr(Н3РО4)
= Ar(Н)∙3 + Ar(Р) + Ar(О)∙4 = 1∙3 + 31 + 16∙7 = 146г/моль.
Так как из
одного моля Mg2P2O7 образуется 2 моля Н3РО4,
то из 222 г Mg2P2O7 будет образовываться 146
г∙2 = 292 г Н3РО4.
Рассчитываем
фактор пересчета:
222г/292г = 0,76.
Ответ:
фактор пересчета для определяемого вещества Н3РО4
при весовой форме Mg2P2O7 равняется 0,76.
ЗАДАЧА № 320
Условие
Сульфат
алюминия содержит около 88 % Al2(SO4)3×18H2O.
Рассчитать навеску, необходимую для определения алюминия в виде Al2O3,
если масса Al2O3 0,1 г.
Решение
Al2(SO4)3×18H2O
®
Al2O3
Рассчитываем
молярную массу данных веществ (М), которая равна молекулярной массе (Мr):
М(Al2(SO4)3×18H2O)
= Мr(Al2(SO4)3×18H2O) =
Ar(Al)∙2 + Ar(S)∙3 + Ar(О)∙12 + (Ar(Н)∙2 + Ar(О))×18
= 27∙2 + 32∙3 + 16∙12 + (1×2 + 16)×18
= 666 г/моль;
М(Al2O3) = Мr(Al2O3)
= Ar(Al)∙3 + Ar(О)∙3 = 27∙3 + 16∙3 = 102 г/моль.
Для
образования одного моля Al2O3 необходим 1 моль Al2(SO4)3×18H2O.
Следовательно, для образования 102 г Al2O3 требуется 666
г Al2(SO4)3×18H2O, а
для образования 0,1 г Al2O3
потребуется х г Al2(SO4)3×18H2O.
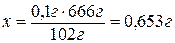
По условию
задачи 0,653 г Al2(SO4)3×18H2O
составляют 88 % навески,
тогда х г - 100 %.
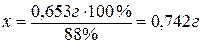
Ответ:
для получения 0,1 г Al2O3 необходимо взять навеску,
массой 0,742 г.
ЗАДАЧА № 343
Условие
Сколько
процентов составят потери при промывании 300 мл воды осадка Al(OH)3,
полученного из 0,1000 г Al2O3?
Решение
Al2O3
®
2 Al(OH)3
Рассчитываем
молярную массу данных веществ (М), которая равна молекулярной массе (Мr):
М(Al2O3) = Мr(Al2O3)
= Ar(Al)∙3 + Ar(О)∙3 = 27∙3 + 16∙3 = 102 г/моль;
М(Al(OН)3) = Мr(Al(OН)3) = Ar(Al) +
Ar(О)∙3 + Ar(Н)∙3 = 27 + 16∙3 + 1×3 = 78 г/моль.
1 моль Al2O3
расходуется на образование двух молей Al(OH)3. Следовательно,
из 102 г Al2O3 образуется 78 г×2 = 156 г Al(OH)3,
а
из 0,1000г Al2O3 - х
г Al(OH)3.

Растворимость
Al(OH)3 в воде составляет 5,2×10-9
моль/л (справочные данные). Тогда в 300 мл (0,3 л) воды растворится 5,2×10-9
моль/л×0,3
л = 1,56×10-9
моль Al(OH)3.
Если 1 моль
Al(OH)3 весит 78 г, то
1,56×10-9
моль Al(OH)3 - х
г.
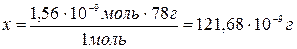
Масса осадка Al(OH)3 0,1529 г составляет 100 %, а
масса растворившегося в воде Al(OH)3 0,12168×10-6
г – х %.
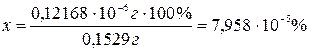
Ответ:
потери Al(OH)3 составят 7,958×10-5 %.
ЗАДАЧА № 477
Условие
Какую навеску
х.ч. NaNO3 взяли для анализа по методу восстановления NO3-
до NH3, если выделившийся аммиак был поглощен 40,00 мл 0,1245 н. HCl
и избыток кислоты оттитрован 22,40 мл 0,1002 н. NaOH?
Решение
Определяем
массу HCl, взятой для поглощения NH3. Запись 0,1245 н. HCl означает,
что в 1 л раствора содержится 0,1245 эквивалентов HCl. Рассчитываем
эквивалентную массу HCl.
Мэкв.(HCl)= Mr(HCl) = Ar(Н) + Ar(Cl) = 1 + 35,5 =
36,5 г-экв.
Если 1 эквивалент HCl весит 36,5 г, то
0,1245
эквивалентов - х
г.
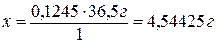
Следовательно, в 1000 мл раствора содержится 4,54425 г HCl,
тогда
в 40,00 мл раствора -
х г HCl.
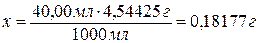
Количество
HCl, оставшейся в избытке и оттитрованной 22,40 мл 0,1002 н. NaOH будет равно
22,40 мл 0,1002 н. HCl. Рассчитываем массу этой кислоты.
Если 1 эквивалент HCl весит 36,5 г, то
0,1002
эквивалента -
х г.
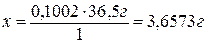
Если в 1000 мл раствора содержится 3,6573 г HCl, то
в 22,40 мл
раствора - х
г HCl.
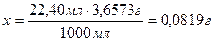
Рассчитываем
массу HCl, израсходованной на поглощение NH3.
0,18177 г – 0,0819 г = 0,09987 г
NaNO3
®
NH3;
NH3
+ HCl = NH4Cl.
Из
записанного выше видим, что 1 моль HCl расходуется на поглощение 1 моля NH3,
для образования которого необходим 1 моль NaNO3.
Рассчитываем
молярную массу NaNO3.
М(NaNO3)
= Mr(NaNO3) = Ar(Na) + Ar(N)+ Ar(О)∙3 = 23 + 14 + 16∙3 =
85 г/моль.
Если 36,5 г
HCl соответствует 85 г NaNO3, то
0,09987 г HCl - х г NaNO3.
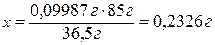
Ответ:
для анализа взяли навеску NaNO3, массой 0,2326 г.
ЗАДАЧА № 617
Условие
Сколько
граммов Н2О2 содержится в пробе, если при титровании
израсходовано 14,50 мл раствора КMnO4, 1,00 мл которого эквивалентен
0,08376 г Fe?
Решение
1 мл КMnO4
эквивалентен 0,08376 г Fe. Это означает, что в 1 мл раствора КMnO4
масса эквивалентов равна 0,08376 г. Тогда, в 1000 мл раствора КMnO4
масса эквивалентов будет в 1000 раз больше: 0,08376 г×1000 = 83,76 г.
Рассчитываем
массу 1 эквивалента КMnO4.
Мэкв.(КMnO4)= Mr(КMnO4) =
Ar(К) + Ar(Mn) + Ar(О)∙4 = 39 + 55 + 16∙4 =
= 158 г-экв.
Определяем,
сколько эквивалентов содержится в 83,76 г КMnO4: 83,76 г / 158
г-экв. = 0,53013.
Следовательно,
на титрование раствора Н2О2 пошло 14,5 мл 0,53013 н. КMnO4.
Значит и количество оттитрованного раствора Н2О2 тоже
можно определить как 14,5 мл 0,53013 н. Н2О2. Определяем массу
данного раствора, для чего находим эквивалентную массу Н2О2.
Мэкв.(Н2О2) = Мr(Н2О2)/2
= (Ar(Н)∙2 + Ar(О)∙2)/2 = (1∙2 + 16∙2)/2 = 17 г-экв.
Если 1 эквивалент Н2О2 составляет 17
г, то 0,53013 эквивалентов Н2О2 будут весить 0,53013×17
г = 9,01215 г.
9,01215 г Н2О2
содержится в 1000 мл раствора, тогда
х г Н2О2 - в 14,5 мл.
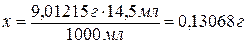
Ответ: в пробе
содержится 0,13068 г Н2О2.
ЧАСТЬ II
В качестве
одной нерешенной задачи выбрана задача № 741.
ЗАДАЧА № 667
Условие
Определить
процентное содержание марганца в стали, если при фотометрировании получены
следующие данные:
Эталон I
II III
СMn, % 1,20 0,94
0,48
DS
0,47 0,39
0,17
Анализируемый образец имеет DSх = 0,30.
Решение
Основываясь на полученных данных по фотометрированию
эталонных образцов, строим калибровочный график (рис. 1).
По калибровочному графику определяем, что DSх = 0,30 соответствует
концентрация марганца 0,77 %.
Рис. 1.
Ответ:
содержание марганца в стали составляет 0,77 %.
ЗАДАЧА № 719 (вариант 3)
Условие
Определить
процентное содержание индифферентных примесей в образце медного купороса CuSО4×5H2O,
если после растворения его навески, массой 0,6274 г и электролиза полученного
раствора выделено на платиновом катоде 0,1586 г меди.
Решение
Рассчитываем
молекулярную массу CuSО4×5H2O.
Мr(CuSО4×5H2O) = Ar(Cu) + Ar(S) +
Ar(О)∙4 + (Ar(Н)×2 + Ar(О))×5 = 64 + 32 + 16∙4 + (1×2 + 16) 5 = 250
Согласно формуле 64 г Cu содержится
в 250 г CuSО4×5H2O, тогда
0,1586
г Cu - в
х г CuSО4×5H2O.
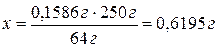
0,6274 г навески составляют 100
%, а
0,6195 г содержащегося в ней CuSО4×5H2O
– х %.
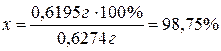
Тогда масса
примесей будет составлять 100 % - 98,75 % = 1,25 %.
Ответ:
содержание индифферентных примесей в образце медного купороса составляет 1,25
%.
ЗАДАЧА № 753 (вариант 4)
Условие
После соответствующей обработки соответствующих образцов
стали, содержащих хром, сняли их полярограммы и получили следующие результаты:
Образцы 1 2
3 4
СCr, % 0,30
0,42 0,96 1,40
h, мм 8,0
10,0 20,0 28,0
Построить
калибровочный график и определить процентное содержание хрома в анализируемом
образце, если при его полярографировании высота волны оказалась 14,0 мм.
Решение
Строим
калибровочный график (рис. 3).
Рис. 3.
Полярограмме, высотой 18,0 мм,
соответствует концентрация Cr 0,63 %.
Ответ:
содержание хрома в исследуемом образце составляет 0,63 %.
ЗАДАЧА № 757 (вариант 5)
Условие
Для
определения содержания кадмия в сплаве методом добавок навеску сплава а 2,2940 г растворили и после
соответствующей обработки объем раствора довели до 250,0 мл. Для снятия
полярограммы взяли 18,0 мл этого раствора. Высота волны оказалась 19,5 мм.
После добавки 5,0 мл 0,043 н. CdSO4 (Vст) высота волны
увеличилась до h¢
28,0 мм. Определить процентное содержание кадмия в сплаве.
Решение
0,043 н. CdSO4
означает, что
в 1 л раствора содержится 0,043 эквивалента CdSO4,
тогда
в 0,005 л раствора
- х.
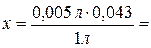 21,5×10-5
21,5×10-5
Рассчитываем массу 1 эквивалента
CdSO4:
Мэкв.(CdSO4)
= Mr(CdSO4)/2 = (Ar(Cd) + Ar(S) + Ar(О)×4)/2 = (112 + 32 + 16×4)/2 =104 г-экв.
Если масса 1 эквивалента CdSO4 равна 104 г,
то масса 21,5×10-5 эквивалента - х
г.
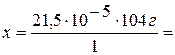 2,236×10-2 г.
2,236×10-2 г.
Mr(CdSO4)×= Ar(Cd) + Ar(S) + Ar(О)×4 = 112 + 32 + 16×4= 208
Если в 208 г CdSO4 содержится 112 г Cd, то
в 2,236×10-2
г - х.
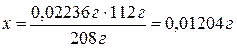
Рассчитываем
высоту волны, приходящуюся на 0,01204 г Cd:
28 мм – 19,5 мм = 8,5 мм.
Волна, высотой 8,5 мм соответствует 0,01204 г Cd, тогда
волна, высотой 19,5 мм - х.
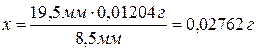
Следовательно,
в 18 мл раствора содержится 0,02762 г Cd, тогда
в 250
мл - х.
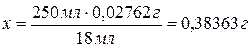
Масса 2,2940
г составляет 100 %, а
масса
0,38363 г - х.
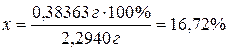
Ответ:
содержание кадмия в сплаве составляет 16,72 %.
ЗАДАЧА № 773 (вариант 5)
Условие
Для
хроматографического определения никеля на бумаге, пропитанной раствором
диметилглиоксима, приготовили три стандартных раствора. Для этого навеску NiCl2×6Н2О,
массой 0,2480 г, растворили в мерной колбе на 50 мл. Затем из этой колбы взяли
5,0; 10,0 и 20,0 мл и разбавили в колбах на 50 мл. Исследуемый раствор также
разбавили в мерной колбе на 50 мл.
Построить
калибровочный график в координатах h-CNi
и определить содержание никеля (мг) в исследуемом растворе, если высота пиков
стандартных растворов равна 25,5; 37,5 и 61,3 мм, а высота пика исследуемого
раствора равна 49,0 мм.
Решение
Определяем
молекулярную массу NiCl2×6Н2О:
Мr(NiCl2×6Н2О)
= Ar(Ni) + Ar(Cl)×2
+ ((Ar(Н)×2
+ Ar(О))×6)
= 59 + 35,5×2
+ ((1×2
+ + 16)×6)
= 238
Исходя из формулы в 238 мг NiCl2×6Н2О
содержится 59 мг Ni, а
в 248
мг - х.
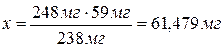
Определяем
содержание Ni в 1 мл стандартных растворов. Если 61,479 мг Ni содержится в 50
мл раствора, то в 1 мл данного раствора содержится 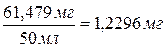 .
.
На
основе этих данных определяем массу никеля в каждом из стандартных растворов
(табл. 3).
Таблица
3
|
Высота
пиков, мм
|
25,5
|
37,5
|
61,3
|
|
Объем
раствора, мл
|
5,0
|
10,0
|
20,0
|
|
Масса
никеля, мг
|
6,148
|
12,296
|
24,592
|
Строим
калибровочный график (рис. 2).
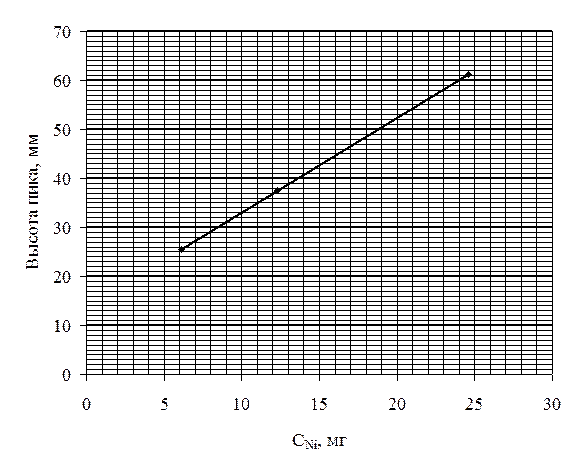 Рис. 2.
Рис. 2.
По
калибровочному графику определяем, что концентрация никеля в исследуемом
растворе равна 18,1 мг.
Ответ:
содержание никеля в исследуемом растворе равно 18,1 мг.
ЗАДАЧА № 784
Условие
При
фотометрическом определении меди в растворе получили следующие данные (г/л):
5,1×10-3;
5,5×10-3;
5,4×10-3;
5,8×10-3;
5,2×10-3.
Вычислить стандартное отклонение единичного определения и доверительный
интервал среднего значения (для a = 0,95).
Решение
Рассчитываем
среднее для данного массива значений:
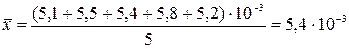 .
.
Стандартное
отклонение – это мера того, насколько широко разбросаны точки данных
относительно их среднего. Оно определяется по формуле:
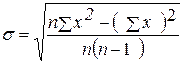
å(х) = 2,7×10-3
åх2 = (5,1×10-3)2
+ (5,5×10-3)2
+ (5,4×10-3)2
+ (5,8×10-3)2
+ (5,2×10-3)2
= 1,46×10-4
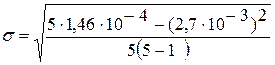 = 2,74×10-4
= 2,74×10-4
Доверительный
интервал – это интервал с обеих сторон от среднего выборки.
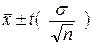 .
.
t – та часть
стандартной нормальной кривой, которая равняется (1 – a). Это значение равно ±
0,063 (справочные данные).
Доверительный
интервал равен:
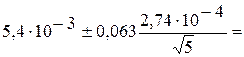 5,4×10-3 ± 7,7×10-6.
5,4×10-3 ± 7,7×10-6.
Ответ:
стандартное отклонение единичного определения равно 2,74×10-4;
доверительный интервал среднего значения равен 5,4×10-3 ± 7,7×10-6.