Содержание
Задача № 15. 3
Задача № 19. 7
Задача № 39. 8
Задача № 59. 10
Задача № 79. 11
Задача № 99. 12
Задача № 119. 15
Задача № 139. 18
Список используемой литературы.. 19
Задача № 15
Чем отличаются растворы высокомолекулярных веществ (ВМВ) от дисперсных систем? Какие процессы называют набуханием ВМВ, а какие застудневанием?
Решение.
Растворы ВМС имеют ряд специфических особенностей. В отличие от коллоидных систем растворы высокомолекулярных веществ образуются самопроизвольно при контакте полимера с растворителем путем набухания, переходящего в растворение. Самопроизвольный процесс растворения сопровождается уменьшением энергии Гельмгольца в системе (∆А < 0), тогда как диспергирование вещества до коллоидного состояния требует значительных затрат энергии (∆А > 0). Коллоидные растворы, обладающие избыточной поверхностной энергией, термически неустойчивы, не могут быть получены и не могут существовать без присутствия стабилизатора и даже при его наличии способны стареть. Растворы же высокомолекулярных соединений при неизменности внешних условий могут существовать неограниченно долго без стабилизирующих добавок и являются термодинамически устойчивыми. Вследствие этого процессы, происходящие в них с изменением температуры, давления и концентрации, обратимы. Обратимость свойств и подчинение растворов ВМС правилу фаз также подтверждают их термодинамическую устойчивость. Однако следует отметить, что равновесие в растворах ВМС устанавливается чрезвычайно медленно (иногда через недели и месяцы и более).
Высокомолекулярные соединения, как и низкомолекулярные вещества в зависимости от условий могут образовывать не только истинные, но и коллоидные растворы (например, латексы — это коллоидные растворы каучуков в водной среде). Нередко растворы ВМС проявляют свойства коллоидов лишь частично. Гибкие макромолекулы способны при тепловом движении изменять форму в растворе. Такие различные формы макромолекул, переходящие друг в друга, называют конформациями. В хороших растворителях макромолекулы обычно вытянуты и гибки, в плохих — более жестки, проявляют тенденцию к свертыванию. Растворы, в которых макромолекулы свернуты в клубок, в большей степени проявляют свойства коллоидных растворов, так как макромолекулы, свернутые в клубок, можно рассматривать как зародыши новой фазы, поскольку наружные и внутренние части клубка находятся в разных условиях. Как зародыши новой фазы можно рассматривать ассоциаты молекул, тенденция к образованию которых наблюдается в растворах средних концентраций. Такие растворы высокомолекулярных соединений сближаются по свойствам с коллоидными.
Растворение высокомолекулярных соединений представляет собой весьма своеобразный процесс, отличающийся от растворения низкомолекулярных веществ. При растворении низкомолекулярных веществ происходит взаимное смешение растворителя и растворенного вещества, близких по размерам молекул и по скорости диффузии. При растворении высокомолекулярных соединений обычно вначале происходит набухание, т.е. проникновение небольших и подвижных молекул растворителя в полимер. Молекулы растворителя раздвигают макромолекулы, ослабляя связи между ними и облегчая им тем самым переход в раствор. При растворении полимера можно выделить четыре стадии существования системы (см. рис. 1.). В исходном состоянии система состоит из двух индивидуальных веществ: растворителя и полимера (I). Далее происходит набухание полимера и образование студнеобразного раствора низкомолекулярного растворителя в полимере Ж2/Ж2, погруженного в чистый растворитель Ж1 (II). Таким образом, на начальном этапе происходит набухание, т.е. одностороннее растворение. В дальнейшем вследствие увеличения расстояния между макромолекулами и ослабления связей между ними происходит отрыв макромолекул от полимера и переход их в растворитель. Образуется два раствора: жидкий — полимера в растворителе — Ж1/Ж2 и студнеобразный — растворителя в полимере — Ж2/Ж1 (III). Процесс набухания может прекратиться на стадиях II и III. В этом случае говорят об ограниченном набухании. В пределе наблюдается равномерное распределение молекул высокомолекулярного вещества по всему объему низкомолекулярного растворителя с образованием истинного раствора (IV). В этом случае говорят о неограниченном набухании.
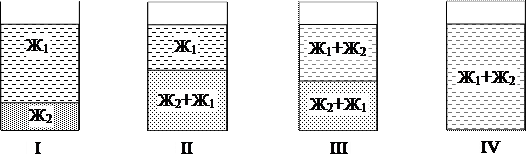 |
Рис. 1. Схема последовательных стадий растворения ВМС.
Способность полимеров к набуханию в различных растворителях
измеряется степенью набухания α. Величина α — это отношение массы поглощенной
низкомолекулярной жидкости к массе исходного полимера: 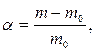 где т0 и т — масса полимера
до и после набухания. Часто о набухании судят не по привесу, а по увеличению
объема образца.[1]
где т0 и т — масса полимера
до и после набухания. Часто о набухании судят не по привесу, а по увеличению
объема образца.[1]
Наблюдения за процессом набухания показали, что его, в большинстве случаев, можно разделить на две стадии. Первая протекает с выделением теплоты набухания Q, сопровождается контракцией системы и характеризуется сравнительно небольшим значением α.
Дифференциальная теплота в процессе набухания уменьшается, поскольку сольватация вначале идет по наиболее активным участкам, а затем молярная энергия взаимодействия молекул растворителя с полимером постепенно уменьшается.
Для второй стадии характерно почти полное прекращение выделения теплоты и контракции. Но именно на этой стадии происходит основное увеличение объема и массы полимера. Отсюда следует, что процесс набухания во второй стадии определяется не энергетическими, а иными причинами. Наиболее общим объяснением механизма второй стадии является увеличение энтропии системы благодаря росту числа возможных конформаций.
Процесс перехода раствора в студень называется застудневанием или желатинированием. Желатинирование — это своеобразная коагуляция, когда одновременно с дисперсной фазой выпадает в осадок и дисперсионная среда. Желатинирование происходит в том случае, когда частицы золя сильно связаны с дисперсионной средой.
Процесс желатинирования можно представить себе следующим образом. Отдельные, удлиненные мицеллы, сталкиваясь между собой в процессе кинетического движения, соединяются гидрофобными участками. В результате образуется рыхлая сетка (каркас), которая охватывает весь объем раствора. Дисперсионная среда состоит, вероятнее всего, из молекулярно-дисперсного раствора очень низкой концентрации, что и приводит систему к потере подвижности. Утрата раствором текучести (не выливается из опрокинутого сосуда) служит внешним признаком момента образования студня.
Связи между частицами дисперсной фазы могут также образовываться за счет взаимодействия полярных и ионизированных групп макромолекул. Соединение мицелл в сетку может быть настолько непрочно, что достаточно встряхивания, чтобы произошло разрушение структуры студня и получился раствор, который при стоянии опять может застыть.
Таким образом, истинное застудневание обусловливается не слиянием сольватных оболочек коллоидных частиц (лиосфер), а образованием достаточно прочной внутренней структуры за счет взаимодействия незащищенных растворителем лиофобных участков мицелл.[2]
Задача № 19
С позиции ДЛФО, ответьте, какую электролитную коагуляцию называют нейтрализационной. а какую – концентрационной? Какие электролиты являются индифферентными, а какие – неиндифферентными?
Решение.
Наиболее легко достижима коагуляция золей под действием электролитов. Прибавление электролитов к ионостабилизированному коллоидному раствору приводит к снижению электрокинетического потенциала и, следовательно, к уменьшению сил отталкивания. Различают два вида коагуляции золей электролитами – концентрационную и нейтрализационную коагуляцию.
Концентрационная коагуляция наблюдается при увеличении концентрации электролита, не вступающего в химическое взаимодействие с компонентами коллоидного раствора. Такие электролиты называются индифферентными; они не должны иметь ионов, способных достраивать кристаллическую решетку агрегата коллоидной мицеллы и вступать в реакцию с потенциалопределяющими ионами. При увеличении концентрации индифферентного электролита диффузный слой противоионов мицеллы сжимается, переходя в адсорбционный слой. В результате уменьшается электрокинетический потенциал, и он может стать равным нулю. Такое состояние коллоидной системы называется изоэлектрическим. С уменьшением электрокинетического потенциала агрегативная устойчивость коллоидного раствора снижается и при некотором критическом значении ζ-потенциала начинается коагуляция. Поверхностный потенциал при этом не изменяется.
При нейтрализационной коагуляции ионы прибавляемого электролита нейтрализуют потенциалопределяющие ионы, уменьшается поверхностный потенциал φ и соответственно уменьшается ζ-потеициал.[3]
Задача № 39
Коллоидный раствор (золь) АД получен при смешивании V1 мл водного раствора АС с молярной концентрацией эквивалентов С1 и V2 мл водного раствора ВД с молярной концентрацией эквивалентов С2.
1. Напишите уравнение реакции получения вещества, образующего золь АД.
2. Рассчитайте, какое из исходных веществ АС или ВД в избытке. Определите ионный состав раствора и выберите, какой из ионов будет потенциалопределяющим (ПОИ).
3. Напишите формулу мицеллы в гидрозоле АД и назовите его составные части.
4. Укажите заряд коллоидной частицы (гранулы) и определите, какой ион (катион или анион) будет ионом-коагулятором.
5. Расположите электролиты K2SO4, Na3PO4, MgCl2, Cd(NO3)2, Al2(SO4)3 в порядке увеличения коагулирующей способности иона-коагулятора (или уменьшении порога коагуляции золя).
Исходные данные:
|
АД |
АС |
V1, мл |
С1, моль/л |
ВД |
V2, мл |
С2, моль/л |
|
Cr(OH)3 |
CrCl3 |
10 |
0,01 |
NH4OH |
16 |
0,02 |
Решение.
1. CrCl3 + 3NH4OH = Cr(OH)3 ↓ + 3NH4Cl
Золь образует нерастворимое в воде вещество Cr(OH)3.
2. Рассчитаем, какое из исходных веществ взято в избытке, для этого находим число моль эквивалентов каждого из исходных веществ по формуле:
![]()
где V – объем раствора, л; См – молярная концентрация, моль/л; Z – число эквивалентности вещества.
![]() моль, где Z
(CrCl3) = 3
моль, где Z
(CrCl3) = 3
![]() моль, где Z
(NH4OH) = 1
моль, где Z
(NH4OH) = 1
![]() <
< ![]() следовательно, в
избытке взят NH4OH.
следовательно, в
избытке взят NH4OH.
Ионный состав раствора: NH4+,
Потенциалопределяющими ионами (ПОИ) являются OH-, т.к. они взяты в избытке и способны достраивать кристаллическую решетку агрегата.
3. Формула мицеллы в гидрозоле гидроксида хрома имеет вид:
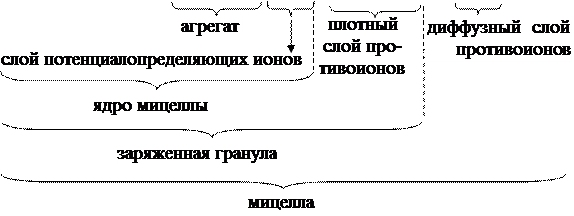 [m (Cr(OH)3) · n
[m (Cr(OH)3) · n
4. Заряд коллоидной частицы – отрицательный, равный –х.
Ион-коагулятор – ион, который несет заряд, противоположный по знаку заряду коллоидной частицы. В нашем случае это катион NH4+.
5. Коагулирующая способность ионов растет с увеличением заряда, следовательно, электролиты K2SO4, Na3PO4, MgCl2, Cd(NO3)2, Al2(SO4)3 расположатся в такой ряд: Na3PO4, K2SO4, MgCl2, Cd(NO3)2, Al2(SO4)3; коагулирующие ионы (катионы) соответственно: Na+, K+, Mg2+, Cd2+, Al3+.
Задача № 59
Определите радиус частиц суспензии каолина в воде, если
среднеквадратичный сдвиг ![]() равен 12 мкм2 за время 120 с. Температура опыта
293 К, вязкость среды 1,1 · 10-3 Па·с.
равен 12 мкм2 за время 120 с. Температура опыта
293 К, вязкость среды 1,1 · 10-3 Па·с.
Решение.
Определим радиус частиц суспензии каолина в воде по формуле:
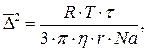
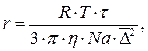
где R –
универсальная газовая постоянная, равная 8,314 Дж/(моль·К); Т – абсолютная температура, К; ![]() - время, с;
- время, с; ![]() - вязкость среды,
Н·с/м2 (Па·с); Na – число Авогадро,
равное 6,022 · 1023 моль-1.
- вязкость среды,
Н·с/м2 (Па·с); Na – число Авогадро,
равное 6,022 · 1023 моль-1.
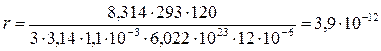 м
м
Задача № 79
Сточные воды производства фотоматериалов содержат коллоидное серебро в виде йодида серебра. Рассчитайте расход Al2(SO4)3 (кг) на очистку 1000 м3сточных вод, предполагая, что знак электрических зарядов коллоидных частиц положительный. Пороги коагуляции (в моль/м3) для одновалентных ионов – 140; для двухвалентных – 1,98; для трехвалентных – 0,052.
Решение.
Так как знак электрических зарядов коллоидных частиц положительный, ионом-коагулятором является анион SO42- (двухвалентный).
Определим массу Al2(SO4)3 требуемую для очистки сточных вод по формуле:
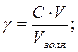
![]()
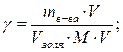
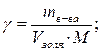
![]()
где ![]() - порог коагуляции, моль/м3; М – молярная масса, кг/моль; Vзоля – объем
сточных вод, м3.
- порог коагуляции, моль/м3; М – молярная масса, кг/моль; Vзоля – объем
сточных вод, м3.
М (Al2(SO4)3) = 342 г/моль или 0,342 кг/моль
![]() кг
кг
Задача № 99
Какие процессы называют адгезией? Перечислите основные виды адгезии. Какова роль адгезии в процессах прилипания, склеивания, смачивания?
Решение.
При соприкосновении двух разнородных твердых или жидких фаз вследствие взаимодействия разнородных поверхностных молекул возникает связь между этими фазами, называемая адгезией («прилипанием»). Адгезия, следовательно, характеризует прилипание вещества одной фазы к веществу другой фазы и измеряется работой разрыва (или сопротивлением разрыву) соприкасающихся фаз на единицу площади контакта. Межмолекулярное сцепление между молекулами одной фазы называют когезией.
Количественно адгезия характеризуется удельной работой, затрачиваемой на разделение тел. Эта работа рассчитывается на единицу площади соприкасающихся поверхностей и зависит от того, как производится их разделение: сдвигом вдоль поверхности раздела или отрывом в направлении, перпендикулярном поверхности.
Адгезия между двумя твердыми телами обычно весьма мала, поскольку из-за неровностей поверхности истинная площадь контакта твердых тел гораздо меньше, чем кажущаяся площадь соприкосновения. Если соприкасающиеся тела находятся в пластичном или эластичном состоянии, адгезия увеличивается.
При одновременном контакте трех фаз условия равновесия системы определяются соотношением взаимной адгезии всех трех фаз. Если хотя бы одна из фаз — жидкость, ее подвижная граница может изменять форму, удовлетворяя стремление системы к минимуму поверхностной энергии. Капля жидкости, нанесенная на поверхность твердого тела или другой жидкости, может либо растекаться по поверхности, смачивать ее, либо оставаться на поверхности в виде капли (линзы).
Если работа адгезии больше работы когезии, то капля жидкости, нанесенная на поверхность другой жидкости или твердого тела, не существует в виде капли (линзы), а растекается по поверхности, образуя тонкие слои или поверхностные пленки.
Условием хорошего смачивания жидкостью твердого тела является слабое взаимодействие между ее молекулами (слабая когезия). Жидкости с малым поверхностным натяжением обычно хорошо смачивают поверхности.[4]
Адгезия жидкости и твёрдого тела и двух несмешивающихся жидкостей достигает предельно высокого значения вследствие полного контакта по всей площади соприкосновения. При покрытии твёрдого тела полимером в текучем состоянии последний проникает в углубления и поры. После отвердевания полимера возникает связь, иногда называемая механической адгезией. В этом случае для отрыва полимерной плёнки необходимо преодолеть когезию в затвердевшем полимере. Для достижения предельной адгезии твёрдые тела соединяют в пластическом или эластичном состоянии под давлением, например при склеивании резиновым клеем или при холодной сварке металлов. Прочная адгезия достигается также при образовании новой твёрдой фазы на поверхности раздела, например в случае гальванических покрытий, или при возникновении поверхностных химических соединений (окисные, сульфидные и др. плёнки).
Адгезия полимеров происходит лучше в том случае, если макромолекулы полярны и имеют большое число химически активных функциональных групп. Для улучшения адгезии в состав клея или плёнкообразующего полимера вводят активные добавки, молекулы которых одним концом прочно связываются с плёнкой, другим - с подложкой, образуя ориентированный адсорбционный слой. При контакте двух объёмов одного и того же полимера может произойти автогезия (самослипание), когда имеет место диффузия макромолекул или их участков из одного объёма в другой. При этом прочность связи со временем увеличивается, стремясь к пределу - когезионной прочности.
Явление адгезии имеет место при сварке, паянии, лужении, склеивании, при изготовлении фотоматериалов, а также при нанесении лакокрасочных полимерных покрытий, предохраняющих металлические детали от коррозии.
Адгезия не только является условием образования высококачественного покрытия, связующего сварного или клеевого шва, но также и вызывает повышенный износ трущихся деталей. Для устранения адгезии вводят слой смазки, препятствующий контакту поверхностей.[5]
Задача № 119
Дана система, состоящая из парообразного вещества и твердого пористого адсорбента, при температуре Т.
1. Постройте изотермы адсорбции и десорбции.
2. Определите тип сорбции, возможность гистерезиса адсорбции и капиллярной конденсации.
3. Рассчитайте пористость адсорбента по ветви десорбцию, в случае ее отсутствия – по ветви адсорбции.
4. Рассчитайте радиусы пор по уравнению Томсона-Кельвина и постройте интегральную и дифференциальную кривые распределения пор адсорбента по радиусам.
Исходные данные:
- Т = 293 К
- монтмориллонит
- Н2О
|
2,34 |
4,68 |
7,03 |
9,35 |
11,7 |
14,0 |
16,4 |
21,0 |
23,0 |
|
|
4,0 |
6,0 |
7,3 |
8,3 |
9,0 |
9,5 |
10,0 |
12,6 |
17,0 |
|
|
4,0 |
6,0 |
7,3 |
8,3 |
9,0 |
11,0 |
11,6 |
14,0 |
17,0 |
Решение.
1. Изотерма адсорбции – это график зависимости адсорбции паров воды от давления этих паров. Изотерма десорбции – это график зависимости десорбции паров воды от давления этих паров (см. рис. 2).
2. При построении графиков, оказалось, что изотерма адсорбции – нижняя кривая, изотерма десорбции – верхняя кривая не совпадают, что свидетельствует о наличии явления, называемого гистерезисом.
Явление гистерезиса свидетельствует о том, что монтмориллонит – пористый адсорбент. Вид сорбции – капиллярная конденсация. Адсорбция паров воды на монтмориллоните по классификационным признакам является молекулярной, физико-химической, протекающей на границе газ – твердое тело, по механизму – полимолекулярная адсорбция.
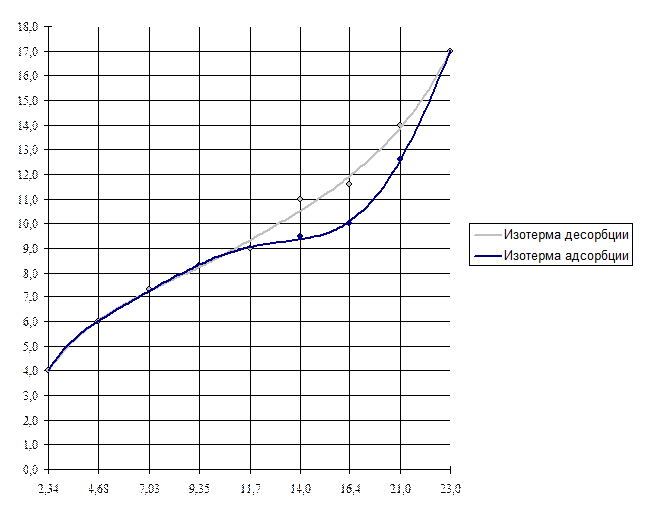
Рис. 2. Изотермы адсорбции и десорбции.
3. Расчет пористости адсорбента и радиусов пор проводим по следующим формулам:
![]()
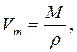
где: Wn – пористость адсорбента, м3/кг;
D – десорбция, моль/кг;
Vm – молярный объем молярный объем адсорбата, м3/моль;
М – молярная масса адсорбата, кг/моль;
ρ – плотность адсорбата, кг/м3.
Рассчитываем пористость при различных значениях десорбции паров воды на монтмориллоните. Для воды находим: ρ = 1000 кг/м3; М = 18·10-3 кг/моль.
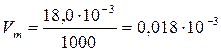 м3/моль.
м3/моль.
Рассчитаем Wn для D = 4,0
![]()
Аналогично рассчитываем Wn для других значений десорбции паров воды на монтмориллоните. Рассчитанные величины представим в виде таблицы (см. таблицу 1).
4. Рассчитаем радиусы пор по уравнению Томсона-Кельвина:
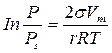 ,
,
где: Р – давление паров адсорбата при данной температуре, Па;
Рs – давление насыщенных паров адсорбата при данной температуре, Па;
σ – поверхностное натяжение адсорбата, Дж/м2;
r – радиус пор адсорбента, м;
R – универсальная газовая постоянная, Дж/(моль·К);
Т – температура, К.
Для воды находим: σ = 72,5·10-3 Дж/м2; Рs = 23,4 ·10-2 Па.
Рассчитаем r при Р = 2,34
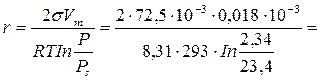
Задача № 139
Для полного обессоливания методом ионообменной адсорбции V м3 природной или разбавленной сточной воды последовательно пропускают через колонки с m1 кг катионита в Н-форме и с m2 кг анионита в ОН-форме. Динамические обменные емкости катионита равны:
А![]() В
В![]()
Охарактеризуйте процесс ионообменной адсорбции из воды на ионитах.
1. Напишите уравнения ионообменных реакций, протекающих на катионите и анионите с участием ионов каждой соли.
Исходные данные:
|
х |
х |
4,0 |
4,2 |
120 |
Pb(NO3)2 AgNO3 Hg(NO3)2 Al(NO3)3 |
0,01 0,04 0,021 0,012 |
Решение.
1. Уравнения ионообменных реакций имеют вид:
2R–H + Pb(NO3)2 = PbR2 + 2HNO3 на катионите
R–H + AgNO3 = AgR + HNO3 на катионите
2R–H + Hg(NO3)2 = HgR2 + 2HNO3 на катионите
3R–H + Al(NO3)3 = AlR3 + 3HNO3 на катионите
R–OH + HNO3 = RNO3 + H2O на анионите.
Список используемой литературы
1. Дерягин Б.В. и др. Адгезия. - М., 1980.
2. Лукьянов А.Б. Физическая и коллоидная химия. – М.: Химия, 1988.
3. Физическая и коллоидная химия: Учебное пособие. / Под ред. Добычина Д.П. – М.: Просвещение, 1986.
4. Фридрихсберг Д.А. Курс коллоидной химии: Учебник. – Л.: Химия, 1984.
[1] Физическая и коллоидная химия: Учебное пособие. / Под ред. Добычина Д.П. – М.: Просвещение, 1986, с. 436 – 439.
[2] См.: Фридрихсберг Д.А. Курс коллоидной химии: Учебник. – Л.: Химия, 1984.
[3] Лукьянов А.Б. Физическая и коллоидная химия. – М.: Химия, 1988, с. 204 – 205.
[4] Физическая и коллоидная химия: Учебное пособие. / Под ред. Добычина Д.П. – М.: Просвещение, 1986, с. 196 – 199.
[5] См.: Дерягин Б.В. и др. Адгезия. - М., 1980.