Задание 7-175
При помощи каких реакций можно осуществить следующие превращения
СН4 → СН3 Сl → С2 Н6 → С2 Н3 Сl → С3 Н8
Решение:
1) Хлорметан можно получить хлорированием метана на свету
СН4 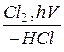 СН3 Сl
СН3 Сl
метан хлорметан
2) Этан можно получить действием на хлорметан металлического натрия (реакция Вюрца).
2 СН3 Сl + 2 Nа → СН3 – СН3 + 2 Na Cl
этан
3) Для получения хлорвинила, предварительно получим хлорированием этана дихлорэтан
С2
Н6 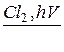 Сl СН2 – СН2 Сl
Сl СН2 – СН2 Сl
этан 1,2 дихлорэтан
При нагревании со спиртовым раствором щёлочи или при пропускании над нагретым катализатором (активированный уголь, оксид алюминия) дихлорэтан подвергается дигидрогалоидироанию:
Сl СН2 – СН2 Сl → СН2 = СН Сl
дихлоэтан - НСl хлорвинил
4) Гидрированием хлорвинила можно получить хлорэтан
СН2 = СН Сl 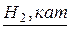 СН3 – СН2
Сl
СН3 – СН2
Сl
По реакции Вюрца (действием металлического натрия) при добавлении к хлорэтану хлорметана, можно получить среди прочих продуктов (образуется смесь продуктов) пропан
СН3 – СН2 Сl = 2 Nа + Сl - СН3 → СН3 – СН2 – СН3 + 2 Na Сl
Задание 8-193
Какой объём водорода необходимо затратить для гидрирования смесей объёмом 10 л, состоящей из этана (массовая доля 20% и этина 30%).
Какой объём этана при этом получается?
Дано:
Vсмеси = 10 л
![]() = (С2 Н6)
= 20%
= (С2 Н6)
= 20%
![]() = (С2 Н2)
= 30%
= (С2 Н2)
= 30%
Найти:
VН2 затр = ?
VС2 Н6 = ?
всего
Решение:
При действии водорода на смесь газов, гидрированию подвергается только этин
СН ![]() СН
СН 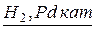 → СН3
– СН3
→ СН3
– СН3
этин (ацетилен) этан
или:
С2 Н2 + 2 Н2 = С2 Н6
1) Находим общее количество вещества газов в 10 л их смеси (зная, что молярный объём любого газа составляет 22,4 л/моль)
nгазов = 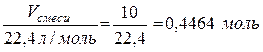
2) Находим молярные массы газов, входящие в смесь
М = (С2 Н6) = 12 * 2 + 6 = 30 г/моль
М = (С2 Н2) = 12 * 2 + 2 = 26 г/моль
М (Н2) = 2 г/моль
3) Находим массовую долю водорода в смеси
![]() = (Н2) =
100% -
= (Н2) =
100% - ![]() (С2 Н6)
-
(С2 Н6)
- ![]() (С2 Н2)
= 100 – 20 – 30 = 50%
(С2 Н2)
= 100 – 20 – 30 = 50%
4) Находим массу смеси. Для этого составим уравнение. Для составления уравнения используем следующие формулы.
m (В) = mсмеси * ![]() (В), где
(В), где
m (В) – масса вещества в смеси
![]() = (В) – массовая доля
вещества (относительная)
= (В) – массовая доля
вещества (относительная)
n (B) = 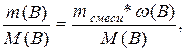 где:
где:
n (B) – количество вещества, моль;
m (B) – масса вещества, г;
М (В) – молярная масса вещества, г/моль.
Исходя из этих формул, получим уравнение:
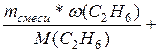
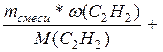
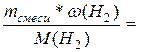 nсмеси
nсмеси
mсмеси = 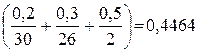 моль
моль
mсмеси = (0,006667 + 0,01154 + 0,25) = 0,4464
mсмеси * 0,2682 = 0,4464
mсмеси = 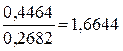 г
г
5) Находим количества вещества газов в смеси:
n (С2
Н6) = ![]() моль
моль
n (С2
Н2) = ![]() моль
моль
n (Н2)
= ![]() моль
моль
6) В соответствии с уравнением реакции для гидрирования 1 моль этина используется 2 моль водорода, т.е. для гидрирования 0,0192 моль этина требуется
0,0192 * 2 = 0,0384 моль водорода.
7) Находим объём использованного водорода
V (![]() ) = 0,0384 моль * 22,4 л/моль = 0,8601 л
) = 0,0384 моль * 22,4 л/моль = 0,8601 л
8) Находим общее количество этана в смеси в концентрации
n (С2 Н6) = n (С2 Н6) + n (С2 Н2) = 0,0111 моль + 0,0192 моль = 0,0303
конечное исх исх
моль.
9) Находим объём этана в конечной смеси
V (С2 Н6) = n (С2 Н6) * 22,4 л/моль = 0,0303 * 22,4 = 0,6787 л
Объём вновь полученного этана
V (С2 Н6)получ = 0,0192 моль * 22,4 = 0,43 л
Ответ: Для гидрирования затрачивается из смеси объём водорода V (Н2) = 0,86 л, при этом в конечной смеси содержится объём этана
V (С2 Н6)получ. = 0,43 л.
Задание 9-212.
Вычислите массу монобромбензола, которая получится при бромировании бензола массой 100 кг, если выход составляет 40%.
Дано:
m (С6 Н6) = 100 кг
Р = 40%
Найти:
m (С6 Н5 Br) = ?
Решение:
При бромировании бензола протекает реакция:

 Br2 Br
Br2 Br
 |
 |
||||||
бензол С6 Н6 бромбензол С6 Н5 Br
1) Находим молярные массы бензола и бромбензола:
М (С6 Н6) = 12*6 + 6 = 78 г/моль
М (С6 Н5 Br) = 12*6 + 5 = 156,9 г/моль
2) Находим массу бромбензола при выходе 100%. В соответствии со стехиометрией реакции составим соотношение:
78 г бензола – 156,9 г бромбензола
100 кг бензола – х кг бромбензола
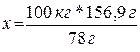 = 201,15кг
= 201,15кг
3) Находим массу бромбензола, полученную из 100 кг бензола при выходе 40%.
![]()
Ответ: m (С6 Н5 Вr) = 80,46 кг.
Задание 10-232.
При нагревании 30 г спирта с серной кислотой образуется 3,92 л газообразного углеводорода, содержащего одну двойную связь. Каково строение исходного спирта, если выход полученного углеводорода составляет 35%.
Дано:
mспирта = 30 г
Р = 35%
VCn H2n = 3,92 л
Найти:
Сх Н2х+1 ОН = ?
Решение:
В определённых условиях спирты способны терять воду, при взаимодействии с серной кислотой, последняя служит сильным водоотнимающим средством и спирт подвергается внутримолекулярной дегидротации по схеме:
Сх Н2х+1 ОН → Сх Н2х
- Н2О
1) Находим количество вещества полученного олефина, зная, что молярный объём любого газа составляет 22,4 г/моль.
n (Сх
Н2х) = 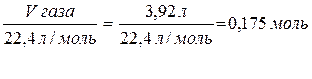
2) В соответствии со стехиометрией реакции 0,175 моль олефина получается из 0,175 моль спирта.
3) Находим количество вещества исходного спирта с учётом выхода 35%.
nспирта = 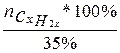 =
= ![]()
4) Находим молярную массу спирта:
Мспирта = mспирта /nспирта = 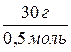 = 60 г/моль
= 60 г/моль
5) Молярная масса спирта складывается из молярной массы гидроксильной группы, концевого атома водорода и х повторяющихся групп СН2.
Находим молярную массу х групп СН2.
М![]() = Мспирта – МОН – МН = 60
г/моль – (16+1) г/моль – 1 г/моль = 42 г/моль
= Мспирта – МОН – МН = 60
г/моль – (16+1) г/моль – 1 г/моль = 42 г/моль
Находим молярную массу группы СН2:
М (СН2) = 12 + 2 = 14 г/моль
Находим количество групп СН2:
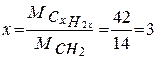
Формула спирта:
СН3 – СН2 СН2ОН – это пропанол.
Ответ: Пропанол С3 Н7 ОН.
Задача 11-247.
Напишите сокращённые линейные структурные формулы альдегидов, образующихся при окислении спиртов:
а) пропилового СН3 СН2 СН2 ОН
б) бутилового СН3 СН2 СН2 СН2 ОН
в) амилового СН3 СН2 СН2 СН2 СН2 ОН
Решение:
При окислении спиртов получаются соответствующие или альдегиды, а именно:
а) СН3 – СН2
– ![]()
пропионовый альдегид (пропаналь)
б) СН3 – СН2
– СН2 - ![]()
бутаналь, бутиловый альдегид
в) СН3 – СН2
– СН2 – СН2 - ![]()
амиловый альдегид
Задача 12-265.
Какая предельная одноосновная кислота получится при окислении:
а) этанола С2 Н5 ОН
б) метанола СН3 ОН
в) пропионового
альдегида С2
Н5 ![]()
Решение:
При окислении спиртов и альдегидов, окисление протекает по функциональной группе ОН или СНО, поэтому получаются предельные одноосновные кислоты с тем же числом атомов углерода, что и у исходного соединения. Поэтому получится:
а) СН3 - ![]() уксусная кислота
уксусная кислота
б) Н - ![]() муравьиная кислота
муравьиная кислота
в) СН3 – СН2
- ![]() пропионовая
кислота
пропионовая
кислота
Задача 13-283.
На гидрирование триолеата был затрачен водород объёмом 112 л. Какая масса жира была взята?
Решение:
При гидрировании триолеата протекает реакция:
![]() СН2 – О –
СН2 – О – ![]() - С17 Н33 СН2
– О -
- С17 Н33 СН2
– О - ![]() - С17 Н35
- С17 Н35
![]() 3
Н2
3
Н2
![]() СН – О -
СН – О - ![]() - С17 Н33 СН
– О -
- С17 Н33 СН
– О - ![]() - С17 Н35
- С17 Н35
СН2
– О - ![]() - С17 Н33 СН3
– О -
- С17 Н33 СН3
– О - ![]() - С17 Н35
- С17 Н35
Триолеат (содержит остатки тристеарат
непредельной олеиновой кислоты)
1) В соответствии с уравнением реакции для гидрирования 1 моль триолеата требуется 3 моль водорода. Находим количество вещества затраченного водорода, зная, что молярный объём любого газа равен 22,4 л/моль.
n (Н2)
=  = 5 моль
= 5 моль
2) Находим количество вещества триолеата, прогидрированного 5-ю молями водорода.
nс3 н5 = (ООС – С17 Н33)3 = 5/3 моль
3) Находим молярную массу триолеата:
Мтриолеата = (12*3 + 5) + 3 * (16*2 + 12*18 + 33) = 884 г/моль.
4) Находим массу взятого жира (триолеата):
mжира = Мтриолеата * nтриолеата = 884 г/моль * 5/3 моль = 1473,33 г.
Ответ: mжира ![]() 1473 г.
1473 г.
Задача 14-298.
Напишите уравнения реакции получения эфиров клетчатки:
а) тринитроклетчатки;
б) триацетата целлюлозы.
Решение:
а) При действии на целлюлозу смесью азотной и серной кислот получают нитраты целлюлозы. Максимальное число остатков азотной кислоты, которые можно ввести в клетчатку равно трём, на каждое звено глюкозы, т.е. получается тринитроклетчатка.
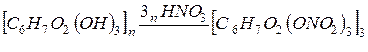
целлюлоза тринитроклетчатка
или в структурном виде:
|
|
|
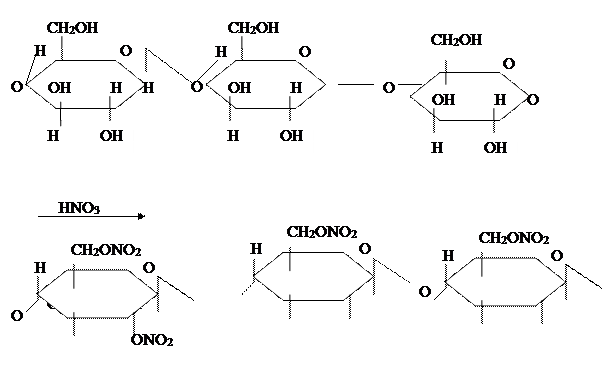
б) Триацетат целлюлозы – полный уксуснокислый эфир целлюлозы. Получают при действии на целлюлозу смеси уксусного ангидрида, уксусной кислоты исерной кислоты или хлористого цинка (последние играют роль катализатора):

целлюлоза триацетат целлюлозы
|
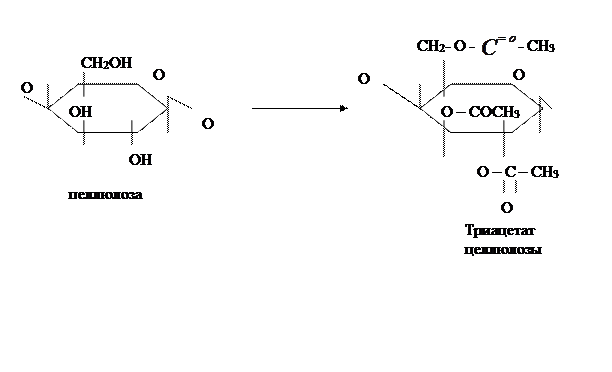
Задача 15-315.
За счёт чего происходит
образование дипептидов? Напишите уравнение реакции образования неполного
ангидрида между ![]() - аминоуксусной
кислотой,
- аминоуксусной
кислотой, ![]() - аминопропионовой
кислотой.
- аминопропионовой
кислотой.
Решение:
Образование дипептидов происходит за счёт образования амидной связи за счёт группы – СООН одной аминокислоты и группы – NН 2 другой аминокислоты. Образовавшуюся амидную группировку – СО – NН - принято в этом случае называть пептидной.
NН2 – СН2 – СООН + NН2 – СН – СООН
![]() - аминоуксусная
кислота СН3
- аминоуксусная
кислота СН3
(глицин) ![]() - аминопропионовая
кислота
- аминопропионовая
кислота
(аланин)
![]() NН2 – СН2 – С – NН – С – СООН
NН2 – СН2 – С – NН – С – СООН
О СН3
глицил – аланин (дипептид)
Литература:
1. Потапов В.М., Татаринчик С.Н. Органическая химия, М. Химия, 1972 г.
2. Жиряков В.Г. Органическая химия. М. Химия, 1968 г.
3. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. М. Дрофа, 2004 г.