Задача № 2
Определите фактор эквивалентности и молярные массы эквивалентов серной
кислоты в реакциях:
H2SO4
+ NaOH = NaHSO4 + H2O (1)
H2SO4
(разб.) + Zn =
ZnSO4 + H2↑ (2)
Решение. Молярная масса вещества и фактор эквивалентности могут иметь
различные значения в зависимости от того, в какую реакцию вступает это
вещество.
В реакции (1) каждый моль серной кислоты отдает 1 моль ионов водорода и
фактор эквивалентности f
= 1, а молярная масса эквивалента равна
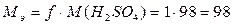 г/моль
г/моль
В реакции (2) каждый моль серной кислоты отдает 2 моль ионов водорода,
фактор эквивалентности f
= ½, тогда молярная масса эквивалента равна
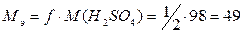 г/моль
г/моль
Задача № 24
Сколько протонов и нейтронов содержат ядра изотопов 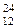 Mg и
Mg и 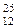 Mg?
Составьте электронную формулу данного атома, подчеркните валентные электроны.
Распределите электроны этого атома по квантовым ячейкам. К какому электронному
семейству относится этот элемент?
Mg?
Составьте электронную формулу данного атома, подчеркните валентные электроны.
Распределите электроны этого атома по квантовым ячейкам. К какому электронному
семейству относится этот элемент?
Решение. Порядковый номер элемента в периодической системе совпадает с
величиной заряда ядра, т.е. индекс внизу слева символа элемента указывает на
количество протонов в ядре, следовательно, в ядрах изотопов магния имеется 12 протонов.
Число нейтронов равняется разности между массовым числом (индекс вверху слева
символа) и порядковым номером элемента, следовательно, в ядрах изотопа 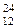 Mg
находится 12 нейтронов (24 – –12 = 12),
а
Mg
находится 12 нейтронов (24 – –12 = 12),
а 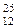 Mg –
13 нейтронов (25 – 12 = 13).
Mg –
13 нейтронов (25 – 12 = 13).
Электронные формулы отображают распределение электронов в атоме по
энергетическим уровням и подуровням. При этом следует учитывать, что электрон
занимает тот энергетический подуровень, на котором он будет обладать наименьшей
энергией. Так как число электронов в атоме элемента равно заряду ядра, т.е. его
порядковому номеру в таблице Д.И. Менделеева, то для элемента № 12 – магния
электронная формула, согласно шкале энергии, будет
12Mg 1s22s22p63s2
Электронографические схемы отображают распределение электронов атомов по
квантовым (энергетическим) ячейкам. В каждой квантовой ячейке может быть не
более двух электронов с противоположными спинами (принцип Паули). Орбитали
данного подуровня заполняются сначала по одному электрону с одинаковыми
спинами, а затем по второму электрону с противоположными спинами (правило
Хунда)
|
s
|
|
|
|
|
|
|
|
|
|
n = 1
|
↑↓
|
|
p
|
|
|
|
|
|
|
|
n = 2
|
↑↓
|
↑↓
|
↑↓
|
↑↓
|
|
|
d
|
|
|
|
n = 3
|
↑↓
|
|
|
|
|
|
|
|
|
Последний, 12-й электрон атома магния занимает s-орбиталь, следовательно,
магний относится к s-электронному
семейству.
Задача № 51
Как влияет повышение степени окисления элемента на свойства образуемых
ими оксидов и гидроксидов? Исходя из этого, объясните, как меняются химические
свойства оксидов MnO, MnO2,
Mn2O7 и гидроксидов
Mn(OH)2, Mn(OH)4, HMnO4.
Решение. Свойства оксидов и гидроксидов зависят от степени окисления
образующих их элементов. Если данный элемент проявляет переменную степень
окисления и образует несколько оксидов и гидроксидов, то с увеличением степени
окисления свойства последних меняются от основных через амфотерные к кислотным.
Степень окисления марганца в оксидах MnO, MnO2, Mn2O7 равна соответственно +2,
+4, +7, следовательно:
·
MnO – основной оксид (реагирует с кислотными
оксидами и кислотами);
·
MnO2
– амфотерный оксид (реагирует и с основаниями и с кислотами, основными и
кислотными оксидами);
·
Mn2O7 – кислотный
оксид (реагирует с основными оксидами и основаниями).
Степень окисления марганца в гидроксидах Mn(OH)2, Mn(OH)4, HMnO4
равна соответственно +2, +4, +7, следовательно:
·
Mn(OH)2 – основание (взаимодействует с кислотами);
·
Mn(OH)4 – амфотерный
гидроксид (взаимодействует и с основаниями и с кислотами);
·
HMnO4
– кислота (взаимодействует с основаниями).
Задача № 90
При какой температуре наступит равновесие системы
4HCl (г) + O2
(г) ↔ 2H2O (г) + 2Cl2 (г), ∆Н = -114,42 кДж?
Что в этой системе является более сильным окислителем – хлор или кислород
– и при каких температурах?
Решение. При состоянии равновесия ∆G = 0; ∆H = T∆S
температура начала равновесной реакции равна:
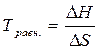 .
.
∆Sх.р. определим из уравнения 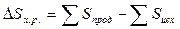 .
.
Используя табличные данные, определим стандартные энтропии HCl (г), О2 (г), Н2О
(г) и Cl2
(г):
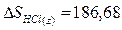 Дж/(моль∙К);
Дж/(моль∙К);
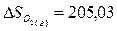 Дж/(моль∙К);
Дж/(моль∙К);
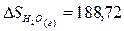 Дж/(моль∙К);
Дж/(моль∙К);
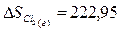 Дж/(моль∙К).
Дж/(моль∙К).
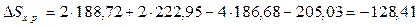 Дж/(моль∙К)
или – 0,12841 кДж/(моль∙К).
Дж/(моль∙К)
или – 0,12841 кДж/(моль∙К).
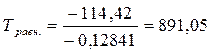 К
К
В этой системе более сильным окислителем является кислород при температуре больше 891,05 К
Задача № 107
Каким законом выражается зависимость скорости реакции от концентрации
реагирующих веществ? Рассчитайте, как изменится скорость прямой реакции,
протекающей по уравнению: 2SO2 + O2 ↔ 2SO3, если увеличить давление в 2 раза?
Решение. Зависимость скорости химической реакции от концентрации
реагирующих веществ выражается законом действующих масс: скорость химической
реакции при постоянной температуре прямо пропорциональна произведению
концентраций реагирующих веществ
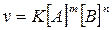 ,
,
где: v – скорость реакции; [А], [В] –
молярная концентрация реагирующих веществ; m
и n – коэффициенты в уравнении
реакции; К – константа скорости реакции, зависящая от природы реагирующих
веществ и температуры.
Примем обозначения: [SO2]
= a; [O2] = b – концентрация
до изменения давления. Согласно закону действующих масс, 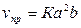 . Вследствие увеличения давления в 2 раза концентрация
каждого из реагирующих веществ увеличится в 2 раза. Следовательно,
. Вследствие увеличения давления в 2 раза концентрация
каждого из реагирующих веществ увеличится в 2 раза. Следовательно,
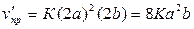
Отсюда
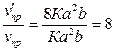 .
.
Скорость прямой
реакции возрастет в 8 раз.
Задача № 135
Как изменится скорость прямой реакции: 2SO2 + O2 ↔ 2SO3 при
увеличении: а) концентрации диоксида серы в 2 раза, б) концентрации кислорода в
2 раза, в) концентрации обоих веществ в 2 раза? Напишите выражение для
константы равновесия данной системы.
Решение. Примем обозначения: [SO2] = a;
[O2] = b – концентрация до изменения
концентраций. Согласно закону действующих масс, 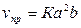 .
.
а) При увеличении концентрации диоксида серы в 2 раза скорость прямой
реакции станет равной: 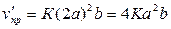 . Отсюда
. Отсюда
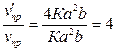 .
.
Скорость прямой
реакции возрастет в 4 раз.
б) При увеличении концентрации кислорода в 2 раза скорость прямой реакции
станет равной: 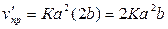 . Отсюда
. Отсюда
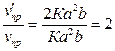 .
.
Скорость прямой
реакции возрастет в 2 раз.
в) При увеличении концентрации обоих веществ в 2 раза скорость прямой
реакции станет равной: 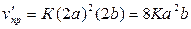 . Отсюда
. Отсюда
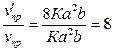 .
.
Скорость прямой
реакции возрастет в 8 раз.
Выражение для константы равновесия данной системы имеет вид
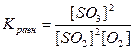 .
.
Задача № 166
Составьте молекулярные и ионно-молекулярные уравнения реакций
взаимодействия в растворах между: а) CdS и HCl; б) FeCl3 и NH4OH; в) KOH и H2S;
г) AgNO3 и HCl.
Решение. Запишем уравнения взаимодействия указанных веществ в
молекулярном виде:
а) CdS + 2HCl = CdCl2
+ H2S
б) FeCl3 +
3NH4OH = Fe(OH)3 + 3NH4Cl
в) 2KOH + H2S
= K2S + 2H2O
г) AgNO3 +
HCl = AgCl + HNO3
Исключив одинаковые ионы из обеих частей равенства а) Cl-; б) Cl- и NH4+;
в) K+; г) NO3- и
Н+, получим ионно-молекулярные уравнения соответствующих реакций:
а) CdS + 2H+
= Cd2+ + H2S
б) Fe3+ + 3OH-
= Fe(OH)3
в) 2OH- + H2S
= S2- + 2H2O
г) Ag+ + Cl-
= AgCl
Задача № 215
Составьте электронные уравнения и укажите, какой процесс (окисление или
восстановление) происходит при следующих превращениях Se0 → Se6+, Cl0 → Cl5+, N5+
→ N3-.
На основании электронных уравнений расставьте коэффициенты в уравнении реакции,
идущей по схеме
Zn + HNO3
→ Zn(NO3)2 + H2O + NH4NO3
Укажите
окислитель и восстановитель.
Решение.
- Se0 – 6ē → Se6+ процесс окисления;
- Cl0 –
5ē → Cl5+
процесс окисления;
- N5+ +
8ē → N3-
процесс восстановления.
0 +5
+2 -3
Zn + HNO3
→ Zn(NO3)2 + H2O + NH4NO3
Коэффициенты в уравнении определим методом электронного баланса с помощью
электронных уравнений. Вычислим, как изменяют свою степень окисления
восстановитель и окислитель, и отразим это в электронных уравнениях:
 восстановитель 4
Zn0 –
2ē = Zn2+ процесс окисления
восстановитель 4
Zn0 –
2ē = Zn2+ процесс окисления
окислитель 1 N5+ + 8ē = N3- процесс восстановления
Общее число электронов, отданных восстановителем, должно быть равно числу
электронов, которое присоединяет окислитель. Общее наименьшее кратное для
отданных и принятых электронов восемь. Разделив это число на 2, получаем
коэффициент 4 для восстановителя и продукта его окисления, а при делении 8 на 8
получаем коэффициент 1 для окислителя и продукта его восстановления.
Коэффициенты перед веществами, атомы которых не меняют свою степень окисления,
находят подбором. Уравнение реакции будет иметь вид
4Zn + 10HNO3
→ 4Zn(NO3)2 + 3H2O + NH4NO3
Задача № 236
В какой пробирке происходит реакция при внесении цинковых пластинок в
растворы нитрата алюминия и сульфата железа?
Решение. Сравним стандартные электродные потенциалы металлов. Так как 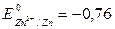 В, т.е. имеет большую алгебраическую величину, чем
В, т.е. имеет большую алгебраическую величину, чем 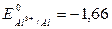 В, то взаимодействие
цинка с раствором нитрата алюминия не произойдет. Поскольку
В, то взаимодействие
цинка с раствором нитрата алюминия не произойдет. Поскольку 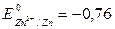 В меньше, чем
В меньше, чем 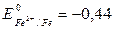 В, то цинк будет реагировать с раствором сульфата железа:
В, то цинк будет реагировать с раствором сульфата железа:
Zn + FeSO4
= Fe + ZnSO4
Электронные уравнения:
 восстановитель 1
Zn0 – 2ē = Zn2+ процесс окисления
восстановитель 1
Zn0 – 2ē = Zn2+ процесс окисления
окислитель 1 Fe2+ + 2ē = Fe0 процесс восстановления
Задача № 247
На чем основан принцип катодной защиты металлов? Напишите электронные
уравнения анодного и катодного процессов, происходящих при катодной защите
железа, если в качестве анода использовали металлолом.
Решение. Катодная защита основана на присоединении защищаемого металла к
отрицательному полюсу источника постоянного тока, тогда как в качестве анода
может служить закопанный в землю металлический лом. Электроны отнимаются от
анода источником тока, анод (защищающий метал) разрушается, а на катоде
происходит восстановление окислителя.
Например, при атмосферной коррозии:
Анодный процесс: Катодный процесс:
Ni0 -
2ē = Ni2+
½
О2 + Н2О + 2ē = 2ОН-
Список литературы
1.
Ахметов Н.С. Общая и неорганическая химия: Учебник для
вузов. – М.: Высшая школа, 1981.
2.
Глинка Н.Л. Общая химия, 2000
3.
Зубович И.А. Неорганическая химия: Учебник для технол.
спец. вузов. – М.: Высшая школа, 1989.
4.
Степин Б.Д. и др. Неорганическая химия. – М.: Высшая
школа, 1994.
5.
Угай Я.А. Общая химия. – М.: Высшая школа, 1984.