Задача № 2
В какой массе NaOH содержится столько же эквивалентов,
сколько в 140 г КОН.
Решение. Эквивалентная масса КОН равна его мольной массе, т.е. 56 г/моль.
Следовательно, в 140 г КОН содержится  эквивалентов. Эквивалентная масса NaOH равна его мольной массе, т.е. 40
г/моль. Отсюда 2,5 эквивалентов составляют
эквивалентов. Эквивалентная масса NaOH равна его мольной массе, т.е. 40
г/моль. Отсюда 2,5 эквивалентов составляют 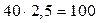 г.
г.
Задача № 23
Какое максимальное число
электронов могут занимать s-, p-, d- и f-орбитали данного энергетического уровня? Почему? Напишите
электронную формулу атома элемента с порядковым номером 31.
Решение. Максимальное число электронов в подуровне определяется по формуле:
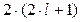 ,
,
где: l – орбитальное квантовое число.
Для s-орбитали l = 0, следовательно, максимальное
число электронов, которые могут занимать
s-орбиталь, равно
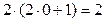 .
.
Для p-орбитали l = 1, следовательно, максимальное
число электронов, которые могут занимать
p-орбиталь, равно
 .
.
Для d-орбитали l = 0, следовательно, максимальное
число электронов, которые могут занимать
d-орбиталь, равно
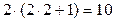 .
.
Для f-орбитали l = 0, следовательно, максимальное
число электронов, которые могут занимать
f-орбиталь, равно
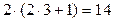 .
.
Электронные
формулы изображают распределение электронов в атоме по энергетическим уровням и
подуровням (атомным орбиталям).
Так
как число электронов в атоме того или иного элемента равно его порядковому
номеру в таблице Д.И.Менделеева, то для элемента № 31 (галлий) электронная формула имеет вид:
31Ga 1s22s22p63s23p63d104s24p1
Задача № 44
Исходя из положения
германия, молибдена и рения в периодической системе, составьте формулы
водородного соединения германия, оксида молибдена и рениевой кислоты,
отвечающие их высшей степени окисления. Изобразите формулы этих соединений
графически.
Решение. Высшая степень окисления
элемента соответствует номеру группы периодической системы Д.И. Менделеева, в
которой он находится.
Германий
находится в IV группе
периодической системы, формула его водородного соединения – GeH4.
Молибден находится в VI группе периодической системы, формула его оксида – MoO3.
|
O
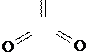
Mo
|
Рений находится в VII группе периодической системы, формула рениевой кислоты – HReO4.
Задача № 65
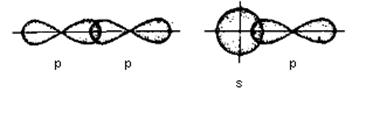
Какую ковалентную связь
называют σ-связью и какую π-связью? Разберите на примере строения
молекулы азота.
Решение. Ковалентная σ-связь – это связь, которая образуется путем
перекрывания атомных орбиталей, причем
область перекрывания лежит на линии соединяющей ядра атомов.
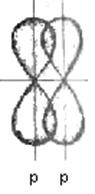
Ковалентная π-связь
– это связь, которая образуется путем перекрывания атомных орбиталей, причем область перекрывания лежит
по обе стороны от линии соединяющей ядра атомов.
Как следует из
электронного строения внешнего уровня атома азота:
7N 1s22s22p3
|
s
|
|
|
|
|
n
= 1
|
↑↓
|
|
p
|
|
|
n
= 2
|
↑↓
|
↑
|
↑
|
↑
|
его химический связи осуществляются
тремя неспаренными р-электронами каждого атома. Образование химической связи
есть результат перекрывания орбиталей атомов. В молекуле азота химическая связь
осуществляется за счет общих пар р-электронов, орбитали которых направлены по
осям x, y,z. Образование тройной связи в молекуле азота можно представить следующим
образом:
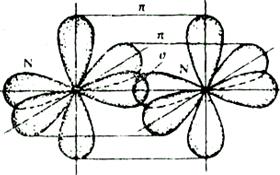
Таким образом, в молекуле
азота имеется одна σ-связь и две π-связи.
Задача № 86
Тепловой эффект какой
реакции равен теплоте образования NO? Вычислите теплоту образования NO, исходя из следующих термохимических
уравнений:
4 NH3 (г) + 5 O2 (г) = 4 NO (г) + 6 H2O (ж);
ΔН = -1168,80 кДж
4 NH3 (г) + 3 O2 (г) = 2 N2 (г) + 6 H2O (ж);
ΔН = -1530,28 кДж
Решение. Теплотой образования данного соединения называют тепловой эффект реакции
образования 1 моль этого соединения из простых веществ, взятых в их устойчивом
состоянии при данных условиях. Следовательно, нужно вычислить тепловой эффект
реакции, термохимическое уравнение которой имеет вид:
½ N2 (г) + ½ O2 (г) = NO (г); ΔН = ?
На основании закона Гесса
термохимическими уравнениями можно оперировать так же, как и с алгебраическими.
Для получения искомого результата следует оба уравнения разделить на 4 и из
первого уравнения вычесть второе:
NH3 + 5/4 O2 – NH3
– 3/4 O2 = NO + 6/4 H2О – 2/4
N2 – 6/4 H2О
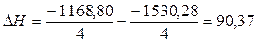
Задача № 107
Прямая или обратная
реакция будет протекать при стандартных условиях в системе
2 NO (г) + O2 (г) ↔ 2 NO2 (г)
Ответ мотивируйте,
вычислив ΔG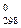 прямой реакции.
прямой реакции.
Решение. 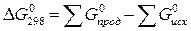
Используя табличные
данные, определим стандартные энергии Гиббса NO (г) и NО2 (г):
∆G (NO(г)) = 86,69 кДж/моль;
∆G (NO2 (г)) = 51,84 кДж/моль.
Зная, что ΔG есть функция состояния и что ΔG для простых веществ, находящихся в
устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим
ΔG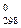 процесса:
процесса:
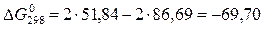 кДж
кДж
То что ΔG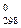 < 0, указывает на самопроизвольное протекание
прямой реакции при Т = 298 К и равенстве давлений взятых газов
< 0, указывает на самопроизвольное протекание
прямой реакции при Т = 298 К и равенстве давлений взятых газов  Па (760 мм рт.ст. = 1 атм.)
Па (760 мм рт.ст. = 1 атм.)
Задача № 128
В гомогенной системе СО +
Cl2 ↔ COCl2 равновесные концентрации реагирующих веществ: [CO] = 0,2 моль/л; [Cl2] = 0,3 моль/л; [COCl2] = 1,2 моль/л. Вычислите константу равновесия системы
и исходные концентрации хлора и СО.
Решение. При равновесии скорости прямой и обратной реакции равны, а отношение
констант этих скоростей постоянно и называется константой равновесия данной
системы:
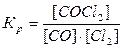
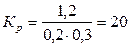 .
.
Согласно уравнению
реакции число молей образовавшегося COCl2 равно числу молей СО и Cl2. Следовательно, [CO]прореаг. = [Cl2]прореаг. = [COCl2]равнов. = 1,2 моль/л.
[CO]исх. =
[CO]прореаг. + [CO]равн. = 1,2 + 0,2 = 1,4 моль/л
[Cl2]исх. = [Cl2]прореаг. + [Cl2]равн. = 1,2 + 0,3 = 1,5 моль/л
Задача № 149
Смешали 10 см3
10%-ного раствора HNO3
(пл. 1,056 г/см3) и 100 см3 30%-ного раствора HNO3 (пл. 1,184 г/см3). Вычислите процентную
концентрацию полученного раствора.
Решение. Масса 10 см3 10%-ного раствора HNO3 равна 10,56 г.
В этом растворе содержится 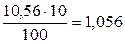 г HNO3.
Масса 100 см3 30%-ного раствора HNO3 равна 118,4 г. В этом растворе содержится
г HNO3.
Масса 100 см3 30%-ного раствора HNO3 равна 118,4 г. В этом растворе содержится 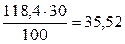 г HNO3.
г HNO3.
В общей массе полученного
раствора (10,56 + 118,4 = 128,96 г) содержание HNO3 составляет 1,056 + 35,52 = 36,576 г. Отсюда
процентная концентрация полученного раствора равна:
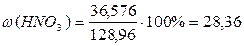 %
%
Задача № 170
При растворении 4,86 г
серы в 60 г бензола температура кипения его повысилась на 0,810.
Сколько атомов содержит молекула серы в этом растворе. Эбуллиоскопическая
константа бензола 2,570.
Решение. По закону Рауля понижение температуры кристаллизации и повышение
температуры кипения раствора (Δt) по сравнению с температурами
кристаллизации и кипения растворителя выражаются уравнением

где: К – криоскопическая или
эбуллиоскопическая константа; m и М – соответственно масса растворенного вещества и его
мольная масса; m1
– масса растворителя.
Отсюда молярная масса
серы равна:
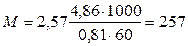 г/моль.
г/моль.
Атомная масса серы равна
32, следовательно, молекула серы в этом растворе содержит 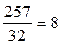 атомов.
атомов.
Задача № 191
Составьте молекулярные
уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) CaCO3
+ 2H+ = Ca2+ + H2O + CO2
б) Al(OH)3
+ OH- = AlO2- + 2H2O
в) Pb2+ + 2I- = PbI2
Решение. В данных ионно-молекулярных уравнениях указаны свободные ионы, которые
образуются при диссоциации растворимых сильных электролитов, следовательно, при
составлении молекулярных уравнений следует исходить из соответствующих
растворимых сильных электролитов. Например:
а) CaCO3
+ 2 HCl = CaCl2 + H2O + CO2
б) Al(OH)3
+ NaOH = NaAlO2 + 2 H2O
в) Pb(NO3)2
+ 2 NaI = PbI2 + 2 NaNO3
Задача № 212
К раствору Al2(SO4)3 добавили следующие вещества: а) H2SO4; б) КОН; в) Na2SO3; г) ZnSO4. В каких случаях гидролиз сульфата алюминия усилится?
Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
Решение. Сульфат алюминия Al2(SO4)3
– соль слабого многоосновного основания Al(ОН)3 и сильной кислоты H2SO4. При растворении в воде молекулы Al2(SO4)3 полностью диссоциируют на катионы Al3+ и анионы SO42-. Катионы Al3+ связывают гидроксильные ионы воды,
образуя катионы основной соли AlОН2+. Образование молекул Al(ОН)3 не происходит, так
как ионы AlОН2+ диссоциируют гораздо труднее, чем молекулы Al(ОН)3. Анионы SO42- не могут связывать ионы Н+
воды, так как H2SO4
– сильный электролит. В обычных условиях
гидролиз идет по первой ступени. Соль гидролизуется по катиону.
Ионно-молекулярное уравнение гидролиза
Al3+ + H2O ↔ AlOH2+ + H+
или в молекулярной форме
Al2(SO4)3 + 2 H2O ↔ 2 AlOHSO4
+ H2SO4
В растворе появляется
избыток ионов водорода, поэтому раствор Al2(SO4)3 имеет
кислую реакцию (рН < 7).
а) При добавлении к
раствору Al2(SO4)3 серной кислоты гидролиз сульфата
алюминия уменьшится, так как в растворе увеличится содержание ионов Н+
(за счет того, что H2SO4 полностью диссоциирует на катионы Н+ и анионы SO42-) и гидролитическое равновесие
сдвинется влево (по принципу Ле Шателье).
б) При добавлении к
раствору Al2(SO4)3 гидроксида калия гидролиз сульфата
алюминия усилится, так как в растворе появятся ионы ОН- (за счет
того, что КОН полностью диссоциирует на
катионы К+ и анионы ОН-), которые с Н+ ионами
образуют молекулу слабого электролита Н2О, при этом гидролитическое
равновесие сдвигается вправо.
в) Сульфит натрия Na2SO3 – соль слабой многоосновной кислоты H2SО3 и сильного основания NaOH. При растворении в воде молекулы Na2SO3 полностью диссоциируют на катионы Na+ и анионы SO32-. Катионы Na+ не могут связывать ионы ОН- воды, так как NaOH – сильный электролит. Анионы SO32- связывают ионы Н+ воды,
образуя анионы кислой соли HSO3-, а не молекулы H2SО3, так как ионы HSО3-
диссоциируют гораздо труднее, чем молекулы H2SО3. В обычных условиях
гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное
уравнение гидролиза
SО32-
+ H2O ↔ HSО3- + OH-
При добавлении к раствору
Al2(SO4)3 сульфита натрия идет взаимное усиление
гидролиза каждой из солей, ибо ионы Н+ и ОН- образуют
молекулу слабого электролита Н2О. При этом гидролитическое равновесие
сдвигается вправо и гидролиз каждой из взятых солей идет до конца с
образованием Al(ОН)3 и Н2SО3. Ионно-молекулярное
уравнение:
2 Al3+ + 3 SO32- + 6 H2O = 2
Al(ОН)3
+ 3 Н2SО3
молекулярное уравнение:
Al2(SO4)3 + 3 Na2SO3
+ 6 H2O = 2 Al(ОН)3 + 3 Н2SО3 +
3 Na2SO4
г) Сульфат цинка ZnSO4 – соль слабого многоосновного основания Zn(ОН)2 и сильной кислоты Н2SO4. В этом случае катионы Zn2+ связывают гидроксильные ионы воды,
образуя катионы основной соли ZnОН+. Образование молекул Zn(ОН)2 не происходит, так
как ионы ZnОН+ диссоциируют гораздо труднее, чем молекулы Zn(ОН)2. В обычных условиях
гидролиз идет по первой ступени. Соль гидролизуется по катиону.
Ионно-молекулярное уравнение гидролиза
Zn2+ + H2O ↔ ZnOH+ + H+
При добавлении к раствору
Al2(SO4)3 сульфата цинка гидролиз сульфата
алюминия уменьшится, так как в растворе увеличится содержание ионов Н+
и гидролитическое равновесие сдвинется влево (по принципу Ле Шателье).
Задача № 223
Составьте электронные
уравнения и укажите, какой процесс – окисление или восстановление – происходит
при следующих превращениях:
As3- → As5+; N3+ → N3-; S2- → S0
На основании электронных
уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
Na2SO3 + KMnO4 + H2O →
Na2SO4 + MnO2 + KOH
Решение. Окисление – восстановление – это единый, взаимосвязанный процесс.
Окисление приводит к повышению степени окисления восстановителя, а
восстановление – к ее понижению у окислителя.
As3- - 8 ē → As5+ процесс окисления;
N3+ + 6ē → N3- процесс восстановления;
S2- - 2ē → S0 процесс окисления.ё
+4 +7
+6
+4
Na2SO3 + KMnO4 + H2O →
Na2SO4 + MnO2 + KOH
Коэффициенты в уравнении
определим методом электронного баланса с помощью электронных уравнений.
Вычислим, как изменяют свою степень окисления восстановитель и окислитель, и
отразим это в электронных уравнениях:
 восстановитель 3
S4+ - 2ē
= S6+
процесс окисления
восстановитель 3
S4+ - 2ē
= S6+
процесс окисления
окислитель 2 Mn7+ + 3ē = Mn4+
процесс восстановления
Общее число электронов,
отданных восстановителем, должно быть равно числу электронов, которое
присоединяет окислитель. Общее наименьшее кратное для отданных и принятых
электронов шесть. Разделив это число на 2, получаем коэффициент 3 для
восстановителя и продукта его окисления, а при делении 6 на 3 получаем
коэффициент 2 для окислителя и продукта его восстановления. Коэффициенты перед
веществами, атомы которых не меняют свою степень окисления, находят подбором.
Уравнение реакции будет иметь вид
3 Na2SO3 + 2 KMnO4 + H2O
→ 3 Na2SO4 + 2 MnO2 + 2 KOH
Задача № 244
Увеличится, уменьшится
или останется без изменения масса кадмиевой пластинки при взаимодействии ее с
растворами: а) AgNO3;
б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные
уравнения соответствующих реакций.
Решение.
а) Стандартный электродный потенциал кадмия равен -0,403 В,
а серебра – (+ 0,80). Так как кадмий
имеет меньший потенциал, на пластинке будет протекать окислительный процесс:
Cd0 – 2ē = Cd2+
ионы кадмия переходят в раствор.
Ионы серебра, принимая
электроны, восстанавливаются до серебра:
Ag+ + 1ē = Ag0
Уравнение происходящей
окислительно-восстановительной реакции можно получить, сложив электронные уравнения
анодного и катодного процессов (при этом общее число электронов, отданных
восстановителем, должно быть равно числу электронов, которое присоединяет
окислитель):
Cd + 2 Ag+ = Cd2+ + 2 Ag
Cd + 2 AgNO3 = Cd(NO3)2 + 2 Ag
Изменение массы пластинки
связано с осаждением серебра (увеличение массы) и растворением кадмия
(уменьшение массы). Масса растворившегося кадмия равна 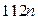 (n – количество вещества кадмия). По уравнению реакции количество вещества
кадмия относится к количеству вещества серебра как 1:2, следовательно, масса
осажденного серебра равна
(n – количество вещества кадмия). По уравнению реакции количество вещества
кадмия относится к количеству вещества серебра как 1:2, следовательно, масса
осажденного серебра равна 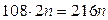 . Так как масса осажденного серебра больше массы
растворившегося кадмия, масса кадмиевой пластинки увеличится.
. Так как масса осажденного серебра больше массы
растворившегося кадмия, масса кадмиевой пластинки увеличится.
б) Стандартный электродный потенциал цинка равен -0,763 В. Цинк
имеет меньший потенциал, он должен окисляться, а кадмий восстанавливаться
Zn0 – 2ē = Zn2+
Cd2+ + 2ē = Cd0
В данном случае масса
кадмиевой пластинки не изменится, т.к. кадмий не будет реагировать с растворами
солей цинка.
в) Стандартный электродный потенциал никеля равен -0,25 В. В
данном случае кадмий имеет меньший потенциал, на пластинке будет протекать
окислительный процесс:
Cd0 – 2ē = Cd2+
ионы кадмия переходят в раствор.
Ионы никеля, принимая
электроны, восстанавливаются до никеля:
Ni2+ + 2ē = Ni0
Уравнение происходящей
окислительно-восстановительной реакции можно получить, сложив электронные
уравнения анодного и катодного процессов:
Cd + Ni+ = Cd2+ + Ni
Cd + NiSO4 = CdSO4 + Ni
Изменение массы пластинки
связано с осаждением никеля (увеличение массы) и растворением кадмия
(уменьшение массы). Масса растворившегося кадмия равна 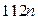 (n – количество вещества кадмия). По уравнению реакции количество вещества
кадмия относится к количеству вещества никеля как 1:1, следовательно, масса
осажденного никеля равна
(n – количество вещества кадмия). По уравнению реакции количество вещества
кадмия относится к количеству вещества никеля как 1:1, следовательно, масса
осажденного никеля равна 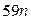 . Так как масса осажденного никеля меньше массы
растворившегося кадмия, масса кадмиевой пластинки уменьшится.
. Так как масса осажденного никеля меньше массы
растворившегося кадмия, масса кадмиевой пластинки уменьшится.
Задача № 265
Электролиз раствора
нитрата серебра проводили при силе тока 2 А в течение 4ч. Составьте электронные
уравнения процессов, происходящих на электродах. Какая масса серебра и каков
объем газа (н.у.), выделившегося на аноде?
Решение. В растворе нитрат серебра диссоциирует на ионы:
AgNO3
↔ Ag+
+ NO3-
Ионы серебра могут
восстанавливаться на катоде в водном растворе. Нитрат-ионы в водном растворе не
окисляются, поэтому на аноде будет протекать окисление воды. Схема электролиза:
 Ag+
+ 1ē = Ag0
4
Ag+
+ 1ē = Ag0
4
2H2O - 4ē = 4H+ + O2 1
Общее уравнение
электролиза водного раствора AgNO3 в ионной форме имеет вид
электролиз
 4 Ag+ + 2 H2O 4 Ag + O2 + 4 H+
4 Ag+ + 2 H2O 4 Ag + O2 + 4 H+
или в молекулярной форме:
электролиз
 4 AgNO3+ 2 H2O 4 Ag + O2 + 4 HNO3
4 AgNO3+ 2 H2O 4 Ag + O2 + 4 HNO3
Согласно законам Фарадея
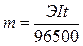 ,
,
где: m – масса вещества, окисленного или
восстановленного на электродах; Э – эквивалентная масса вещества; I – сила тока, А; t – продолжительность электролиза,
с. Эквивалентная масса серебра в AgNO3 равна 107,87 / 1 = = 107,87 г/моль; t = 14400 (4 ч = 14400 с), подставляя
данные значения в формулу, получим:
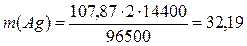 г.
г.
Так как необходимо найти
объем кислорода, то эквивалентную массу кислорода заменяем эквивалентным
объемом. Эквивалентный объем кислорода (н.у.) равен 22,4 / 4 = 5,6 л. Отсюда
объем газа, выделившегося на аноде:
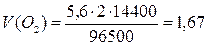 г.
г.
Задача № 286
Железное изделие покрыли
никелем. Какое это покрытие – анодное или катодное? Почему? Составьте
электронные уравнения анодного и катодного процессов коррозии этого изделия при
нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте.
Какие продукты коррозии образуются в первом и во втором случаях?
Решение. Никель имеет более отрицательный потенциал (-0,25 В), чем железо
(-0,037), поэтому он является анодом, а железо катодом (т.е. это покрытие
анодное).
Анодный процесс:
Ni0 - 2ē = Ni2+
Катодный процесс:
- во влажном воздухе ½
О2 + Н2О + 2ē = 2 ОН-
Так как ионы Ni2+ с гидроксильной группой образуют
нерастворимый гидроксид, то продуктом коррозии будет Ni(OH)2.
- в хлороводородной (соляной)
кислоте 2 Н+ + 2ē = Н2
В данном случае продуктом
коррозии будет хлорид никеля NiCl2.
Задача № 307
Из сочетания частиц Со3+,
NH3, NO2- и К+ можно составить семь координационных
формул комплексных соединений кобальта, одна из которых [Co(NH3)6](NO2)3. Составьте формулы других шести
соединений и напишите уравнения их диссоциации в водных растворах.
Решение.
K3[Co(NO2)6], K2[Co(NH3)(NO2)5],
K[Co(NH3)2(NO2)4], [Co(NH3)3(NO2)3],
[Co(NH3)4(NO2)2]NO2,
[Co(NH3)5(NO2)](NO2)2.
Данные комплексные соли (кроме
тринитротриамминкобальта) являются сильными электролитами, в водном растворе
они необратимо диссоциируют на ионы внешней и внутренней сфер
K3[Co(NO2)6] = 3 K+ + [Co(NO2)6]3-;
K2[Co(NH3)(NO2)5]
= 2 K+ + [Co(NH3)(NO2)5]2-;
K[Co(NH3)2(NO2)4] = K+
+ [Co(NH3)2(NO2)4]-;
[Co(NH3)4(NO2)2]NO2
= [Co(NH3)4(NO2)2]+ + NO2-;
[Co(NH3)5(NO2)](NO2)2
= [Co(NH3)5(NO2)]2+ + 2 NO2-,
комплексные же ионы диссоциируют
обратимо и в незначительной степени на составляющие их частицы:
[Co(NO2)6]3- ↔ Co3+ + 6
NO2-;
[Co(NH3)(NO2)5]2- ↔ Co3+
+ NH3 + 5 NO2-;
[Co(NH3)2(NO2)4]-
↔ Co3+ + 2 NH3 + 4 NO2-;
[Co(NH3)4(NO2)2]+
↔ Co3+ + 4 NH3 + 2 NO2-;
[Co(NH3)5(NO2)]2+ ↔ Co3+
+ 5 NH3 + NO2-.
Тринитротриамминкобальта диссоциируют
обратимо и в незначительной степени
[Co(NH3)3(NO2)3] ↔ Co3+
+ 3 NH3 + 3 NO2-.
Задача № 328
Назовите
три изотопа водорода. Укажите состав их ядер. Что такое тяжелая вода? Как она получается
и каковы ее свойства?
Три
изотопа водорода:
Протий
– 11Н: 1 протон, 0 нейтронов
Дейтерий
– 12Н: 1 протон, 1 нейтрон
Тритий
– 13Н: 1 протон, 2 нейтрона
Тяжелая
вода – вода, содержащая тяжелый водород (Д2О).
Молекулярная
масса – 20.
Плотность
при 200 С – 1,1050 г/см3
Температура
кристаллизации – 3,80 С.
Температура
кипения – 101,40 С.
Химические
реакции с тяжелой водой протекают значительно медленнее, чем с обычной водой.
Получение:
1. Из
обычной воды многоступенчато.
2.
Окислением дейтерия: Д2 + О2 → Д2О
3.
Перегонкой: Н2О + Д2S = H2S + Д2О
Задача № 349
Жесткость воды, в которой
растворен только гидрокарбонат кальция, равна 4 мэкв. Какой объем 0,1 н
раствора HCl потребуется для реакции с гидрокарбонатом кальция, содержащимся в 75 см3
этой воды?
Решение. Жесткость воды равна 4 мэкв, т.е. концентрация гидрокарбонат кальция
равна 0,004 н. Так как вещества взаимодействуют между собой в эквивалентных
соотношениях, то растворы равной нормальности реагируют в равных объемах. При
разных нормальностях объемы растворов реагирующих веществ обратно
пропорциональны их нормальностям, т.е.
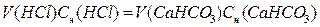 , откуда
, откуда
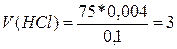 см3
см3
Задача № 382
Какие реакции нужно
провести для осуществления следующих превращений:
NaCl → HCl → Cl2 → KClO3
Уравнения
окислительно-восстановительных реакций составьте на основании электронных
уравнений.
Решение.
а) NaCl + H2SO4
(кон.)→
HCl + NaHSO4
-
+4 0 +2
б) 4
HCl + MnO2 = Cl2 + MnCl2 + 2 H2O
 восстановитель 3
2 Cl-
- 2ē = Cl2 процесс окисления
восстановитель 3
2 Cl-
- 2ē = Cl2 процесс окисления
окислитель 2 Mn4+ + 2ē = Mn2+
процесс восстановления
0 -
+5
в) 3
Cl2 + 6 KOH = 5 KCl + KClO3 + 3 H2O
 восстановитель 3
Cl0
- 5ē = Cl5+ процесс окисления
восстановитель 3
Cl0
- 5ē = Cl5+ процесс окисления
окислитель 2 Cl0 + 1ē = Cl- процесс
восстановления
Задача № 392
Составьте уравнения
реакций, которые надо провести для осуществления следующих превращений:
Cu → Cu(NO3)2 → Cu(OH)2
→ CuCl2 → [Cu(NH3)4]Cl2
Решение.
0 +5 +2 +2
3 Cu + 8 HNO3 = 3 Cu(NO3)2 +2 NO + 4 H2O
 восстановитель 3
Cu0
- 2ē = Cu2+ процесс окисления
восстановитель 3
Cu0
- 2ē = Cu2+ процесс окисления
окислитель 2 N5+ + 3ē = N2+
процесс восстановления
Cu(NO3)2 + 2 КOH = Cu(OH)2 + 2 КNO3
Cu(OH)2 + 2 HCl = CuCl2 + 2 H2O
CuCl2 + 4 NH3 = [Cu(NH3)6]Cl2
Задача № 413
При сплавлении хромита
железа Fe(CrO2)2
с карбонатом натрия в присутствии кислорода хром (III) и железо (II) окисляются и приобретают
соответственно степени окисления +6 и +3. Составьте электронные и молекулярные
уравнения реакции.
Решение.
+2 +3 0
+3 +6
-2
4 Fe(CrO2)2 + 7 O2 + 8 Na2CO3
= 2 Fe2O3 + 8 Na2CrO4 + 8 CO2
|
восстановители
|
Fe2+
- 1ē
= Fe3+
2
Cr3+ - 6ē = 2 Cr6+
|
7ē
|
4
|
|
окислитель
|
O20
+ 4ē =
O2-
|
4ē
|
7
|
Задача № 434
Как можно получить
винилхлорид, имея карбид кальция, хлорид натрия, серную кислоту и воду.
Напишите уравнения соответствующих реакций. Составьте схему полимеризации
винилхлорида.
Решение.
1. NaCl
+ H2SO4 (кон.)→
HCl + NaHSO4
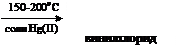 2.
CaC2 + H2O → Ca(OH)2 + HC≡CH
2.
CaC2 + H2O → Ca(OH)2 + HC≡CH
3. HC≡CH + HCl
H2C=CH–Cl
Схема реакции полимеризации винилхлорида:


 n (СН2=СН) → n (٠СН2-СН٠) → n (-СН2-СН-)
n (СН2=СН) → n (٠СН2-СН٠) → n (-СН2-СН-)
Cl Cl Cl
n – степень
полимеризации.
Список используемой литературы
1.
Ахметов
Н.С. Общая и неорганическая химия: Учебник для вузов. – М.: Высшая школа, 1981.
2.
Глинка
Н.Л. Общая химия. – СПб.: Химия, 2000.
3.
Ким
А.М. Органическая химия. – Новосибирск: Изд-во НГПУ, 1999.
4.
Степин
Б.Д. и др. Неорганическая химия. – М.: Высшая школа, 1994.
5.
Угай
Я.А. Общая химия. – М.: Высшая школа, 1984.