Задача № 5
Оксид трехвалентного элемента содержит 31,58 % кислорода. Вычислите эквивалентную, мольную и атомную массы этого элемента.
Решение. По закону эквивалентов:
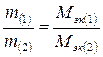 ,
,
где: m1 и m2 – масса веществ 1 и 2, г;
Мэк (1) и Мэк (2) – молярная масса эквивалентов веществ 1 и 2, г/моль.
Если массу оксида принять за 10 г, то масса кислорода в нем равна 3,158 г, а масса трехвалентного элемента: (10 – 3,158) = 6,842 г.
Эквивалентная масса О2- равна 16 / 2 = 8 г/моль. Подставляя данные значения в формулу, имеем
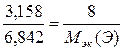 ;
; ![]() г/моль.
г/моль.
Атомная
масса трехвалентного элемента равна: ![]() , данный трехвалентный элемент – хром. Мольная масса хрома
равна его атомной массе, равна 51,996 г/моль.
, данный трехвалентный элемент – хром. Мольная масса хрома
равна его атомной массе, равна 51,996 г/моль.
Задача № 26
Изотоп никеля-57 образуется при бомбардировке α-частицами ядер атомов железа-54. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
Решение. Превращения атомных ядер записываются в виде уравнений ядерных реакций. При этом следует помнить, что суммы массовых чисел (цифры, стоящие у символа элемента вверху слева) и алгебраические суммы зарядов (цифры, стоящие у символа элемента внизу слева) частиц в левой и правой частях равенства должны быть равны. Данную реакцию выражают уравнением
![]() Fe +
Fe + ![]() He =
He = ![]() Ni +
Ni + ![]() n
n
Часто применяют сокращенную форму записи. Для
приведенной реакции она имеет вид: ![]() Fe(α, n)
Fe(α, n)![]() Ni.
Ni.
Задача № 52
Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: Ba(OH)2 или Mg(OH)2; Сa(OH)2 или Fe(OH)2; Cd(OH)2 или Sr(OH)2?
Решение. Сила оснований зависит от прочности и полярности связи Э–О. Полярность связи определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами атомов. Чем больше размер атома и меньше эффективный заряд атомного ядра элемента, образующего гидроксид, тем прочность связи Э–О меньше и тем сильнее основание.
Барий и магний находятся в одной группе периодической системы. В группе с увеличением порядкового номера увеличивается атомный радиус элементов, так как увеличивается число энергетических уровней. Следовательно, связь Mg–О будет прочнее связи Ва–О, т.е. Ba(OH)2 более сильное основание, чем Mg(OH)2.
Кальций и железо, кадмий и стронций находятся в одном периоде. В периоде с увеличением порядкового номера атомный радиус элементов уменьшается, так как увеличивается эффективный заряд атомного ядра. Следовательно, связь Fe–О будет прочнее связи Cа–О, а связь Cd–О прочнее Sr–О, т.е. Сa(OH)2 более сильное основание, чем Fe(OH)2, а Sr(OH)2 более сильное основание, чем Cd(OH)2.
Задача № 64
Как метод валентных связей (ВС) объясняет линейное строение молекулы BeCl2 и тетраэдрическое СН4?
Решение. Теория валентных связей (ВС) предполагает участие в образовании ковалентных связей не только «чистых» атомных орбиталей, но и «смешанных», так называемых гибридных, АО. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и одинаковой энергии. Число гибридных орбиталей равно числу исходных.
При образовании молекулы хлорида бериллия атом бериллия переходит в возбужденное состояние, сопровождающееся разъединение спаренных электронов, т.е. распадом двухэлектронного облака (2s2) на одноэлектронные. Схематически это можно изобразить так:
|
4Ве* 1s22s12p1 |
В образовании связи в молекуле BeCl2 участвуют один s- и один p-электрон центрального атома, т.е. бериллия. В этом случае происходит sp-гибридизация орбиталей. Две гибридные орбитали ориентируются под углом 1800 друг к другу, т.е. молекула BeCl2 имеет линейную форму – все три атома расположены на одной линии.
При образовании молекулы метана атом углерода переходит в возбужденное состояние, сопровождающееся разъединение спаренных 2s-электронов, т.е. распадом двухэлектронного облака на одноэлектронные:
|
6С* 1s22s12p3 |
При образовании молекулы метана у атома углерода подверглись гибридизации орбитали одного s- и трех p-электронов и получились четыре одинаковые гибридные орбитали. Такая гибридизация называется sp3-гибридизацией. Валентный угол между осями гибридных орбиталей составляет 109,50 друг к другу, т.е. молекула СН4 имеет тетраэдрическую форму.
Задача № 98
При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа FeS.
Решение.
Fe + S =
Количество
вещества железа участвовавшего в реакции равно 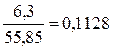 моль. По уравнению реакции количество вещества железа
относится к количеству вещества сульфида железа как 1:1, т.е. n (FeS) =
0,1128 моль. Использую полученные данные можно составить пропорцию:
моль. По уравнению реакции количество вещества железа
относится к количеству вещества сульфида железа как 1:1, т.е. n (FeS) =
0,1128 моль. Использую полученные данные можно составить пропорцию:
0,1128 моль FeS – 11,31 кДж теплоты
1 моль FeS – х кДж теплоты
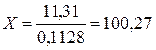 кДж.
кДж.
Задача № 114
Какие
из карбонатов: ВеСО3 или ВаСО3 – можно получить по
реакции взаимодействия соответствующих оксидов с СО2? Какая реакция
идет наиболее энергично? Вывод сделайте, вычислив ΔG![]() реакции.
реакции.
Решение.
а) ВеО + СО2 = ВеСО3
б) ВаО + СО2 = ВаСО3
![]()
Используя табличные данные, определим стандартные энергии Гиббса ВеO, ВаО, СО2 (г), ВеСО3 и ВаСО3:
∆G (ВеO) = -581,61 кДж/моль;
∆G (ВаO) = -528,4 кДж/моль;
∆G (СO2 (г)) = -394,38 кДж/моль;
∆G (ВеСО3) = -944,75 кДж/моль;
∆G (ВаСО3) = -1138,8 кДж/моль.
Находим ΔG![]() процесса:
процесса:
а)![]() кДж
кДж
б)![]() кДж
кДж
То что ΔG![]() < 0, указывает на
самопроизвольное протекание прямой реакции при Т = 298 К и равенстве давлений
взятых газов
< 0, указывает на
самопроизвольное протекание прямой реакции при Т = 298 К и равенстве давлений
взятых газов ![]() Па (760 мм рт.ст. = 1 атм.). Т.е. ВаСО3 можно
получить по реакции взаимодействия соответствующего оксида (ВаО) с СО2.
Па (760 мм рт.ст. = 1 атм.). Т.е. ВаСО3 можно
получить по реакции взаимодействия соответствующего оксида (ВаО) с СО2.
Задача № 140
Исходные концентрации [NO]исх и [Cl2]исх в гомогенной системе 2NO + + Cl2 ↔ 2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO.
Решение. Константа равновесия данной системы
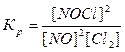
В условии задачи даны исходные концентрации, тогда как в выражении Кр входят только равновесные концентрации всех веществ системы.
После того как прореагировало 20% NO, его
концентрация стала ![]() моль/л – равновесна концентрация NO. Т.е. в реакцию вступило
0,1 моль NO, следовательно, концентрация прореагировавшего Cl2 равна
моль/л – равновесна концентрация NO. Т.е. в реакцию вступило
0,1 моль NO, следовательно, концентрация прореагировавшего Cl2 равна ![]() моль/л (по уравнению реакции на 2 NO приходится 1 Cl2). Отсюда равновесная
концентрация Cl2 равна
моль/л (по уравнению реакции на 2 NO приходится 1 Cl2). Отсюда равновесная
концентрация Cl2 равна ![]() моль/л. Равновесная концентрация NOCl равна концентрации
прореагировавшего NO, т.е. 0,1 моль/л.
моль/л. Равновесная концентрация NOCl равна концентрации
прореагировавшего NO, т.е. 0,1 моль/л.
Следовательно:
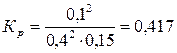
Задача № 147
Для осаждения в виде AgCl всего серебра, содержащегося в 100 см3 раствора AgNO3, потребовалось 50 см3 0,2 н. раствора HCl. Какова нормальность раствора AgNO3? Какая масса AgCl выпала в осадок?
Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.:
![]() , откуда
, откуда
![]() н.
н.
Эквивалент AgNO3 равен ![]() моль (100 см3 = 0,1 л), следовательно, эквивалент AgCl
также равен 0,01 моль. Эквивалентная масса AgCl равна его мольной массе,
т.е. 143,37 г/моль. Отсюда масса AgCl равна
моль (100 см3 = 0,1 л), следовательно, эквивалент AgCl
также равен 0,01 моль. Эквивалентная масса AgCl равна его мольной массе,
т.е. 143,37 г/моль. Отсюда масса AgCl равна ![]() г.
г.
Задача № 188
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Sn(OH)2 и HCl; б) BeSO4 и KOH; в) NH4Cl и Ba(OH)2.
Решение. Запишем уравнения взаимодействия указанных веществ в молекулярном виде:
а) Sn(OH)2 + 2HCl = SnCl2 + 2H2O
б) BeSO4 + 4NaOH = Na2[Be(OH)4] + Na2SO4
в) Ba(OH)2 + 2NH4Cl = BaCl2 + 2NH3 + 2H2O
Исключив одинаковые ионы из обеих частей равенства а) Cl-; б) Na+ и SO42-; в) Ba2+ и Cl-, получим ионно-молекулярные уравнения соответствующих реакций:
а) Sn(OH)2 + 2H+ = Sn2+ + 2H2O
б) Be2+ + 4OH- = [Be(OH)4]2-
в) OH- + NH4+ = NH3 + H2O
Задача № 190
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) AgNO3 и K2CrO4; б) Pb(NO3)2 и KI; в) CdSO4 и Na2S.
Решение. Запишем уравнения взаимодействия указанных веществ в молекулярном виде:
а) 2AgNO3 + K2CrO4 = Ag2CrO4 + 2KNO3
б) Pb(NO3)2 + 2KI = PbI2 + 2KNO3
в) CdSO4 + Na2S = CdS + Na2SO4
Исключив одинаковые ионы из обеих частей равенства а) K+ и NO3- б) К+ и NO3-; в) Na+ и SO42-, получим ионно-молекулярные уравнения соответствующих реакций:
а) 2Ag+ + CrO42- = Ag2CrO4
б) Pb2+ + 2I- = PbI2
в) Cd2+ + S2- = CdS
Задача № 210
Составьте ионно-молекулярное и молекулярное уравнения гидролиза солей CuCl2, Cs2CO3, Cr(NO3)3. Какое значение рН (>7<) имеют растворы этих солей.
Решение. а) хлорид меди CuCl2 – соль слабого многоосновного основания Cu(ОН)2 и сильной кислоты HCl. При растворении в воде молекулы CuCl2 полностью диссоциируют на катионы Cu2+ и анионы Cl-. Катионы Cu2+ связывают гидроксильные ионы воды, образуя катионы основной соли CuОН+. Образование молекул Cu(ОН)2 не происходит, так как ионы CuОН+ диссоциируют гораздо труднее, чем молекулы Cu(ОН)2. Анионы Cl- не могут связывать ионы Н+ воды, так как HCl – сильный электролит. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Cu2+ + H2O ↔ CuOH+ + H+
или в молекулярной форме
CuCl2 + H2O ↔ CuOHCl + HCl
В растворе появляется избыток ионов водорода, поэтому раствор CuCl2 имеет кислую реакцию (рН < 7).
б) карбонат цезия Cs2CO3 – соль слабой многоосновной кислоты H2СО3 и сильного основания CsOH. В этом случае анионы соли СO32- связывают ионы Н+ воды, образуя анионы кислой соли HСO3-, а не молекулы H2СО3, так как ионы HСО3- диссоциируют гораздо труднее, чем молекулы H2СО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
СО32- + H2O ↔ HСО3- + OH-
или в молекулярной форме
Cs2СО3 + H2O ↔ CsHСО3 + CsOH
В растворе появляется избыток ионов OH-, поэтому раствор Cs2СО3 имеет щелочную реакцию (рН > 7).
в) нитрат хрома (III) Cr(NO3)3 – соль слабого многоосновного основания Cr(ОН)3 и сильной кислоты НNO3. В этом случае катионы Cr3+ связывают гидроксильные ионы воды, образуя катионы основной соли CrОН2+. Образование молекул Cr(ОН)3 не происходит, так как ионы CrОН2+ диссоциируют гораздо труднее, чем молекулы Cr(ОН)3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Cr3+ + H2O ↔ CrOH2+ + H+
или в молекулярной форме
Cr(NO3)3 + H2O ↔ CrOH(NO3)2 + HNO3
В растворе появляется избыток ионов водорода, поэтому раствор Cr(NO3)3 имеет кислую реакцию (рН < 7).
Задача № 230
Реакции выражаются схемами:
KClO3 + Na2SO3 → KCl + Na2SO4
KMnO4 + HBr → Br2 + KBr + MnBr2 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; Какое вещество окисляется, какое – восстанавливается.
Решение:
+5 +4 -1 +6
KClO3 + Na2SO3 → KCl + Na2SO4
Коэффициенты в уравнении определим методом электронного баланса с помощью электронных уравнений. Вычислим, как изменяют свою степень окисления восстановитель и окислитель, и отразим это в электронных уравнениях:
![]() S4+ - 2ē = S6+
3 процесс
окисления, восстановитель
S4+ - 2ē = S6+
3 процесс
окисления, восстановитель
Cl5+ + 6ē = Cl- 1 процесс восстановления, окислитель
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которое присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 2, получаем коэффициент 3 для восстановителя и продукта его окисления, а при делении 6 на 6 получаем коэффициент 1 для окислителя и продукта его восстановления. Коэффициенты перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид
KClO3 + 3Na2SO3 → KCl + 3Na2SO4
+7 -1 0 +2
KMnO4 + HBr → Br2 + KBr + MnBr2 + H2O
![]() 2Br- - 2ē = Br20 5 процесс окисления, восстановитель
2Br- - 2ē = Br20 5 процесс окисления, восстановитель
Mn7+ + 5ē = Mn2+ 2 процесс восстановления, окислитель
2KMnO4 + 16HBr → 5Br2 + 2KBr + 2MnBr2 + 8H2O
Задача № 249
При какой концентрации ионов Cu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода?
Решение. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
![]() ,
,
где: Е0 – стандартный электродный потенциал; n – число электронов, принимающих участие в процессе; С – концентрация гидратированных ионов металла в растворе. Е0 для меди составляет +0,34 В, Е0 для водорода составляет 0 В.
![]() ,
,
![]() ,
,
![]() ,
,
![]() моль/л.
моль/л.
Задача № 274
Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора KBr. Какая масса вещества выделяется на катоде и аноде, если электролиз проводить в течение 1 ч 35 мин при силе тока 15 А?
Решение. В растворе KBr находятся гидратированные ионы K+ и Br-, а также молекулы воды. Если в этот раствор погрузить инертные (угольные) электроды и пропустить постоянный электрический ток, то ионы будут двигаться к электродам: катионы K+ - к катоду, анионы Br- - к аноду. Однако вместо ионов калия восстанавливаются молекулы воды (т.к. калий имеет малый стандартный электродный потенциал):
2H2O + 2ē = H2 + 2OH-
а на аноде окисляются бромид-ионы:
2Br- - 2ē = Br2
В итоге на катоде выделяется водород, на аноде – бром, а в растворе (вблизи катода) накапливается гидроксид калия КОН. Общее уравнение электролиза водного раствора KBr в ионной форме имеет вид
электролиз
![]() 2H2O + 2Br- H2 + Br2 + 2OH-
2H2O + 2Br- H2 + Br2 + 2OH-
или в молекулярной форме:
электролиз
![]() 2H2O + 2KBr
H2 + Br2 + 2KOH
2H2O + 2KBr
H2 + Br2 + 2KOH
Согласно законам Фарадея
![]() ,
,
где: m – масса вещества, окисленного или восстановленного на электродах; Э – эквивалентная масса вещества; I – сила тока, А; t – продолжительность электролиза, с. Эквивалентная масса водорода равна 2 / 2 = 1 г/моль, брома – 160 / 2 = 80 г/моль; t = 5700 (1 ч 35 мин = 5700 с), подставляя данные значения в формулу, получим:
![]() г;
г;
![]() г.
г.
Задача № 281
Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
Решение. Луженое железо – покрытое слоем олова. Олово имеет более отрицательный потенциал (-0,136 В), чем железо (-0,037), поэтому он является анодом, а железо катодом.
Анодный процесс:
Sn0 - 2ē = Sn2+
Катодный процесс:
½ О2 + Н2О + 2ē = 2ОН-
Цинк имеет более отрицательный потенциал (-0,763 В), чем железо (-0,037), поэтому он является анодом, а железо катодом.
Анодный процесс:
Zn0 - 2ē = Zn2+
Катодный процесс:
½ О2 + Н2О + 2ē = 2ОН-
Задача № 320
Константы нестойкости комплексных ионов [Co(NH3)6]3+, [Fe(CN)6]4-, [Fe(CN)6]3- соответственно равны 6,2 · 10-36, 1,0 · 10-37, 1,0 · 10-44. Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ионы.
Решение. Чем меньше значение Кн, тем более прочен комплекс, следовательно, более прочным ионом является [Fe(CN)6]3-.
Выражения для констант нестойкости указанных комплексных ионов выглядят следующим образом:
а) [Co(NH3)6]3+ ↔ Co3+ + 6NН3;
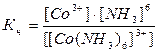
Соединения, содержащие этот ион – [Cо(NH3)6]Cl3, [Cо(NH3)6](OH)3
б) [Fe(CN)6]4- ↔ Fe2+ + 6CN-
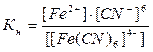
Соединения, содержащие этот ион – K4[Fe(CN)6], K2Na2[Fe(CN)6]
в) [Fe(CN)6]3- ↔ Fe3+ + 6CN-
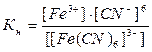
Соединения, содержащие этот ион – K3[Fe(CN)6], Fe3[Fe(CN)6]2
Задача № 329
Гидроксид какого из s-элементов проявляет амфотерные свойства? Составьте молекулярные и ионно-молекулярные уравнения реакций этого гидроксида: а) с кислотой; б) со щелочью.
Решение. Гидроксид бериллия (s-элемент) проявляет амфотерные свойства.
а) Ве(OH)2 + 2HCl = ВеCl2 + 2Н2О
H+
+
б) Ве(OH)2 + 2KOН = K2ВеО2 + 2Н2О
Ве(OH)2 + 2OН- = ВеО22- + 2Н2О
Задача № 350
В 1 м3 воды содержится 140 г сульфата магния. вычислите жесткость этой воды.
Решение. Жесткость воды определяется по формуле:
![]() ,
,
где: m – масса вещества обуславливающего жесткость воды или применяемого для устранения жесткости воды, мг; Э – эквивалентная масса этого вещества; V – объем воды, л. Эквивалентная масса сульфата магния MgSO4 120,37 / 2 = 60,185 г/моль, подставляя ее в формулу, находим (1 м3 = 1000 л)
![]() мэкв.
мэкв.
Задача № 385
Напишите формулы и назовите кислородные кислоты хлора, укажите степень окисления хлора в каждой из них. Какая из кислот более сильный окислитель? На основании электронных уравнений закончите уравнение реакции:
KI + NaOCl + H2SO4 → I2 + …
Хлор приобретает низшую степень окисления.
Решение.
+1
HClO – хлорноватистая кислота;
+3
HClO2 – хлористая кислота;
+5
HClO3 – хлорноватая кислота;
+7
HClO – хлорная кислота.
Более сильный окислитель – хлорная кислота, так как хлор в ней имеет высшую степень окисления, в остальные кислоты могут быть как окислителями, так и восстановителями.
-1 +1 0
КI + NaClO + H2SO4 → I2 + …
![]() 2I- - 2ē = I20 1
процесс окисления, восстановитель
2I- - 2ē = I20 1
процесс окисления, восстановитель
Cl+ + 2ē = Cl- 1 процесс восстановления, окислитель
2КI + NaClO + H2SO4 → I2 + NaCl + K2SO4 + H2O
Задача № 391
Серебро не взаимодействует с разбавленной серной кислотой, тогда как в концентрированной оно растворяется. Чем это можно объяснить? составьте электронные и молекулярные уравнения соответствующей реакции.
Решение. В разбавленной серной кислоте в качестве окислителя выступает водород. Так как серебро имеет больший электродный потенциал (+0,80) по сравнению с водородом, то оно должно быть окислителем, а водород восстановителем. Поэтому серебро не взаимодействует с разбавленной серной кислотой.
Концентрированная серная кислота при нагревании взаимодействует почти со всеми металлами (в том числе и с серебром), т.к. она выступает как окислитель.
0 +6 +1 +4
Ag + H2SO4 (к) → Ag2SO4 + SO2 + H2O
![]() Ag0 - 1ē = Ag+ 2 процесс
окисления, восстановитель
Ag0 - 1ē = Ag+ 2 процесс
окисления, восстановитель
S6+ + 2ē = S4+ 1 процесс восстановления, окислитель
2Ag + 2H2SO4 (к) → Ag2SO4 + SO2 + 2H2O
Задача № 425
Чем отличается взаимодействие гидроксидов кобальта (III) и никеля (III) с кислотами от взаимодействия гидроксида железа (III) с кислотами? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение. Гидроксиды Fe(III), Co(III), Ni(III) носят в обычных условиях основной характер. При растворении в кислотах Co(OH)3 и Ni(OH)3 проявляют сильные основные свойства и восстанавливаются до катионов Ni2+ и Co2+, гидроксид железа (III) такими свойствами не обладает.
4Co(OH)3 + 4H2SO4 = 4CoSO4 + O2 + 10H2O
![]() 2О2- - 4ē = О20 1
процесс окисления, восстановитель
2О2- - 4ē = О20 1
процесс окисления, восстановитель
Со3+ + ē = Со2+ 4 процесс восстановления, окислитель
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
Задача № 450
Какие полимеры называют термопластичными, термореактивными? Укажите три состояния полимеров. Чем характеризуется переход из одного состояния в другое?
Решение. Полимером называется органическое вещество, длинные молекулы которого построены из одинаковых многократно повторяющихся звеньев — мономеров. По химической структуре полимеры делятся на линейные, разветвленные, сетчатые и пространственные.
Молекулы линейных полимеров химически инертны по отношению друг к другу и связаны между собой лишь силами Ван-дер-Ваальса. При нагревании вязкость таких полимеров уменьшается. Поскольку единственным следствием нагрева является изменение пластичности, линейные полимеры называют термопластичными. Термопластичные полимеры можно не только плавить, но и растворять, так как связи Ван-дер-Ваальса легко рвутся под действием реагентов.
Разветвленные (привитые) полимеры более прочны, чем линейные. Контролируемое разветвление цепей служит одним из основных промышленных методов модификации свойств термопластичных полимеров.
Сетчатая структура характерна тем, что цепи связаны друг с другом, а это сильно ограничивает движение и приводит к изменению как механических, так и химических свойств. Обычная резина мягка, но при вулканизации серой образуются ковалентные связи типа S-О, и прочность растет. Полимер может приобрести сетчатую структуру и спонтанно, например, под действием света и кислорода произойдет старение с потерей эластичности и работоспособности. Наконец, если молекулы полимера содержат реакционно-способные группы, то при нагревании они соединяются множеством прочных поперечных связей, полимер оказывается сшитым, т. е. приобретает пространственную структуру. Таким образом, нагрев вызывает реакции, резко и необратимо изменяющие свойства материала, который приобретает прочность и высокую вязкость, становится нерастворимым и неплавким. Вследствие большой реакционной способности молекул, проявляющейся при повышении температуры, такие полимеры называют термореактивными.
Для незакристаллизованных полимеров в зависимости от температуры (и величины механического напряжения) возможны три физических (деформационных) состояния: стеклообразное, высокоэластическое и вязкотекучее. Практическое применение полимеров определяется тем, в каком из этих состояний находится данный полимер при температуре его использования.
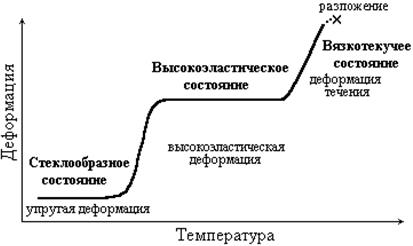
Для стеклообразных полимеров характерны относительно небольшие упругие (обратимые) деформации (1-10%). Причем полимерные стекла отличаются повышенной прочностью от низкомолекулярных стеклообразных тел, которые разрушаются при деформировании уже на 0,1-1%. Полимеры в стеклообразном состоянии применяются в производстве пластмасс.
Высокоэластические полимеры способны обратимо деформироваться на сотни процентов. В высокоэластическом состоянии в условиях эксплуатации находятся все каучуки. Это состояние характерно лишь для полимеров.
В вязкотекучем состоянии полимер ведет себя как очень вязкая жидкость, которая под действием силы проявляет необратимую деформацию (деформацию течения). Это состояние реализуется обычно при повышенных температурах и используется для переработки полимеров в изделия.
Список литературы
1. Глинка Н.Л. Общая химия. – СПб.: Химия, 2000.
2. Зубович И.А. Неорганическая химия: Учебник для технол. спец. вузов. – М.: Высшая школа, 1989.
3. Степин Б.Д. и др. Неорганическая химия. – М.: Высшая школа, 1994.
4. Стрепихеев А.А. и др. Основы химии высокомолекулярных соединений – М., 1967.
5. Угай Я.А. Общая химия. – М.: Высшая школа, 1984.