Содержание
Задача 34. 3
Задача 41. 4
Задача 99. 5
Задача 132. 6
Задача 173. 7
Задача 205. 8
Задача 240. 9
Задача 250. 10
Список литературы.. 12
Задача
34
Сколько протонов и нейтронов содержат ядра изотопов?
Составьте электронную формулу данного атома, подчеркните валентные электроны.
Распределите электроны этого атома по квантовым ячейкам. К какому электронному
семейству относится этот элемент? 3581Br и 3579Br
Решение:
3581Br и 3579Br
Число нейтронов в ядре атома элемента равно разности
округленного до целого значения атомной массы Аr и числа протонов (порядкового
номера)[1]. Таким образом, число
нейтронов в 3581Br равно:
81 – 35 = 46
Число нейтронов в 3579Br равно:
79 – 35 = 44
Электронная формула элемента:
1s22s2 2p63s23p64s23d104р5
Распределение электронов по квантовым ячейкам выглядит
следующим образом (рис.1):
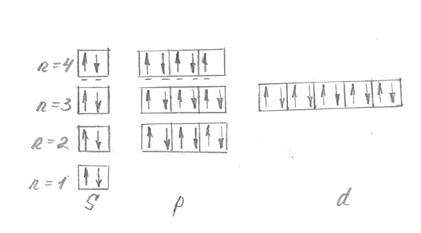
Рисунок 1 –
Распределение электронов по квантовым ячейкам в атоме элемента Br
Атом элемента брома содержит семь валентных электронов на
внешнем энергетическом уровне.
Данный элемент относится к семейству р-
элементов, т.к. последним заполняется р-энергетический
уровень..
Задача
41
Приведите современную формулировку периодического закона
Д.И. Менделеева. Почему Li,
Na, K, Cs, Rb, Fr составляют I главную подгруппу, а С, Si, Ge, Sn, Pb – IV
главную подгруппу элементов? Ответ мотивируйте строением внешних энергетических
уровней атомов соответствующих элементов.
Решение:
Свойства элементов и их соединений находятся в периодической
зависимости от их порядкового номера (от заряда ядра атомов элементов)[2].
Атомы всех главных (А-групп) имеют равное число внешних
электронов на высшем энергетическом уровне. Номер главной (А-группы) показывает
число внешних электронов или число электронов на внешнем энергетическом уровне.
Таким образом, у атомов I
главной подгруппы одинаковое число электронов на внешнем энергетическом уровне.
Рассмотрим строение внешних энергетических уровней элементов I главной подгруппы.
Электронные формулы элементов:
Li ~ …2s1
Na ~ …3s1
K ~ …4s1
Rb ~
…5s1
Cs ~
…6s1
Fr ~
…7s1
Графически это изображается следующим образом:
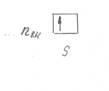
Рисунок 2 – Графическое изображение электронов на внешнем
энергетическом слое у элементов I
главной подгруппы
Рассмотрим IV
главную подгруппу элементов. Номер группы показывает число электронов на
внешнем энергетическом уровне. Электронные формулы элементов:
С ~ …2s22р2
Si ~ …3s23р2
Ge ~ …4s24р2
Sn ~ …5s25р2
Pb ~
…6s26р2
Или графически (рис. 3).
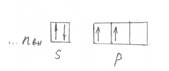
Рисунок 3 – Графическое изображение электронов на внешнем
энергетическом слое у элементов IV
главной подгруппы
Задача
99
Вычислите значения ∆G298 для реакции:
2 СО (г) + О2 (г) = 2СО2 (г)
Вычисления сделайте на основании стандартных теплот образования абсолютных стандартных энтропий
соответствующих веществ.
Решение:
Для решения задачи воспользуемся выражением энергии Гиббса:
∆Gº298
= ∆Нº298 – Т * Sº298
∆Нº298
= Σ∆Нºпрод
- ∆Нºреаг =2∆Нº(СО2) - ∆Нº(О2) -2∆Нº (СО)
∆Нº(СО2)
= - 393, 51 кДж/ моль
∆Нº(СО) = -110,53
кДж/моль
∆Нº (О2)
= 0
Тогда ∆Нº298
= 2*(-393,51) - 0 – 2 * (-110,53) = -565,96 кДж
Sº298
= ΣSºпрод
- ΣSºреаг
Sº (СО2)[3] = 213, 66 Дж/ (моль*К)
Sº (СО) = 197,55 Дж/ (моль*К)
Sº (О2) = 205,04 Дж/ (моль*К)
Sº298
= 2 * 213,66 - 197,55 - 205,04
= 24,73 Дж/К
∆Gº298
= ∆Нº298 – Т * Sº298 =-565,96*10 3– 298 * 24,73
= -573329,54 Дж = -573,3 кДж
Задача
132
В каком направлении сместится равновесие реакции
PCl5
↔ PCl3
+ Сl2, ∆Нº298
= + 92,45 кДж/моль
Если повысить температуру на 40º С. Приведите расчет,
если температурный коэффициент прямой реакции равен 3, а обратной 2?
Решение:
В соответствии с принципом Ле-Шателье
при повышении температуры равновесие смещается в направлении эндотермической
реакции. Рассматриваемая реакция является эндотермической (∆Нº298
> 0), следовательно, направление реакции сместится в сторону прямой реакции.
По правилу Вант-Гоффа:
v2 = v1gDt/10 ,
где v2 и v1 – скорости реакции при
конечной (t2) и начальной (t1)
температурах
Для прямой реакции:
v2 = v1gDt/10
v2 / v1 =
340/10 = 81
При
повышении температуры на 40º С скорость прямой реакции
возрастет в 4 раза.
Для
обратной реакции:
v2 / v1 =
240/10 =16
При
повышении температуры на 40º С скорость обратной реакции
возрастет в 16 раз.
Равновесие
сместится в сторону прямой реакции, т.к. скорость прямой реакции выше.
Задача
173
Составьте молекулярные уравнения реакций, которым
соответствуют следующие ионно-молекулярные уравнения:
S2-
+ 2H+ = H2S
HNO2
+ OH-
= NO2- + H2O
Ag+
+ Cl- = AgCl
Решение:
Для составления молекулярных уравнений на основе
ионно-молекулярных необходимо подобрать пары соответствующих сильных
электролитов. В соответствии с таблицей растворимости молекулярное уравнение
для первой реакции может выражаться следующим образом:
Na2S + 2HCl = H2S
+ 2 NaCl
Для второй реакции:
HNO2
+ NaOH = Na NO2 + H2O
Для третьей реакции:
Ag NO3
+ КCl = AgCl
+ КNO3
Задача
205
Исходя из степени окисления хрома в веществах Cr, КCrO2 , K2Cr2O7,
определите, какое из них может быть
только восстановителем, какое только окислителем или проявляет
окислительно-восстановительную двойственность? На основании электронных
уравнений расставьте коэффициенты в уравнении реакции:
K2Cr2O7 + H2S + Н2SO4 → Cr2 (SO4)3
+ S + K2 SO4
+ H2O
Решение:
В
данных соединениях хром проявляет следующие степени окисления:
С.о. Cr = 0; с.о. хрома в КCrO2 равна +3, степень
окисления хрома в K2Cr2O7 равна +6.
Окислитель – это вещество,
которое принимает электроны и при этом его степень окисления понижается
Восстановитель – это вещество,
которое отдает электроны и при этом его степень окисления повышается. Хром
способен проявлять степени окисления: +6, +3, +2, 0
Хром с нулевой степенью окисления
может ее только повысить, т.е. является только восстановителем. Хром со
степенью окисления +6 (K2Cr2O7) может ее
только понизить (это максимальная степень окисления), следовательно, может
являться только окислителем. Хром в соединении КCrO2 может быть и окислителем
и восстановителем, т.к. может и повысить и понизить степень окисления.
+6 -2 +3 0
K2Cr2O7
+ H2S + Н2SO4 → Cr2 (SO4)3
+ S + K2 SO4
+ H2O
Cr+6 + 3е = Cr+3| 2 | восстановление, восстановитель
S2- - 2e-
= S0 | 3 | окисление,
восстановитель
Тогда суммарное ионно-молекулярное уравнение
реакции:
2 Cr+6 + 3S2- = 2 Cr+3 + 3 S0
K2Cr2O7 + 3 H2S + 4Н2SO4 → Cr2 (SO4)3
+ 3 S + 7H2O + K2 SO4
Для проверки правильности подбора
коэффициентов подсчитываем количество вещества атомов кислорода в левой и
правой частях уравнения. В левой части (7 + 4*4) моль = 23 моль. В правой
части: (3*4 + 4 + 7) моль = 23 моль. Следовательно, уравнение написано
правильно.
Задача
240
Какие из оксидов (Li2O,
К2О, CuO, Mn2O3) могут быть
восстановлены алюминием?
Решение:
Окислительно-восстановительные реакции протекают в том
направлении, для которого разность между стандартными потенциалами пары,
включающей окислитель, Еок и пары,
включающей восстановитель, ЕВс больше
нуля:
Еокº - ЕВсº > 0
Алюминий имеет стандартный электродный потенциал Еº (Al3+/
Al) = -1,7 В
Электродный потенциал пары: Li+ / Li = - 3.045 B
-3.045 – (-1.7) < 0 реакция невозможна
Электродный потенциал пары: К+ / К = - 2,924 В
- 2,924 – (-1.7) < 0 реакция невозможна
Электродный потенциал пары Cu2+ /Cu = + 0,338 В
+0,338 – (-1.7) > 0 реакция возможна
3CuO + 2Al
= Аl2O3
+ 3Cu
Cu2+
+ 2 е = Cu0
| 3 | восстановление, окислитель
Al0
– 3 е = Al 3+ | 2 | окисление, восстановитель
3 Cu2+
+ 2 Al0 = 3 Cu0 + 2 Al 3+
Электродный потенциал пары Cu2+ /Cu = + 0,338 В
Алюминий восстанавливает только оксид Mn2+ / Mn = -1,18 В:
-1,18 – (-1.7) > 0 реакция возможна
2Аl
+ Mn2O3 = Аl2O3 + 2Mn
2Mn3+
+ 6 е = 2Mn0
| 3 | 3 | восстановление, окислитель
Al0
– 3 е = Al 3+ | 6 | 2 | окисление, восстановитель
Mn2+
+ 2Al0 = Mn0 + 2 Al 3+
Задача 250
Какое покрытие металла называют катодным и какое анодным?
Перечислите металлы, которые могут быть использованы для катодного покрытия,
происходящих при коррозии железа, покрытого свинцом, при нарушении покрытия в
сильнокислой среде. Составьте схему образовавшегося коррозионного
гальванического элемента.
Решение:
Анодным называется металлическое покрытие, имеющее
электродный потенциал меньше электродного потенциала защищаемого металла. Для
железа (Еº = - 0,44 В) это могут быть цинк (Еº = - 0,76 В), хром (Еº
= - 0,91 В), алюминий (Еº = - 1,70 В), магний (Еº = - 2,37 В).
Механизм защиты:
Оцинкованное железо: Zn | H2O + O2| Fe
Zn – 2e- = Zn2+ (электроны переходят с
цинка на железо в месте, где железо имеет контакт со средой, т.е. появилась трещина)
2Н2О
+ О2 + 4е- = 4ОН-
Анодное покрытие более надежно, чем катодное, т.к. при
коррозии разрушается само покрытие.
Катодное покрытие металла – металлическое покрытие, имеющее
электродный потенциал больше электродного потенциала защищаемого металла. Для
железа (Еº = - 0,44 В) это могут быть никель (Еº = - 0,25 В), медь (Еº
= + 0,34 В), висмут (Еº = + 0,215В), серебро (Еº = + 0,80 В), олово
(Еº = - 0,136 В).
Механизм защиты:
Луженое железо (железо, покрытое слоем олова)
Sn |
H+ | Fe
Fe –
2 e- = Fe2+
Вывод: катодное покрытие менее надежно, т.к. при нарушении
покрытия окисляется сам металл.
При коррозии железа, покрытого свинцом (Еº(Pb2+/Pb) = -0,12В,
следовательно, катодное покрытие) возникает
микрогальванический элемент, анодом которого будет являться железо. На аноде
будет происходить процесс окисления железа, ионы железа будут переходить на
свинцовый участок, заряжая его отрицательно. Ионы водорода будут притягиваться
к свинцу, и восстанавливаться на нем.
Fe –
анод | Fe0 – 2e = Fe2+ | окисление, восстановитель
Pb –
катод | H+
+ e = H0 | восстановление, окислитель
Схема данного микрогальванического элемента:
(- ) Fe | H+
| Pb (+)
Список литературы
1. Химия
/ Под ред. В. Шретера . – М.: Химия, 1986. – 648 с.
2. Рабинович
В.А., Хавин З.Я. Краткий химический справочник. – Л.: Химия, 1977. – 376 с.
3. Ходаков
Ю.В., Цветков Л.А. Химия – М.: Государственное учебно-педагогическое
издательство министерства просвещения РСФСР, 1961. – 424 с.
4. Некрасов Б.В. Учебник общей химии. – М.: Химия, 1972. –
472 с.
5. Краткий
справочник физико-химических величин. – Л.: Химия, 1983. – 232 с.
[1] Химия / Под ред. В. Шретера . – М.: Химия, 1986. – 648 с.
[2] Химия / Под ред. В. Шретера
. – М.: Химия, 1986. – 648 с.
[3]
Рабинович В.А., Хавин З.Я. Краткий химический справочник. – Л.: Химия, 1977. –
376 с.