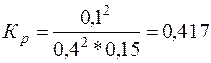Вариант 60
Задача № 24
Напишите электронные формулы атомов элементов с порядковыми
номерами 9 и 28. Покажите распределение электронов этих атомов по квантовым
ячейкам. К какому электронному семейству относится каждый из этих элементов?
Решение. Электронные формулы изображают распределение
электронов в атоме по энергетическим уровням и подуровням (атомным орбиталям).
Электронная конфигурация обозначается группами символов nlх,
где n -
главное квантовое число, l -
орбитальное квантовое число (вместо него указывают соответствующее буквенное
обозначение - s, p, d, f), x - число электронов в данном
подуровне (орбитали). При этом следует учитывать, что электрон занимает тот
энергетический подуровень, на котором он будет обладать наименьшей энергией -
меньшая сумма n+l.
Заполнение энергетических
уровней и подуровней идет в такой последовательности: 1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→ (5d1)→4f→(5d2-10)→6р→7s→(6d1)→5f→(6d2-10)→7р
Так как число электронов в
атоме того или иного элемента равно его порядковому номеру в таблице
Д.И.Менделеева, то для элементов № 9 (фтор)
и № 28 (никель) электронные формулы имеют вид:
9F
1s22s22p5
28Ni
1s22s22p63s23p63d84s2
Электронная структура атома
может быть изображена также в виде схем размещения электронов в квантовых
(энергетических) ячейках, которые являются схематическим изображением атомных
орбиталей (АО):
|
s
|
|
|
|
|
n
= 1
|
↑↓
|
|
p
|
|
|
n
= 2
|
↑↓
|
↑↓
|
↑↓
|
↑
|
9F
|
s
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n
= 1
|
↑↓
|
|
p
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n
= 2
|
↑↓
|
↑↓
|
↑↓
|
↑↓
|
|
|
d
|
|
|
|
|
|
|
|
|
|
|
n
= 3
|
↑↓
|
↑↓
|
↑↓
|
↑↓
|
↑↓
|
↑↓
|
↑↓
|
↑
|
↑
|
|
|
|
f
|
|
|
|
|
n
= 4
|
↑↓
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28Ni
Задача № 42
Что такое энергия ионизации? В каких единицах она
выражается? Как изменяется восстановительная активность s- и p-элементов в группах периодической системы с увеличением
порядкового номера? Почему?
Решение. Энергией ионизации
I называется
количество энергии, необходимое для отрыва электрона от невозбужденного атома:
Э0 + I =Э+ + ē
Энергия ионизации выражается в кдж/г-ат или эв/атом.
Значения энергии ионизации в эв/атом численно равны потенциалам ионизации
в в.
Наименьшей энергией ионизации (3 - 5 эв) обладают s-элементы I группы, наибольшей — s- и р-элементы VIII
группы. Возрастание энергии ионизации (соответственно возрастание
восстановительной активности) при переходе от s-элементов I группы к р-элементам VIII группы обусловливается возрастанием
эффективного заряда ядра. Восстановительная активность s- и p-элементов в группах периодической системы с увеличением
порядкового номера уменьшается, так как увеличивается радиус и уменьшается
эффективный заряд ядра.
Задача № 105
Уменьшается или
увеличивается энтропия при переходах: а) воды в пар; б) графита в алмаз?
Почему? Вычислите ΔS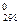 для каждого
превращения. Сделайте вывод о количественном изменении энтропии при фазовых и
аллотропических превращениях.
для каждого
превращения. Сделайте вывод о количественном изменении энтропии при фазовых и
аллотропических превращениях.
Решение. Энтропия
отражает движение частиц веществ и является мерой неупорядоченности системы.
Она возрастает с увеличением движения частиц.
В
первой системе энтропия возрастает, так как хотя в жидком состоянии молекулы
могут свободно двигаться, для газа
возможность хаотического движения больше. Во второй системе энтропия
уменьшается, так как уменьшается возможность хаотического движения: в
соответствии с sp2-гибридизацией графита атомы углерода в нем объединяются в
макромолекулы С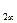 , углеродные слои объединяются в кристаллическую решетку в
основном за счет межмолекулярных сил – поэтому графит довольно мягок и легко
расслаивается, а в алмазе, вследствие sp3-гибридизации каждый атом
образует равноценные прочные σ-связи с четырьмя соседними – это
обуславливает его исключительную твердость.
, углеродные слои объединяются в кристаллическую решетку в
основном за счет межмолекулярных сил – поэтому графит довольно мягок и легко
расслаивается, а в алмазе, вследствие sp3-гибридизации каждый атом
образует равноценные прочные σ-связи с четырьмя соседними – это
обуславливает его исключительную твердость.
Для
первого превращения ΔS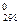 = ΔS
= ΔS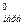 - ΔS
- ΔS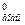 ; для
второго - ΔS
; для
второго - ΔS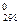 = = ΔS
= = ΔS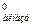 - ΔS
- ΔS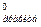 . Используя табличные данные, определим стандартные энтропии Н2О
(г), Н2О(ж), С (графит), С (алмаз):
. Используя табличные данные, определим стандартные энтропии Н2О
(г), Н2О(ж), С (графит), С (алмаз):
Н2О (г) = 188,72 Дж/(моль*К);
Н2О(ж) = 69,94 Дж/(моль*К);
С (графит) = 5,69 Дж/(моль*К);
С (алмаз) = 2,44 Дж/(моль*К).
а) ΔS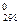 = 188,72 –
69,94 = 118,78 Дж/(моль*К);
= 188,72 –
69,94 = 118,78 Дж/(моль*К);
б) ΔS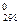 = 2,44 – 5,69 =
-3,25 Дж/(моль*К).
= 2,44 – 5,69 =
-3,25 Дж/(моль*К).
Вывод. При фазовых
превращениях изменение энтропии происходит в большем диапазоне, чем при
аллотропических превращениях.
Задача № 130
В гомогенной газовой системе А + В ↔ С + D равновесие установилось при
концентрациях: [В] = 0,05 моль/л, [С] = 0,02 моль/л. Константа равновесия
системы равна 0,04. Вычислите исходные концентрации веществ А и В.
Решение. Константа
равновесия данной системы
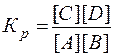
В
выражение Кр входят только равновесные концентрации всех веществ
системы.
По уравнению реакции моли всех веществ равны, следовательно,
[С]р = [D]р
= [В]прор. = [А]прор. =0,02 моль. Отсюда определим
равновесную концентрацию вещества А:
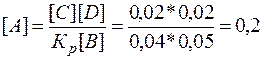 моль/л
моль/л
Следовательно
исходные концентрации веществ
А и В равны: [А]исх.= [A]рав. + [А]прор.
= 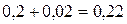 моль/л;
моль/л;
[В]исх.= [В]рав.
+ [В]прор. = 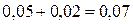 моль/л.
моль/л.
Задача № 147
Для осаждения в виде AgCl всего серебра, содержащегося в 100 см3 раствора AgNO3,
потребовалось 50 см3 0,2 н. раствора HCl. Какова нормальность раствора AgNO3? Какая масса
AgCl выпала в осадок?
Решение. Так как
вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы
равной нормальности реагируют в равных объемах. При разных нормальностях объемы
растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.
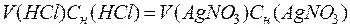 , откуда
, откуда
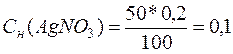 н.
н.
Эквивалент
AgNO3
равен 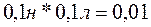 моль (100 см3 = 0,1 л), следовательно, эквивалент AgCl также равен 0,01 моль.
Эквивалентная масса AgCl
равна его мольной массе, т.е. 143,37 г/моль. Отсюда масса AgCl равна
моль (100 см3 = 0,1 л), следовательно, эквивалент AgCl также равен 0,01 моль.
Эквивалентная масса AgCl
равна его мольной массе, т.е. 143,37 г/моль. Отсюда масса AgCl равна 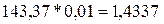 г.
г.
Вариант 20
Задача № 20
На нейтрализацию 0,943 г фосфористой кислоты H3PO3 израсходовано
1,291 г КОН. Вычислите эквивалент, эквивалентную массу и основность кислоты. На
основании расчета напишите уравнение реакции.
Решение. По закону
эквивалентов:
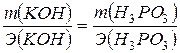
Эквивалентная масса КОН равна его молярной массе, т.е. 56
г/моль, отсюда
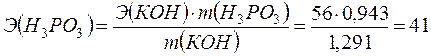 г/моль
г/моль
Так как мольная масса H3PO3
равна 82 г/моль, то основность данной кислоты 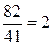 .
.
Уравнение данной реакции имеет вид
H3PO3 + 2KOH = K2HPO3 + 2H2O
Задача № 100
При получении эквивалентной массы гидроксида кальция из CaO (к) и Н2О (ж)
выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и
вычислите теплоту образования оксида кальция.
Решение.
Эквивалентная масса Са(ОН)2
равна ½ его мольной массы, т.е. 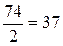 г/моль. При получении 37 г/моль гидроксида кальция выделяется 32,53 кДж тепла,
определим, сколько теплоты выделится при получении 74 г/моль (1 моль) гидроксида
кальция:
г/моль. При получении 37 г/моль гидроксида кальция выделяется 32,53 кДж тепла,
определим, сколько теплоты выделится при получении 74 г/моль (1 моль) гидроксида
кальция:
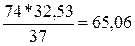 кДж
кДж
Если
в результате реакции выделяется теплота, то ΔН < 0. Учитывая сказанное,
составим термохимическое уравнение данной реакции:
СаО (к) + Н2О (ж)
= Са(ОН)2 (к); ΔНх.р.
= -65,06 кДж.
Для
решения задачи применим вывод из закона Гесса:
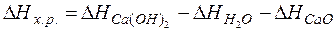
Используя
табличные данные, определим теплоты образования Са(ОН)2 (к), Н2О
(ж):
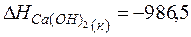 кДж;
кДж;
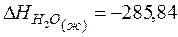 кДж;
кДж;
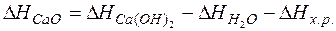
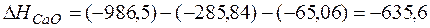 ;
;
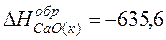 кДж/моль.
кДж/моль.
Задача № 120
Вычислите изменение энтропии для реакций, протекающих по
уравнениям:
2CH4
(г) = С2Н2 (г) + 3Н2 (г)
N2
(г) + 3Н2 (г) = 2NH3
(г)
С (графит) + О2 (г) = СО2 (г)
Почему в этих реакциях ΔS > 0; < ;
= 0?
> 0; < ;
= 0?
Решение. 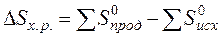
Используя табличные данные, определим стандартные энтропии CH4 (г), С2Н2
(г), Н2 (г), N2
(г), NH3
(г), С (графит), О2 (г) и СО2 (г):
CH4
(г) = 186,19 Дж/(моль*К);
С2Н2 (г) = 200,82 Дж/(моль*К);
Н2 (г) = 130,59 Дж/(моль*К);
N2
(г) = 191,49 Дж/(моль*К);
NH3
(г) = 192,50 Дж/(моль*К);
С (графит) = 5,69 Дж/(моль*К);
О2 (г) = 205,03 Дж/(моль*К);
СО2 (г) = 213,65 Дж/(моль*К).
1.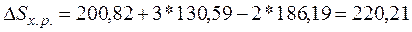 Дж/(моль*К);
Дж/(моль*К);
2.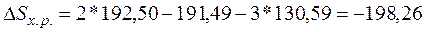 Дж/(моль*К);
Дж/(моль*К);
3.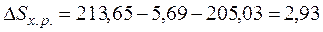 Дж/(моль*К).
Дж/(моль*К).
Энтропия отражает движение частиц веществ и является мерой
неупорядоченности системы. Она возрастает с увеличением движения частиц.
В первой системе энтропия возрастает ΔS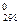 > 0, так как
увеличивается количество молекул газа, возможность хаотического движения
больше. Во второй системе энтропия уменьшается ΔS
> 0, так как
увеличивается количество молекул газа, возможность хаотического движения
больше. Во второй системе энтропия уменьшается ΔS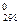 < 0, так как
уменьшается количество молекул газа, возможность хаотического движения меньше.
В третьей системе энтропия не изменяется ΔS
< 0, так как
уменьшается количество молекул газа, возможность хаотического движения меньше.
В третьей системе энтропия не изменяется ΔS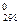 = 0, так как
количество молекул газа остается неизменным.
= 0, так как
количество молекул газа остается неизменным.
Задача № 140
Исходные концентрации [NO]исх и [Cl2]исх в
гомогенной системе 2NO + + Cl2 ↔ 2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите
константу равновесия, если к моменту наступления равновесия прореагировало 20% NO.
Решение. Константа равновесия данной
системы
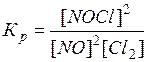
В
условии задачи даны исходные концентрации, тогда как в выражении Кр
входят только равновесные концентрации всех веществ системы.
После
того как прореагировало 20% NO, его концентрация стала 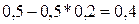 моль/л – равновесна концентрация NO. Т.е. в реакцию вступило
0,1 моль NO ([NO]исх. – [NO]прор. = 0,5 –
0,4 = 0,1), следовательно, концентрация прореагировавшего Cl2 равна
моль/л – равновесна концентрация NO. Т.е. в реакцию вступило
0,1 моль NO ([NO]исх. – [NO]прор. = 0,5 –
0,4 = 0,1), следовательно, концентрация прореагировавшего Cl2 равна 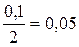 моль/л (по уравнению реакции на 2 NO приходится 1Cl2). Отсюда равновесная
концентрация Cl2
равна
моль/л (по уравнению реакции на 2 NO приходится 1Cl2). Отсюда равновесная
концентрация Cl2
равна 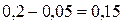 моль/л. Равновесная концентрация NOCl равна концентрации
прореагировавшего NO,
т.е. 0,1 моль/л.
моль/л. Равновесная концентрация NOCl равна концентрации
прореагировавшего NO,
т.е. 0,1 моль/л.
Следовательно: