Содержание
Задача 5. 3
Задача 38. 4
Задача 43. 5
Задача 97. 8
Задача 102. 8
Задача 128. 9
Задача 171. 10
Задача 219. 11
Задача 232. 11
Задача 257. 12
Список литературы.. 13
Задача 5
На нейтрализацию 0,944 г фосфористой кислоты Н3РО3 израсходовано 1,291 г гидроксида калия. Вычислите молярную массу эквивалента, фактор эквивалентности и основность кислоты. На основании проделанных вычислений составьте уравнение реакции.
Решение:
Н3РО3 + КОН = К3РО3 + Н2О
0,944 г 1,291 г
Эквивалентом называется весовое количество элемента, соединяющееся с одной (точнее с 1,008) весовой частью водорода или замещающее ее в соединениях. Элементы соединяются между собой в определенных весовых количествах, соответствующих их эквивалентам[1].
Эквивалентная масса КОН равна молярной массе и равна 56 г/моль.
0,943 г Н3РО3 соответствует 1,291 г КОН
х г Н3РО3 соответствует 56 г/моль
Тогда эквивалентная масса кислоты равна:
0,943 * 56 / 1,291 = 40,9 г/моль = 41 г/моль.
Эквивалент кислоты равен отношению эквивалентной массы к молярной массе кислоты и равен:
41 / 82 = 0,5 моль
Основность кислоты – число атомов кислорода, способных замещаться на металл. В данной реакции основность кислоты равна:
1/0,5 = 2.
Задача 38
Сколько протонов и нейтронов содержат ядра изотопов? Составьте электронную формулу данного атома, подчеркните валентные электроны. Распределите электроны этого атома по квантовым ячейкам. К какому электронному семейству относится этот элемент? 2247Ti и 2248Ti
Решение:
2247Ti и 2248Ti
Число нейтронов в ядре атома элемента равно разности округленного до целого значения атомной массы Аr и числа протонов (порядкового номера)[2]. Таким образом, число нейтронов в 2247Ti равно:
47 – 22 = 25
Число нейтронов в 2248Ti равно:
48 – 22 = 26
Электронная формула элемента:
1s22s2 2p63s23p64s23d2
4 s 2 и 3d2 – валентные электроны
Распределение электронов по квантовым ячейкам выглядит следующим образом (рис.1):
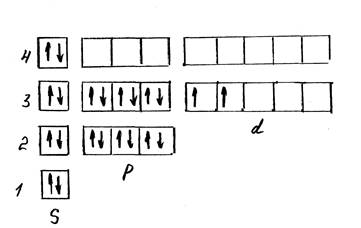
Рисунок 1 – Распределение электронов по квантовым ячейкам в атоме элемента Ti
У рассматриваемого элемента четыре валентных электрона.
Данный элемент относится к семейству d- элементов.
Задача 43
Приведите по два элемента, относящихся к s-, p-, d – электронным семействам. Ответ мотивируйте строением внешних и предвнешних (для d-элементов) уровней атомов.
Ответ:
Элементы s-электронного семейства
К семейству s-элементов относится, например, бериллий Ве. Его электронная формула 1s2 2s2.
Графическое распределение электронов представлено на рис. 1
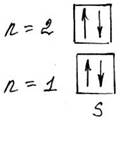
Рисунок 1 – Распределение электронов по квантовым ячейкам у атома бериллия
Также к семейству s-элементов относится кальций. Электронная формула элемента имеет вид: 1s22s22p63s23p64s2. Графическое распределение электронов по квантовым ячейкам представлено на рис. 2:
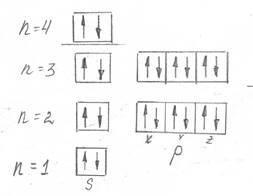
Рисунок 2 – Графическое распределение электронов по квантовым ячейкам в атоме элемента кальция
Элементы р-электронного семейства
Элемент с порядковым номером 9 – F (фтор). Его электронная формула: 1s22s22p5. Данный элемент относится к семейству р-элементов. Графическое распределение электронов представлено на рис. 3.
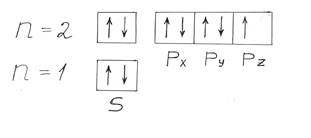
Рисунок 3 – Распределение электронов по квантовым ячейкам у атома фтора
Электронная формула элемента алюминия Al:
1s22s2 2p63s23p1
Распределение электронов по квантовым ячейкам выглядит следующим образом (рис.4):
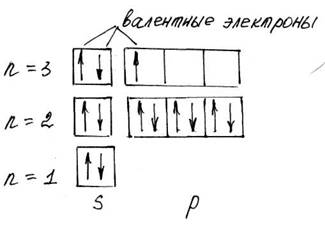
Рисунок 4 – Распределение электронов по квантовым ячейкам в атоме элементаAl
Атом элемента алюминия содержит семь валентных электронов на внешнем энергетическом уровне.
Данный элемент относится к семейству р- элементов.
Элементы d-электронного семейства
Элемент с порядковым номером 28 – Ni (никель). Его электронная формула: 1s22s22p63s23p64s23d8. Данный элемент относится к семейству d-элементов. Графическое распределение электронов представлено на рис. 5
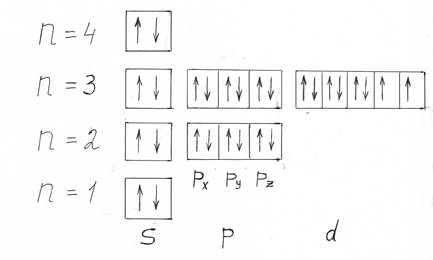
Рисунок 5 – Графическое распределение электронов у атома никеля
Электронная формула элемента скандия Sc:
1s22s2 2p63s23p64s23d1
Распределение электронов по квантовым ячейкам выглядит следующим образом (рис.6):
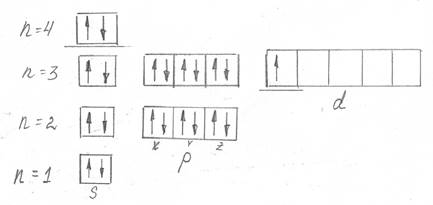
Рисунок 6 – Распределение электронов по квантовым ячейкам в атоме элемента Sc
У рассматриваемого элемента три валентных электрона.
Данный элемент относится к семейству d- элементов.
Задача 97
Какие из перечисленных оксидов могут быть получены окислением металла при стандартных условиях: CaO, FeO, BaO.
Решение:
Окислением металла при стандартных условиях может быть получен оксид кальция CaO:
2 СаО + О2 = 2 СаО
и оксид бария:
2 ВаО + О2 = 2 ВаО.
На воздухе щелочноземельные металлы тотчас покрываются пленкой.
Закись железа FeO получается при высокой температуре в результате взаимодействия железа с водяными парами:
Fe + Н2О = FeO + Н2↑
Задача 102
Определите изменение скорости прямых газовых реакции при увеличении давления в 2 раза:
1) Н2 + Cl2 = 2 HCl
2) N2O4 = 2NO2
Решение:
Рассмотрим реакцию 1:
Н2 + Cl2 = 2 HCl
vпр = k[Н2][ Cl2]
Вместо концентраций в газовых реакциях используют парциальные давления газов:
vпр = k р(Н2) р(Cl2)
При увеличении давления системы вдвое возрастают и парциальные давления газов:
vпр1 = 2р(Н2) 2р(Cl2)
vпр1/ vпр = 2р(Н2) 2р(Cl2)/ р(Н2) р(Cl2) = 4
Таким образом, при увеличении давления системы скорость прямой реакции увеличится в 4 раза
Рассмотрим реакцию 2:
N2O4 = 2NO2
Скорость прямой реакции равна:
vпр = k р(N2O4)
После увеличения давления в системе скорость реакции будет равна:
vпр 1 = k 2 р(N2O4)
Изменение скорости реакции составит:
vпр 1 / vпр = k 2 р(N2O4) / k р(N2O4) = 2
Таким образом, при увеличении давления системы скорость прямой реакции увеличится в 2 раза
Задача 128
Применяя принцип Ле Шателье, укажите, в каком направлении произойдет смещение равновесия системы
СО + H2O ↔ CO2 + H2 ∆ H = +2.85 кДж
Если:
а) увеличить концентрацию водорода, б) понизить температуру, в) понизить концентрацию диоксида углерода.
Решение:
СО + H2O ↔ CO2 + H2 ∆ H = +2.85 кДж
а) Согласно закону действия масс и принципу Ле Шателье при увеличении концентрации одного из реагирующих веществ, участвующих в реакции, химическое равновесие сдвигается в таком направлении, чтобы отношение произведения новых равновесных концентраций продуктов к произведению новых равновесных концентраций реагентов стало равным константе равновесия.
Т.е. при увеличении концентрации одного из реагентов (водорода) равновесие сместится в сторону образования продуктов реакции.
б) В соответствии с принципом Ле Шателье при понижении температуры химическое равновесие смещается в направлении экзотермической реакции. Рассматриваемая реакция (прямая) является эндотермической, т.е. ∆ H >0. Таким образом, при понижении температуры химическое равновесие сместится в сторону образования реагентов.
в) При понижении концентрации диоксида углерода (одного из продукта реакции) химическое равновесие сместится в сторону образования реагентов (по принципу Ле Шателье).
Задача 171
Подберите по три молекулярных уравнения реакции, которые выражается следующими уравнениями:
Н+ + ОН- = Н2О
Ва2+ + СО32- = ВаСО3
Решение:
Первому уравнению реакции могут соответствовать следующие процессы:
КОН + HCl = КCl + Н2О
H2SO4 + NaOH = Na2SO4 + Н2О
HNO3 + NH4OH = NH4 NO3 + Н2О
Второму уравнению реакции будут соответствовать следующие процессы:
ВаCl2 + К2 СО3 = ВаСО3 + 2 КСl
(СН3СОО)2 Ва + 2NH4 СО3 = ВаСО3 +2 NH4 СН3СОО
ВаS + К2 СО3 = ВаСО3 + К2 S
Задача 219
На основании электронных уравнений расставьте коэффициенты в уравнениях реакций, идущих по схемам:
Cr2(SO4 )3 + H2O2 + NaOH → Na2SO4 + NaCrO4 + Н2О
Na2SO3 + O2 → Na2SO4
Для каждой реакции укажите, какое вещество является окислителем, а какое – восстановителем, какое вещество окисляется, а какое – восстанавливается.
Решение:
3+ -1 +7 -2
Cr2(SO4 )3 + H2O2 + NaOH → Na2SO4 + NaCrO4 + Н2О
2 Cr3+ - 8 е → 2 Cr7+| 2 | окисление, восстановитель
2 O-1 + 2 е → 2 О-2 | 8 | восстановление, окислитель
4 Cr3+ +16 O-1 = 4Cr7+ + 16 О-2
Cr2(SO4 )3 + 4 H2O2 + 8NaOH → 4 Na2SO4 + 2 NaCrO4 + 8Н2О
+4 0 +6 -2
Na2SO3 + O2 → Na2SO4
S+4 – 2 е→ S+6 | 2 | окисление, восстановитель
O20 + 4 е → 2 O-2 | 1 | восстановление, окислитель
2 S+4 + O20 = 2 S+6 + 2 O-2
2 Na2SO3 + O2 → 2 Na2SO4
Задача 232
В две пробирки с синим раствором сульфата меди опустили цинковую и серебряную пластинки. В какой пробирке цвет раствора постепенно изменится и почему?
Решение:
Процессы, происходящие в пробирках, можно выразить следующими уравнениями реакций:
CuSO4 + Zn
CuSO4 +Ag
Как известно, каждый металл вытесняет из растворов солей все другие металлы, стоящие правее его в электрохимическом ряду напряжений. Таким образом, цинк способен вытеснить медь из раствора сульфата меди. Реакция протекает следующим образом:
CuSO4 + Zn = Zn SO4 + Cu
Так как раствор сульфата меди имеет голубую окраску, а раствор сульфата цинка – бесцветный, то цвет раствора постепенно изменится.
Взаимодействие серебряной пластинки с раствором сульфата меди принципиально невозможна, т.к. серебро находится правее меди в электрохимическом ряду напряжений.
Задача 257
Составьте электронные уравнения анодного и катодного процессов, протекающих при протекторной защите стали в морской воде с помощью цинкового сплава.
Решение:
Протекторная защита осуществляется путем присоединения к защищаемому металлу более активного металла, который легче окисляется и тем самым предохраняет металл от коррозии.
Цинковая защита стали:
Анодный процесс
Zn – 2е = Zn2+ окисление, восстановитель
Катодный процесс
O2 + 2Н2О + 4 е = 4 ОН- восстановление, окислитель
Список литературы
1. Химия / Под ред. В. Шретера . – М.: Химия, 1986. – 648 с.
2. Рабинович В.А., Хавин З.Я. Краткий химический справочник. – Л.: Химия, 1977. – 376 с.
3. Ходаков Ю.В., Цветков Л.А. Химия – М.: Государственное учебно-педагогическое издательство министерства просвещения РСФСР, 1961. – 424 с.
4. Некрасов Б.В. Учебник общей химии. – М.: Химия, 1972. – 472 с.
5. Краткий справочник физико-химических величин. – Л.: Химия, 1983. – 232 с.
[1] Некрасов Б.В. Учебник общей химии. – М.: Химия, 1972. – 472 с.
[2] Химия / Под ред. В. Шретера . – М.: Химия, 1986. – 648 с.