Содержание
Задача 18. 2
Задача 38. 2
Задача 58. 3
Задача 98. 5
Задача 118. 7
Задача 138. 7
Задача 178. 8
Задача 218. 8
Задача 221. 9
Задача 238. 11
Задача 258. 12
Список литературы.. 13
Задача 18
Вычислите массу 0,25 моль кислорода. Какой объем (н.у.) занимает это количество вещества? Сколько молекул кислорода содержится в этом объеме?
Решение:
Масса 0,25 моль кислорода равна:
0,25*32 = 8 г
Объем 0,25 моль кислорода равен:
22,4 * 0,25 = 5,6 л
Количество молекул, которое содержится в данном объеме:
0,25*6,023*1023 = 1,5*1023 молекул.
Задача 38
Сколько протонов и нейтронов содержат ядра изотопов? Составьте электронную формулу данного атома, подчеркните валентные электроны. Распределите электроны этого атома по квантовым ячейкам. К какому электронному семейству относится этот элемент? 2247Ti и 2248Ti
Решение:
2247Ti и 2248Ti
Число нейтронов в ядре атома элемента равно разности округленного до целого значения атомной массы Аr и числа протонов (порядкового номера)[1]. Таким образом, число нейтронов в 2247Ti равно:
47 – 22 = 25
Число нейтронов в 2248Ti равно:
48 – 22 = 26
Электронная формула элемента:
1s22s2 2p63s23p64s23d2
4 s 2 и 3d2 – валентные электроны
Распределение электронов по квантовым ячейкам выглядит следующим образом (рис.1):
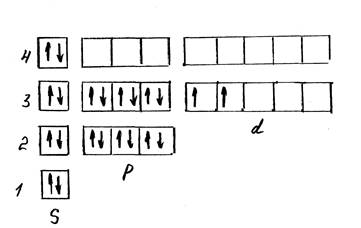
Рисунок 1 – Распределение электронов по квантовым ячейкам в атоме элемента Ti
У рассматриваемого элемента четыре валентных электрона.
Данный элемент относится к семейству d- элементов.
Задача 58
У какого элемента – титана или германия – сильнее выражены металлические свойства? Ответ мотивируйте строением атомов титана и германия. Какой из этих элементов образует газообразное соединение с водородом?
Решение:
В главных группах металлические свойства элементов увеличиваются, а неметаллические свойства уменьшаются с возрастанием порядкового номера элемента.
В периодах для элементов главных групп металлические свойства уменьшаются, а неметаллические свойства увеличиваются с возрастанием порядкового номера элемента.
Титан является элементом IV Б (побочной) группы Периодической системы, германий – IV А (главной) группы.
Титан и германий находятся в четвертом периоде, третьей группе Периодической системы.
Рассмотрим строение электронных оболочек атомов титана и германия:
Титан: Электронная формула элемента:
1s22s2 2p63s23p64s23d2
4 s 2 и 3d2 – валентные электроны
Распределение электронов по квантовым ячейкам выглядит следующим образом (рис.2):
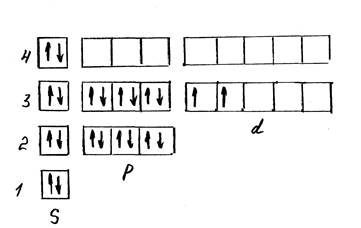
Рисунок 2 – Распределение электронов по квантовым ячейкам в атоме элемента Ti
У рассматриваемого элемента четыре валентных электрона. Данный элемент относится к семейству d- элементов.
Германий: Электронная формула элемента:
1s22s2 2p63s23p64s23d104р2
Графическое строение оболочки атома германия представлено на рис. 3
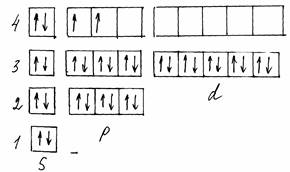
Рисунок 3 – Распределение электронов по квантовым ячейкам в атоме элемента Ge
На внешнем энергетическом уровне у атомов находится по четыре электрона. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а следовательно, тенденцией терять эти электроны.
В качестве меры металлического и неметаллического характера элементов можно принять энергию ионизации их атомов. Энергия ионизации – это энергия, которую необходимо затратить для полного удаления одного электрона из атома.
Для титана энергия ионизации равна 6,82 эВ, для германия – 7,9 эВ. Таким образом, для отрыва электрона в атоме германия необходимо затратить больше энергии, чем в атоме титана. Металлический характер, т.е. способность легко отдавать электроны, сильнее выражена у атома титана. И действительно, 3d- электроны атома титана будут отрываться значительно легче, чем 4р-электроны атома германия.
Газообразное соединение с водородом образует германий: GeH4.
Задача 98
Вычислите значения ∆G2980 реакций:
FeO (к) + ½ С (графит) = Fe(к) + ½ СО2 (г)
FeO (к) + СО (г) = Fe(к) + СО2 (г)
Протекание какой из этих реакций наиболее вероятнее?
Решение:
∆Gº298 = ∆Нº298 – Т * Sº298
1. ∆Нº298 = Σ∆Нºпрод - ∆Нºреаг
∆Нº298 =1/2 ∆Нº(СО2)+∆Нº( Fe)-1/2∆Нº(С) - ∆Нº (FeO)
∆Нº(СО2) = - 393, 51 кДж
∆Нº( Fe) = 0 кДж
∆Нº (С) = 0
∆Нº (FeO) = -264,8 кДж
Тогда ∆Нº298 = 1/2*(-393,51) – (-264,8 ) = 68,04 кДж
Sº298 = ΣSºпрод - Sºреаг
Sº (СО2)[2] = 213, 66 Дж/ моль*К
Sº (Fe) = 27,15 Дж/ моль*К
Sº (С) = 2,37 Дж/ моль*К
Sº (FeO)[3] = 60,75 Дж/ моль*К
∆Sº298 =1/2 ∆Sº(СО2)+∆Sº( Fe)-1/2∆Sº(С) - ∆Sº (FeO)
Sº298 = 1/2 * 213.66 + 27.15 - ½*2.37 + 60.75 = 193.55 Дж = 0.193 кДж
При стандартных условиях (температуре 298 К)
∆Gº298 = ∆Нº298 – Т * Sº298 = 68,04 *10 3– 298 * 193,55= 10362,1 Дж = 10,362 кДж
2. FeO (к) + СО (г) = Fe(к) + СО2 (г)
∆Нº298 = ∆Нº(СО2)+∆Нº( Fe)- ∆Нº(СО) - ∆Нº (FeO)
∆Нº(СО2) = - 393, 51 кДж
∆Нº( Fe) = 0 кДж
∆Нº (СО) = -110,52 кДж
∆Нº (FeO) = -264,8 кДж
Тогда ∆Нº298 = -393,51 – (-110,52) – (-264,8) = -18,19 кДж
Sº298 = ΣSºпрод - Sºреаг
Sº (СО2)[4] = 213, 66 Дж/ моль*К
Sº (Fe) = 27,15 Дж/ моль*К
Sº (СО) = 197,54 Дж/ моль*К
Sº (FeO)[5] = 60,75 Дж/ моль*К
∆Sº298 =∆Sº(СО2)+∆Sº( Fe)- ∆Sº(СО) - ∆Sº (FeO)
Sº298 = 213,66 + 27.15 - 197,54 - 60.75 = -17,48 Дж
При стандартных условиях (температуре 298 К)
∆Gº298 = ∆Нº298 – Т * Sº298 = -18,19 *10 3– 298 * (-17,48)= -12980,9 Дж = -12,98 кДж
Критерием самопроизвольности реакций является условие ∆Gº298 < 0.
Таким образом, наиболее вероятнее протекание второй реакции.
Задача 118
Реакция идет по уравнению Н2 + I2 = 2 НI. Константа скорости данной реакции при 500 ° С равна 0,16. Исходные концентрации реагирующих веществ:
СН2 = 0,04 моль/л
СI2 = 0.03 моль/л
Вычислите скорость реакции, когда СН2 = 0,03 моль/л.
Решение:
Н2 + I2 = 2 НI
Выражение для скорости данной реакции имеет вид:
V =k[Н2][ I2]
Когда СН2 = 0,03 моль/л, СI2 =0,03*0,03/0,04 = 0,0225 моль/л
V = 0,16*0,03*0,0225 = 0,000108
Задача 138
Исходные концентрации оксида углерода и паров воды равны 0,05 моль/л. Вычислите равновесные концентрации СО, Н2О и Н2 в системе
СО + Н2О ↔ СО2 + Н2
если равновесная концентрация СО2 равнялась 0,01 моль/л. Вычислите константу равновесия.
Решение:
СО + Н2О ↔ СО2 + Н2
С(СО) = С(Н2О) = 0,05 моль/л
[CO2 ] = 0.01 моль/л
Равновесная концентрация выражается через исходную следующим образом:
Ср = Сисх - Сизрасх
Найдем Сизрасх для СО, Н2О и Н2
Сизрасх (СО) = Сизрасх (Н2О) = Сизрасх (Н2) = 0,01 моль/л
Равновесные концентрации равны:
[СО] = [Н2О] = 0.05 – 0.01 = 0,04 моль/л
[Н2] = 0,01 моль/л
Константа равновесия для данной системы равна:
Кр = [СО2 ] [Н2] / [СО] [Н2О] = 0,01*0,01/0,04*0,04 = 0,0625
Задача 178
Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения:
SO32- + H+ = H SO3-
ClO- + H+ = HClO
Fe3+ + 3OH- = Fe (OH)3
Решение:
К2 SO3 + НСl = КH SO3 + КСl
Na ClO + НСl = HclO + NaСl
FeCl3 + 3NaOH = Fe (OH)3+ 3 NaСl
Задача 218
Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях:
Cl0 → Cl+7
Cr+3 → Cr+6
S+6 → S-2
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
Н2SO4 (конц.) + Zn → Zn SO4 + H2O + H2S
Укажите окислитель и восстановитель.
Решение:
Cl0 → Cl+7
Cl0 – 7 e = Cl+7 окисление, восстановитель
Cr+3 → Cr+6
Cr+3 -3 e→ Cr+6 окисление, восстановитель
S+6 → S-2
S+6 + 8 e→ S-2 восстановление, окислитель
+6 0 +2 -2
Н2SO4 (конц.) + Zn → Zn SO4 + H2O + H2S
S+6 +8е → S-2 | 1 | восстановление, окислитель
Zn0 – 2е → Zn2+ | 4| окисление, восстановитель
S+6 + 4 Zn0 → S-2 + 4 Zn2+
5 Н2SO4 (конц.) + 4 Zn → 4 Zn SO4 + 4 H2O + H2S
Задача 221
В каком случае происходит реакция при внесении цинковой, железной и свинцовой пластинок в пробирки с раствором сульфата олова (II)? Напишите молекулярные и электронные уравнения реакций.
Решение:
SnSO4 + Zn
SnSO4 + Fe
SnSO4 + Pb
Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в ряду напряжений после него.
Стандартные электродные потенциалы металлов.
Электрод Е 0 ,В:
Li + /Li = -3,02
Co 2+ /Co = -0,28
Rb + /Rb = -2,99
Ni 2+ /Ni = -0,25
K + /K = -2,92
Sn 2+ /Sn = -0,14
Ba 2+ /Ba = -2,90
Pb 2+ /Pb = -0,13
Sr 2+ /Sr = -2,89
H + / 1 / 2 H 2 = 0,00
Ca 2+ /Ca = -2,87
Sb 3+ /Sb = +0,20
Na + /Na = -2,71
Bi 3+ /Bi = +0,23
La 3+ /La = -2,37
Cu 2+ /Cu = +0,34
Mg 2+ /Mg = -2,34
Cu + /Cu = +0,52
Al 3+ /Al = -1,67
Ag + /Ag = +0,80
Mn 2+ /Mn = -1,05
Pd 2+ /Pd = +0,83
Zn 2+ /Zn = -0,76
Hg 2+ /Hg = +0,86
Cr 3+ /Cr = -0,71
Pt 2+ /Pt = +1,20
Fe 2+ /Fe = -0,44
Au 3+ /Au = +1,42
Cd 2+ /Cd = -0,40
Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, и образуют электрохимический ряд напряжений металлов: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Таким образом, цинк способен вытеснить олово из раствора сульфата олова:
SnSO4 + Zn = Zn SO4 +Sn
Sn2+ + 2е = Sn0 восстановление, окислитель
Zn0 – 2е = Zn2+ окисление, восстановитель
Sn2+ + Zn0 = Sn0 + Zn2+
Железо также способно вытеснить олово из раствора сульфата олова:
SnSO4 + Fe = Fe SO4 +Sn
Sn2+ + 2е = Sn0 восстановление, окислитель
Fe0 – 2е = Fe2+ окисление, восстановитель
Sn2+ + Fe0 = Sn0 + Fe2+
Свинец не способен вытеснить олово из раствора сульфата олова.
Задача 238
Какие из приведенных оксидов могут быть восстановлены водородом: MgO, CuO, ZnO, HgO?
Решение:
Окислительно-восстановительные реакции протекают, если выполнено условие:
Е°ок - Е°восст > 0
Е°восст (Н2 ) = 0
Т.е водородом могут быть восстановлены те оксиды, где положительны электродные потенциалы элементов, входящих в оксиды. Таковыми являются:
Е° Cu + /Cu = +0,52 В
Е° Hg 2+ /Hg = +0,86 В
CuO + H2 = Cu + H2 O
HgO + H2 = Hg+ H2 O
Задача 258
В раствор соляной кислоты опустили кусочек чистого железа и железа, частично покрытого оловом. Масса железа в обоих случаях одинакова. В каком случае железо растворится быстрее? Напишите электронные уравнения анодного и катодного процессов коррозии железа.
Решение:
Если взаимодействию с кислотой подвергается химически чистый металл, то выделяющийся первоначально водород в большей или меньшей степени удерживается его поверхностью и предохраняет последнюю от дальнейшей коррозии. При наличии контакта двух разнородных металлов создается гальваническая пара, причем водород выделяется на менее активном металле, который тем самым и предохраняется от коррозии. Напротив, более активный металл в этом случае разрушается быстро. При коррозии луженого железа, начиная от поврежденного места, происходит дальнейшее ржавление железа под остающимся неизменным слоем олова.
Луженое железо (железо, покрытое слоем олова)
Sn | H+ | Fe
Анодный процесс:
Fe – 2 e- = Fe2+ (в результате взаимодействия с водой впоследствии образуется гидроксид железа, т.е. ржавчина).
Катодный процесс (в кислой среде):
2Н+ + 2 е = Н2 (восстановление)
Вывод: коррозия луженого железа проихсодит быстрее, чем коррозия чистого железа.
Список литературы
1. Химия / Под ред. В. Шретера . – М.: Химия, 1986. – 648 с.
2. Ходаков Ю.В., Цветков Л.А. Химия – М.: Государственное учебно-педагогическое издательство министерства просвещения РСФСР, 1961. – 424 с.
3. Рабинович В.А., Хавин З.Я. Краткий химический справочник. – Л.: Химия, 1977. – 376 с.
4. Краткий справочник физико-химических величин. – Л.: Химия, 1983. – 232 с.
5. Некрасов Б.В. Учебник общей химии. – М.: Химия, 1972. – 472 с.
[1] Химия / Под ред. В. Шретера . – М.: Химия, 1986. – 648 с.
[2] Рабинович В.А., Хавин З.Я. Краткий химический справочник. – Л.: Химия, 1977. – 376 с.
[3] . Краткий справочник физико-химических величин. – Л.: Химия, 1983. – 232 с.
[4] Рабинович В.А., Хавин З.Я. Краткий химический справочник. – Л.: Химия, 1977. – 376 с.
[5] . Краткий справочник физико-химических величин. – Л.: Химия, 1983. – 232 с.