 α-Аминокислоты
представляют собой производные карбоновых кислот, у которых один водородный атом, у
α-углерода, замещен на аминогруппу
(—NH2).
α-Аминокислоты
представляют собой производные карбоновых кислот, у которых один водородный атом, у
α-углерода, замещен на аминогруппу
(—NH2).
Для α-аминокислот, как и для других встречающихся в
природе аминокислот, общим свойством является их амфотерность (от греч. amphoteros—двусторонний), т.
е. каждая из них содержит как минимум одну кислотную и одну основную группу
(исключение составляет пролин и его производное гидроксипролин, являющиеся
иминокислотами – содержат иминогруппу >NH). Общий тип строения α-аминокислот поэтому может быть
представлен в виде следующей формулы:
R
│
H─C─
NH2
│
COOH
Как видно из этой общей формулы, аминокислоты отличаются
друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты,
связанную с α-углеродным атомом и не участвующую в образовании пептидной
связи при синтезе белка. Почти все α-амино- и α-карбоксильные
группы участвуют в образовании пептидных связей белковой молекулы, теряя при
этом свои специфические для свободных аминокислот кислотно-основные свойства.
Поэтому все разнообразие особенностей структуры и функции белковых тел связано
с химической природой и физико-химическими свойствами радикалов аминокислот.
Именно благодаря им белки наделены рядом уникальных функций, не свойственных
другим биополимерам.
Кислотно-основные свойства аминокислот определяют многие
физико-химические и биологические свойства белков. На этих свойствах основаны,
кроме того, почти все методы выделения и идентификации аминокислот.
Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных
растворов в форме биполярных (амфотерных) ионов, а не в виде недиссоциированных
молекул.
Задача № 206
Чем можно объяснить, что при стандартных условиях невозможна
экзотермическая реакция Н2 (г) + СО2 (г) = СО (г) + Н2О
(ж), ΔНх.р. = -2,85 кДж. Зная тепловой
эффект реакции и абсолютные стандартные энтропии соответствующих веществ,
определите ΔG0 этой реакции.
Решение. При стандартных
условиях данная экзотермическая реакция невозможна, т.к. уменьшается энтропия
ΔS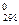 < 0,
вследствие того, что уменьшается количество молекул газа, возможность
хаотического движения меньше.
< 0,
вследствие того, что уменьшается количество молекул газа, возможность
хаотического движения меньше.
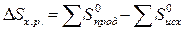
Используя табличные данные, определим стандартные энтропии Н2
(г), СО2 (г), СО (г) и Н2О (ж):
Н2 (г) = 130,59 Дж/(моль*К);
СО2 (г) = 213,65 Дж/(моль*К);
СО (г) = 197,91 Дж/(моль*К);
Н2О (ж) = 69,94 Дж/(моль*К).
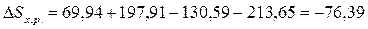 Дж/К или -0,07639 кДж/К.
Дж/К или -0,07639 кДж/К.
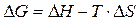
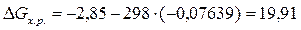 кДж.
кДж.
Самопроизвольно протекающие процессы идут в сторону
уменьшения энергии Гиббса (ΔG). Если ΔG > 0, процесс
самопроизвольно проходить не может. Т.е. данная реакция идет в обратную
сторону: образование диоксида углерода и водорода.