Содержание
Введение. 2
1.Ноцицепция.
Понятие о функциональной системы, периферические и центральные механизмы
ноцицепции. 3
1.1.Нейрофизиологические
механизмы регуляции ноцицептивной систем. 8
1.2.Физиологические
свойства ноцицепторов. 9
1.3.Нейромедиаторкые
и гуморальные механизмы регуляции болевой чувствительности. 11
2.
Антиноцицептивная (обезболивающая) система. 17
2.1.
Стволовые механизмы антиноцицептивной системы. 19
2.2 .
Гипоталамические механизмы. 23
2.3.Корковые
механизмы антиноцицептивной системы. 24
2.4.
Физиологические механизмы обезболивания. 28
3.Болевые
ощущения. 30
3.1. Типы
болевых ощущений и их характеристика. 32
3.3.
Методы борьбы с болью. 33
Заключение. 38
Список
литературы: 39
Введение
Изучение механизмов развития
боли, и поиск эффективных способов обезболивания всегда были и остаются в
центре проблем медицинской науки. Это обусловлено, в первую очередь, их
прикладным клиническим значением. На современном этапе особую теоретическую и практическую значимость приобретают работы, посвященные изучению функциональной
роли центральных структур в регуляции, модуляции и интеграции боли, поскольку
их результаты могут явиться основой для разработки новых и повышения
эффективности известных способов обезболивания.
Боль
и обезболивание являются важнейшими проблемами медицины, а облегчение страданий
больного чело века, снятие боли во время операций, травм, ранений — одна из
самых важных задач анестезиологии и хирургии, решение которой невозможно без
фундаментального изучения сущности функционирования болевой и противоболевой
систем и механизмов влияния на них средств общего обезболивания. Цель моей
работы раскрыть такие понятия, как ноцицепция, антиноцицепция, боль, причины ее возникновения и методы
борьбы с нею. Боль - это неприятное сенсорное и эмоциональное состояние, обусловленное
действительным или возможным повреждающим воздействием на ткани. Боль
сопровождается страхом, тягостными переживаниями, учащением дыхания, пульса,
подъемом АД, расширением зрачка, диспепсическими расстройствами. Боль - неотступный спутник человека, созданный самой
природой в результате эволюционного развития живых существ. Ее биологическая
сущность носит двойственный характер. Возникнув в ответ на повреждающее
воздействие, боль служит сигналом опасности. Но в тоже время длительно
существующая боль причиняет человеку мучения и страдания В моей работе стоят
такие задачи, как рассмотреть понятие
о функциональной системе, периферические и центральные механизмы ноцицепции, нейрофизиологические механизмы регуляции ноцицептивной систем и другие не менее важные задачи.
1.Ноцицепция. Понятие о функциональной системы,
периферические и центральные механизмы ноцицепции.
Понятие "ноцицепция"
подразумевает восприятие организмом сильных (повреждающих) стимулов. В отличие
от ноцицепции боль представляет собой более сложное
ощущение, в котором ноцицепция соединяется с
субъективным опытом, включающим сильный эмоциональный (аффективный) компонент.
Соматическая и висцеральная афферентные системы различаются своими
свойствами. А-б-волокна соматической афферентной ноцицептивной системы передают соматически организованную
сенсорную информацию, которая в различных отделах мозга подвергается пространственно-временному
анализу и воспринимается как локализованная острая, или колющая боль. В
С-волокнах соматической афферентной ноцицептивной
системы кодируется интенсивность действия ноцицептивного
стимула, который вызывает ощущение разлитой жгучей, труднопереносимой
(вторичной) боли и определяет связанные с нею сложные мотивационные и
эмоциональные формы поведения.
Активизация рецепторов висцеральной афферентной ноцицептивней
системы обычно проявляется в вегетативных реакциях и характеризуется
возрастанием мышечного тонуса, развитием тревожного состояния, ощущениями
тупой, диффузной боли, часто осложненной отраженными болями кожных зон или их гиперальгезией. Ноцицептивные
структуры, вызывающие ощущение первичной, вторичной и висцеральной боли, имеют
и различную морфофункциональную организацию и связи с соответствующими
периферическими и центральными структурами мозга. Ноцицептивные
соматические афферентные волокна связаны с нейронами спиноталамического, спиноретикулярного, спиномезенцефалического,
спиноцерви-коталамического трактов и тракта, идущего
к ядрам дорсальных столбов. Нейроны соматической афферентной ноцицептивной системы широко распределены в сером веществе
спинного мозга (за исключением IX пластины), тогда как нейроны висцеральной
афферентной ноцицептивной системы обнаружены лишь среди групп нейронов спиноталамического
тракта, лежащих в I и V пластинах (176).
Ноцицептивная информация, поступающая в задние рога спинного мозга,
попадает в мозг по лемнисковой и экстралемнисковой
восходящим афферентным системам. В
пределах спинного мозга одна из них располагается в дорсальной и дорсолатеральной зоне белого
вещества, другая — в его вентролатеральной части.
В литературе, посвященной проблемам боли, встречается разделение
последней на соматическую и висцеральную в зависимости от области поражения.
При этом в качестве основной характерной черты висцеральной боли выделяется ее
протопатический характер.
Можно отметить следующие объективные предпосылки позволяющие выделить
висцеральную боль в качестве особого вида ноцицепции:
а) сигнальное значение боли при
поражении внутренних органов;
6) висцеральная боль не локализована, широко иррадиирует
и сигнализирует не об угрозе повреждения, а в большинстве случаев позволяет
констатировать развитие уже достаточно далеко зашедшего патологического
процесса;
в) болевой сигнал о повреждении покровов тела и опорно-двигательного
аппарата формирует адаптивное поведение (реакция избегания), тогда как
висцеральная боль — это всегда «неотреагированная»
эмоция.
Таким образом, существует три основных отличия висцеральной боли от
соматической:
1) недостаточность сигнального значения;
2) неполноценность в формировании адаптивного поведения;
3) неадекватность вегетативного обеспечения болевой реакции запросам
поврежденного органа и организма в целом.
Эти признаки позволяют в большинстве случаев отнести боль к
патологической форме реакции организма. Основой выделенных отличительных черт,
в первую очередь, могут явиться особенности организации висцеральных и
соматических афферентных систем. Центральные проекции внутренних и соматических
органов построены по единому принципу с сохранением достаточно строгой
соматической организации в пределах лемнисковой
системы и «специфических» структур мозга — вентробазального
комплекса таламуса и сенсорных областей коры больших полушарий, и более
диффузно организованы в экстралемнисковых системах,
ретикулярной формации, гипоталамусе и других «неспецифических» структурах.
Однако во всех областях мозга отмечены широкая конвергенция и
взаимодействие соматических и висцеральных афферентных систем, что позволяет
предположить принципиальное единство центральных механизмов регуляции болевой
чувствительности.
Таким образом, протопатический характер
висцеральной боли обусловлен не только ее хеморецептивной природой, но и
следующими основными отличительными чертами в организации афферентных систем:
1. Принцип множественности и многосегментарности
афферентных путей, идущих в нескольких нервных стволах и сплетениях и входящих
в ЦНС на разных уровнях.
2. Наличие прямых сегментарных и окольных путей с множественными переключениями. например, в
периферических вегетативных и спинальных
ганглиях, в интрамуральных сплетениях.
3. Принцип «двусторонней воронки» — перекрытие в одном органе афферентных
путей, идущих в разные отделы ЦНС, и перекрытие путей от нескольких органов в
одной мозговой структуре.
В целом, системы соматической и висцеральной боли составляют общую
систему ноцицептивного возбуждения, формирующего
различные поведенческие аффективно-эмоциональные и вегетативные проявления
болевой реакции. Вместе с тем, учет особенностей висцеральной боли имеет огромное
значение для анестезиологии, так как при оперативных вмешательствах
преимущественно формируется висцеральная боль.
Другой областью эндогенной болеутоляющей системы являются ядра шва ствола
и среднего мозга. Они тесно связаны с ЦСВ, а аксоны их клеток проецируются как
в восходящем, так и в нисходящем направлениях. Нисходящие волокна из этих ядер,
особенно из большого ядра шва, проходят в дорсолатерательном
канатике и прослеживаются в заднем роге спинного мозга.
Стимуляция ЦСВ и ядер шва тормозит активность нейронов заднего рога
спинного мозга, связанных с ноцицептивной афферентацией. Особенно отчетливо изменяется активность
нейронов спиноталамического тракта. Раздражение ЦСВ, угнетающее активность спиноталамичсских нейронов спинного мозга, одновременно активирует
клетки БЯШ. Кроме того, стимуляция ЦСВ вызывает активацию нейронов желатинозной субстанции, которая участвует в пресинаптическом торможении ноцицептивной
информации. Наряду с нисходящей системой ядер шва существует система нисходящих
связей ядер ретикулярной формации ствола головного мозга.
Раздражение этой области вызывает отчетливое обезболивание и угнетает
ответы нейронов заднего рога спинного мозга на ноцицептивные
стимулы. По некоторым данным, стимуляция ретикулярных ядер ствола в значительно
большей степени, чем раздражение ядер шва, угнетает передачу ноцицептивной информации в спинном мозге. В отличие от
волокон, нисходящих из ядер шва, ретикулоспинальные пути оканчиваются не только
в I—V слоях заднего рога, но и в боковом и передних рогах, что
имеет существенное значение для сопряженной регуляции вегетативной и моторной
деятельности при стимуляционной анальгезии. В
настоящее время значительное внимание уделяется изучению роли в регуляции
болевой чувствительности латерального ретикулярного ядра, раздражение которого
сопровождается отчетливой анальгезией,
что реализуется через дор-солатеральные и
вентролатеральные канатики. Некоторые нейроны латерального ядра выполняют
функцию релейного звена в системе ЦСВ — ядра шва — спинной мозг и имеют
морфологические прямые проекции из ЦСВ и ядер шва. Исследователями недавно
получены данные о том, что стимуляция ЦСВ тормозит активность нодицептивных клеток в медиальном таламусе. Установлено
также, что некоторые клетки ЦСВ увеличивают свою активность при периферическом ноцицептивном раздражении, что совпадает с моментом
активации ЭЭГ в коре больших полушарий.
ЦСВ имеет тесные связи с лимбической системой и
интраламинарными ядрами тапамуса. Помимо восходящих
проекций из ЦСВ существуют такие восходящие проекции из ядер шва, которые могут
оказывать модулирующее влияние на ноцицептивные реакции
не только на уровне спинного мозга, но и на выше лежащих уровнях, в частности в
таламусе. Наличие прямых проекций от ядер шва обнаружено также к парафасцикулярному и вентробазальному
комплексам таламуса, хвостатому ядру, латеральной перегородке, гипокампу и мозжечку. Установлены двусторонние
моносинаптические связи ДЯШ с. гипоталамусом и гипокампом.
Большое значение в регуляции болевой чувствительности имеет гипоталамус. При
его стимуляции отмечается подавление ноцицептивных
реакций в парафасцикулярном комплексе таламуса.
Предполагается, что анальгетический эффект при
стимуляции гипоталамуса реализуется через БЯШ. Кроме того, гипоталамус имеет
прямые проекции в спинной мозг, которые заканчиваются в I, IV и VIII пластинах
дорсального рога. При раздражении гипоталамуса тормозится активность ноцицептивных нейронов дорсального рога. Гипоталамус
проецируется также и к орбитофронтальной и сома-тосенсорной областям коры больших полушарий.
Анализ данных литературы дает основание считать, что наряду с
существованием соматической и висцеральной ноцицептивных
систем, приспособленных для передачи и анализа отдельных субмодальностей,
существует антиноцидептивная система, структуры
которой расположены на всех уровнях ЦНС, начиная со спинного мозга, вплоть до
коры больших полушарий. Анализ организации нейронных цепей в задних рогах
спинного мозга позволил сделать вывод, что спинной мозг представляет собой интегративный центр для сенсорных процессов, а не
передаточный механизм. В спинном мозге отдельные сенсорные модальности не
передаются по жестко определенным восходящим путям, а подвергаются сложной
переработке.
1.1.Нейрофизиологические механизмы регуляции ноцицептивной систем
Формирование многокомпонентных реакций организма на боль происходит при
обязательном участии структур ствола мозга. Концепция о трех
морфофункциональных системах ствола мозга и их взаимоотношениях позволяет
показать возможные уровни взаимодействия различных ноцицептивньгх
рефлексов ствола мозга и спинного мозга с интегративной
и нейрорегуляторной системами. Согласно этой
концепции участие образований ствола мозга в обеспечении жизненно важных
функций базируется на способности интегративной системы
ствола мозга объединить отдельные простые рефлексы в сложные рефлекторные акты,
управляющие нейрорегуляторными функциями.[1]
Ноцицептивная модулирующая система образована скоплениями нейронов
медиальных областей промежуточного и среднего мозга, моста и продолговатого
мозга, а также спинного мозга. Ее основу образуют три звена: нейроны
вентролатеральной области ЦСВ среднего мозга, нейроны большого ядра шва, интернейроны поверхностных пластин серого вещества спинного
мозга. Важное место в ноцицептивной модулирующей
системе принадлежит гигантоклеточному, парагигантоклеточному
и парагигантоклеточному латеральному ядрам ретикулярной формации.
Группу ядер ретикулярной формации вместе
с большим ядром шва объединяют в ростральную вентромедиальную область продолговатого
мозга. Важную роль в ноцицептивной модулирующей системе
выполняют нейроны орбито-фронтальной коры, перивентрикулярных областей гипоталамуса, а также
каудальной вентролатеральной ретикулярной формации. Эффекторная
часть ноцицептивной модулирующей системы образована
нисходящими трактами, которые локализованы в дорсолатеральных канатиках
спинного мозга.
1.2.Физиологические свойства ноцицепторов.
Большинство ноцицепторов реагируют на механические, термические
и химические раздражители.
Электрофизиологический механизм возникновения рецепторных
потенциалов ноцицепторов изучен недостаточно.
Высказываются предположения, что в случае механического
воздействия на мембрану ноцицептора рецепторный
потенциал возникает в результате
деформации и растяжения фрагмента мембраны, активирующих перенос
катионов натрия внутрь ноцицептора. Возможна и иная
схема возникновения рецепторного потенциала. Предполагается, что под влиянием
механического воздействия из терминалей сенсорной клетки выделяется медиаторное вещество. В случае термического воздействия – формирование рецепторных потенциалов протекает, очевидно,
также с участием медиаторного вещества, выделяющегося
из терминалей сенсорной клетки в ответ на изменение
интенсивности метаболических реакций под влиянием температуры. Медиаторное вещество вступает в реакцию с хеморецепторами,
запуская генерацию рецепторного потенциала, при этом динамика развития
рецепторного потенциала, отражающая скорость взаимодействия медиаторного вещества с хеморецепторами и
предопределяющая частоту возникающих потенциалов действия, по-видимому,
модулируется температурным воздействием на ноцицептор
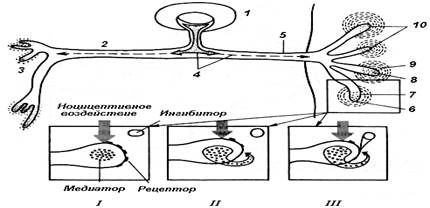
Рис. 1. Механизм возможной
активации ноцицептора под влиянием сильного
механического воздействия.
В теле сенсорного нейрона (1)
синтезируется нейротрансмиттер (вещество П), доставляемый по центральному отростку (2)
и периферическому отростку (5) сенсорного нейрона к центральным
синапсам (3) и к периферическим свободным нервным окончаниям (6),
выполняющих функцию ноцицепторов. Под влиянием
сильного механического стимула происходит выделение нейротрансмиттера
(8) из нервных окончаний (10) с последующим взаимодействием с
рецепторами (7) их мембраны. Возникающие потенциалы действия передаются
в ЦНС, фермент-ингибитор (9) разрушает нейротрансмиттер.
I, II, III – этапы взаимодействия нейротрансмиттера и
фермента-ингибитора.
При воспалительных
реакциях ощущение боли у человека обычно возникает в результате активации ноницепторов химическими
веществами – алгогенами, действующими, как
выяснилось, и на ноцицептор, и на проводниковую мембрану
сенсорного нейрона в составе своеобразного химического конвейера. В него
входят тканевые алгогены,
появляющиеся в результате разрушения тканевых структур, а также плазменные алгогены,
появляющиеся в результате выхода в межклеточное пространство компонентов
крови, катализирующих механизм образования кининов –
в первую очередь каллидина и брадикинина, в
значительной степени усиливающих активацию ноцицепторов.
Подчеркнем, что алгогены всех типов отчетливо
угнетают клеточное дыхание. Это обстоятельство допускает возможность
существования некоего общего механизма раздражающего влияния алгогенов на ноницепторы избыточными
концентрациями катионов водорода. Несмотря на то, что при
экспериментальном изучении электрофизиологической активности ноцицепторов иногда удается показать феномен их адаптации к
действию болевого раздражителя, субъективный опыт, клиническая практика,
свидетельствуют о том, что практически адаптации к боли не наблюдается.
1.3.Нейромедиаторкые и гуморальные механизмы
регуляции болевой чувствительности
В настоящее время большое внимание уделяется эндогенным системам
контроля передачи болевых сигналов. Имеются данные, согласно которым существуют
четыре эндогенные анальгезические системы:
а) нейронная опиатная — энкефалинергическая;
б) нейронная неопиатная — норадреналиновая,
серотониновая и дофаминергическая;
в) гормональная опиатная — эндорфиновая;
г) гормональная неопиатиая — пептиды и другие
регуляторы.
Опиатные рецепторы были открыты в 1973 году как
высокоспецифичные места связывания с морфином. Опиатные
рецепторы представляют собой стабильный комплекс кислого гликолиптида
со щелочным полипептидом длиной порядка 20 аминокислот. Областями, богатыми
местами связывания опиатов, являются лимбическая
система, желатинозная субстанция, задние рога
спинного мозга, большое ядро шва, средний таламус, околоводопроводное
и перивевтрикулярное серое вещество. Опиатные рецепторы обнаружены в различных периферийных
тканях. Существует несколько типов опиатных
рецепторов, различающихся по гомологичности к
фармакологическим лигандам и по участию в
физиологических функциях. Так u-рецепторы, гомонимные к морфину, опосредуют анальгезию, угнетение дыхания,
развитие зависимости; х-рецепторы, гомонимные к кетоциклозину,
опосредуют анальгезию, успокоение; о-рецепторы, гомонимные к у-амилнорциклазацину
— учащение дыхания, манию, галлюцинации;
б-рецепторы, гомонимные к аланин-лей-энкефалину, определяют эйфорию, изменение
поведенческих реакций. Наибольшая плотность опиоидных
пептидов выявляется в области таламуса, базальных ядер, лимбической
системы и спинного мозга. u17 и u2 -
рецепторы локализованы преимущественно в желатинозной
субстанции спинного мозга ядрах ствола мозга, гипоталамусе, таламусе, в IV слое
соматосенсорной зоны коры. б-Рецепторов много в лимбических структурах, перегородке, гипоталамусе. х-рецепторы располагаются преимущественно в желатинозной субстанции спинного мозга, в ЦСВ, гипоталамусе,
коре мозга.
Нейронная опиатная анальгезическая
система образована тремя уровнями мозга — средним, продолговатым и спинным
мозгом. На всех трех уровнях четко локализованы эндогенные опиоидные
пептиды (энкефалины). Данные химические соединения
были впервые выделены в 1975 году из мозга морской свинки. Биохимическими
предшественниками эндогенных опиоидных пептидов
являются три вида пропептидов: проопиомеланокортин,
проэнксфалин А и проэнкефалин
В.
Анализ аминокислотного состава проэнкефалина А
и проэнкефалина В показал, что первый является предшественником
лей-энкефалина, мет-энкефалина,
лей-энке-фалин-аргинин-фенилаланина, а второй — динорфина. Энкефалинсодержащие
волокна представлены практически на всех уровнях ЦНС. Так, их находят в аркуатном ядре, пери- и паравентрикулярных
ядрах, дорсо- и вентромедиальных ядрах гипоталамуса.
На уровне сегментов спинного мозга энкефалинергические
терминали формируют активные связи в I, II, IV
пластинах задних рогов. Энкефалинреактивные нейроны определяются на пре- и постганглионарном уровне симпатического и
парасимпатического отделов вегетативной нервной системы. Опиоидные
пептиды могут вести себя как классические нейромодуляторы,
т. е. взаимодействовать со специфическими постсинаптическими рецепторами как нейромодуляторы, действуя на пресинаптические
рецепторы и изменяя вход основного медиатора. Энкефалины
имеют высокое сродство с б-опиатными рецепторами и
почти такое же с u-опиатными. Опиоидные пептиды (мет-лей-энкефалины)
сосуществуют в одних и тех же нейронах с классическими нейромедиаторами,
такими как дофамин, серотонин, норадреналин,
ацетилхолин. Энкефалины регулируют формирование сенсорно-ноцицептивного импульса, начиная с сегментарного
уровня спинного мозга, где они тормозят афферентную передачу с С-волокон на
передаточные клетки. На уровне головного мозга опиоидные
пептиды оказывают возбуждающее действие на нейтроны ядер шва,
гигантоклеточного ядра, ретикулярной
формации, ЦСВ, формирующих нисходящие серотонинергические
и энкефалипсргическис бульбоспинальные пути.
Таким образом, анальгезирующее влияние из ЦСВ среднего мозга передается в
спинной мозг через нейронные структуры большого ядра шва и ретикулярного парагигантоклеточного ядра при активном участии мет - и лейэнкефалинов.
Гормональная опиатная анальгезическая
система образована пятью уровнями мозга — спинным, продолговатым, средним
мозгом, а также гипоталамусом и гипофизом.
Афферентная импульсация из спинного мозга достигает
гипоталамуса и гипофиза, приводит к высвобождению из гипофиза кортикотропина и
в-эндорфина. Предшественником в-эндорфина
является проопиомеланокортин, который содержит в-эндорфин, у-эндорфин, АКТГ и а, в, у-меланостимулирующий
гормон и синтезируется в передней и промежуточной долях гипофиза, в гипоталамусе
и некоторых других тканях. В промежуточной доле АКТГ подвергается дальнейшему
расщеплению на а-меланостимулирующий гормон и кортикотропиноподобный пептид, а в-липотропин
-- на в-эндорфин и у-липотропин.
В мозге обнаружены две основные группы в-эндорфинреактивных
клеток. Одна располагается дорсолатеральнее аркуатного ядра гипоталамуса, вторая соединяется с первой и
лежит кпереди и латеральнее в базальном гипоталамусе.
В-эндорфинсодержащие клетки представлены в лимбических структурах, медиальном таламусе, околоводопроводном пространстве. Для центральных
нейроэндокринных отношений самыми важными являются пептидэргические
нейроны гипоталамуса, аксоны которых заканчиваются на первичном сосудистом
сплетении капилляров в области медиального возвышения и проходят ножкой гипофиза
в нейрогипофиз. Эндорфин,
войдя в кровеносное русло, тормозит релейные ноцицептивные
нейроны и, попав через систему портальной вены в спинномозговую жидкость
третьего желудочка мозга, оказывает прямой тормозный
эффект на нейроны таламуса, а также возбуждает тормозящие нейроны ЦСВ и
благодаря этому создает длительную и глубокую анальгезию.
Нейронные неопиатные аналгезические
эффекты осуществляются при участии моноаминергических структур ствола,
представленных серотонинергической, норадреналинергической и дофаминергической
системами. Экспериментальные и клинические наблюдения свидетельствуют о большой
роли моноаминовой иннервации в модуляции анальгезии.
Ядра ретикулярной формации ствола и моста мозга являются источником нескольких восходящиx катехоламинергических
путей. Наиболее мощные из них — вентральный и дорсальный восходящие норадренергические пути. Вентральный путь берет начало из
нейронов ретикулярных ядер А1 и А5, на уровне верхней оливы, а, также в
ретикулярной формации вентральнее верхних ножек
мозжечка (А7) и из клеток А2 и А10. Аксоны этих ядер проецируются в ЦСВ, базолатеральный и медиальный таламус, каудальные ядра, преоптическую область, лимбическую
систему.
Второй катехоламинергический
путь берет начало в основном из синего пятна (А6) и на границе между
промежуточным и передним мозгом отдает проекции в субталамус,
парафасцикулярный комплекс таламуса и латеральный
гипоталамус. Входя в состав супракаллозального пучка,
аксоны нейронов ядра А6 отдают проекции во фронтальную и цингулярную
кору и гиппокамп. В нисходящем направлении нейроны
синего пятна иннервируют задние рога спинного мозга, заднее ядро шва и из него
получают восходящие проекции. Кроме этого, ядерные образования ретикулярной
формации посредством заднего и вентрального перивентрикулярных НА-ергических
путей иннервируют передние, вентральные ядра, латеральное ядро таламуса и
заднюю часть гипоталамуса. Так, норадренергическис
структуры мозга сосредоточены в латеральном отделе ствола и промежуточном
мозге, особенно ими богата ретикулярная формация. Часть их аксонов идет к коре,
а другая — к образованиям мозга. Если активировать центральные адренергические
структуры, то формируется анальгезия с подавлением эмоционально-поведенческих
и гиподинамических проявлений боли. Адренергические механизмы супрасегментарного уровня регулируют гиподинамические
реакции с участием а2-рецепторов, а сегментарно-поведенческие проявления,
реализуются через а1-адренорецепторы. При
сильном болевом воздействии активизируются отрицательные эмоциональные зоны
гипоталамуса и возбуждается адренергический механизм, что приводит к блокаде
болевой импульсации с последующим вовлечением и опиатного механизма.
Экспериментальные данные свидетельствуют о большой роли серотонинергическои системы в модуляции анальгезии.
Основной массив серотонинергических нейронов
расположен в ядрах шва среднего мозга, распространяющих свои волокна в кору,
миндалину, гиппокамп, септум,
таламическое и гипоталамическое ядра, а также в спинной мозг. Обнаружено
уменьшение опиатной анестезии при снижении уровня серотонина в этих образованиях. Нисходящее тормозное
влияние ядер шва ЦСВ является серотонинергическим.
Подавление этой системы опиатсеротонинергическим
веществом уменьшает выраженность анальгезии.
Таким образом, все эти системы имеют прямой выход на передаточные
структуры ноцицептивных путей. Стимуляция важнейших
моноаминергических структур ствола мозга приводит к возникновению выраженной
анальгезии. При этом выделение значительных количеств серотонина
и норадренолина
вблизи нейронных структур спинного мозга осушествляющих
переработку и передачу болевых импульсов в головной мозг. В целом нейронная неопиатная антиноцицептивная
система устроена так, что возбуждаемые тонкие афферентные волокна первичных
сенсорных нейронов, связанных с ноцицепторами,
оканчиваются в желатинозной субстанции. В свою очередь,
нейроны желатинозной субстанции активируют нейроны
восходящих путей переднего и переднебокового канатиков. Восходящая информация
поступает к нейронам ядер шва, голубого пятна, ЦСВ, таламуса и активизирует
их, а они запускают в действие моноаминергаческие
нисходящие системы.
В последние годы широко и интенсивно изучается роль холинергических
механизмов в формировании боли. Активация холинергической модальности галантамином уменьшает двигательную реакцию на боль, но
усиливает интенсивность эмоциональных проявлений. Введение М-холинолитиков сопровождается угнетением рефлекторных ноцицептивных реакций за счет непосредственного влияния на
сданной мозг. Угнетающее действие холинергических веществ на проведение
афферентного ноцицептивного сигнала в спинном мозге
реализуется при участии опиатергических систем. Активация
холинергической системы усиливает, а ее блокада ослабляет морфиновую
анальгезию.[2]
В настоящее время весьма актуально дальнейшее изучение роли ГАМК-ергических механизмов в повышении устойчивости
организма к боли. Однако исследования подобного плана немногочисленны и
противоречивы, что обусловливает необходимость изучения ГАМК-ергических
процессов как факторов нейромедиаторной и метаболической
адаптации к ноцицептивному воздействию различного
генеза. Болеутоляющее действие ГАМК-мнистов и
ингибиторов ГАМК-трансаминазы опосредуется не только
через ГАМК-Б, но и через ГАМК-А рецепторы. Формирование ГАМК-ергической
анальгезии зависит от функциональной активности адренергической, серотонинергической и холинергической систем. Анальгети-жкий эффект реализуется с участием опиоидергическиx механизмов. Развитие
толерантности к болеутоляющему действию ГАМК-агонистов
и ингибиторов ГАМК-трансаминазы опосредуется через
а1-адренергические, серотонинергические, но не М-холинергические процессы регментарного
уровня.
2. Антиноцицептивная (обезболивающая) система
В ходе алгезиметрии – выведения зависимости между силой
потенциально болевого раздражителя, действующего на человека, и характером
вызываемой у него субъективной реакции было показано, что ощущения боли впервые
обнаруживаются при некоторой минимальной силе
раздражителя, получившей название болевого порога. Сила раздражителя,
при которой испытуемый просит прекратить его действие из-за невыносимой боли, получила название
порога болеустойчивости.
Детальное изучение вопроса о способности испытуемых
переносить болевые воздействия в разных вариантах опытов по алгезиметрии, психологические, клинические наблюдения
представили убедительные доказательства того, что при некоторых изменениях
общего состояния испытуемых у них наблюдается варьирование болевых порогов, а
также порогов болеустойчивости. В ряде случаев это
– гипералгезия,
характеризующаяся снижением болевого порога, порога болеустойчивости,
но часто это – гипоалгезии,
характеризующаяся повышением болевого порога, порога болеустойчивости вплоть до
аналгезии, т. е. полной нечувствительности к боли. Исследования, проведенные
на животных и человеке с целью уточнения функциональных особенностей различных
подкорковых образований ЦНС при электрической стимуляции ядер промежуточного,
среднего, продолговатого мозга показали, что часто следствием стимуляции
подкорковых ядер была достоверная гипоалгелзия или
аналгезия. Собранные воедино факты позволили высказать предположения, что
активность структур, относящихся к болевому анализатору, может изменяться
некими центральными механизмами, обладающими способностью редуцировать болевые
импульсации, перемещающиеся в ЦНС, вплоть до
низведения их на уровень, при котором
возникают состояния гипоалгезии и аналгезии.
Соответствующий комплекс механизмов получил название эндогенной антиноцицептивной (обезболивающей)
системы.
Дополнительным толчком к изучению частных принципов ее
работы, внутренней архитектоники явилось открытие в ЦНС опиатных
рецепторов – участков связывания препаратов опия. Было известно, что препараты
опия (морфин, его производные), взаимодействуя с опиатными
рецепторами, вызывают состояние аналгезии. Открытие опиатных
рецепторов интенсифицировало поиск эндогенных, т. е. естественных, аналогов
морфина, вырабатываемых клетками самого организма. В конечном итоге эндогенные опиоиды были обнаружены. Ими оказались пептиды – продукты протеолиза
гипофизарного гормона бета-липотропина, получившие
название эндорфинов (альфа, бета, гамма), энкефалинов (метионин-энкефалин, лейцин-энкефалин), динорфинов.
Анализ свойств эндорфинов, энкефалинов,
динорфинов показал, что они, как и морфин, угнетают
действие веществ (простагландины, брадикинин и др.),
вызывающих активацию ноцицепторов, уменьшают
возбудимость и проводимость проводников болевой импульсации,
угнетают вызванную реакцию нейронов, находящихся в составе цепей, опосредующих
передачу болевой импульсации.[3]
Наряду с констатацией уникальных свойств эндогенных опиоидов,
получением доказательств того, что они выделяются в окончаниях пептидергических нейронов, в разных экспериментах была
установлена причастность к антиноцицептивным
механизмам серотонинергических, норадренергических,
дофаминергических нейронов, а также нейротензина, ангиотензина,
окситоцина, холецистокинина, других биологически активных веществ. Все вместе взятое подтвердило правильность
исходных гипотез об антиноцицептивной системе как
совокупности гетерогенных механизмов ЦНС, фактически выступающих составной
частью ноцицептивной системы организма, т. е. системы
болевого анализатора.[4]
2.1. Стволовые механизмы антиноцицептивной системы.
В первую очередь к стволовым механизмам антиноцицептивной системы относятся механизмы центрального
серого околоводопроводного вещества (ЦСОВ) и ядер шва
(ЯШ), образующие единый функциональный
блок. Доказано, что изолированная электрическая стимуляция ЦСОВ–ЯШ блокирует
прохождение болевой импульсации на уровне релейных
нейронов ядер задних рогов спинного мозга, а также релейных нейронов сенсорных
ядер тройничного нерва.
Специфические влияния ЦСОВ-ЯШ на ядра–мишени
реализуются нисходящими волокнами, большинство из которых в своих окончаниях
выделяют серотонин (СТ), вызывающий ТПСП на релейных
нейронах и ВПСП на энкефалинергических вставочных
нейронах ядер–мишеней. Вовлечение энкефалинергических
нейронов, располагающихся в непосредственной близости от релейных, включает
дополнительные механизмы пост– и пресинаптического
торможения, что приводит к существенному удлинению тормозного состояния
релейных нейронов в сравнении с тем, что обеспечивается серотонином.
Отметим, что пусковые угнетающие влияния ЦСОВ-ЯШ на
передачу болевой импульсации не сводятся исключительно
к серотонинергическим механизмам, т. к. около 15%
нейронов ЦСОВ-ЯШ в окончаниях своих аксонов выделяют не серотонин,
а энкефалины (Эн), вещество П (ВП), ацетилхолин (АХ), другие вещества,
очевидно выполняющих функции модуляторов
синаптической передачи в нейронных объединениях
ядер–мишеней. Кроме ЦСОВ-ЯШ в состав антиноцицептивных
механизмов стволового уровня входят крупноклеточное, парагигантоклеточное
ядра ретикулярной формации продолговатого мозга и голубое пятно. Все они
морфологически связаны между собой, с комплексом ЦСОВ-ЯШ прямыми и обратными связями.
Необходимо подчеркнуть, что хотя аксоны ядер
ретикулярной формации, голубого пятна обнаруживаются в задних рогах спинного
мозга, наибольшая их плотность
наблюдается в местах расположения сенсорных ядер тройничного нерва. Показано,
что стимуляция парагигантоклеточного ядра ретикулярной
формации, стимуляция голубого пятна подавляют ответы нейронов тройничных
сенсорных ядер, вызванных болевыми стимулами. Механизмы подавления ответов
– пост– и пресинаптические за счет энкефалинергических
и норадренергических влияний на рецепторы соматической мембраны нейронов, а
также рецепторы мембраны пресинаптических С–волокон.
Особенностью норадренергических антиноцицептивных
механизмов ствола мозга является привнесение большей избирательности в процесс
угнетения передачи болевой импульсации в сравнении с
качеством угнетения за счет ЦСОВ-ЯШ. Последние
блокируют импульсации не только болевого, но и
неболевого характера.
Каким образом в обычных условиях активируются
стволовые механизмы антиноцицептивной системы, какова
их функциональная роль? Одна из гипотез приспособительную активность стволовых
механизмов антиноцицепции связывает с управлением
интенсивности восходящего болевого потока в условиях усиления его на входе в
ЦНС. Так, в случаях возрастания силы болевого воздействия усиливающийся поток импульсаций по волокнам спинно-таламических, тригемино-таламичесих трактов активирует за счет
коллатералей нейроны гигантоклееточного ядра
ретикулярной формации. Последнее возбуждает почти весь комплекс антиноцицептивных механизмов ствола мозга. В итоге –
включаются нисходящие механизмы ограничения поступления избыточной болевой импульсации в ЦНС. Фактически в данной ситуации мы
сталкиваемся с проявлением модуляции физиологического процесса отрицательной
обратной связью.
Существует
антиноцицептивная система, способствующая уменьшению
чувства боли. Существует несколько теорий формирования антиноцицептивной
системы (теория R. Melzack, P. Wall,
теория Г. Н. Крыжановского). По теории Г. Н. Крыжановского, создание дополнительного очага возбуждения
ликвидирует ощущение боли. К настоящему времени хорошо изучены биохимические
механизмы антиноцицептивной системы: опиоидный, серотонинэргический и адренэргический. К опиоидной антиноцицептивной системе относятся участки головного и
спинного мозга, адсорбирующие морфий и другие опиаты. Они находятся в области
задних рогов спинного мозга, зрительного бугра, в гипоталамусе, центральном околопроводном веществе, ретикулярной формации. Эти
рецепторы весьма чувствительны не только к опиатам, но и к некоторым олигопептидам (эндорфин, энкефалин), которые существенно уменьшают проведение
болевой импульсации и ее влияние на нервные клетки,
имеющие отношение к боли. Опиоидная система служит
ограничителем ноцицептивного возбуждения и не
допускает его нарастания выше выносливости организма.
Серотонинэргическая
антиноцицептивная система представляет собой ряд
восходящих и нисходящих путей, начинающихся от нейронов ядер ствола мозга и
центрального околопроводного вещества, медиатором
которых является серотонин. Раздражение серотонинэргических нейронов вызывает противоболевой
эффект. При хроническом болевом синдроме уменьшается содержание серотонина в церебральных структурах, спинно-мозговой
жидкости и крови. На основании этих данных для лечения болевых синдромов
используются электрофорез серотонина и препарата,
ингибирующего ферменты, которые разрушают ферменты, ингибирующие серотонин.
Адренэргическая
антиноцицептивная система связана с функционированием
эмоциональных зон мозга, раздражение которых вызывает положительные и
отрицательные эмоции. При воздействии болевого раздражителя под влиянием адренэргических механизмов наступает антиноцицептивный
эффект, а в отдельных случаях - ноцицептивный эффект.
Антиноцицептивным действием обладает также нейротензин, окситоцин, глицин, ангиотензин,
ацетилхолин. Существует также и корковый противоболевой механизм, на что
указывает уменьшение боли под влиянием гипноза, однако его морфологический и
биохимический субстраты изучены недостаточно.
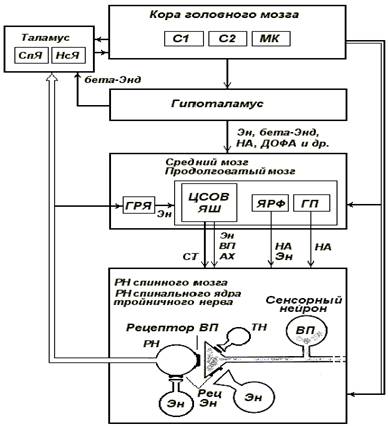
Рис. 2. Упрощенная схема,
иллюстрирующая основные механизмы антиноцицептивной
системы.
С1, С2
– соматосенсорные проекционные поля коры
1 и 2; МК – моторная область
коры; СпЯ
– специфические ядра таламуса; НсЯ –
неспецифические ядра таламуса; ГРЯ – гигантоклеточное ядро ретикулярной
формации; ЦСОВ – центральное серое околоводопроводное
вещество; ЯШ – ядра шва; ЯРФ – ядра ретикулярной формации
продолговатого мозга; ГП – голубое пятно; АХ – ацетилхолин; бета-Энд –бета-эндорфин; ВП – вещество П; ДОФА – дофамин, НА–
норадреналин; СТ – серотонин; РН
– релейный нейрон; РецЭн
– рецептор Эн (опиатный
рецептор); ТН – тормозные нейроны, реализующие постсинаптическое
торможение под влиянием серотонина, норадреналина и
т. д. ; Эн – энкефалинергический
нейрон;
2.2 . Гипоталамические механизмы.
Гипоталамические механизмы – с одной стороны функционируют
самостоятельно, с другой – выступают как надстройка, контролирующая и
регулирующая антиноцицептивные механизмы стволового
уровня за счет связей гипоталамических нейронов разной ядерной принадлежности
и разной нейрохимической специфичности. Среди них идентифицированы нейроны, в
окончаниях аксонов которых выделяются энкефалины, бета-эндорфин, норадреналин, дофамин.
Известно, что многие гипоталамические ядра входят в
зоны, стимуляция которых вызывает эмоционально окрашенные состояния –
положительные и отрицательные (Дж. Олдс, Ю. А.
Макаренко). Как оказалось, раздражение зон положительного подкрепления (дорзомедиальное ядро гипоталамуса) вызывает гипоалгезию – частично, за счет энкефалинергических
влияний, повышающих активность антиноциптивных
механизмов стволового уровня, частично за счет бета-эндорфинергических
влияний, угнетающих передачу болевой импульсации
через неспецифические ядра таламуса.
Раздражение зон отрицательного
подкрепления (вентромедиальное ядро), как
и натуральные состояния агрессии,
тоски, страха (стрессовые состояния) также сопровождаются гипоалгезией,
в ряде случаев – аналгезией. Показано,
что применительно к этим ситуациям первостепенная роль в возникновении
состояний гипоалгезии, аналгезии отводится активации
норадренергических и дофаминергических механизмов. Интересно, что всегда
отмечаемый при стрессе выброс в кровь из
передней доли гипофиза АКТГ, всегда сопровождается параллельным выбросом также
из передней доли гипофиза бета-эндорфина (Ф. Блюм). Бета-эндорфин, реализуя свои влияния гуморально, оказывает
угнетающее влияние на активность ноцицепторов,
а также нейронов большинства каналов передачи болевой импульсации
в ЦНС, внося дополнительный вклад в поддержание гипоалгезии
или аналгезии гипоталамического происхождения при стрессе.
2.3.Корковые механизмы антиноцицептивной системы.
Нисходящие волокна коркового контроля болевой
чувствительности, направляющиеся к задним
рогам спинного мозга, сенсорным ядрам тройничного нерва, берут начало в различных областях
моторной, орбитальной коры, в полях С1, С2, при этом наибольшее число волокон
составляют аксоны нейронов, локализованных в поле С2.
В целом кортикофугальные влияния на ядра-мишени
проявляют себя по-разному. Они могут оказывать возбуждающие моносинаптические
влияния на выходные нейроны ядер-мишеней, однако преобладают пост- и пресинаптические
тормозные влияния на эти нейроны, в особенности
на нейроны, контактирующие с афферентами
С–типа. Помимо прямых влияний на ядра спинного мозга, тройничного нерва, поле
С2 контролирует их активность опосредованно, видоизменяя активность стволового комплекса антиноцицептивной системы. Нельзя не отметить специфическую
роль моторных, соматосенсорных полей коры мозга в контроле проведения
афферентных импульсаций через таламус. В экспериментах, проведенных многими исследователями,
было установлено, что пропускная активность таламических ядер всегда
организуется с учетом функционального состояния организма и направлена на
изменение «удельного веса» определенных импульсаций,
проходящих в кору (П. Г. Костюк, Т. Цумото, С. Накамура, К. Ивама). Например, в
условиях обычного состояния организма под влиянием фазной активности
кортикальных нейронов приоритетно пропускается импульсация
от кожных неболевых рецепторов. При выполнении
моторных движений преимущественно пропускается кинестетическая импульсация, при
действии болевых раздражителей на организм – из общего потока возбуждений
на уровне таламуса начинают дозировано выделяться
болевые импульсации, направляющиеся в
ассоциативные, орбито-фронтальные поля, поля С1, С2 – для всесторонней оценки и
анализа. Физиологические механизмы выделения возбуждений той или иной модальности,
в частности, болевой – пост- и пресинаптические виды торможения, реализуемые вставочными
нейронами, контактирующие с кортикальными нейронами.
Помимо таламуса, корковые влияния,
регламентирующие прохождение болевых импульсаций в ЦНС, проявляют себя в
гипоталамусе, а также в связанных с ним функционально образованиях лимбического мозга, ретикулярной формации.
Ведущая роль в обеспечении кортико-гипоталамических
влияний отводится нейронам лобной коры. Характер корковых влияний на гипоталамус
– модулирующий, имеющий результатом в одних случаях усиление активности
гипоталамических ядер, участвующих в обработке болевых импульсаций,
в других – их угнетение. Знак влияний зависит от многих факторов, вытекающих, в основном, из складывающейся
наличной ситуации в отношении целей и задач подготавливаемых корой
поведенческих актов. Примером чисто корковой коррекции реагирования организма
на болевой раздражитель за счет первоочередного изменения гипоталамической
активности являются опыты, проведенные в лаборатории И. П. Павлова, по
выработке пищевого условного рефлекса у собак на болевой раздражитель в качестве условного сигнала. Как оказалось, реакция на боль у собаки в
виде генерализованных движений, учащенного дыхания,
голосовых реакций и т. п., свидетельствующих об очевидном проявлении
эмоционального переживания боли в результате вовлечения в процесс
гипоталамических эмоциогенных центров, наблюдалась
только в первых предъявлениях условного болевого сигнала. В дальнейшем эта
реакция исчезала, а в ответ на предъявление условного болевого сигнала у собаки отмечалось выделение слюны.
В заключение отметим, что субъективное восприятие боли
человеком не определяется одной лишь
силой экзогенного или эндогенного болевого воздействия. Во многом оно зависит
от баланса активностей ноцицептивной и антиноцицептивной систем организма. Повышение функциональной активности ноцицептивной
системы или снижение активности антиноцицептивной
системы приводит к уменьшению болевого порога. Наоборот, снижение активности ноцицептивной системы при одновременном повышении
активности антиноцицептивной системы приводит к
повышению болевого порога. Подобного рода сочетанные изменения тонической
активности двух систем имеют приспособительное значение.
В последние годы были открыты существующие в норме механизмы регуляции и
контроля ноцицептивного возбуждения, получившего
название антиноцицептивных систем. Ключевое место
среди анальгенных зон головного мозга занимает ЦСВ
среднего мозга. Оно находится в непосредственной близости от структур, в
которые направляются афферентные волокна восходящих ноцицептивных
систем, и получает проекции от спинальных сенсорных путей, от восходящих
проекций ретикуляной формации. При электрическом
раздражении, в основном вентральных отделов ЦСВ, впервые был выявлен феномен
селективного обезболивания. ЦСВ не имеет прямых связей со спинным мозгом, все
его аксоны оканчиваются на нейронах группы ядер РФ вместе с большим ядром шва.
Антиноцицептивный эффект, наблюдаемый при раздражении красного ядра,
возникает за счет существования как прямых руброспинальных проекций, так и за
счет проекций к ядрам шва. Наличие связей центрального ядра миндалины с ядрами
шва, с ЦСВ, синим пятном и черной субстанцией объясняет возможность возникновения
анальгетического эффекта при стимуляции миндалины. Электрораздражение других структур лимбической
системы, в частности перегородки и гипокампа, также
вызывает анальгетический эффект. При этом отмечается
подавление вызванной активности ноцицептивных и неноцидептивных нейронов в ядрах шва и ЦСВ.
Стимуляция гипофиза у обезьян также вызывает анальгетический
эффект. При этом отмечается
торможение ноцицептивиых ответов в таламусе и коре
больших полушарий.
Антиноцицептивный эффект может быть достигнут не только за счет стимуляции
центральных, супрасегментарных структур мозга, но и
за счет стимуляции дорсальных столбов спинного мозга. Возникает он в данном
случае в результате антидромного распространения
возбуждения в нисходящем направлении по коллатералям в желатинозную
субстанцию.[5]
Таким образом, антиноцицептивная система формируется
на разных уровнях ЦНС. Ее первое звено расположено на сегментарном уровне и
представлено воротным контролем боли. Тормозная активность интернейронов
желатинозной субстанции контролируется ретикулярными
стволовыми аппаратами— это второе звено антиноцицептивной
системы. Установлена гипоталамо-спинальная система торможения боли, которая
возникает в паравентрикулярном и медиальном преоптическом ядрах дорсальных отделов гипоталамуса и
заканчивается на нейронах желатинозной субстанции. Антиноцицептивная система зрительного бугра представлена ретикулярным
таламическим ядром. Увеличение потока афферентной импульсации
по таламо-кортикальным путям активирует тормозно-модулирующую систему таламуса. Важную роль в
интеграции специфической и неспецифической сенсорной информации играет
соматосенсорная область коры, контролирующая деятельность антиноцицептивных
систем разных уровней. Одним из важных условий для адекватной перцепции является
баланс активности систем ноцицепции и антиноцицепции. Дефицит афферентной импульсации
приводит к нарушению функции антиноцицептивной
системы.
Антиноцицептивная система включает три компонента:
а) множественные ноцицептивные системы, с помощью которых происходит восприятие
качеств болевых стимулов, а также формирование разнообразных защитных
рефлексов;
б) нейрогенные группы местных и общих анальгезирующих систем;
в) антианальгетические системы, предназначенные
для быстрого восстановления исходных порогов чувствительности к боли.
2.4. Физиологические механизмы обезболивания.
Проведение болевой импульсации
на уровне ноцицепторов, периферических нервных
волокон можно предотвратить, используя местную
инфильтрационную анестезию. При этом ткань (например, мышца) инфильтрируется
анестезирующим веществом. В случае применения проводниковой анестезии анестезирующее вещество подводят в область
расположения того или иного нервного
ствола.[6]
Продолжительность местной анестезии зависит от вида анестетика, обычно длится
20-60 мин, используется при вмешательствах малого объема и продолжительности
(удаление зуба). Местные анестетики (новокаин)
блокируют реакции воротного механизма
натриевых потенциал-управляемых каналов нервных
волокон на изменения мембранного потенциала. Это приводит к тому, что
распространяющиеся потенциалы действия в зоне обработанного анестетиком волокна
оказываются неспособными открыть натриевые каналы и запустить регенеративную
деполяризацию. Именно поэтому в обработанном участке нервные волокна временно
теряют возбудимость и проводимость.
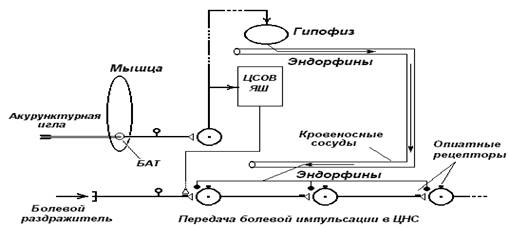
Рис. 3. Схема возможного
механизма акупунктурной аналгезии (По Б. Померанцу, с
изменениями). Описание в тексте. БАТ – биологически активная точка; ЦСОВ-ЯШ
– ядра центрального серого околоводопроводного
вещества, ядра шва. [7]
Общая
анестезия –
используется при выполнении сложных, длительных оперативных вмешательств.
Достигается применением особых наркотических препаратов, которые вводятся ингаляционно,
внутривенно, прерывая проведение болевой импульсации
преимущественно на подкорковом уровне.[8]
В последние годы для борьбы с болью широкое
распространение получили нетрадиционные методы обезболивания. Среди них
отметим метод механического воздействия на биологически
активные точки тела (скопление сенсорных
рецепторов) с помощью специальных
игл – иглоукалывание, или акупунктура. Разновидностью акупунктуры является электроакупунктура – метод электрического воздействия на
биологически активные точки. В обоих случаях стимуляция биологически активных
точек в течение 20-30 мин вызывает эффект аналгезии. Физиологический механизм акупунктурной аналгезии объясняется рефлекторным выбросом
в кровь из гипофиза во время проведения сеанса иглоукалывания эндорфинов (рис. 3). В последующем эндорфины
возвращаются в мозг, связываются с опиатными
рецепторы, нарушая синаптическую передачу болевой импульсации в ЦНС (Б. Померанц).
Подтверждением данной гипотезы являются опыты с удалением гипофиза у крыс. Как
выяснилось, после гипофизэктомии акупунктурная
аналгезия не наступает. [9]
3.Болевые ощущения
Боль - это неприятное сенсорное и эмоциональное состояние,
обусловленное действительным или возможным повреждающим воздействием на ткани.
Определение "неприятное" включает в себя целый комплекс ощущений от
простого дискомфорта до страдания, беспокойства, депрессии и отчаяния с
мучительным желанием наступления облегчения или даже смерти. Она является отрицательной
биологической системой, сигналом опасности. В то же время боль формирует
мотивацию избавления от нее. Установлено, что порог и переносимость различны у
отдельных людей. Порог боли генетически детерминирован и имеет меньше различий,
тогда как переносимость имеет большие различия.
Болевые
синдромы возникают при поражении различных отделов болевого анализатора,
начиная от рецепторов. Поражение соматических чувствительных или смешанных
нервов вызывает соматалгию, поражение вегетативных
нервов - вегеталгию, которая носит жгучий, давящий
характер, но не имеет четкой локализации, сопровождается трофическими и
сосудистыми расстройствами. Вследствие первичного поражения органов и тканей и
вовлечения в процесс нервных окончаний боль носит симптоматический характер. Различают
несколько видов боли:
Острая
или эпикритическая боль имеет физиологическое значение, она направлена на
восстановление нарушенного гомеостаза. Эта боль короткая, подвергается
адаптации через 1-2 с, сопровождается фазическим
сокращением мышц, активирует воспалительные процессы, не нарушает трофику
тканей, не вызывает их гипоксию, стимулирует пролиферативные процессы.
Хроническая
боль, появляющаяся через 20-30 секунд от момента раздражения, суммируется в
интенсивности, расширяется зона ее восприятия. В результате вторичной боли
возникает тоническое сокращение мышц, тормозится активность репаративных
процессов, развитие коллатералей, развивается тканевая гипоксия и ацидоз,
изменяется трофика тканей. Хроническая боль является дезадаптирующей,
дезинтегрирующей в деятельности многих функциональных систем. Следует
подчеркнуть, что первичная боль является предупреждением о наступившем
повреждении, а вторичная - регистрирующей и напоминающей о состоявшемся
повреждении. Тем самым устанавливается роль вторичной боли в активации тех
механизмов, которые устраняют последствия повреждения.
Сигналы
первичной боли проводятся миелинизированными Аб - волокнами со скоростью 4-20 м/с до самых разнообразных
центров обработки сенсорных сигналов. Вторичная боль передается по тонким безмиелиновым волокнам типа С со скоростью 0,4-2 м/с при
большой задержке на различных уровнях нервной системы.
Первичная
боль воспринимается специфическими А - ноцицепторами,
в основном, механорецепторами, расположенными в коже,
в суставных сумках и др. Вторичная же боль регистрируется С - полимодальными
рецепторами.
В
клинической практике принято разделение чувствительности на поверхностную и
глубокую. Путями проведения болевой чувствительности являются спинно-таламический,
спинно-ретикулярный, спинно-мезэнцефалический. Спинно-таламический путь
является филогенетически новым и проводит первичную боль. Состоит он из трех
нейронов. Тело первого нейрона расположено в межпозвонковом ганглии, на
периферии он заканчивается рецептором. Центральный конец первого нейрона
заканчивается в заднем роге сегмента спинного мозга. Здесь берет начало второй
нейрон спинно-таламического пути, совершает переход на другую сторону сегмента
и формирует восходящий спинно-таламический путь в составе боковых столбов
спинного мозга. На своем пути этот путь отдает коллатерали в стволе головного
мозга ретикулярной формации, ядрам черепных нервов, гипоталамусу. Большая часть
волокон второго нейрона заканчивается в заднем вентролатеральном ядре
зрительного бугра. Второй нейрон тройничного нерва заканчивается в заднем
вентромедиальном ядре. Берущий начало в этом ядре третий нейрон заканчивается в
задней центральной извилине. Считается, что эта зона ответственна в тонком
дискриминационном анализе болевого сигнала.
3.1. Типы болевых ощущений и их характеристика.
По критерию места
возникновения боль разделяют на соматическую
и висцеральную. Боль, возникающая в коже,
получила название соматической
поверхностной боли. Её примером является боль, вызываемая введением
инъекционной иглы под кожу человека. В чувственной картине такой боли выделяют
два компонента. Первый – «быстрый»,
непродолжительный, легко локализуемый компонент, отражающий ощущение четкой,
яркой боли, возникающей с латентным периодом порядка 0,1 с. Второй – «медленный», поздний, плохо локализуемый
компонент, отражающий ощущение тупой боли, возникающей с латентным периодом
порядка 1 с и более, постепенно увеличивающейся по выраженности в течение
нескольких секунд или минут.
Боль, возникающая в мышцах, суставах, суставных
связках, костных образованиях, получила название соматической глубокой боли. Типичным примером такой боли является
зубная боль. Основные причины ее возникновения: 1) ишемия тканей, приводящая к накоплению метаболитов и
нарушению тканевого дыхания; 2) выход
содержимого полых органов при повреждении целостности их стенок (например,
выход содержимого аппендикса в брюшную полость при его воспалении и разрыве);
3) cильные тонические сокращения или растяжения мышц желудка,
желчного пузыря, кишечника, мочевого пузыря, мочеточников.
По критерию продолжительности во времени различают боль острую, подострую
и хроническую. Острая – внезапно
возникающая боль. Острая боль обычно имеет предупредительное значение.
Хроническая – длительная, долго
сохраняющаяся или регулярно повторяющаяся боль разной интенсивности.
По
критерию отношения боли к причинным
факторам ее возникновения – различают боль физическую
и психогенную. Физическая боль возникает
в результате влияния на тканевые структуры организма неких конкретных внешних или внутренних факторов различной
природы.
3.3. Методы борьбы с болью.
Ацетаминофен (парацетамол) - эффективный препарат,
механизм действия которого еще точно не установлен. Предполагают, что он
повышает порог восприятия боли в центральных структурах нервной системы.
Парацетамол входит в состав многочисленных комплексных лекарственных средств,
применяемых как обезболивающие и жаропонижающие.
Наиболее часто применяются
для лечения боли нестероидные противовоспалительные средства (НПВС).
Основной механизм их действия заключается в подавлении синтеза простагландинов
(циклооксигеназы-2 - ЦОГ-2) - основных алгетиков,
раздражающих ноцицепторы. Предполагается также, что НПВС воздействуют
на таламические центры болевой чувствительности, снижая их чувствительность.
Приводим таблицу распространенных и относительно новых НПВС и их синонимы.
|
Препарат
|
Синонимы
|
Дозы в мг
|
|
Аспирин
|
Аспро-500, ацилпирин, картия, алька сельтцер
|
1000 мг 4 раза
|
|
Диклофенак
|
Вольтарен, ортофен,
абитрен, бетарен
|
50-75 мг 2 раза
|
|
Ибупрофен
|
Бруфен, ипрен,
адекс, ибуфен, нурофен
|
400 мг 4 раза
|
|
Индометацин
|
Метиндол, индоцин,
индотард, индовис, индомед
|
25 мг 3-4 раза
|
|
Кетопрофен
|
Профенид, кетонал,
оруваил
|
75 мг 3 раза
|
|
Напроксен
|
Напросин, апонацин,
нароцин, наксин
|
250-500 мг 2 раза
|
|
Пироксикам
|
Пирокс, эразон,
фельден, эксипан
|
20 мг 1 раз
|
|
Дипирон
|
Метапирин, анальгин, опталгин, новалгин, фаналгин
|
500 мг 3 раза
|
|
Ацетомифен (парацетамол)
|
Акамол, дексамол
|
500 мг 3-4 раза
|
Самым неприятным и
опасным побочным действием НПВС является
их влияние на слизистую желудка - образование эрозий и язв, опасность развития гастродуоденальных кровотечений, поскольку вместе с ЦОГ-2
ингибируется простагландин ЦОГ-1, являющийся цитопротектором
слизистой желудка. Эти побочные действия можно предупредить или смягчить,
назначая больному вместе с НПВС антисекреторные
препараты - ранитидин, омепразол
или препараты простагландинов - мизопростол. Синтезированы
препараты мелоксикам, нимесулид,
целекоксиб - селективные ингибиторы ЦОГ-2.
Холинолитики. Это препараты, которые
блокируют действие ацетилхолина на холинорецепторы,
тем самым, снижая выделение желудочного сока и соляной кислоты. Они снижают тонус
желудка, кишечника, желчного пузыря и протоков, устраняют спастические
сокращения этих органов. Уменьшается раздражение интерорецепторов и болевые ощущения. Применяются атропин,
препараты красавки. Относительно новым средством из этой группы является пирензепин.
Спазмолитические средства. Они эффективны при
повышенной двигательной активности желудка, кишечника, желчного пузыря,
уменьшают спастические сокращения этих органов и, таким образом, оказывают
противоболевое действие.
Антисекреторные препараты. Получили такое название в
связи со способностью массивно подавлять секрецию в желудке. Параллельно с этим
эти средства нормализуют моторику желудка, устраняя, таким образом, источник
болей. Опосредовано уменьшается секреция панкреатических ферментов, снижается
их агрессивное действие на паренхиму железы, что является одной из важных
причин наиболее тяжелого абдоминального болевого синдрома при панкреатите.
Антисекреторные средства - блокаторы протоновой помпы. По современным
представлениям это самые сильные антисекреторные
средства, они подавляют конечные этапы синтеза соляной кислоты, действуют
длительно, поэтому применять их можно 1 раз в сутки. Основные препараты омепразол, ланзопразол, пантопразол.
Ферментные препараты. Современные ферментные
препараты, применяемые в гастроэнтерологической практике, содержат ферменты
поджелудочной железы - амилазу, трипсин и липазу, которые способствуют
гидролизу основных компонентов пищи - белков, жиров и углеводов. Есть
препараты, не содержащие добавок: панкреатин, мезим-форте,
трифермент, панцитрат, креон, панкреофлат. Дигестал, фестал, энзистал, фестизим, котазим, энципальмед содержат
дополнительно компоненты желчи и гемицеллюлазу; панзинорм-форте и меркензим - бромелин и соляную кислоту. Большинство из этих средств выпускается
в виде драже или таблеток в оболочках, которые растворяются только в тонкой
кишке. В ферментных средствах обнаружены эндорфины и энкефалины, а также представители некоторых
гастроинтестинальных гормонов, модулирующих двигательную активность органов
пищеварительной системы. Последнее обстоятельство позволило объяснить
противоболевой эффект ферментных препаратов и влияние их на нарушения моторики
кишечника.
Наркотические анальгетики. Большинство лекарственных
средств, входящих в эту группу, обладают сильным болеутоляющим эффектом. Они
воздействуют на противоболевую систему, связываясь с опиоидными
рецепторами тканей. Но их применение при хронических болевых синдромах
ограничено, поскольку длительный прием наркотиков вызывает болезненное
привыкание к ним.
Антиконвульсанты. Препараты этой группы в
основном применяются при судорожных состояниях. Некоторые из них оказались
эффективными при лечении болей, обусловленных поражением периферических нервов
- финлепсин, габапентин. В
механизме их действия предполагается влияние на антиноцицептивную
систему через рецепторы гаммаоксимасляной кислоты.
Немедикаментозные методы играют важную роль в реабилитационных программах для лиц с
хроническими болевыми синдромами, особенно при поражениях опорно-двигательного аппарата.
Иглорефлексотерапия. Один из эффективных методов
аналгезии. Механизмы этого благоприятного действия и для других немедикаментозных методов, точно не установлены. Следует
лишь подчеркнуть, что акупунктура дает эффект в руках специалистов, владеющими
знаниями о расположении биологически активных точек и правильном их выборе.
Мануальная терапия. Мануальная терапия- система
приемов, которые руками проводит специалист - мануальный терапевт с целью
устранения или облегчения болезненных явлений, вызванных изменениями в
опорно-двигательном аппарате. Высокая эффективность мануальной терапии при
некоторых видах хронических болевых синдромов никем не отрицается. [10]
Грязелечение. Лечебные грязи или пелоиды - пластичные массы, состоящие из органических и
минеральных компонентов, содержащие также вещества, подобные гормонам и
витаминам человека.
Физиотерапия. Здесь имеются в виду
различные методы аппаратного лечения. Каждый из методов физиотерапии,
применяемый при хронических болевых синдромах имеет те или иные особенности
механизма действия. Но чаще всего
физиотерапия действует как противовоспалительный фактор, при этом
уменьшается выделение в очаге воспаления алгетиков -
веществ, действующих на болевые рецепторы.
Массаж. Применяется, главным
образом, при болевых синдромах мышечного происхождения. Массаж усиливает тонус
мышц и в то же время снижает их повышенную чувствительность, предупреждает
спазм в различных мышечных группах. Под влиянием массажа укрепляются связки,
улучшается функция суставов. [11]
Лечебная физкультура. Используется, как правило,
в сочетании с другими методами лечения. Особенностью метода является активное участие больного в лечебном
процессе, что мобилизует его на преодоление болезненных проявлений. ЛФК
стимулирует функциональную деятельность практически всех систем организма,
повышает жизненный тонус организма. Стимулируется, в частности, антиноцицептивная система.
Заключение
При одном и том же ноцицептивном
компоненте аффективный компонент может существенно меняться. Боль - это не только симптом
различных острых и хронических патологических процессов, но это и сложный
психофизиологический феномен, вовлекающий механизмы регуляции и формирования
эмоций, гуморальные и гемодинамические проявления. Нейрофизиологические
механизмы боли включают в себя участие периферических, сегментарных и супрасегментарных структур. Одной из задач этой работы было
рассмотрение понятий ноцицепции и антиноцицепции,
боли, методов борьбы с нею. До настоящего времени, несмотря на огромное
количество исследований, нет четких представлений о морфофункциональной
организации рецепторного аппарата, воспринимающего болевые воздействия, а также
о существовании самих воздействий, адекватных для болевых рецепторов. Таким
образом профилактическое использование, начиная с пред- и интраоперационного
этапов, рассмотренных выше патогенетических средств не только повышает
эффективность и безопасность обезболивания на всех этапах инвазивной
диагностики и хирургического лечения пациента, но и позволяет уменьшить общие и
местные последствия хирургической травмы, уменьшить вероятность различных
осложнений, позволяя при этом значительно снизить потребность в использовании опиоидных веществ или полностью отказаться от их
использования.
Список литературы
1. Арутюнян Р.Ю. Влияние мануальной терапии на болевые
рефлекторные синдромы и некоторые гипокоагуляционные
показатели больных ишемической болезнью сердца после хирургического лечения.
Тер. Архив, 2000,12: 196с.
2. Бускила Д. Фибромиалгия,
синдром хронической усталости и синдром миофасциальной
боли. Межд. Мед. Ж., 2000, - 206с..
3. Клиническая медицина. Справочник практического врача. М., 1997,T.1. 630с.
4. Литвинова С.В., Надеждин А.В., Авдеев С.Н. и др. Анализ соотношения порогов ноцицептивных реакций и оценки энкефалиновой
активности сыворотки крови у больных героиновой наркоманией. Меж.Мед. Ж, 2000-352с.
5. Новик А.А., Матвеев С.А., Ионова Т.И. и др. Оценка
качества жизни больного в медицине. Клинич. мед.,
2000, -168с..
6. Петров О.В., Лихванцев В.В., Субботин В.В. и др.
Информационная концепция боли. Межд. Мед. Ж., 1998, 958с.
7. Ревенко С.В., Ермишкин В.В., Селектор Л.Я.
Периферические механизмы ноцицепции. Сенсорные
системы, 1988, 256с.
8. Хаютин В.М. Механизмы ноцицепции
и антиноцицептивная система ромбовидного мозга. Вестн. АМН СССР, 1980, 9: 26-33.
9."Физиология человека". В.М. Покровский, М., "Медицина",
1998, Т.2, 570с.
10.Ноздрачева, М., "Высшая школа", 1991, Т. 1., с. 570.
11."Физиология человека" под ред.
Г.И. Косицкого, М., "Медицина", 1985-596с.
12.Практикум по нормальной физиологии под
ред. А.В. Коробкова с. 250
13.
Брагина Н. Н., Доброхотова Т. А. Функциональные асимметрии человека.
М.: Медицина,
1981. – 288 с.
14. Судаков К. В. Церебральные механизмы боли и обезболивания. Вестн. АМН СССР.- 1980.-N9.-С. 17-22.
15.
Табеева Д. М. Руководство по иглорефлексотерапии.- М.: Медицина,
1980.- 560 с.
[1] Клиническая
медицина. Справочник практического врача. М., 1997, T.1, стр. 497-501.
[2] Ноздрачева, М., "Высшая
школа", 1991, Т. 1., с. 429 - 438, 448 - 457
[3]."Физиология
человека" под ред. Г.И. Косицкого, М.,
"Медицина", 1985-596с
[4] Новик
А.А., Матвеев С.А., Ионова Т.И. и др. Оценка качества
жизни больного в
медицине. Клинич. мед., 2000, 2: 10-13.
[5] Хаютин В.М. Механизмы ноцицепции
и антиноцицептивная система ромбовидного мозга. Вестн. АМН СССР, 1980, 9: 26-33.
[6] . Клиническая медицина.
Справочник практического врача. М., 1997, T.1, стр. 256
[7]
Литвинова С.В., Надеждин А.В., Авдеев С.Н. и др. Анализ соотношения порогов ноцицептивных реакций и оценки энкефалиновой
активности сыворотки крови у больных героиновой наркоманией. Межд. Мед. Ж.,
2000, 5: 431-5.
[8] Петров
О.В., Лихванцев В.В., Субботин В.В. и др.
Информационная концепция боли. Межд. Мед. Ж., 1998, 9-10: 795-803.
[9] Ревенко С.В., Ермишкин В.В., Селектор Л.Я. Периферические
механизмы ноцицепции. Сенсорные системы, 1988, 2:
198-210.
[10]
Арутюнян Р.Ю. Влияние мануальной терапии на болевые рефлекторные синдромы и
некоторые гипокоагуляционные показатели больных
ишемической болезнью сердца после хирургического лечения. Тер. Архив, 2000,12:
24-26.
[11] Табеева Д. М. Руководство по иглорефлексотерапии.- М.: Медицина,
1980.-253с.