Нервные механизмы болевой чувствительности
В. Т. Ивашкин, Ю. О. Шульпекова
Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 2002, №4, том 12, с.16-20
Клиника пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко Московской медицинской академии им. И.М. Сеченова
Лекция помогает глубже раскрыть и полнее представить абдоминальный болевой синдром. Практическим врачам предоставлена возможность получить базисную информацию о физиологии боли, столь необходимую в трактовании симптомов гастроэнтерологического больного и выборе тактики адекватного лечения. Ключевые слова: болевая чувствительность, абдоминальная боль.
Боль для пациентов - один из важнейших клинических признаков любого патологического процесса и одно из самых отрицательных проявлений болезни. В то же время своевременная и правильная оценка болевого синдрома помогает врачу составить представление о характере заболевания.
В понятие боли включаются, во-первых, своеобразное ощущение боли и, во-вторых, реакция на это ощущение, характеризующаяся определенной эмоциональной окраской, рефлекторными изменениями функций внутренних органов, двигательными безусловными рефлексами и волевыми усилиями, направленными на устранение болевого воздействия.
Реакция на боль чрезвычайно индивидуальна, так как зависит от влияния факторов, из которых основное значение имеют локализация, степень повреждения тканей, конституциональные особенности нервной системы, воспитание, эмоциональное состояние пациента в момент нанесения болевого раздражения.
Из всех видов чувствительности боль занимает особое место. В то время как другие виды чувствительности в качестве адекватного раздражителя имеют определенный физический фактор (тепловой, тактильный, электрический и пр.), боль сигнализирует о таких состояниях органов, которые требуют специальных сложных приспособительных реакций. Для боли нет единого универсального раздражителя. Как общее выражение в сознании человека боль вызывается разнообразными факторами в различных органах.
Рассмотрим подробнее общие механизмы болевой (ноцицептивной) чувствительности.
Афферентные (приносящие) ноцицептивные периферические нервы содержат первичные волокна малого диаметра, имеющие рецепторы в различных органах и тканях. Ощущение боли сопряжено с появлением электрической активности - деполяризацией чувствительных нервных окончаний.
Для чувствительных окончаний возбуждающими могут явиться разнообразные механические, термические, химические стимулы.
Согласно одной гипотезе, боль не является специфическим чувством, и не существует специальных рецепторов, воспринимающих только болевое раздражение. Любое раздражение тех или иных рецепторов может вызвать чувство боли, если сила раздражения достаточно велика.
Согласно другой, более распространенной точке зрения, существуют специальные болевые рецепторы, характеризующиеся высоким порогом восприятия - возбуждающиеся стимулами "повреждающей" интенсивности.
В то время как проводниками тактильной и глубокой чувствительности служат толстые миелинизированные волокна с высокой скоростью распространения импульса (Аa, Аb), проведение периферического болевого раздражения обеспечивается медленно проводящими нервными волокнами малого диаметра, значительно более устойчивыми к условиям аноксии.
Существуют афферентные ноцицептивные волокна двух типов:
- С-полимодальные ноцицепторы (PMN) - немиелинизированные С-волокна с низкой скоростью проведения импульса (< 1 м/с); при их раздражении ощущается отсроченная тупая диффузная жгучая длительная боль (протопатическая);
- Аd-миелинизированные волокна с более высокой скоростью проведения импульса; при их раздражении ощущается немедленная острая, четко локализованная, быстро стихающая (эпикритическая) боль .
Аксоны афферентных ноцицептивных волокон заканчиваются в столбах заднего рога спинного мозга (рис. 1).
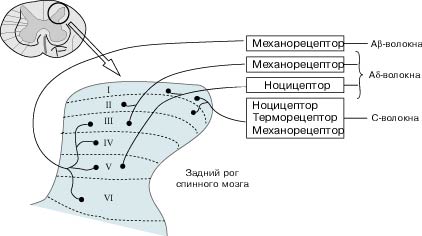 Рис. 1. Локализация окончаний чувствительных волокон в столбах
заднего рога спинного мозга. Аксоны афферентных чувствительных нервных волокон
заканчиваются в соответствующих сегментах заднего рога спинного мозга. Здесь
они контактируют с передаточными нейронами спиноталамического пути. Аb-волокна,
ответственные за тактильную чувствительность, проецируются в III-VI сегментах.
Аd-волокна, ответственные за тактильную чувствительность и ноцицепцию,
проецируются в I-III и V сегментах. С-волокна, проводящие болевые,
температурные и тактильные стимулы, проецируются в I и II сегментах
Рис. 1. Локализация окончаний чувствительных волокон в столбах
заднего рога спинного мозга. Аксоны афферентных чувствительных нервных волокон
заканчиваются в соответствующих сегментах заднего рога спинного мозга. Здесь
они контактируют с передаточными нейронами спиноталамического пути. Аb-волокна,
ответственные за тактильную чувствительность, проецируются в III-VI сегментах.
Аd-волокна, ответственные за тактильную чувствительность и ноцицепцию,
проецируются в I-III и V сегментах. С-волокна, проводящие болевые,
температурные и тактильные стимулы, проецируются в I и II сегментах
Здесь они контактируют с передаточными нейронами спиноталамического пути, по которому болевая имульсация достигает задних ядер таламуса (рис. 2), а затем соматосенсорного поля коры большого мозга.
Клетки II сегмента заднего рога составляют студенистое вещество (substantia gelatinosa - SG). Согласно теории "контроля ворот" (Wall, Melzack. Gate control theory. - 1965), короткие вставочные нейроны, составляющие SG, регулируют проведение болевых импульсов от периферических афферентных волокон к зрительному бугру (рис. 2).
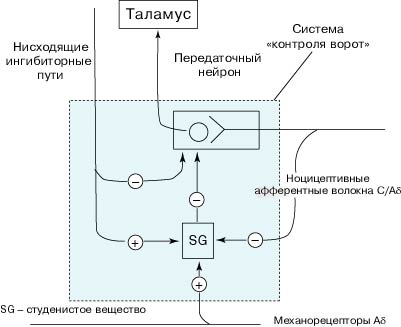 Рис. 2. Система "контроля ворот". Аксоны афферентных
ноцицептивных волокон контактируют с передаточными нейронами спиноталамического
пути, по которому болевая имульсация достигает задних ядер таламуса, а затем
соматосенсорного поля коры большого мозга. Нервные клетки SG подавляют передачу
нервного импульса от афферентных ноцицептивных волокон и нейронами
спиноталамического тракта. SG-интернейроны активируются нисходящими
ингибиторными нейронами и волокнами неноцицептивной чувствительности;
тормозятся афферентными ноцицептивными С-волокнами
Рис. 2. Система "контроля ворот". Аксоны афферентных
ноцицептивных волокон контактируют с передаточными нейронами спиноталамического
пути, по которому болевая имульсация достигает задних ядер таламуса, а затем
соматосенсорного поля коры большого мозга. Нервные клетки SG подавляют передачу
нервного импульса от афферентных ноцицептивных волокон и нейронами
спиноталамического тракта. SG-интернейроны активируются нисходящими
ингибиторными нейронами и волокнами неноцицептивной чувствительности;
тормозятся афферентными ноцицептивными С-волокнами
Нервные клетки SG проецируются на сегменты I и V заднего рога. Посредством пресинаптического торможения они ингибируют передачу нервного импульса на уровне первого синапса между афферентными ноцицептивными волокнами и передаточными нейронами спиноталамического тракта.
Активность самих SG-интернейронов подвержена модулирующим влияниям.
Они активируются нисходящими ингибиторными нейронами или неноцицептивными афферентными импульсами (например, импульсами тактильной чувствительности, проводящимся по Аb-волокнам).
Таким образом, нервные импульсы, приходящие по толстым волокнам, "закрывают ворота" для потока болевой импульсации. "Отвлекающие процедуры", усиливающие импульсацию в толстых миелиновых волокнах, способствуют уменьшению чувства боли. При повреждении толстых волокон (например, в условиях гипоксии, при механическом повреждении) болевая чувствительность усиливается.
SG-интернейроны тормозятся афферентными ноцицептивными С-волокнами. Благодаря постоянной электрической активности ноцицептивных С-волокон облегчается возбуждение передаточных нейронов спиноталамического тракта под воздействием импульсов как болевой, так и неболевой чувствительности.
SG-интернейроны богаты опиоидными пептидами и опиоидными рецепторами.
Аналогичная система "контроля ворот" существует и в таламусе.
Результаты многочисленных наблюдений и исследований позволили сформировать представление о существовании в организме антиноцицептивной системы, подавляющей восприятие боли. Структуры, относящиеся к этой системе, включают некоторые зоны центрального серого вещества, покрышки моста, миндалевидного тела, гиппокампа, ядер мозжечка, сетчатой формации. Они оказывают нисходящий, цереброспинальный, контроль афферентного "притока", вызывая торможение нейронов спинного мозга (рис. 3).
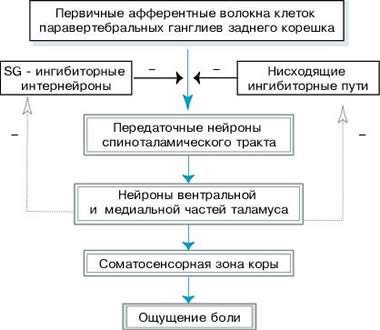 Рис. 3. Соотношение ноцицептивной и антиноцицептивной систем.
Болевой импульс, передающийся от первичных ноцицептивных волокон к коре
головного мозга (синие стрелки) изменяется благодаря активности
антиноцицептивных звеньев, в частности клеток студенистого вещества и
нисходящих цереброспинальных ингибиторных путей, берущих начало в центральном
сером веществе, покрышке моста, миндалевидном теле, гиппокампе, ядрах мозжечка,
сетчатой формации. Нейроны вентральной и медиальной частей таламуса подавляют
антиноцицептивные импульсы
Рис. 3. Соотношение ноцицептивной и антиноцицептивной систем.
Болевой импульс, передающийся от первичных ноцицептивных волокон к коре
головного мозга (синие стрелки) изменяется благодаря активности
антиноцицептивных звеньев, в частности клеток студенистого вещества и
нисходящих цереброспинальных ингибиторных путей, берущих начало в центральном
сером веществе, покрышке моста, миндалевидном теле, гиппокампе, ядрах мозжечка,
сетчатой формации. Нейроны вентральной и медиальной частей таламуса подавляют
антиноцицептивные импульсы
Существование антиноцицептивной системы позволяет предполагать, что ее повреждение может сопровождаться появлением боли.
Гуморальные механизмы регуляции ноцицептивной чувствительности
Можно заключить, что ноцицептивные нервные окончания являются хемочувствительными, поскольку воздействие всех раздражителей, вызывающих ощущение боли (механические, термические, воспалительные, ишемические, химические), связано с изменением химического окружения болевых рецепторов.
На рис. 4 представлено многообразие факторов, с помощью которых осуществляется нейрогуморальная регуляция болевой чувствительности на разных уровнях.
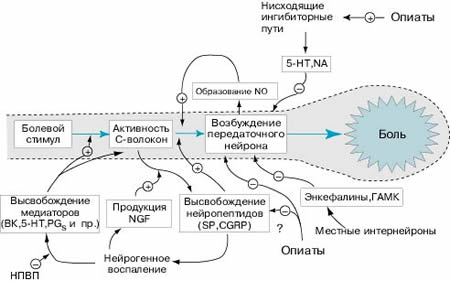 Рис. 4. Механизмы регуляции ноцицептивного пути. Болевой стимул
воспринимается ноцицептивными афферентными волокнами, передающими возбуждение
передаточным нейронам спиноталамического тракта. Далее по таламокортикальным
волокнам импульс достигает коры головного мозга, где формируется восприятие
боли. Передача болевого импульса с периферии на передаточные нейроны спиноталамического
тракта облегчается посредством NO, SP и CGRP. Медиаторами нисходящих
цереброспинальных антиноцицептивных импульсов служат 5-HT, NA. Медиаторами
антиноцицептивных импульсов от SG-нейронов - энкефалины, ГАМК.
При нейрогенном воспалении наблюдается избыточное и длительное высвобождение
нейропептидов SP, CGRP из С-волокон, поддерживаемое такими воспалительными
веществами, как BK, 5-HT, PGs и NGF. Применение НПВП позволяет уменьшить
продукцию воспалительных медиаторов. Опиаты снижают болевую чувствительность
посредством активации нисходящих антиноцицептивных сигналов и угнетения
передаточных нейронов спиноталамического тракта. NGF - фактор роста нервов, BK
- брадикинин, 5-НТ - 5-гидрокситриптамин (серотонин), PGs - простагландины, NA
- норадреналин, SP - субстанция Р, CGRP - пептид, относящийся к гену
кальцитонина
Рис. 4. Механизмы регуляции ноцицептивного пути. Болевой стимул
воспринимается ноцицептивными афферентными волокнами, передающими возбуждение
передаточным нейронам спиноталамического тракта. Далее по таламокортикальным
волокнам импульс достигает коры головного мозга, где формируется восприятие
боли. Передача болевого импульса с периферии на передаточные нейроны спиноталамического
тракта облегчается посредством NO, SP и CGRP. Медиаторами нисходящих
цереброспинальных антиноцицептивных импульсов служат 5-HT, NA. Медиаторами
антиноцицептивных импульсов от SG-нейронов - энкефалины, ГАМК.
При нейрогенном воспалении наблюдается избыточное и длительное высвобождение
нейропептидов SP, CGRP из С-волокон, поддерживаемое такими воспалительными
веществами, как BK, 5-HT, PGs и NGF. Применение НПВП позволяет уменьшить
продукцию воспалительных медиаторов. Опиаты снижают болевую чувствительность
посредством активации нисходящих антиноцицептивных сигналов и угнетения
передаточных нейронов спиноталамического тракта. NGF - фактор роста нервов, BK
- брадикинин, 5-НТ - 5-гидрокситриптамин (серотонин), PGs - простагландины, NA
- норадреналин, SP - субстанция Р, CGRP - пептид, относящийся к гену
кальцитонина
Рассмотрим химические медиаторы, участвующие в ноцицептивной передаче и регуляции потока болевых импульсов.
1. Нейротрансмиттеры:
o 5-гидрокситриптамин (5-НТ) - представляет собой наиболее активный медиатор;
o гистамин (наиболее вероятно, что он вызывает скорее зуд, нежели боль).
2. Кинины:
o брадикинин - мощный продуцент боли, способствующий высвобождению простагландинов, усиливающих болевой эффект; является агонистом специфических рецепторов, сопряженных с G-белком;
o каллидин - вызывает аналогичные эффекты.
3. Низкий рН - способствует открытию протонактивируемых катионных каналов ноцицептивных афферентных нейронов.
4. АТФ - стимулирует открытие АТФ-активируемых катионных каналов чувствительных нейронов.
5. Молочная кислота - стимулирует открытие протонактивируемых катионных каналов ноцицептивных афферентных нейронов, является потенциальным медиатором ишемической боли.
6. Ионы К+ - стимулируют катионные обменники (К+/Н+; К+/Na+); потенциальные медиаторы ишемической боли.
7. Простагландины - непосредственно не вызывают ощущения боли; существенно повышают болевой эффект серотонина (5-НТ) или брадикинина. Простагландины Е и F (PGE и PGF) высвобождаются при воспалении и тканевой ишемии, повышают чувствительность нервных окончаний по отношению к другим агентам, подавляют активность К+-каналов и вызывают раскрытие катионных каналов.
8. Тахикинины - субстанция Р (SP), нейрокинин А (NKA), нейрокинин В (NKB) - широко представлены в центральной и периферической нервной системе; ноцицептивные чувствительные нейроны экспрессируют SP и NKA. Различают 3 типа тахикининовых рецепторов: NK1, NK2 и NK3. SР - агонист NK1, NKА - агонист NK2, NKВ - агонист NK3.
9.
Опиоидные пептиды.
Роль эндогенных опиоидов в регуляции потока болевой импульсации весьма
значительна. Опиоды, воздействуя на разные уровни ноцицептивного канала,
составляют своеобразную нисходящую систему контроля боли (рис. 5). Они снижают
чувствительность болевых рецепторов, угнетают синаптическую передачу болевого
импульса на уровне заднего рога спинного мозга.
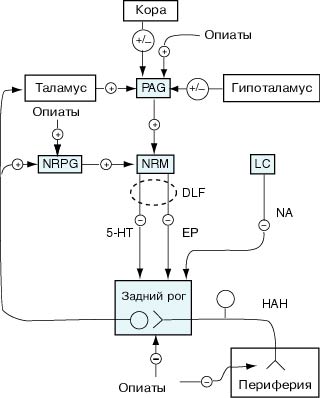 Рис. 5. Нисходящая система контроля - главные зоны участия опиатов
в передаче боли.
Опиоиды снижают чувствительность болевых рецепторов, угнетают синаптическую
передачу болевого импульса на уровне заднего рога спинного мозга. Под их
воздействием активируется антиноцицептивный цереброспинальный контроль:
возрастает поток активирующих импульсов из парагигантоклеточного ретикулярного
ядра и периакведуктального серого вещества к большому ядру шва, нейроны
которого тормозят передачу ноцицептивного сигнала на уровне задних рогов
спинного мозга. PAG - периакведуктальное серое вещество, NRPG -
парагигантоклеточное ретикулярное ядро, NRM - большое ядро шва, LC - locus
ceruleus, DLF - дорсолатеральный канатик, 5-HT - 5-гидрокситриптамин
(серотонин), EP - энкефалин, NA - норадреналин, HAH - ноцицептивный афферентный
нейрон (по Fields, Basbaum, 1994)
Кроме того, под их воздействием возрастает поток активирующих импульсов из
парагигантоклеточного ретикулярного ядра и периакведуктального серого вещества
к большому ядру шва, нейроны которого тормозят передачу ноцицептивного сигнала
на уровне задних рогов спинного мозга.
Рис. 5. Нисходящая система контроля - главные зоны участия опиатов
в передаче боли.
Опиоиды снижают чувствительность болевых рецепторов, угнетают синаптическую
передачу болевого импульса на уровне заднего рога спинного мозга. Под их
воздействием активируется антиноцицептивный цереброспинальный контроль:
возрастает поток активирующих импульсов из парагигантоклеточного ретикулярного
ядра и периакведуктального серого вещества к большому ядру шва, нейроны
которого тормозят передачу ноцицептивного сигнала на уровне задних рогов
спинного мозга. PAG - периакведуктальное серое вещество, NRPG -
парагигантоклеточное ретикулярное ядро, NRM - большое ядро шва, LC - locus
ceruleus, DLF - дорсолатеральный канатик, 5-HT - 5-гидрокситриптамин
(серотонин), EP - энкефалин, NA - норадреналин, HAH - ноцицептивный афферентный
нейрон (по Fields, Basbaum, 1994)
Кроме того, под их воздействием возрастает поток активирующих импульсов из
парагигантоклеточного ретикулярного ядра и периакведуктального серого вещества
к большому ядру шва, нейроны которого тормозят передачу ноцицептивного сигнала
на уровне задних рогов спинного мозга.
Обезболивающие средства, применяемые в клинической практике, на разных уровнях воздействуют на ноцицептивный канал. Выделяют анальгетики следующих классов:
1. морфиноподобные препараты (опиаты), фармакологическая мишень которых - центральная нервная система;
2. нестероидные противовоспалительные препараты (НПВП), воздействующие на уровне центральной нервной системы и периферических рецепторов;
3. локальные анестетики, блокирующие периферические рецепторы.
Противоболевой активностью обладают также центрально действующие неопиоидные препараты:
- антидепрессанты (амитриптилин и др.), которые обладают способностью усиливать ингибиторные моноаминергические пути регуляции болевых импульсов;
- средства, применяемые при специфических болевых синдромах, - карбамазепин (применяется при невралгии тройничного нерва), эрготамин (используется для лечения мигрени).
Один из перспективных путей борьбы с болью - разработка способов активации функции антиноцицептивной системы.
Разновидности боли
Острая боль - интенсивное неприятное ощущение, обусловленное чрезмерной повреждающей стимуляцией чувствительных рецепторов.
Хроническая боль - результат дисфункции нормального ноцицептивного канала, в частности нарушения работы SG.
Существуют разновидности хронической боли:
- гипералгезия - боль, возникающая под воздействием мягких повреждающих стимулов;
- аллодиния - боль, возникающая под воздействием стимулов неповреждающей интенсивности;
- спонтанные болевые спазмы - боли, возникающие при отсутствии инициирующих стимулов.
В возникновении гипералгезии и аллодинии играет роль нарушение баланса нейрогуморальных воздействий:
1. снижение порога чувствительности периферических ноцицептивных окончаний под влиянием брадикининов и простагландинов;
2. облегчение центральной передачи сигнала на уровне заднего рога спинного мозга (ускорение синаптической передачи) под влиянием окиси азота (NO), нейропептидов, SР, пептида, относящегося к гену кальцитонина (CGRP) и фактора роста нервов (NGF).
В условиях воспаления повышается выработка SР нервными клетками. Воздействуя на кровеносные сосуды и клетки иммунной системы (макрофаги), SР, CGRP и другие провоспалительные субстанции способствуют развитию так называемого нейрогенного воспаления.
При нейрогенном воспалении поддерживается повышенная активность нейрогенных афферентных волокон (в этом важная роль принадлежит NK1-рецепторам нейронов) и формируется гипералгезия.
Фармакологическая блокада механизмов развития боли может осуществляться благодаря введению:
- НПВП;
- опиатов, опиоидного пептида динорфина (+/-);
- энкефалинов, гамма-аминомасляной кислоты (GABA);
- 5-НТ, норадреналина.
Применение антагонистов NK1-рецепторов в будущем позволит значительно повысить эффективность обезболивания.
Отдельно следует охарактеризовать такой вид хронической боли, как нейропатическая - тяжелая боль нейрогенного происхождения. Причина ее возникновения - непосредственное поражение сенсорного пути, обычно с вовлечением периферических механизмов формирования боли.
В качестве примеров болезней, сопровождающихся нейропатической болью, можно привести инфаркт миокарда, множественный (системный) склероз, поражение нервов (механическая травма, спондилоартрит, диабетическая нейропатия, злокачественная опухоль, herpes zoster и др.).
Ампутационная (фантомная) боль также представляет собой вариант нейропатической боли.
Непосредственными механизмами формирования болевого ощущения при нейропатической боли могут быть:
- спонтанная активность поврежденных чувствительных нейронов;
- экспрессия чувствительными нейронами a-адренорецепторов, повышением их чувствительности к адреналину (симпатико-опосредованная боль).
Нейропатическая боль плохо контролируется обычными анальгетиками.
Соотношение понятий "боль" и "ноцицепция"
Понятие "ноцицепция" подразумевает восприятие организмом сильных (повреждающих) стимулов. В отличие от ноцицепции боль представляет собой более сложное ощущение, в котором ноцицепция соединяется с субъективным опытом, включающим сильный эмоциональный (аффективный) компонент.
При одном и том же ноцицептивном компоненте аффективный компонент может существенно меняться. В связи с этим требует дальнейшего изучения вопрос о том, что является основой болевого синдрома при так называемых функциональных заболеваниях: собственно ноцицепция или особый тип восприятия боли?
|
Рефлексотерапия в дерматологии |
|
2. АНТИНОЦИЦЕПТИВНОЕ (АНАЛГЕТИЧЕСКОЕ) ДЕЙСТВИЕ РТ Как уже было сказано, основным и наиболее часто используемым в клинической практике свойством РТ является ее антиноцицептивное (аналгетическое) действие. Использование методов рефлекторной аналгезии наиболее широко распространено при лечении хронических болевых синдромов самой различной природы. Изучению вопросов рефлекторного обезболивания посвящено большое количество работ как отечественных, так и зарубежных исследователей (Решетняк В.К., 1985; БрагинЕ.О., 1981, 1985; Цибуляк В.Н., 1985; Барашков Г.Н., Маслов С.С., 1989; Man P., Chen C., 1972; Chaves Y., Barber T., Goldstein A., 1980 и многие другие). Благодаря изучению фундаментальных механизмов рефлекторного обезболивания доказано, что наиболее оптимальный эффект достигается при электростимуляции ТА (Решетняк В.К., 1985; Cocchi R., 1983). При этом искусственно вызванный поток сигналов создает торможение синаптических структур определенной группы чувствительных нервных клеток сегментарного спинального уровня и вышележащих отделов мозга, которые одновременно воспринимают нецицептивные (болевые) сигналы (Melzak R., 1973). Наиболее оптимальными параметрами рефлекторной аналгезии является низкочастотная (до 3 Гц) стимуляция высокой интенсивности, т.к. при этом наряду с толстыми миелинизированными волокнами происходит активация тонких миелинизированных, а также центральных структур антиноцицептивной системы - центрального серого вещества, и только при высокой интенсивности электроакупунктурной стимуляции происходит выделение эндогенных опиатов. Помимо купирования болевого синдрома РТ вызывает также реакцию со стороны мышечного тонуса и регионарного кровообращения пораженной области, что имеет важное значение для устранения причин, вызывающих боль (Ведентьева Р.А., 1981). В механизмах рефлекторного обезболивания, так же как при лечении ряда функциональных патологических состояний, помимо процессов конкурентного торможения на нейронах центральной нервной системы особенно важное значение имеет стимуляция продукции в структурах мозга эндогенных опиоподобных веществ и других биологически активных соединений, относящихся к нейромедиаторам. Эндорфины, энкефалины и другие опиоидные нейропептиды не только сами обладают обезболивающим действием, но и влияют на обмен других медиаторов: норадреналина, дофамина, серотонина (Брагин Е.О., 1981 и др.). В механизмах рефлекторного обезболивания принимают участие и другие нейрохимические субстанции (Калюжный А. В., 1984; Брагин Е.О., 1985), в частности костный миелопептид, В-активин (Василенко А.М., Решетняк В. К., 1983), который активно вырабатывается при РТ-воздействии. В обезболивающем и седативном эффектах РТ играют роль также эндогенные бензодиазепины, поскольку на лимфоцитах существуют помимо опиатных бензодиазепиновые рецепторы, число которых возрастает после процедуры АП (Быкова А.А. и соавт., 1983). Вопросы рефлекторного обезболивания являются важными применительно к дерматологической практике потому, что на основании имеющихся данных экспериментальных исследований, и несмотря на имеющиеся противоречия и пробелы в изучении соотношений механизмов боли и зуда, эти ощущения в настоящее время объединяются одним термином - ноцицепция, т.к. механизмы их образования - периферические, проводниковые и центральные - имеют много общих черт (Гра-фова В.Н. и соавт., 1976; Ушаков И.В., 1984; Артур Р., Шелли У., 1962). Сопряженность их патогенетических механизмов обусловлена поражением идентичных уровней нервной системы. Обоснована теория центральных генераторных механизмов развития болей, указывающая на возникновение генераторов патологически усиленного нейронального возбуждения (Карлов В.А. и соавт., 1980; Крыжановский Г.Н , 1980). Нами было проведено сравнительное изучение изменений электроэнцефалографической картины у больных с хроническим болевым синдромом (невралгия тройничного нерва) и больных с атопическим дерматитом, при котором зуд является одним из ведущих симптомов, с целью изучения центральных механизмов формирования боли и зуда (Даплакян И. Г. и соавт., 1988). При этом на ЭЭГ у больных атопическим дерматитом и невралгией тройничного нерва преобладали признаки гиперсинхронизации, как правило, в диапазоне альфа-частот по таким признакам, как усиление их по амплитуде, генерация или смещение фокуса альфа-активности в передние отделы мозга. В ряде случаев наблюдалась стертость зональных различий, когда альфа-колебания были практически одинаково выражены во всех областях полушарий. Явления гиперсинхронизации альфа-ритма у больных атопическим дерматитом наблюдались преимущественно при большой интенсивности и продолжительности зуда. После курса печения методами РТ (акупунктура и электроакупунктура низкими частотами 2-10 Гц с силой тока 25-100 мкА) наряду с положительной клинической динамикой отмечены сходные изменения ЭЭГ у больных атопическим дерматитом и невралгией тройничного нерва: снижение амплитуды, восстановление нормального распределения альфа-активности по областям мозга, установление зональных различий и исчезновение разрядов гиперсинхронной пароксизмальной активности. Таким образом, результаты проведенных исследований свидетельствовали о том, что у больных с выраженными зудом и болью наиболее характерной особенностью ЭЭГ было усиление синхронизации биопотенциалов. Считается, что в доминировании определенного вида синхронизированной активности особая роль принадлежит глубинным структурам мозга, и прежде всего таламусу и гипоталамусу (Болдырева Г.Н., 1978). Им придается большое значение в формировании ЭЭГ, и в частности альфа-ритма. Выявленные особенности изменений ЭЭГ свидетельствуют о функциональной заинтересованности таламокортикальной системы в происхождении зуда и боли. Согласно современным представлениям таламус рассматривается как главная структура ноцицепции и антиноцицепции. В эксперименте установлено блокирование ноцицептивных сигналов как возможный механизм рефлекторной аналгезии при стимуляции ТА (Дуринян Р.А., 1980; Решетняк В.К., 1985). Прослеженная в процессе РТ динамика клинических и электроэнцефалографических данных позволяет заключить, что сходство обнаруженных нейродинамических изменений у больных с болью и зудом, по-видимому, является следствием общности патогенетических механизмов, а также результатом их реализации через одни и те же мозговые структуры. Это положение имеет клиническое подтверждение: рефлексотерапевтическое воздействие обладает выраженным противозудным эффектом, что отмечено всеми дерматологами, применяющими методы РТ (Беренбейн Б.А., 1970; Шинаев КН., 1982 и многие другие). |
Опубликовано в журнале: Международный Медицинский Журнал »» 3 / 2001
ИЗУЧЕНИЕ И ЛЕЧЕНИЕ БОЛИ (ОБЗОР ЛИТЕРАТУРЫ И ПОСТАНОВКА ЗАДАЧ)
А.С. Бронштейн, В.Л. Ривкин Центр эндохирургии и литотрипсии, Москва, Россия
В последние годы в медицинской литературе появился и утвердился термин "качество жизни". Это словосочетание все чаще употребляется вместо традиционного термина "здоровье". Здоровье это состояние полного физического, душевного и социального благополучия, а не только отсутствие болезней и физических дефектов (устав ООН). Качество жизни - состояние здоровья человека, ассоциированное с условиями жизни, профессиональными способностями, работой, учебой, домашней обстановкой. Хорошее качество жизни, естественно, немыслимо без физического здоровья, т.е. предполагается отсутствие "болезни", болей, которые изначально возникают или сопровождают большинство болезней. Как известно, термин "боль" имеет два определения: это своеобразное психофизиологическое состояние, возникающее в результате воздействия сверхсильных или разрушительных раздражителей, вызывающих органические или функциональные нарушения в организме. В более узком смысле боль (dolor) - субъективно тягостное ощущение, возникающее в результате воздействия указанных сверхсильных раздражителей. Боль есть интегративная функция организма, мобилизующая разные функциональные системы для защиты от воздействия вредящего фактора. Отсюда во многих случаях (при "остром животе" прежде всего) следует практическое правило не использовать болеутоляющие средства до точной диагностики. С другой стороны, при головной и суставных болях, составляющих соответственно до 22% и 17% всех обращений к врачам по поводу болевых ощущений [23], самостоятельное применение анальгетиков широко распространено; почти 80% больных пожилого возраста минимум раз в год прибегают к противоболевому самолечению [41]. Широкий набор безрецептурных болеутоляющих средств (анальгин, баралгин, парацетамол) и агрессивная реклама все новых "экстрасильных" анальгетиков дезориентирует больных. В.С. Шухов совершенно правильно ставит вопрос о том, что широчайшая, постоянно нарастающая, в том числе безрецептурная практика использования самих анальгетиков и нестероидных противовоспалительных препаратов (НПВС) в качестве анальгетиков (аспирин, ибупрофен, индометацин) делает необходимой оценку соотношения риска и пользы их применения. Исследования показывают, что НПВС ежедневно принимают более 30 миллионов людей в мире и что осложнения от их приема, в первую очередь гастроинтестинальные, весьма часты и постоянно нарастают [51].
Из 28 отдельных видов (типов, локализаций) боли, перечисленных в Энциклопедическом словаре, по крайне мере, 4 представлены именно как признаки, сигналы определенных болезней: 1) давящие, сжимающие, жгучие боли за грудиной, иррадиирующие в руку, плечо, предплечье при стенокардии; 2) боли в мышцах и суставах при декомпрессионной болезни; 3) тянущие боли в нижней части живота у женщин в период овуляции; 4) боли в животе при острых воспалениях органов брюшной полости (острый аппендицит, острый холецистит).
Патогенезу и лечению боли и болевых синдромов посвящена огромная зарубежная литература, в том числе коллективные монографии [58]. Объективная оценка интенсивности боли очень трудна, особенно у детей [14, 32]. Болевая чувствительность (ноцицепция, от латинского nocens - вредный) может быть условно выражена четырьмя степенями интенсивности - отсутствие боли ("0"), боль как сигнал, затем "болезнь" и "катастрофа". По предложенной [14] 30-балльной шкале на основании субъективной оценки и объективных признаков (частота сердечных сокращений и дыхания, фотоплетизмография, сатурация кислорода) боль предлагается делить на мягкую (50-200 условных единиц), умеренную (201-500), сильную (501-1000) и очень сильную (1001-2000). Катастрофа наступает при интенсивности боли выше 2000 или ниже 50 условных единиц (в последнем случае клинически наступает апатия). В большом обзоре О.В. Петрова с соавт. [18] приводятся основные современные концепции боли как явления. Первая, предложенная и конце 19 века Фреем, сводилась к тому, что в организме существуют специализированные афферентные болевые нервные окончания (рецепторы) и пути, по которым сверхсильное раздражение передается в головной мозг. По-видимому, так оно и есть, причем основную роль играет интенсивность неспецифического раздражителя, и лишь по достижении суммарного критического уровня раздражения возникают и поступают в головной мозг особые, специфические сигналы, запускающие центральный ноцицептивный механизм [22]. Эта теория специфичности и интенсивности боли получила развитие в работе [19]: кожные окончания ноцицептивных (воспринимающих боль) нейронов возбуждаются вначале неболевыми стимулами на низких частотах (меньше 2 Гц), а затем, с нарастанием интенсивности болевых стимулов, появляется высокочастотное возбуждение. Намного ранее было показано, что все виды кожной чувствительности есть результат суммации пространственных и временных неспецифических импульсов, которые затем возбуждают именно болевой импульс (теория pattern). В 1965 году R. Melzack a. P. Wall выдвинули теорию "воротного контроля" боли, согласно которой в спинном мозге специальный механизм контроля регулирует поток импульсов с периферии в вышележащие отделы, "ведающие" уже именно ноцицептивными восприятиями. Эти взгляды развивались в работах А.В. Вальдмана, показавшего в частности, что на спинальном уровне анальгезии центральные анальгетики блокируют восходящий поток болевой информации и, с другой стороны, усиливают нисходящие влияния антиноцицептивных структур.
Среди наиболее частых болевых синдромов, патогенез которых изучен недостаточно, ведущее место занимают головные боли. Различают головную боль напряжения (tension headache) - ежедневную, давящего характера боль, снижающую способность к сосредоточению, усиливающуюся при эмоциональных нагрузках, усталости, повышенном шуме, ярком свете, стрессовых ситуациях. Боль охватывает всю голову, но сильнее ощущается в затылочной области и на задней поверхности шеи. Каких-либо четких фокальных неврологических симптомов при этом нет. Лечение сводится к назначению анальгетиков и препаратов, применяемых при мигрени, о чем ниже. Вторая по частоте форма - депрессивная головная боль (depression headache), сопровождающаяся общими признаками депрессии и усиливающаяся по утрам. Лечение сводится к антидепрессантам и в необходимых случаях консультировании больных с психиатром. Наиболее частый диагноз при головной боли - мигрень, для которой характерны приступы пульсирующих болей длительностью от нескольких часов до нескольких дней, чаще в одной половине головы, чаще у женщин, а также в молодом и юношеском возрасте. Среди соматических признаков мигрени описывают визуальные нарушения (дефекты полей зрения, фотопсия, мерцающая скотома), иногда возникает афазия, онемение, звон в ушах, тошнота и рвота, светобоязнь, изредка временный гемипарез. Характерен семейный анамнез и связь приступов с какими-либо провоцирующими факторами - определенными видами продуктов (шоколад, красное вино), голодом, физическими или эмоциональными напряжениями, менструацией. При отдельной "мигрени базилярной артерии" возникают пульсирующие боли в затылке, нарушения зрения, дизартрия, нарушения равновесия, тошнота, расстройства сознания. При офтальмологической форме мигрень протекает с латеральной болью, диплопией, тошнотой и рвотой. Описано состояние, именуемое эквивалентом мигрени, когда возникают болевые неврологические или симптоматические приступы без самой головной боли. Лечение мигрени сводится прежде всего к исключению провоцирующих факторов. Во время приступа состояние облегчает помещение больного в тихую темную комнату. Из медикаментов применяют анальгетики (они эффективны, к сожалению, только во время применения), экстракраниальные вазоконстрикторы (эрготамин, кофеин, суматрипан), а при частых приступах проводят профилактическое лечение амитриптилином, пропранолом, блокаторами кальциевых каналов. Отдельно рассматривают т.н. ассоциированную головную боль (cluster headache) или мигренозную невралгию. Это приступы ночной интенсивной односторонней периорбитальной боли со слезотечением, симптомом Горнера, ипсилатеральной заложенностью носа, ринореей. Лечение этого синдрома мало эффективно, но полезно назначение эрготамина, бутопропанола, ингаляций чистого кислорода, а с целью профилактики приступов проводят то же лечение, что и при мигрени. Описан синдром гигантоклеточного височного или черепного артериита (giant cell artheriitis) - головные боли пожилых людей, сопровождающиеся миалгией, усталостью, анорексией, снижением массы тела, иногда субфебрилитетом, высокой СОЭ и другими неспецифическими признаками. Пальпация черепа, особенно зоны височных артерий, болезнена. При подозрении на это заболевание необходима ангиография. Лечение сводится к назначению стероидов, и критерием успеха лечения является снижение СОЭ. Более простым синдромом являются посттравматические головные боли и боли, вызванные упорным кашлем. Лечение в первом случае состоит в анальгезии, но особого эффекта, как правило, нет, хотя боль с течением времени, т.е. с отдалением от первопричины, постепенно сходит на нет. Что касается болевого синдрома при кашле, то необходимо ЯМР-сканирование, ибо примерно в 10% таких случаев могут быть найдены внутричерепные образования, преимущественно в задней черепной ямке. Часто в таких ситуациях показана и весьма эффективна люмбальная пункция. Вообще любые внутричерепные процессы могут вызывать головную боль; она является симптомом цереброваскулярных поражений, субарахноидальных кровотечений, феохромоцитомы, пароксизмальной гипертонии; она может быть вызвана люмбальными пункциями и длиться в течение нескольких дней после них.
Наиболее частая причина лицевых болей - тригеминия, невралгия тройничного нерва. Приступ возникает внезапно в максилярной или мандибулярной области и иррадиирует вверх, к глазу или к уху. Прикосновения, движения, еда провоцируют и обостряют боль, которая может длиться долго, прерываясь такими же длительными ремиссиями. Клиника настолько характерна, что обычно никаких других исследований не требуется. В очень редких случаях лицевые боли могут возникать при множественном склерозе или при стволовых опухолях, так что бывает необходимо и полное обследование, особенно у молодых больных. Без лечения лицевые боли прогрессируют, ремиссии становятся короче и тупые болевые ощущения остаются и между ремиссиями. Средство выбора медикаментозного лечения тригеминии - карбамазепин. Применяют также фенитоин, баклофен, инъекции спирта в зону пораженного нерва, а также ризотомию (лучше радиочастотную) и трактотомию. У тяжелых больных в задней черепной ямке могут обнаруживаться сосудистые аномалии или опухоли в области корешка тройничного нерва. Изредка у больных возникают локальные, жгучие лицевые боли без типичных признаков тригеминии; они чаще наблюдаются у женщин среднего возраста в депрессивных состояниях. Есть еще заболевание, выражающееся болями в глотке, у корня языка и в ухе - глоссофарингеальная невралгия, приступы которой провоцируются жеванием, глотанием, разговором, зеванием. Лечение сводится к назначению карбамазепина. Из других болевых лицевых синдромов следует отметить постгерпетическую невралгию, остающуюся примерно у 10% больных после опоясывающего герпеса. Лечение герпеса кортикостероидами значительно урежает случаи таких остаточных болей. Наконец, лицевые боли могут изредка выступать на первый план при дисфункции челюстно-лицевых суставов, поражениях зубов, синуситах, отитах, глаукоме, стенокардии. Об этом необходимо помнить.
Что касается т.н. висцеральных болей, то известно два принципа их определения [34]: их неврологический механизм отличается от такового при соматических болях и второе - сами висцеральные боли отличаются от соматических и имеют минимум 5 характеристик: 1) они не вызываются раздражением внутренних органов, не имеющих чувствительных нервных окончаний (печень, почки, легочная паренхима; 2) они не всегда связаны с висцеральными травмами (к примеру, разрез кишки не вызывает боль, в то время как натяжение мочевого пузыря или брыжейки аппендикса очень болезненно); 3) висцеральные боли диффузны и плохо локализованы; 4) они иррадиируют и 5) они ассоциируются с двигательными или автономными патологическими рефлексами (тошнота, рвота, спазм спинных мышц при почечной колике и др.). К висцеральным рецепторам с высокой пороговой активностью относят чувствительные нервные окончания в сердце, венах, легких, дыхательном тракте, пищеводе, желчных путях, кишечнике, мочеточниках, мочевом пузыре и в матке. Современная электрофизиологическая и изобразительная диагностика позволяет ближе подойти к пониманию перцепции висцеральных болей. В частности, микростимуляция таламуса в эксперименте выявляет его интегративную роль в процессе "запоминания" боли и дает возможность создать "карту" активных точек головного мозга, воспринимающих висцеральные боли. Пока эти исследования мало что дают для разработки методов лечения таких неспецифических висцеральных болевых синдромов как, к примеру, синдром раздраженного кишечника или функциональная кишечная диспепсия [49]. Такие боли, длящиеся 7 и более дней, и не имеющие точного анатомического субстрата, определяются в 13-40% всех ургентных госпитализаций и, несмотря на все самые современные и дорогостоящие обследования, почти треть таких больных выписывают без диагноза (есть для этого даже специальный термин - "дорогостоящая тайна"). Компьютерная диагностика улучшила распознавание патологии у таких больных примерно на 20%, но наилучшим методом распознавания причин таких хронических болевых абдоминальных синдромов является ранняя лапароскопия [36, 51]. Мы лично в этом абсолютно убеждены и считаем, что если в крупной многопрофильной больнице, обслуживающей в том числе ургентных больных, нет специального подразделения диагностической эндоскопии, то такое медицинское учреждение не может считаться современным. Лапароскопию сочетают с лаважем брюшной полости и забором перитонеальной жидкости для исследования нейтрофилов: если их больше 50% среди всех клеток, то возникают показания к операции. M.E. Klingesmi et аl. (1996) выполнили лапароскопию у больных с неясными болями в животе длительностью более 2 месяцев и в 66% случаев выяснили их причину - спайки брюшной полости, которые не удавалось диагностировать никакими другими методами. После лапароскопического адгезиолизиса у большинства больных болевой синдром исчез или резко уменьшился. Особенно актуальна проблема висцеральных болей для онкологических пациентов. В большом обзоре на эту тему [9] показано, что из ежегодно диагностируемых почти 6 миллионов случаев рака примерно 25% этих больных умирают без адекватной помощи. В России из 500 тысяч больных с впервые установленным диагнозом рака у 20% опухоль обнаруживают в запущенной форме и 30% больных умирают в течение первого года. От болей разной интенсивности страдает больше половины раковых больных. Острая боль (меньше 3 месяцев) есть симптом, сигнал тревоги (часто признак рецидива опухоли), требующий определения причины, в то время как хронический болевой синдром требует прежде всего лечения. Возникла и во всем мире обсуждается проблема эвтаназии, и главным фактором в желании терминальных (чаще всего онкологических) больных добровольно уйти из жизни являются невыносимые, ничем не купирующиеся боли. Chochinov et аl. провели исследование за и против эвтаназии путем опроса 585 онкологических больных, определяя по визуальной 100-миллиметровой шкале значение наиболее тягостных симптомов, и показали, что на первом месте были боли. Что касается лечения болевого синдрома у онкологических больных, то основная роль, как и много лет назад, отводится фармакотерапии - ненаркотическим и наркотическим анальгетикам, применяемым по трехступенчатой схеме: 1) выбрать препарат, устраняющий или уменьшающий боль за 2-3 дня; 2) назначать анальгетики по "часовой" схеме, когда очередную дозу вводят до прекращения действия предыдущей и 3) обезболивание "по восходящей" - от максимальной слабодействующей до минимальной сильнодействующей дозы. Основной упор делается, по-прежнему, на опиоиды, причем при очень сильных болях целесообразно введение наркотических препаратов эпидурально или субарахноидально. Такое регионарное, спинногмозговое обезболивание обосновано и теоретически: болевые рецепторы передают импульсы через немиелиновые ("С") и тонкие миелиновые ("А-дельта") волокна в желатинозную субстанцию дорзальных рогов спинного мозга, причем важную роль играет интенсивность стимула и латентность его передачи, определяемая по амплитуде и длительности раздражения. Эти [32] исследования обосновывают новые подходы к лечению боли. Обсуждается, к примеру, понятие "образа боли" [18]: периферическая неспецифическая импульсация становится болью только тогда, когда в центральной нервной системе возник "образ" боли, и обезболивание основывается на механизме нарушения распознавания этого "образа боли". В частности, О.В. Петров выдвинул информационную концепцию боли, сводящуюся к тому, что боль может быть вытеснена из ЦНС конкурентным способом, для чего необходимы два условия - внешний поток информации и полное восприятие этого потока ЦНС. Эти исследования интересны, но сам автор справедливо ставит вопрос о том, в какой степени информационную теорию боли можно применить для объяснения, например, патологических форм боли? Эта и множество других проблем, связанных прежде всего с практической разработкой современных, особенно не наркотических методов обезболивания, остаются весьма актуальными. В частности, отметим работу [13], посвященную пока неразрешимой проблеме лечения героиновой наркомании. Авторы изучали различные проявления болезни, в том числе динамику порогов термоноцицептивных реакций как одного из маркеров состояния эндогенной опиоидной системы на фоне индивидуально подобранной терапии. Высказано предположение, что снижение порога термоболевых реакций может быть обусловлено как гипофункцией эндогенной опиоидной системы, так и резким повышением активности некоторых ферментов в ответ на увеличение синтеза опиоидов.
Особое внимание уделяется болям в спине [3, 24, 27, 28, 31, 35, 42, 47, 57]. R. Deyo a. J. Weinstein указывают, что около двух третей взрослых людей страдают болями в спине, в основном, в пояснице, и что в США эти больные по частоте обращений к врачам занимают второе место после заболеваний верхних дыхательных путей. Оптимальных, унифицированных подходов к лечению этих больных нет и многие считают даже эту проблему "внемедицинской". Анализируя традиционные и суперсовременные (ЯМР) методы выявления возможных анатомических субстратов поясничных болей, авторы, как и много лет назад, признают многие случаи болей этой локализации "неспецифическими", оценивают ведущую роль интервертебральных грыж, спинального стеноза и считают, что на данном этапе морфологический диагноз поясничных болей часто невозможен. С другой стороны, следует пересмотреть методы лечения этого синдрома, ибо современные рентгенологические методы позволяют более точно выделить группу больных, подлежащих хирургическому лечению. Ранее применявшееся лечение с помощью постельного режима и неподвижности ныне заменяется (исключая, понятно, острую боль), активными движениями и специальными упражнениями.
Анализ литературы со всей очевидностью свидетельствует, что целый ряд хронических болевых синдромов, таких как головная боль, одонталгия, кокцигодиния, лицевые и невралгические, опоясывающие и фантомные боли либо не имеют точно изученной причины, либо связаны с несколькими патогенетическими факторами. Болевые синдромы, резко ухудшающие качество жизни, требуют, конечно, дальнейшего изучения, но прежде всего лечения. Это можно сравнить, к примеру, с хроническими запорами, которые надо лечить, воздействуя, если удается, на причину колостаза или, часто, независимо от этой причины, которую иногда трудно объективизировать. В нашей стране проблемы точной диагностики, определения степени тяжести и практической помощи больным с хроническими болевыми синдромами только начинают изучаться. Четких, стандартизованных, научно обоснованных, комплексных методов лечения хронической боли пока нет и приходится по-прежнему назначать и увеличивать дозы анальгетиков, в том числе наркотических препаратов, что приводит к зависимости от них. Возникает целесообразность и даже необходимость создания Клиник боли, штатные сотрудники которых (анестезиолог, невропатолог, нейрохирург, мануальный терапевт) и, при необходимости, консультанты (психоневролог, психиатр) ведут амбулаторный прием, квалифицированно оценивают современные эндоскопические и изобразительные методы диагностики и владеют медикаментозными, физиотерапевтическими и хирургическими методами борьбы с наиболее распространенными и тягостными хроническими болевыми синдромами. Такие клиники в развитых странах Запада создаются уже давно, в США их ныне около 1000 [25], а в нашей стране они только начинают формироваться. В частности, Клиника боли работает в нашем Центре. Еженедельный прием первичных или направленных другими врачами больных составляет сейчас 35-40 человек и постоянно растет. В основном, как это показано выше, действительно, это пациенты с болями в спине, которые длительно и безуспешно лечатся у разных специалистов - от мануальных терапевтов и народных целителей до невропатологов и нейрохирургов. Совершенно ясно, что диагностика причин боли в такой штатной клинике более квалифицирована, а практическая помощь этим многочисленным больным, независимо от известной или невыясненной причины болей, намного более действенная, чем при обращении к отдельным специалистам.
Литература
1. Алилуев И.Г. Боль в грудной клетке. М., Эко-трендз,
2000.
2. Арутюнян Р.Ю. Влияние мануальной терапии на болевые рефлекторные синдромы и
некоторые гипокоагуляционные показатели больных ишемической болезнью сердца
после хирургического лечения. Тер. Архив, 2000,12: 24-26.
3. Боренстайн Д. Эпидемиология, этиология, диагностическая оценка и лечение
поясничной боли. Межд. Мед. Ж., 2000, 1: 36-43.
4. Бускила Д. Фибромиалгия, синдром хронической усталости и синдром
миофасциальной боли. Межд. Мед. Ж., 2000, 1: 28-36.
5. Вальдман А.В., Игнатов Ю.Д. Центральные механизмы боли. Л., Наука, 1976.
6. Вальдман А.В. Боль как эмоционально-стрессовая реакция. Вестн. АМН СССР,
1980, 9: 11-17.
7. Вейн A.M., Авруцкий М.Я. Боль и обезболивание. М., Медицина, 1977.
8. Звартау Э.Э. Болевой синдром. Л., Медицина, 1990.
9. Исакова М.Е. Проблема боли в онкологии. Русский мед. ж., 2000, 8: 723-6.
10. Клиническая медицина. Справочник практического врача. М., 1997, T.1, стр.
497-501.
11. Корепанов В.И. Лазерная терапия в неврологии, артрологии и лечении болевого
синдрома. М., 1998.
12. Лебедева Р.Н., Никода В.В. Фармакотерапия острой боли. М., Арт, 1998.
13. Литвинова С.В., Надеждин А.В., Авдеев С.Н. и др. Анализ соотношения порогов
ноцицептивных реакций и оценки энкефалиновой активности сыворотки крови у
больных героиновой наркоманией. Межд. Мед. Ж., 2000, 5: 431-5.
14. Михельсон В.А., Биккулова Д.Ш. Болевой синдром у детей младшего возраста
после плановых операций. Сб. Актуальные проблемы хирургии. М., 1995. с. 21.
15. Найхус Л.M., Вителло В.М., Конден Р.Э. Боль в животе. М., Бином, 2000.
16. Новик А.А., Матвеев С.А., Ионова Т.И. и др. Оценка качества жизни больного
в медицине. Клинич. мед., 2000, 2: 10-13.
17. Остова H.A., Новиков Г.А., Прохоров Б.М. Хронический болевой синдром в
онкологии. М., Медицина, 1998.
18. Петров О.В., Лихванцев В.В., Субботин В.В. и др. Информационная концепция
боли. Межд. Мед. Ж., 1998, 9-10: 795-803.
19. Ревенко С.В., Ермишкин В.В., Селектор Л.Я. Периферические механизмы
ноцицепции. Сенсорные системы, 1988, 2: 198-210.
20. Реман К., Лейн Н. Как контролировать боль при остеоартрите. Современные
варианты лечения. Межд. Мед. Ж., 2000, 1: 22-28.
21. Улицкий Л.А., Чухловина М.Л. Головная боль. СПБ, 2000.
22. Хаютин В.М. Механизмы ноцицепции и антиноцицептивная система ромбовидного
мозга. Вестн. АМН СССР, 1980, 9: 26-33.
23. Шухов B.C. Проблемы безопасного самолечения ("безрецептурные"
анальгетики / НПВС"). Межд. Мед. Ж., 2000, 3: 265-8.
24. Anderson G. Epidemiological features of chronic low-back pain. Lancet,
1999, 354: 581-85.
25. Aronoff G.M. The role of pain clinic. In: Principles and Practice of Pain
Management, Washington, 1993, pp 481-491.
26. Bengstone R. Physical measures for pain relief. In: Principles and Practice
of Pain Management.
ЛИТЕРАТУРА:
- "Физиология человека" под ред. В.М. Покровского, М., "Медицына", 1998, том 2, с. 231-252.
- "Физиология человека" под ред. Г.И. Косицкого, М., "Медицина", 1985, с. 458-468, 471 - 472.
- Лекции по теме занятия за 2000-2001 уч.год.
- Практикум по нормальной физиологии под ред. А.В. Коробкова с. 212.
- "Общий курс физиологии человека и животных" под ред. А.Д. Ноздрачева, М., "Высшая школа", 1991, Т. 1., с. 429 - 438, 448 - 457.
- "Основы физиологии человека" под ред. Б.И. Ткаченко, Санкт-Петербург, 1994, Т. 2., с. 71 - 94.
- "Физиология человека" под ред. В.М. Покровского, М., "Медицина", 1998, Т. 2., с. 210-231, 256-258.
- "Физиология человека" под ред. Г.И. Косицкого, М., "Медицина", 1985, с. 441-458, 476 - 479.
- Лекции по теме занятия за 2000-2001 уч.год.
- Практикум по нормальной физиологии под ред. А.В. Коробкова с. 209 - 210.
- "Общий курс физиологии человека и животных" под ред. А.Д. Ноздрачева, М., "Высшая школа", 1991, Т. 1., с. 472 - 479, 483 - 500.
- "Основы физиологии человека" под ред. Б.И. Ткаченко, Санкт-Петербург, 1994, Т. 2., с. 94 - 113.
- Учебно-методическое пособие кафедры "Схемы и рисунки по нормальной физиологии", 2000. - С. 24.
1. Общие представления о механизмах мышечных болей
Хабиров Ф.А., Хабиров Р.А.
Боль - это не только симптом различных острых и хронических патологических процессов, но это и сложный психофизиологический феномен, вовлекающий механизмы регуляции и формирования эмоций, гуморальные и гемодинамические проявления. Нейрофизиологические механизмы боли включают в себя участие периферических, сегментарных и супрасегментарных структур.
До настоящего времени, несмотря на огромное количество исследований, нет четких представлений о морфофункциональной организации рецепторного аппарата, воспринимающего болевые воздействия, а также о существовании самих воздействий, адекватных для болевых рецепторов.
Общим свойством разных по своей модальности стимулов, способных вызвать боль, является повреждение тканей - ноцицепция. Термин "ноцицептор" в современной литературе используется как аналог "болевого рецептора". Гипотезу о существовании специфических болевых рецепторов первым предложил Frey (1884). Согласно современным представлениям, они в большом количестве содержатся в различных органах и тканях, имея множество концевых разветвлений с мелкими аксо-плазматическими отростками, являющимися структурами, которые активируются болевым воздействием.
Установлено, что проводниками первичной боли являются толстые миелинизированные волокна, по которым возбуждение проводится со скоростью в среднем 15 м/с, а вторичной "глубокой" боли - тонкие немиелинизированные С - волокна (скорость проведения 1-2 м/с). Афферентные импульсы большей частью по задним корешкам спинного мозга и чувствительным черепным нервам поступают в ЦНС. Незначительная часть импульсов проходит по С- волокнам через передние корешки. Часть С - волокон проводит эффекторные симпатические импульсы, обеспечивающие вегетативные проявления болевой реакции.
В формировании болевого синдрома участвует не только соматическая нервная система, но и вегетативная. Подтверждением способности проведения симпатическими нервными волокнами болевых ощущений являются боли при поражении кровеносных сосудов желудка, кишечника, эндокринных и экзокринных желез, имеющих только вегетативную иннервацию.
Болевые ощущения из органов и тканей по соответствующим нервам, периваскулярным сплетениям, через узлы пограничного ствола поступают к задним рогам спинного мозга. В задних рогах симпатические волокна встречаются с сенсорными волокнами соматических нервов и, пройдя на противоположную сторону спинного мозга, через спиноталамический тракт достигают ретикулярной формации. Пройдя через продолговатый мозг, мост и ножки мозга, они заканчиваются в зрительном бугре. Отсюда волокна, проводящие болевые ощущения, поступают в кору головного мозга.
В основе нарушений мышечных функций решающую роль играют изменения сократительных процессов в скелетной мускулатуре. Различные по своей природе раздражения могут непосредственно или же рефлекторно вызвать сокращение мышц. В последние годы многие авторы придерживаются рефлекторной теории возникновения болевых мышечных синдромов. Периферический раздражитель возбуждает мотонейроны через афференты ЦНС, что ведет к повышению мышечного тонуса. Возникновению мышечного напряжения могут способствовать также различные психоэмоциональные факторы.
Локальную боль и мышечное напряжение следует считать взаимообусловленным процессом. Появление болевого синдрома можно объяснить образованием гиперактивный структуры в заднем роге спинного мозга, где предполагается ослабление тормозных процессов. Наличие и сохранение боли способствует дальнейшему усилению тонуса мышц ("спазм" - "боль" - "спазм"). Длительно существующий гипертонус может вызвать ишемию вследствие расстройства микроциркуляции с последующим ацидозом ткани и накоплением продуктов обмена, которые вызывают болевые ощущения. Локальная гипоксия стимулирует выделение тучными клетками соединительной ткани гистамина и гепарина. При этом застойный белок приобретает волокнистую структуру - возникает фиброзное перерождение ткани.
Содержание
1.Понятие о функциональной системе, периферические и центральные механизмы ноцицепции 2
1.1.Нейрофизиологические механизмы регуляции ноцицептивной и антиноцицептивной систем 16
1.2.Нейромедиаторные и гуморальные механизмы регуляции болевой чувствительности 18
1.2.1. нейронный опиатный 18
1.2.2. гормональный опиатный 20
1.2.3. нейронный неопиатный 21
1.2.4. гормональный неопиатный 24
2.Реализация принципа предупреждающей аналгезии 28
2.1 Профилактика периферической сенситизации 31
2.2 Профилактика центральной сенситизации 32
2.3 Методы предупреждающей аналгезии 34
Список используемой литературы 36
Список сокращений 37
Список сокращений
1. РФ-ретикулярная формация
2. VPL-вентропостериолатеральное ядро таламуса
3. ЦСВ-центральное серое околоводопроводное вещество
4. S1-S2-соматосенсорные зоны коры головного мозга
5. БЯШ- большое ядро шва
6. ГАМК-гаммо-аминомасляная кислота
7. ЯШ-ядра шва
8. АКТГ-адренокортикотропный гормон
9. НА-норадреналин
10.А- адреналин
11.ДА- дофамин
12.ЭЭГ- электроэнцефалограмма
13.МАО- моноаминоксидаза
14.СТГ- соматотропный гормон
15.ЦНС- центральная нервная система
16.РВМО-ростральная вентромедиальная область
17.ПГКЯ- парагигантоклеточное ядро
18.ДЯШ-дорсальное ядро шва
19.ОЦК- объем циркулярной крови
20.ИВЛ- искусственная вентиляция легких
21.CL-центролатеральное ядро
ПОНЯТИЕ О ФУНКЦИОНАЛЬНОЙ СИСТЕМЕ, ПЕРЕФЕРИЧЕСКИЕ И ЦЕНТРАЛЬНЫЕ МЕХАНИЗМЫ НОЦИЦЕПЦИИ.
Изучение механизмов развития боли и поиск эффективных способов обезболивания всегда были и остаются в центре проблем медицинской науки. Это обусловлено, в первую очередь, их прикладным клиническим значением На современном этапе особую теоретическую и практическую значимость приобретают работы, посвященные изучению функциональной роли центральных структур в регуляции, модуляции и интеграции боли, поскольку их результаты могут явиться основой для разработки новых и повышения эффективности известных способов обезболивания.
Боль и обезболивание являются важнейшими проблемами медицины, а облегчение страданий больного чело века, снятие боли во время операций, травм, ранений — одна из самых важных задач анестезиологии и хирургии, решение которой невозможно без фундаментального изучения сущности функционирования болевой и противоболевой систем и механизмов влияния на них средств общего обезболивания. Боль — это типовой, эволюционно выработанный процесс, возникающий в результате действия на организм ноцицептивных факторов или ослабления противоболевой системы. Он включает в себя перцептуальный, вегетативный, эмоциональный, поведенческий, двигательный, антиноцицептивный компоненты и направлен на защиту организма от повреждения и на устранение боли.
Современные знания о функционировании механизмов боли и обезболивания основываются на данных анатомо-морфологических, нейрофизиологических и биохимичееких исследований. Среди них можно выделить два основных научных направления. К одному из них относится исследование анатомической природы и физиологических свойств нейрональных субстратов, осуществляющих передачу ноцицептивной импульсации. Второе направление связано с изучением физиологических и нейрохимических механизмов в отдельных образованиях мозга при различных видах воздействий, приводящих к обезболиванию (23).
Ощущение боли зависит от активации ноцицепторов, принадлежащих миелиновым А-б и немиелиновым С-волокнам, и связанных с ними нейронов восходящих трактов спинного мозга и ствола мозга, направляющихся в ретикулярную формацию, таламус и кору больших полушарий головного мозга. Существуют различные типы ноцицепторов, которые контролируют целостность функционирования органов и тканей, а также реагируют на резкие отклонения параметров внутренних сред организма. В коже преобладают мономодальные А-б механорецепторы и полимодальные С-ноцицепторы, встречаются и бимодальные (термо- и механорецепторы) А-б и С-ноцицепторы .
Во внутренних органах и тканях распределены преимущественно ноцицепторы, принадлежащие А-5 и С-волокнам и реагирующие на механические стимулы и алгогенные вещества .
Соматическая и висцеральная афферентные системы различаются своими свойствами. А-б-волокна соматической афферентной ноцицептивной системы передают соматически организованную сенсорную информацию, которая в различных отделах мозга подвергается пространственно-временному анализу и воспринимается как локализованная острая, или колющая боль. В С-волокнах соматической афферентной ноцицептивной системы кодируется интенсивность действия ноцицептивного стимула, который вызывает ощущение разлитой жгучей, труднопереносимой (вторичной) боли и определяет связанные с нею сложные мотивационные и эмоциональные формы поведения.
Активизация рецепторов висцеральной афферентной ноцицептивней системы обычно проявляется в вегетативных реакциях и характеризуется возрастанием мышечного тонуса, развитием тревожного состояния, ощущениями тупой, диффузной (висцеральной) боли, часто осложненной отраженными болями кожных зон или их гиперальгезией. Ноцицептивные структуры, вызывающие ощущение первичной, вторичной и висцеральной боли, имеют и различную морфофункциональную организацию и связи с соответствующими периферическими и центральными структурами мозга. Ноцицептивные соматические афферентные волокна связаны с нейронами спиноталамического, спиноретикулярного, спиномезенцефалического, спиноцерви-коталамического трактов и тракта, идущего к ядрам дорсальных столбов. Нейроны соматической афферентной ноцицептивной системы широко распределены в сером веществе спинного мозга (за исключением IX пластины), тогда как нейроны висцеральной афферентной ноцицептивной системы обнаружены лишь среди групп нейронов спиноталамического тракта, лежащих в I и V пластинах (176).
Ноцицептивная информация, поступающая в задние рога спинного мозга, попадает в мозг по лемнисковой и экстралемнисковой восходящим афферентным системам. В пределах спинного мозга одна из них располагается в дорсальной и дорсолатеральной зоне белого вещества, другая — в его вентролатеральной части.
Вентролатеральная система разделяется на спиноталамический, спиноретикулярный и спиномезенцефалический тракты.
Спиноталамический тракт является важным восходящим путем, существующим для передачи широкого спектра информации о свойствах болевого стимула, и обозначается как неоспиноталамический, а два других объединяются в палеоспиноталамический тракт. Нейроны последнего лежат в маргинальной зоне и более глубоких пластинах заднего рога. а также в промежуточной области и вентральном роге всех сегментов спинного мозга .
Нейроны спиноталамического тракта подразделяются на четыре группы: первая — нейроны широкого динамического диапазона или мультирецептивные; вторая — высокопороговые нейроны (ноцицептивно-специфические); третья — низкопороговые; четвертая — глубокие нейроны, активирующиеся различными проприорецептивными раздражениями. Терминали нейронов спиноталамического тракта оканчиваются в специфических (релейных) ядрах таламуса (вентропостериолатеральное ядро — VPL), а также в диффузно-ассоциативных (медиальная часть заднего комплекса) и неспецифических (интраламинарный комплекс — субмедиальное ядро) ядрах. Большинство нейронов, оканчивающихся в специфических ядрах, сконцентрированы в I и IV пластинах, тогда как нейроны, оканчивающиеся в неспецифических ядрах, в частности в CL, сконцентрированы преимущественно в VI—VIII пластинах. Кроме того, определенное число аксонов, направляющихся в VPL из I и V пластин, отдает коллатерали в CL, а также к нейронам медиальной ретикулярной формации и ЦСВ .
Большинство терминалей висцеральных ноцицептив-ных афферентных волокон оканчивается на мультирецепторных нейронах спиноталамического тракта, получающих также информацию от соматических ноцицептивных афферентов, что позволяет рассматривать их как важную афферентную ноцицептивную систему, способную передавать сигналы, вызванные действием механических стимулов с широким диапазоном энергии.
Значительный объем ноцицептивной информации поступает в ствол мозга через те аксоны спино-ретикулярного тракта, нейроны которых лежат в VII—VIII пластинах и терминали которых распределены в медиальной ретикулярной формации продолговатого мозга, а также в релейных ядрах таламуса.
Спиномезенцефалический тракт образован аксонами и нейронами, лежащими вместе с нейронами спиноталамического тракта и сопровождающими их до перешейка среднего мозга, где терминали спиномезенцефалического тракта распределяется среди интегративных структур, которые формируют рефлексы ориентации (верхние бугорки крыши среднего мозга, ретикулярное клиноформное ядро) и управляют вегетативными реакциями (ядра Даркшевича и Эдингера-Вестфаля), — а также структур, участвующих в появлении аверсивных ответов (латеральная область ЦСВ). Некоторые аксоны спиномезенцефалического тракта дают коллатерали в вентробазальные и медиальные ядра таламуса. Через эту систему запускаются сложные соматические и висцеральные антиноци-цептивные рефлексы (292).
Спиноцервикоталамичеекий тракт образован преимущественно низкопороговыми и мультирецептивными нейронами, которые сконцентрированы в III, IV и V пластинах серого вещества. Их импульсация, переключаясь на нейроны латерального цервикального ядра, затем в составе медиального лемниска достигает VPL и несет информацию о действии механических неболевых и температурных раздражителей (184). Дорсальные тракты содержат миелинизированные афференты задних корешков от кожи, сухожилий, мышц и внутренних органов, которые без перерыва в сером веществе спинного мозга восходят в задних столбах др. нижнего и клиновидного ядер. Вторичные проекции от задних ядер столбов через медиальную петлю достигают задневентрального ядра тадамуса, а оттуда проецируются в соматосенсорные зоны коры. Одновременно часть коллатералей заднекорешковых волокон оканчивается на нейронах III—IV пластин заднего рога спинного мозга, аксоны которых образуют так называемый постсинаптический дорсальный тракт, также оканчивающийся в нижнем и клиновидном ядрах .
Основными проводниками, по которым передается афферентная висцеральная информация от интероредепторов, являются блуждающий, чревный и тазовый нервы. Блуждающий нерв передает информацию от внутренних органов грудной и врюшной полостей. Большинство его волокон тонкие, обладающие малой скоростью проведения, и лишь незначительное число — быстропроводящие волокна. Чревный нерв иннервирует желудок, тонкий кишечник, брыжейку. В его состав входят как толстые миелинизированные волокна с большой скоростью проведения, так и медленно проводящие тонкие волокна. Тазовый нерв передает афферентную импульсацию от органов малого таза. В нем преобладают толстые волокна, хотя имеется и значительное количество тонких. Пути для быстропроводящих волокон чревного и тазового нервов проходят в задних столбах спинного мозга подобно тому, как это имеет место для соматических нервных проводников .
В спинном мозге афферентные проводники, передающие сигналы от рецепторов внутренних органов, организованы так же, как и соматические. В дорсальных столбах обе системы представлены волокнами одинакового калибра с достаточно большой скоростью проведения. Существует четкое соматотопическое распределение каждого афферентного канала, независимо от того, принадлежит он к соматическим или висцеральным системам. Пространственное распределение этих проводников обусловливается уровнем последовательного вхождения в спинной мозг. Поэтому-то восходящие волокна тазового нерва расположены по соседству с волокнами седалищного нерва и крестцово-поясничного сплетения, а волокна чревного нерва — с проводниками, идущими от пояснично-грудного отдела. Эти пространственные взаимоотношения сохраняются и на уровне таламуса, а также в коре больших полушарий.
Следовательно, дорсальные столбы спинного мозга являются проводниками не только соматических, но и висцеральных сигналов, поступающих в одноименные структуры таламуса и коры. То же самое относится и к спиноталамическим проводникам, которые содержат в своем составе и соматические, и висцеральные волокна
Однако в литературе, посвященной проблемам боли, встречается разделение последней на соматическую и висцеральную в зависимости от области поражения. При этом в качестве основной характерной черты висцеральной боли выделяется ее протопатический характер.
Можно отметить следующие объективные предпосылки позволяющие выделить висцеральную боль в качестве особого вида ноцицепции:
а) сигнальное значение боли при поражении внутренних органов;
6) висцеральная боль не локализована, широко иррадиирует и сигнализирует не об угрозе повреждения, а в большинстве случаев позволяет констатировать развитие уже достаточно далеко зашедшего патологического процесса;
в) болевой сигнал о повреждении покровов тела и опорно-двигательного аппарата формирует адаптивное поведение (реакция избегания), тогда как висцеральная боль — это всегда «неотреагированная» эмоция.
Таким образом, существует три основных отличия висцеральной боли от соматической:
1) недостаточность сигнального значения;
2) неполноценность в формировании адаптивного поведения;
3) неадекватность вегетативного обеспечения болевой реакции запросам поврежденного органа и организма в целом.
Эти признаки позволяют в большинстве случаев отнести боль к патологической форме реакции организма. Основой выделенных отличительных черт, в первую очередь, могут явиться особенности организации висцеральных и соматических афферентных систем. Центральные проекции внутренних и соматических органов построены по единому принципу с сохранением достаточно строгой соматической организации в пределах лемнисковой системы и «специфических» структур мозга — вентробазального комплекса таламуса и сенсорных областей коры больших полушарий, и более диффузно организованы в экстралемнисковых системах, ретикулярной формации, гипоталамусе и других «неспецифических» структурах .
Однако во всех областях мозга отмечены широкая конвергенция и взаимодействие соматических и висцеральных афферентных систем, что позволяет предположить принципиальное единство центральных механизмов регуляции болевой чувствительности .
Следует отметить, что, по сравнению с соматическими, органы грудной и верхнего отдела брюшной полостей имеют более прямые связи с высшими центрами вегетативной регуляции, в частности с гипоталамусом, за счет бульбарных афферентных систем .
Таким образом, протопатический характер висцеральной боли обусловлен не только ее хеморецептивной природой, но и следующими основными отличительными чертами в организации афферентных систем:
1. Принцип множественности и многосегментарности афферентных путей, идущих в нескольких нервных стволах и сплетениях и входящих в ЦНС на разных уровнях.
2. Наличие прямых сегментарных и окольных путей с множественными переключениями. например, в периферических вегетативных и спинальных ганглиях, в интрамуральных сплетениях.
3. Принцип «двусторонней воронки» — перекрытие в одном органе афферентных путей, идущих в разные отделы ЦНС, и перекрытие путей от нескольких органов в одной мозговой структуре (26).
Одной из главных супрасегментарных зон восприятия афферентного притока и его переработки является ретикулярная формация головного мозга. Эта область продолговатото мозга, получающая афференты по спиретикулярному тракту, в свою очередь посылает дифузные восходящие проекции в ростральные отделы мозга, в частности, проекции от нейронов бульбарной ретикулярной формации к ядрам медиального таламуса. Эти проекции носят название бульботаламический тракт. Помимо проекции к ядрам медиального таламуса ретикулярная формация посылает свои проекции и ЦСВ, к верхним буграм четыреххолмия, к субталамусу, гипоталамусу и другим структурам. ЦСВ является образованием, в котором происходит интеграция ответов на повреждающие стимулы. Известно большое значение гипоталамуса в организации афферентных защитных реакций, установлены его тесные связи с ЦСВ. Ноцицептивные нейроны обнаружены в гипоталамусе, ядрах шва, синем пятне, черной субстанции и других подкорковых образованиях .
Таким образом, диффузные восходящие проекции передают ноцицептивную информацию ко многим образованиям различных этажей мозга, которые выполняют самые разнообразные функции как сенсорного, двигательного, так и вегетативного обеспечения защитных реакций, возникающих в ответ на ноцицептивное раздражение.
В таламусе можно выделить три основных ядерных комплекса, имеющих непосредственное отношение к интеграции боли: вентробазальный комплекс, задняя группа ядер, медиальные и интраламинарные ядра.
Вентробазальный комплекс является главной структурой соматосенсорной системы. Здесь оканчиваются восходящие лемнисковые проекции и лишь в ограниченных зонах VPL — неоспиноталамический тракт. Нейроны вен-тробазального комплекса проецируются в соматосенсорные (S2—S1) зоны коры и частично — в орбитальную кору. Мультисенсорная конвергенция на нейронах вентробазального комплекса обеспечивает точную соматотопическую информацию о локализации боли, ее пространственную соотнесенность и сенсорно-дискриминативный анализ (201).
Наиболее характерной особенностью задней группы ядер является конвергенция на них полисенсорных входов из спиноталамических, спиноцервикальных и лемнискового трактов. Здесь же оканчиваются спиноретикулярные и спиномезенцефалоталамические проекции. Нейрональная активность этих ядер сильно подавляется общими анестетиками. Задняя группа ядер имеет многоканальные проекции в кору, и в том числе в заднюю часть ее соматосенсорной области (S1,S2). Таламические ядра наряду с вентробазальным комплексом участвуют в передаче и оценке информации о локализации болевого воздействия и частично — в формировании мотивационно-аффективных компонентов боли.
К медиальным и интраламинарным ядрам относятся ассоциативное медиодорсальное ядро и неспецифические интраламинарные ядра — центральное медиальное, центральное латеральное, парацентральное, парафасцикулярное, а также срединный центр. На них оканчиваются волокна спиноталамического тракта и все восходящие тракты, связанные с ноцицепцией. Клетки этих ядер отвечают на соматические, висцеральные, слуховые, зрительные и болевые стимулы. Медиальные и интраламинарные ядра таламуса, получающие наряду с ноципептивными входами массивный афферентный приток из ЦСВ, гипоталамуса, лимбической и стриопаллидарной систем и имеющие обширные субкортикальные и корковые проекции, играют основополагающую роль в интеграции «вторичной», протопатической боли. Эти ядра формируют также сложные вегетомоторные высокоинтегрированные защитные реакции на ноцицепцию, а также мотивационно-поведенческие проявления боли и ее аффективное, дискомфортное восприятие.
Кора головного мозга принимает участие как в перцепции боли, так и в ее генезе.
Первая соматосенсорная зона коры S1 принимает непосредственное участие в механизмах формирования перцептуально-дискриминативного компонента системной болевой реакции, ее удаление приводит к повышению порогов восприятия боли.
Вторая соматосенсорная область коры имеет ведущее значение в механизмах формирования адекватных защитных реакций организма в ответ на болевое раздражение, ее удаление приводит к снижению порогов восприятия. Орбито-фронтальная область коры непосредственно участвует в механизмах формирования эмоционально-аффективного компонента системной болевой реакции организма, ее удаление не изменяет порогов восприятия перцептуально-дискриминативного компонента и значительно повышает пороги восприятия эмоционально-аффективного компонента боли.
Таким образом, данные литературы свидетельствуют о разделении болевой чувствительности на эпикритическую и протопатическую. Следует отметить, что эпикритическая боль — это, в большинстве случаев, соматическая, а протопатическая — висцеральная.
Эпикритическая боль возникает при активации преимущественно быстропроводящих миелинизированных А-б-афферентов. Ноцицептивная информация в этом случае передается в основном по неоспиноталамическому тракту и частично — по системе дорсолатеральных и дорсальных лемнисковых проекций. Через вентролатеральный отдел таламуса она достигает в основном соматосенсорной коры. Благодаря быстрой передаче информации через эту систему обеспечивается точная локализация боли, ее сенсорная дискриминация, опенка длительности и интенсивности ноцицептивного стимула.
Протопатическая боль, как правило, вторична. Она в значительной степени обусловлена проведением по медленным немиелинизированным С-афферентам ноцицептивной информации, которая затем передается по палеоспиноталамическим восходящим системам (спиноретикулоталамическому, спиномезенцефалоталамическому трактам и по другим подразделениям этих диффузных проекций), а также по проприоспинальной системе. По мере рострального проведения ноцицептивных сигналов происходит активация ряда супрасегментарных структур — ретикулярной формации, гипоталамуса, лимбической и стриопаллидарной систем. Ноцицептивный поток преимущественно через медиальные, интраламинарные и задние ядра таламуса достигает различных областей коры головного мозга. Вся эта сложноорганизованная иерархия восходящих проекций и структур головного мозга обусловливает ощущение труднодифференцируемой по качеству и локализации боли, ее многокомпонентные висцеромоторные и эмоционально-аффективные проявления и психическое переживание боли.
В целом, описанные выше системы соматической и висцеральной боли составляют общую систему ноцицептивного возбуждения, формирующего различные поведенческие аффективно-эмоциональные и вегетативные проявления болевой реакции. Вместе с тем, учет особенностей висцеральной боли имеет важное значение для анестезиологии, так как при оперативных вмешательствах преимущественно формируется висцеральная боль.
В последние годы были открыты существующие в норме механизмы регуляции и контроля ноцицептивного возбуждения, получившего название антиноцицептивных систем. Ключевое место среди анальгенных зон головного мозга занимает ЦСВ среднего мозга. Оно находится в непосредственной близости от структур, в которые направляются афферентные волокна восходящих ноцицептивных систем, и получает проекции от спинальных сенсорных путей, от восходящих проекций ретикуляной формации. При электрическом раздражении, в основном вентральных отделов ЦСВ, впервые был выявлен феномен селективного обезболивания. ЦСВ не имеет прямых связей со спинным мозгом, все его аксоны оканчиваются на нейронах группы ядер РФ вместе с большим ядром шва.
Другой областью эндогенной болеутоляющей системы являются ядра шва ствола и среднего мозга. Они тесно связаны с ЦСВ, а аксоны их клеток проецируются как в восходящем, так и в нисходящем направлениях. Нисходящие волокна из этих ядер, особенно из большого ядра шва, проходят в дорсолатерательном канатике и прослеживаются в заднем роге спинного мозга.
Стимуляция ЦСВ и ядер шва тормозит активность нейронов заднего рога спинного мозга, связанных с ноцицептивной афферентацией. Особенно отчетливо изменяется активность нейронов спиноталамического тракта. Раздражение ЦСВ, угнетающее активность спиноталамичсских нейронов спинного мозга, одновременно активирует клетки БЯШ . Кроме того, стимуляция ЦСВ вызывает активацию нейронов желатинозной субстанции, которая участвует в пресинаптическом торможении ноцицептивной информации .
Наряду с нисходящей системой ядер шва существует система нисходящих связей ядер ретикулярной формации ствола головного мозга .
Раздражение этой области вызывает отчетливое обезболивание и угнетает ответы нейронов заднего рога спинного мозга на ноцицептивные стимулы. По некоторым данным, стимуляция ретикулярных ядер ствола в значительно большей степени, чем раздражение ядер шва, угнетает передачу ноцицептивной информации в спинном мозге. В отличие от волокон, нисходящих из ядер шва, ретикулоспинальные пути оканчиваются не только в I—V слоях заднего рога, но и в боковом и передних рогах, что имеет существенное значение для сопряженной регуляции вегетативной и моторной деятельности при стимуляционной анальгезии. В настоящее время значительное внимание уделяется изучению роли в регуляции болевой чувствительности латерального ретикулярного ядра, раздражение которого сопровождается отчетливой анальгезией, что реализуется через дор-солатеральные и вентролатеральные канатики. Некоторые нейроны латерального ядра выполняют функцию релейного звена в системе ЦСВ — ядра шва — спинной мозг и имеют морфологические прямые проекции из ЦСВ и ядер шва.
Исследователями недавно получены данные о том,
что стимуляция ЦСВ тормозит активность нодицептивных клеток в медиальном таламусе. Установлено также, что некоторые клетки ЦСВ увеличивают свою активность при периферическом ноцицептивном раздражении, что совпадает с моментом активации ЭЭГ в коре больших полушарий.
ЦСВ имеет тесные связи с лимбической системой и интраламинарными ядрами тапамуса. ЦСВ получает афференты из гипоталамуса и миндалины и, в свою очередь, посылает эфферентные волокна в парасимпатические центры продолговатого мозга.
Помимо восходящих проекций из ЦСВ существуют такие восходящие проекции из ядер шва, которые могут оказывать модулирующее влияние на ноцицептивные реакции не только на уровне спинного мозга, но и на выше лежащих уровнях, в частности в таламусе. Наличие прямых проекций от ядер шва обнаружено также к парафасцикулярному и вентробазальному комплексам таламуса, хвостатому ядру, латеральной перегородке, гипокампу и мозжечку. Установлены двусторонние моносинаптические связи ДЯШ с. гипоталамусом и гипокампом.
В настоящее время существенно пересмотрен взгляд на БЯШ как на центральный источник нисходящих проекций в спинной мозг, через который осуществляются все супрасегментарные антиноцицептивные влияния. Установлено, что при формалиновом тесте разрушение БЯШ не отменяет анальгетический эффект при стимуляции ЦСВ (161). Парагигантоклеточное ядро имеет самостоятельные проекции в спинной мозг, которые заканчиваются в III—V пластинах дорсального рога и вентральном роге спинного мозга. Помимо упомянутых структур, при раздражении которых происходит развитие анальгезии, в мозге существует еще целый ряд образований, разрушение которых приводит к подавлению ноцицептивных реакций. К этим образованиям относится кора головного мозга. Кора оказывает свое модулирующее влияние не только на ноцицептивные нейроны глубоких слоев дорсального рога, но и на специфические ноцицептивные клетки, расположенные в I и II пластинах.
Стимуляция вентробазального комплекса таламуса у крыс и обезьян подавляет активность ноцицептивных нейронов дорсальных рогов спинного мозга.
Тормозное влияние специфических ядер таламуса отмечается не только на уровне спинного и продолговатого мозга, но также и в неспецифических ядрах самого таламуса. При раздражении вентробазального комплекса подавляется активность ноцицептивных нейронов в парафасцикулярном комплексе.
Большое значение в регуляции болевой чувствительности имеет гипоталамус. При его стимуляции отмечается подавление ноцицептивных реакций в парафасцикулярном комплексе таламуса. Предполагается, что анальгетический эффект при стимуляции гипоталамуса реализуется через БЯШ. Кроме того, гипоталамус имеет прямые проекции в спинной мозг, которые заканчиваются в I, IV и VIII пластинах дорсального рога. При раздражении гипоталамуса тормозится активность ноцицептивных нейронов дорсального рога. Гипоталамус проецируется также и к орбитофронтальной и сома-тосенсорной областям коры больших полушарий.
Антиноцицептивный эффект, наблюдаемый при раздражении красного ядра, возникает за счет существования как прямых руброспинальных проекций, так и за счет проекций к ядрам шва. Наличие связей центрального ядра миндалины с ядрами шва, с ЦСВ, синим пятном и черной субстанцией объясняет возможность возникновения анальгетического эффекта при стимуляции миндалины. Электрораздражение других структур лимбической системы, в частности перегородки и гипокампа, также вызывает анальгетический эффект. При этом отмечается подавление вызванной активности ноцицептивных и неноцидептивных нейронов в ядрах шва и ЦСВ.
Стимуляция гипофиза у обезьян также вызывает анальгетический эффект. При этом отмечается торможение ноцицептивиых ответов в таламусе и коре больших полушарий.
Антиноцицептивный эффект может быть достигнут не только за счет стимуляции центральных, супрасегментарных структур мозга, но и за счет стимуляции дорсальных столбов спинного мозга. Возникает он в данном случае в результате антидромного распространения возбуждения в нисходящем направлении по коллатералям в желатинозную субстанцию.
Таким образом, анализ данных литературы дает основание считать, что наряду с существованием соматической и висцеральной ноцицептивных систем, приспособленных для передачи и анализа отдельных субмодальностей, существует антиноцидептивная система, структуры которой расположены на всех уровнях ЦНС, начиная со спинного мозга, вплоть до коры больших полушарий. При этом антиноцицептивная система является гетерогенным образованием и имеет ряд различных нейрофизиологических и нейрохимических механизмов контроля и регуляции болевой чувствительности.
Нейрофизиологические механизмы регуляции ноцицептивной и антиноцицептивной систем
Анализ организации нейронных цепей в задних рогах спинного мозга позволил сделать вывод, что спинной мозг представляет собой интегративный центр для сенсорных процессов, а не передаточный механизм. В спинном мозге отдельные сенсорные модальности не передаются по жестко определенным восходящим путям, а подвергаются сложной переработке. В его многочисленных нейронных цепях и синаптических контактах происходят интегративные процессы, приводящие к тому, что значительное число импульсов, входящих в спинной мозг, отфильтровывается и не достигает высших отделов мозга.
Формирование многокомпонентных реакций организма на боль происходит при обязательном участии структур ствола мозга. Концепция о трех морфофункциональных системах ствола мозга (рефлекторной, интегративной и нейрорегуляторной) и их взаимоотношениях позволяет показать возможные уровни взаимодействия различных ноцицептивньгх рефлексов ствола мозга и спинного мозга с интегративной и нейрорегуляторной системами. Согласно этой концепции участие образований ствола мозга в обеспечении жизненно важных функций (в частности, защита организма от действия болевых стимулов и приспособление его к жизни в условиях длительного болевого раздражения) базируется на способности интегративной системы ствола мозга объединить отдельные простые рефлексы в сложные рефлекторные акты, управляющие нейрорегуляторными функциями
Ноцицептивная модулирующая система образована
скоплениями нейронов медиальных областей промежуточного и среднего мозга, моста и продолговатого мозга, а также спинного мозга. Ее основу образуют три звена: нейроны вентролатеральной области ЦСВ среднего мозга, нейроны большого ядра шва (продолговатый мозг), интернейроны поверхностных пластин серого вещества спинного мозга. Важное место в ноцицептивной модулирующей системе принадлежит гигантоклеточному, парагигантоклеточному и парагигантоклеточному латеральному ядрам ретикулярной формации. Группу ядер ретикулярной формации вместе с большим ядром шва объединяют в ростральную вентромедиальную область (РВМО) продолговатого мозга.
Важную роль в ноцицептивной модулирующей системе выполняют нейроны орбито-фронтальной коры, перивентрикулярных областей гипоталамуса, а также каудальной вентролатеральной ретикулярной формации.
Эффекторная часть ноцицептивной модулирующей системы образована нисходящими трактами, которые локализованы в дорсолатеральных канатиках спинного мозга.
Ноцицептивная модулирующая система тесно связана со структурами, вызывающими эндогенную анальгезию.
Импульсация, вызванная стимуляцией ноцицепторов, может действовать на ЦСВ и БЯШ либо прямо через коллатерали восходящих сенсорных путей, идущих из спинного мозга и ствола мозга, либо через ретикулярную формацию. В цепи «ЦСВ-РВМО-спинной мозг» ЦСВ является Основным интегративным центром, РВМО отводится роль «конечного общего пути», а структуры спинного мозга выполняют эффекторную функцию ноцицептивной модулирующей системы. Вместе с тем каждое из звеньев этой системы имеет аффективные входы от коры головного мозга, хвостатого ядра, ретикулярного клиновидного ядра, бульбопонтивной ретикулярной формации, голубого пятна.
Таким образом, антиноцицептивная система формируется на разных уровнях ЦНС. Ее первое звено расположено на сегментарном уровне и представлен? воротным контролем боли. Тормозная активность интернейронов желатинозной субстанции контролируется ретикулярными стволовыми аппаратами (ЦСВ, ядра шва, гигантоклеточное ядро РФ) — это второе звено антиноцицептивной системы. Установлена гипоталамо-спинальная система торможения боли, которая возникает в паравентрикулярном и медиальном преоптическом ядрах дорсальных отделов гипоталамуса и заканчивается на нейронах желатинозной субстанции. Антиноцицептивная система зрительного бугра представлена ретикулярным таламическим ядром. Увеличение потока афферентной импульсации по таламо-кортикальным путям активирует тормозно-модулирующую систему таламуса. Важную роль в интеграции специфической и неспецифической сенсорной информации играет соматосенсорная область коры, контролирующая деятельность антиноцицептивных систем разных уровней. Одним из важных условий для адекватной перцепции является баланс активности систем ноцицепции и антиноцицепции. Дефицит афферентной импульсации приводит к нарушению функции антиноцицептивной системы.
По мнению Ю.П.Лиманского(1989), антиноцицептивная система включает три компонента:
а) множественные ноцицептивные системы, с помощью которых происходит восприятие качеств болевых стимулов, а также формирование разнообразных защитных рефлексов;
б) нейрогенные группы местных и общих анальгезирующих систем (вторичные компоненты комплекса);
в) антианальгетические системы, предназначенные для быстрого восстановления исходных порогов чувствительности к боли.
Нейромедиаторкые и гуморальные механизмы регуляции болевой чувствительности
В настоящее время большое внимание уделяется эндогенным системам контроля передачи болевых сигналов. Имеются данные, согласно которым существуют четыре эндогенные анальгезические системы:
а) нейронная опиатная — энкефалинергическая;
б) нейронная неопиатная — норадреналиновая, серотониновая и дофаминергическая;
в) гормональная опиатная — эндорфиновая;
г) гормональная неопиатиая — пептиды и другие регуляторы.
Опиатныё рецепторы были открыты в 1973 году как высокоспецифичные места связывания с морфином. Опиатныё рецепторы представляют собой стабильный комплекс кислого гликолиптида со щелочным полипептидом длиной порядка 20 аминокислот. Гликолипид обеспечивает контакт опиоидных пептидов с мембраной .
Областями, богатыми местами связывания опиатов, являются лимбическая система, желатинозная субстанция, задние рога спинного мозга, большое ядро шва, средний таламус, околоводопроводное и перивевтрикулярное серое вещество. Опиатные рецепторы обнаружены в различных периферийных тканях. Существует несколько типов опиатных рецепторов, различающихся по гомологичности к фармакологическим лигандам и по участию в физиологических функциях. Так u-рецепторы, гомонимные к морфину, опосредуют анальгезию, угнетение дыхания, развитие зависимости; х-рецепторы, гомонимные к кетоциклозину, опосредуют анальгезию, успокоение; о-рецепторы, гомонимные к у-амилнорциклазацину — учащение дыхания, манию, галлюцинации;
б-рецепторы, гомонимные к аланин-лей-энкефалину, определяют эйфорию, изменение поведенческих реакций. Наибольшая плотность опиоидных пептидов выявляется в области таламуса, базальных ядер, лимбической системы и спинного мозга. u17 и u2 - рецепторы локализованы преимущественно в желатинозной субстанции спинного мозга ядрах ствола мозга, гипоталамусе, таламусе, в IV слое соматосенсорной зоны коры. б-Рецепторов много в лимбических структурах, перегородке, гипоталамусе. х-рецепторы располагаются преимущественно в желатинозной субстанции спинного мозга, в ЦСВ, гипоталамусе, коре мозга.
Нейронная опиатная анальгезическая система образована тремя уровнями мозга — средним, продолговатым и спинным мозгом. На всех трех уровнях четко локализованы эндогенные опиоидные пептиды (энкефалины). Данные химические соединения были впервые выделены в 1975 году из мозга морской свинки. Биохимическими предшественниками эндогенных опиоидных пептидов являются три вида пропептидов: проопиомеланокортин, проэнксфалин А и проэнкефалин В.
Анализ аминокислотного состава проэнкефалина А и проэнкефалина В показал, что первый является предшественником лей-энкефалина, мет-энкефалина, лей-энке-фалин-аргинин-фенилаланина, а второй — динорфина. Энкефалинсодержащие волокна представлены практически на всех уровнях ЦНС. Так, их находят в аркуатном ядре, пери- и паравентрикулярных ядрах, дорсо- и вентромедиальных ядрах гипоталамуса. На уровне сегментов спинного мозга энкефалинергические терминали формируют активные связи в I, II, IV пластинах задних рогов. Энкефалинреактивные нейроны определяются на пре- и постганглионарном уровне симпатического и парасимпатического отделов вегетативной нервной системы. Опиоидные пептиды могут вести себя как классические нейромодуляторы, т. е. взаимодействовать со специфическими постсинаптическими рецепторами как нейромодуляторы, действуя на пресинаптические рецепторы и изменяя вход основного медиатора. Энкефалины имеют высокое сродство с б-опиатными рецепторами и почти такое же с u-опиатными. Опиоидные пептиды (мет-лей-энкефалины) сосуществуют в одних и тех же нейронах с классическими нейромедиаторами, такими как дофамин, серотонин, норадреналин, ацетилхолин. Энкефалины регулируют формирование сенсорно-ноцицептивного импульса, начиная с сегментарного уровня спинного мозга, где они тормозят афферентную передачу с С-волокон на передаточные клетки. На уровне головного мозга опиоидные пептиды оказывают возбуждающее действие на нейтроны ядер шва, гигантоклеточного ядра, ретикулярной формации, ЦСВ, формирующих нисходящие серотонинергические и энкефалипсргическис бульбоспинальные пути.
Таким образом, анальгезирующее влияние из ЦСВ среднего мозга передается в спинной мозг через нейронные структуры большого ядра шва и ретикулярного парагигантоклеточного ядра при активном участии мет- и лей-энкефалинов.
Гормональная опиатная анальгезическая система образована пятью уровнями мозга — спинным, продолговатым, средним мозгом, а также гипоталамусом и гипофизом.
Афферентная импульсация из спинного мозга достигает гипоталамуса и гипофиза, приводит к высвобождению из гипофиза кортикотропина и в-эндорфина. Предшественником в-эндорфина является проопиомеланокортин, который содержит в-эндорфин, у-эндорфин, АКТГ и а, в, у-меланостимулирующий гормон и синтезируется в передней и промежуточной долях гипофиза, в гипоталамусе и некоторых других тканях. В промежуточной доле АКТГ подвергается дальнейшему расщеплению на а-меланостимулирующий гормон и кортикотропиноподобный пептид, а в-липотропин -- на в-эндорфин и у-липотропин.
В мозге обнаружены две основные группы в-эндорфинреактивных клеток. Одна располагается дорсолатеральнее аркуатного ядра гипоталамуса, вторая соединяется с первой и лежит кпереди и латеральнее в базальном гипоталамусе. в-эндорфинсодержащие клетки представлены в лимбических структурах, медиальном таламусе, околоводопроводном пространстве. Для центральных нейроэндокринных отношений самыми важными являются пептидэргические нейроны гипоталамуса, аксоны которых заканчиваются на первичном сосудистом сплетении капилляров в области медиального возвышения и проходят ножкой гипофиза в нейрогипофиз. Эндорфин, войдя в кровеносное русло, тормозит релейные ноцицептивные нейроны и, попав через систему портальной вены в спинномозговую жидкость третьего желудочка мозга, оказывает прямой тормозный эффект на нейроны таламуса, а также возбуждает тормозящие нейроны ЦСВ и благодаря этому создает длительную и глубокую анальгезию.
Нейронные неопиатные аналгезические эффекты осу-ктвляются при участии моноаминергических структур ствола, представленных серотонинергической, норадреналинергической и дофаминергической системами. Экспериментальные и клинические наблюдения свидетельствуют о большой роли моноаминовой иннервации в модуляции анальгезии. Ядра ретикулярной формации ствола и моста мозга являются источником нескольких восходящиx катехоламинергических путей. Наиболее мощные из них — вентральный и дорсальный восходящие норадренергические пути. Вентральный путь берет начало из нейронов ретикулярных ядер А1 и А5, на уровне верхней оливы, а, также в ретикулярной формации вентральнее верхних ножек мозжечка (А7) и из клеток А2 и А10. Аксоны этих ядер проецируются в ЦСВ, базолатеральный и медиальный таламус, каудальные ядра, преоптическую область, лимбическую систему.
Второй катехоламинергический путь берет начало в основном из синего пятна (А6) и на границе между промежуточным и передним мозгом отдает проекции в субталамус, парафасцикулярный комплекс таламуса и латеральный гипоталамус. Входя в состав супракаллозального пучка, аксоны нейронов ядра А6 отдают проекции во фронтальную и цингулярную кору и гиппокамп. В нисходящем направлении нейроны синего пятна иннервируют задние рога спинного мозга, заднее ядро шва и из него получают восходящие проекции. Кроме этого, ядерные образования ретикулярной формации посредством заднего и вентрального перивентрикулярных НА-ергических путей иннервируют передние, вентральные ядра, латеральное ядро таламуса и заднюю часть гипоталамуса. Таким образом, норадренергическис структуры мозга сосредоточены в латеральном отделе ствола и промежуточном мозге, особенно ими богата ретикулярная формация. Часть их аксонов идет к коре, а другая — к образованиям мозга. Если активировать центральные адренергические структуры, то формируется анальгезия с подавлением эмоционально-поведенческих и гиподинамических проявлений боли. Причем адренергические механизмы супрасегментарного уровня регулируют гиподинамические реакции с участием а2-рецепторов, а сегментарно-поведенческие проявления, реализуются через а1-адренорецепторы. При сильном болевом воздействии активизируются отрицательные эмоциональные зоны гипоталамуса и возбуждается адренергический механизм, что приводит к блокаде болевой импульсации с последующим вовлечением и опиатного механизма.
Дофаминовая система также принимает участие в регуляции боли. Уменьшение анальгезии при стрессе дает блокада дофаминовых рецепторов галоперидолом, а активация дофаминергической системы усиливает морфиновую анестезию.
Известно несколько ДА-ергических пучков, берущих начало в различных отделах головного мозга. Первый — мезостриальный — начинается в клетках компактной зоны (А„) и латеральной части черного ядра (Ад) и проецируется в вентральную часть ЦСВ, хвостатого ядра, переднюю цингулярную, прифронтальную кору. Аксоны мезолимбического пути берут начало в нейронах интерпедикулярных ядер (А10), и их терминали оканчиваются в обонятельных бугорках, ложе ядер терминальных полосок и перегородке.
Одним из возможных механизмов увеличения обмена дофамина является его компенсаторная активность вследствие блокады наркотическими анальгетиками пресинаптических окончаний дофаминергических нейронов. Контроль освобождения ДА в структуре опосредуется через u и o рецепторы.
Экспериментальные данные свидетельствуют о большой роли серотонинергическои системы в модуляции анальгезии. Основной массив серотонинергических нейронов расположен в ядрах шва среднего мозга, распространяющих свои волокна в кору, миндалину, гиппокамп, септум, таламическое и гипоталамическое ядра, а также в спинной мозг.Обнаружено уменьшение опиатной анестезии при снижении уровня серотонина в этих образованиях. Нисходящее тормозное влияние ядер шва ЦСВ является серотонинергичееким. Подавление этой системы опиатсеротонинергическим веществом уменьшает выраженность анальгезии. Электрическая стимуляция у животных области дорсального шва и вентральной части ЦСВ вызывает подавление как функциональной, так и патологической боли, что связывают с активацией как серотонин, так и НА-ергических систем. Серотонин вызывает выделение гипофизом в-эндорфина, преимушественно из передней его доли.
Таким образом, все эти системы имеют прямой выход на передаточные структуры ноцицептивных путей. Стимуляция важнейших моноаминергических структур ствола мозга (ядра шва, голубого пятна и ЦСВ) приводит к возникновению выраженной анальгезии. При этом выделение значительных количеств серотонина и норадренолина вблизи нейронных структур спинного мозга осушествляющих переработку и передачу болевых импульсов в головной мозг. В целом нейронная неопиатная антиноцицептивная система устроена так, что возбуждаемые тонкие афферентные волокна первичных сенсорных нейронов, связанных с ноцицепторами, оканчиваются в желатинозной субстанции В свою очередь, нейроны желатинозной субстанции активируют нейроны восходящих путей переднего и переднебокового канатиков. Восходящая информация поступает к нейронам ядер шва, голубого пятна, ЦСВ, таламуса и активизирует их, а они запускают в действие моноаминерга-ческие нисходящие системы.
В последние годы широко и интенсивно изучается роль холинергических механизмов в формировании боли. Активация холинергической модальности галантамином уменьшает двигательную реакцию на боль, но усиливает интенсивность эмоциональных проявлений (155). Введение М-холинолитиков сопровождается угнетением рефлекторных ноцицептивных реакций за счет непосредственного влияния на сданной мозг. Угнетающее действие холинергических веществ на проведение афферентного ноцицептивного сигнала в спинном мозге реализуется при участии опиатергических систем.
Активация холинергической системы усиливает, а ее блокада ослабляет морфиновую анальгезию.
В настоящее время весьма актуально дальнейшее изучение роли ГАМК-ергических механизмов в повышении устойчивости организма к боли. Однако исследования подобного плана немногочисленны и противоречивы, что обусловливает необходимость изучения ГАМК-ергических процессов как факторов нейромедиаторной и метаболической адаптации к ноцицептивному воздействию различного генеза. Болеутоляющее действие ГАМК-мнистов и ингибиторов ГАМК-трансаминазы опосредуется не только через ГАМК-Б, но и через ГАМК-А рецепторы. Анальгстический эффект, возникающий при активации разных типов ГАМК-рецепторов, имеет относительно независимые механизмы реализации, чем и объясняется отсутствие перекрестной толерантности к болеутоляющему влиянию ГАМК-А и ГАМК-Б агонистов.
Формирование ГАМК-ергической анальгезии зависит от функциональной активности адренергической, серотонинергической и холинергической систем. Анальгети-жкий эффект реализуется с участием опиоидергическиx механизмов. Развитие толерантности к болеутоляющему действию ГАМК-агонистов и ингибиторов ГАМК-трансаминазы опосредуется через а1-адренергические, серотонинергические, но не М-холинергические процессы регментарного уровня. Установлено, что важнейшим механизмом анальгетического эффекта ГАМК-позитивных препаратов в условиях острого и хронического ноцицептивного воздействия является их активирующее влияние на эндогенные анальгезические системы.
Гормональная неопиатная анальгезическая система
Результаты, полученные в исследованиях последних лет, дают основание считать, что помимо опиоидных пептидов в активации антиноцицептивных механизмов принимают участие и другие нейропептиды, широко представленные в ЦНС. К этим пептидам относятся бомбезин, вещество Р, вазопрессин, соматостатин. Общей чертой, характерной для распределения этих веществ в мозге, является то, что большие их количества выявляются в тех структурах, которые известны как основные центры формирования болевого и эмоционального возбуждения, а также как структуры, принимающие непосредственное участие в механизмах развития обезболивающего эффекта при различных воздействиях.
Одним из биологически активных веществ является бомбезин, который в больших количествах содержится в задних рогах спинного мозга, ЦСВ, гипоталамусе, таламических ядрах, структурах переднего мозга: гиппокампе, перегородке, амигдапе, хвостатых ядрах, бледном шаре. Рецепторы бомбезина локализуются в спинном мозге, ядрах ретикулярной формации, ЦСВ, амигдале. Такое распределение бомбезина может свидетельствовать о его участии в механизмах регуляции многих функций, связанных с регуляцией болевой чувствительности, эмоционального статуса и их вегетативного обеспечения. Подавление восходящей ноцицептивной импульсации или ее модуляции опиоидными и бомбезиновыми механизмами происходит на супрасегментарном уровне без вовлечения спинального. Другим важным пептидом, который может оказывать влияние на регуляцию болевой чувствительности, участвуя в механизмах формирования болевого возбуждения и его модуляций на разных уровнях ЦНС, является вещество Р. Вещество Р обнаружено в I и II слоях задних рогов спинного мозга, ЦСВ, черном ядре, переднем таламусе, аркуатных и перивентрикулярных ядрах, гипоталамусе, медиальных преоптических ядрах, гиппокампе, амигдале, боковой перегородке. Такое распределение пептида является свидетельством того, что вещество Р может оказывать существенное влияние на организацию вегетативных, эмоциональных и аверсивных реакций, сопряженных с формированием боли и обезболивания.
Помимо перечисленных данных имеются сведения о том, что действие субстанции Р и ее фрагментов на болевую чувствительность неоднозначно: в зависимости от дозы, исходного состояния, используемого фрагмента и способа введения эффект может быть либо гиперальгетический, либо гипоальгетический. Субстанция Р и ее Фрагменты на уровне спинного мозга вызывают гипоальгезию. Введение вещества Р в дорсальное ядро сопровождается развитием гиперанальгезии. Субстанция Р является преимущественно агонистом кининовых рецепторов. В основе анальгезии, вызванной введением в ДЯШ субстанции Р, лежит механизм активации нейронов этой структуры. Вещество Р является специфическим активатором антиноцицептивной системы.
Hirota N. (1985) считает, что эффекты субстанции Р при болевых воздействиях опосредуются u- и б-опиоидными рецепторами. Механизмы регуляции болевой чувствительности посредством систем вещества Р имеют свою определенную избирательность и специфичность не только по отношению к виду действующего раздражителя, но и по отношению к тем нейрохимическим механизмам, которые активируются при этом же воздействии
Наряду с опиоидной, бомбезиновой системами и системой вещества Р имеется и нейротензиновая, которая может принимать участие в регуляции болевой чувствительности. Нсйротензин — пептид из 13 аминокислот — локализуется в желатинозном веществе спинного мозга, синем пятне, ЦСВ, черном ядре, гипоталамусе, таламусе, бледном шаре, хвостатых ядрах. Незначительное его количество имеется в коре больших полушарий. Появление дозозависимой анальгезии отмечено при введении нейротензина в центральное амигдалоидное ядро, ростральную преоптическую область, вентральный таламус, ретикулярную формацию моста, перивентрикулярное серое вещество.
Вазопрессин синтезируется в нейронах паравентрикулярного и супраоптического ядер гипоталамуса, чьи аксоны транспортируют его либо к нейронам задней доли гипофиза, либо в кровь портальных вен гипофиза, либо через мембраны срединного возвышения в спинномозговую жидкость, заполняющую полости желудочков мозга. Кроме того, вазопрессинергические нейроны посылают свои аксоны в различные структуры мозга — к таламусу, гипоталамусу, мозжечку, миндалевидному телу, черной субстанции, ретикулярной формации, ядрам моноаминергических систем (голубое пятно, ядро шва).
На основании литературных данных можно сделать вывод, что эндогенные анальгетические системы в организме никогда не функционируют отдельно друг от друга. Каждая из них, имея особую структурно-функциональную организацию и взаимодействуя с другими системами, позволяет организму устранять отрицательные последствия, вызванные любыми ноцицептивными факторами, а также перестраивать функции его важнейших систем во время развития различных ноцицептивных рефлексов, начиная от простейших защитных ответов на боль и кончая сложными эмоциональными и стрессовыми реакциями высших отделов мозга. В системе эндогенной регуляции ноцицептивной афферентации и эфферентной модуляции самую активную роль играет нейрорецепторная организация. Взаимоотношение компонентов этой организации, связывающей нервную и эндокринную системы, развивается по четырем уровням:
а) интегральному — эндогенные опиаты;
б) модуляционному — дофаминергическому, НА-ергическому и серотонинергическому;
в) регулирующему — гипоталамическому (либерины и статины);
г) эффекторному — аденогипофизарные тропины (271).
РРЕАЛИЗАЦИЯ ПРИНЦИПА ПРЕДУПРЕЖДАЮЩЕЙ АНАЛГЕЗИИ
Поиск путей повышения эффективности анестезиологической защиты пациента во время и после хирургического вмешательства продолжает оставаться актуальной проблемой, поскольку существующие методы комбинированной анестезии, особенно послеоперационного обезболивания, не являются полностью надежными.
Этап хирургического вмешательства на фоне общей анестезии проходит для пациента незаметно и “безболезненно” благодаря выключению его сознания, но нередко является источником волнения для анестезиолога в связи с наличием у больного косвенных признаков недостаточности антиноцицептивной защиты( тахикардия, гипертензия) и невозможностью получения и не возможностью получения желаемой стабилизации состояния . Послеоперационный период сложен как для оперированного пациента, так и для анестезиолога - реаниматолога. По данным специальных исследований моноанальгезия сильными опиоидами при интенсивном остром послеоперационном и посттравматическом болевом синдроме редко бывает полной, несмотря на применения значительных доз, приводящих к угнетению сознания, дыхания и другим побочным эффектам, осложняющим течение послеоперационного периода.
Методы регионарной анестезии (аналгезии), в том числе при сочетанном применении местного анастетика и сильного опиоида, также не лишены известным всем специалистам недостатков и почти никогда не обеспечивают полного обезболивания после больших хирургических операций. Это объясняется тем, что никакие варианты регионарной анестезии неспособны создать тотальный непрерывный блок ноцицептивного потока, исходящего из существующей длительное время раны. В итоге сохраняются условия развития и поддержания так называемой центральной сенситизации (перевозбуждение центральных ноцицептивных структур), являющейся основой послеоперационного болевого синдрома. Рассчитывать на предотвращение центральной сенситизации можно, только устранив все инициирующие ее факторы - от момента первого разреза, сделанного хирургом, до полного заживления раны. Эти новые идеи явились основой нового профилактического направления в решении проблемы оптимизации общей анестезии и после операционной аналгезии (ПОА), переживающей в настоящее время принципиально новый этап своего развития. Способы и методы ПОА как главный предмет научного поиска уступают место концептуальному подходу к решению проблемы. Основное направление этого нового подхода- мультимодальный принцип профилактики и лечения послеоперационного болевого синдрома (ПОБС). Мультимодальность подразумевает достижения всех необходимых элементов общей анестезии за счет сочетания многих фармакологических агентов со специальными преимущественными свойствами ( подавление сознания, болевой чувствительности, мышечного тонуса, гемодинамических и других стрессовых реакций организма). Ни один общий анестетик при моноанестезии не обеспечивает необходимой антистрессовой защиты организма в условиях операционной травмы, поскольку механизм их действия реализуется на уровне центральных структур ( преимущественно ретикулярной формации) головного мозга, торможение которой приводит к нарушению, но не прекращению, проведения болевой импульсации в ЦНС. Последняя сохраняется даже при глубокой наркотической депрессии ЦНС, хотя благодаря отсутствию сознания не воспринимается как боль. Для реального обеспечения защиты от операционного стресса необходимо:
1.снижение до безопасного уровня интенсивности ноцицептивного потока из операционной раны на всем пути его следования ( от периферических рецепторов до центральных структур мозга;
2.устранение стрессовых гемодинамических, эндокринных метаболических реакций;
3.предотвращение психологического восприятия боли и сопутствующих ей эмоциональных реакций.
Выбор средств для достижения этих целей лежит в компетенции так называемой предупреждающей анальгезии (“preemptive analgesia”) . Этот выбор зависит от этапа формирования боли, связанной с оперативным вмешательством, каждый из которых требует специального подхода:
1. этап операционной травмы;
2. этап выведения пациента из анестезии (постепенное прекращение анестезии, начало восстановления болевых ощущений);
3. послеоперационный период (общие последствия операционной травмы, боль и местные раневые процессы).
Неустраненный предоперационный стресс может приводить к значительному обострению болевых ощущений ( т.е. к снижению болевого порога ), активации гомодинамических и эндокринных реакции ( выброс стресс гормонов ), что затрудняет стабилизацию общей анестезии, требует применения повышенных доз общих анестетиков и наркотических анальгетиков. В связи с этим на данном этапе главное в тактике анестезиолога - создание психологического покоя для пациента путем психотерапевтической подготовки, адекватной премедикации и анестезии и при проведении предоперационных инвазивных исследований и непосредственно перед оперативным вмешательством. Больной должен быть уверен, что будет защищен от боли и переживаний на всех этапах обследования и хирургического лечения. Лучшим средством защиты являются препараты бензодиозепинового ряда типа диазепам и мидазолама. ПО показаниям применяют анальгетики центрального( Трамодол, бупренорфин, промедол, морфин и др.) и периферичвского ( диклофенак, анальгин, баралгин, кеторолак и др) действия, антихолинергические, антигистаминные и другие средства. Болезненные и рефлексогенные диагностические исследования не должны выполнятся без участия анестезиолога. Хорошая защита пациента от страха и боли в период предоперационной диагностики и непосредственно перед вмешательством гарантирует от ситуационного стресса и вегетативных реакций при поступлении больного в операционную, что облегчает выполнение необходимых манипуляций в общую анестезию.
Основой предупреждающей анестезии является профилактический подход к защите пациента от действия операционной травмы и последующего развития ПОБС. Мощное ноцицептивное воздействие, каким является хирургическая операция, создает условия для развития так называемой первичной и вторичной гиперальгезии. Первичная гиперальгезия связана с сенситизацией переферических болевых рецепторов под действием избыточно выделяющихся на фоне механического повреждения тканей переферических медиаторов боли и воспаления из ряда простагландинов (ПГ) и кининов (К). Вторичная гиперальгезия обусловлена развитием центральной сенситизации-перевозбуждением спинальных структур ЦНС. Ее запуск происходит через ноцицептивные С-волокна за счет активации рецепторов возбуждающих аминокислот - NMDA (N-метил- D-аспартат).Последние избыточно выделяются при действии ноцицептивных раздражителей , С учетом этих данных делаются попытки предотвращения первичной и вторичной гиперальгезии соответствующими патогенетическими средствами, поскольку ее развитие не предотвращается даже самыми мощными традиционными средствами защиты - опиоидными анальгетиками.
Профилактика переферической сенситизации
Формирование афферентного ноцицептивного потока начинается с ноцицепторов. Хирургические манипуляции связаны с рассечением, сдавлением, растяжением, ишемизацией, отеком тканей, что сопровождается мощным раздражителем переферических болевых рецепторов как механического и гуморального плана за счет выделения ПГ и К, являющихся медиаторами боли и модуляторами отека и воспаления. Поэтому патогенетически оправдано превентивное применение перед началом операции мощного анальгетика перефирического действия из ряда НПВС, например диклофенана (50-75 мг внутримышечно) и др. Механизм их действия связан с ингибированием синтеза ПГЕ2 - медиатора боли, выделяющегося при травме тканей, взаимодействующего с ноцицепторами и дающего начало восходящему ноцицептивному потоку. Снижение интенсивности этого потока позволяет уменьшить интенсивность ПОБС и дозы сильнодействующих опиоидов для послеоперационного обезболивания. Важную роль в уменьшении боли и других последствий хирургической травмы тканей играют ингибиторы синтеза другого эндогенного аллогена - брадикинина. Внутривенное капельное введение перед началом операции и в процессе нее одного из антикининовых препаратов (контрикал суммарно в среднем 50000 МЕ или другой аналог в эквивалентной дозе) улучшает течение общей анестезии, снижает ПОБС и потребность в общих анестетиках. Уменьшение же афферентного ноцицептивного потока с помощью местной инфильтрационной и регионарной анестезии менее эффективно, т.к при этом не уменьшается избыточный ПГ-и К- генез, что может стать причиной потологического течения раневых процессов, сопровождающегося тяжолыми послеоперационными осложнениями (анастомозиты, несостоятельность швов анастомозов, некроз, инфицирование тканей). Применение же антипростогландиновых и антикининовых агентов в терапевтических дозах значительно уменьшает боль и другие последствия операционной травмы, хотя и не устраняет их полностью. Возможно, при дальнейшем увеличении доз анальгетиков переферического действия можно было бы получить совсем уникальные результаты, но препятствием являются их побочные эффекты ( нарушение коагуляции и реологии крови). Наряду с выражанным анальгетическим и значительным снижением потребности в анальгетиках центрального действия они улудшают течение раневых процессов, способствуют более ранней посленаркозной и послеоперационной активизации пациентов, обеспечивает профилактику тромбоэмболических, респираторных и других осложнений. Местные анестетики могут быть дополнительным эффективным средством уменьшения афферентной ноцицептивной импульсации, способствующим снижению сенситизации ноцицептивных нервных структур.
Профилактика центральной сенситизации
Известно, что средством интра- и послеоперационной антиноцептивной защиты являются анальгетики центрального действия (опиоиды), активирующие антиноцицептивные системы ЦНС на спинальном и супраспинальном уровнях путем взаимодействия с опиоидными рецепторами. Но далеко не всегда удается достичь стабильного течения общей анестезии (ОА) и полноценной послеоперационной аналгезии даже при применении очень больших доз опиоидов, приводящих к глубокой общей депрессии ЦНС и другим побочным эффектам.
Как было сказано выше, в основе перевозбуждения ноцицептивной системы лежит возрастание высвобождения возбуждающих аминокислот, а также уменьшение количества опиоидных рецепторов в задних рогах спинного мозга, что объясняет недостаточную эффективность опиоидов в этих условиях. Наиболее эффективны в предотвращении центральной гиперсенситизации антогонисты NMDA - рецепторов. Таким свойством обладает кетамин. Введение микродоз кетамина в составе премедикации внутримышечно (1,мг\кг) или внутривенно ( 0,15 мг\кг) за 5 минут до начала операции приводит к предотвращению послеоперационной гипералгезии и значительному снижению потребности в морфине для послеоперационной аналгезии (ПОА). Имеются данные о важной роли микродоз кетамина при применении их в составе модифицированной нейролептоаналгезии (НЛА) на основе фентонила, седуксена и дроперидола: улучшается течение ОА, сохраняется более длительная посленаркозная аналгезия по сравнению с традиционными его дозами, применяемыми при ОА (2мг\кл и более), которые могут способствовать дестабилизации ОА, развитию нежелательных центральных активирующих (гемодинамических, психомоторных) эффектов. Профилактическое введение микродозы кетамина важно до начала хирургических манипуляций. Таким образом, кетамин в микродозах, обладающий свойством антогониста NMDA- рецепторов, способствует предотвращению центральной сенситизации ноцицептивных нервных структур и является не только важным анальгетическим компонентом ОА, но и профилактическим средством снижения послеоперационного болевого синдрома.
При наиболее обширных, травматичных и рефлексогенных операциях, особенно у больных с тяжелой сопутствующей сердечно-сосудистой патологией кроме вышеперечисленных средств ( контрикал, НПВС, микро дозы калипсола ) может быть использован специальный патогенетический агент - агонист А2 - адренорецепторов - клофелин, блокирующий ноцицептивные прессорные реакции, не устраняемые опиоидными и общими анестетиками.
Этап выведения больного из общей анестезии является хорошим индикатором качества интраоперационной антистрессовой защиты. Дефекты последней находят отражение в клинических симптомах переферической и центральной сенситизации ( жалобы на сильную боль в ране, психомоторное беспокойство, гипердинамические реакции кровообращения). При применении указанных выше препаратов веред началом анестезии и во время нее выход больных из анестезии происходит спокойно, без вышеуказанных симптомов, а аналгезия сохраняется в течении нескольких часов после окончания операции. Особенно продолжительная и полная посленаркозная аналгезия, не требующая применения опиоидов, наблюдкется у больных, получивших в процессе анестезии большие дозы антикининогена ( 100000МЕ и более в расчете на контрикал).
В большинстве типичных случаев для стабилизации состояния больного в период выведения из анестезии и для предупреждения развития ПОБС достаточно профилактического введения одного из НПВП (диклофенак, кеторолак и др.) в обычной аналгетической дозе за 1 час до начала операции, а также применения в средних терапевтических дозах одного из антикининогенов (контрикал, трасилол, гордокс и др.) перед началом и во время операции.
МЕТОДЫ ПРЕДУПРЕЖДАЮЩЕЙ АНАЛГЕЗИИ
(Коречкин В.А., Страшнов В.И., 1999г)
1.Общая анестезия со спонтанным дыханием больного. В премедикаци, состоящую из сочетания транквилизатора и нейролептика, включают кеторолак (50-100мг внутривенно за 1час до операции) индукцию в наркоз осуществляют диприваном (0,08мг\кг), фентанилом (1,4мкг\кг) и кетамином (0,32мг\кг). Основной наркоз поддерживается инфузией дипривана (2,46мг\кг-ч), фентанила (0,0018мг\кг-ч) и кетамина (0,96 мг\кг-ч).
2.Общая анестезия с применением ИВЛ.
В премедикацию ( транквилизатор + нейролептик) включает внутривенное введение за 1 час до операции 100мг кетопрофена. Перед введением в наркоз внутривенно вводиться 2000 МЕ контрикала. Индукция в наркоз выполняется диприваном (3,0 мг\кг), фентанила (1,6 мкг\кг) и кетамином (0,5 мг\кг ). После интубации трахеи и перевода больного на ИВЛ (закись азота с кислородом в соотношении 1:1) внутривенно вводится 50000 МЕ контрикала . В интраоперационном периоде поддержание анестезии достигается внутривенной инфузией дипривана ( 2,3мг\кг-ч), фентанила (0,0022 мг\кг-ч) и кетамина (0,98мг\кг-ч).
Таким образом профилактическое использование, начиная с пред- и интраоперационного этапов, рассмотренных выше патогенетических средств не только повышает эффективность и безопасность обезболивания на всех этапах инвазивной диагностики и хирургического лечения пациента, но и позволяет уменьшить общие и местные последствия хирургической травмы, уменьшить вероятность различных осложнений, позволяя при этом значительно снизить потребность в использовании опиоидных веществ или полностью отказаться от их использования.
Современные подходы к лечению хронических болевых синдромов
Общепринятого определения понятия 'хронический болевой синдром' нет. По разным источникам боли следуют относить к хроническим, если они беспокоят больного более 3-6 месяцев. Хронические болевые синдромы - частые болезненные состояния. Сообщается, что 35% американцев испытывали в течение жизни хронические боли. В настоящем сообщении речь пойдет об условно доброкачественных болевых синдромах, не связанных с онкологическими заболеваниями. О частоте различных болевых синдромов можно получить представление, взглянув на рисунок 1.
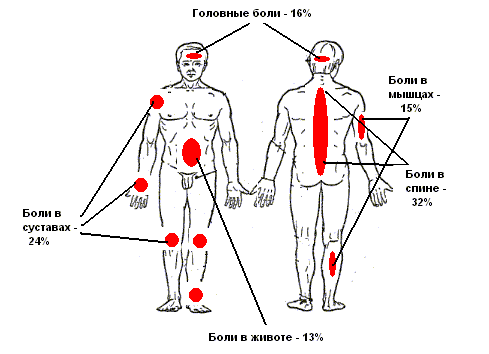
Чаще всего встречаются боли в спине, далее в суставах, примерно с одинаковой частотой боли в мышцах и головные боли, на последнем месте - боли в животе. Таким образом, в 71% хронические боли так или иначе обусловлены поражением опорно-двигательного аппарата.
Говорить о лечении болевых синдромов нельзя, не рассмотрев хотя бы в общих чертах их патофизиологические механизмы. Боль можно рассматривать как последовательную генерализацию негативно-очерченного процесса с нарастающим числом составляющих (см. рисунок 2)
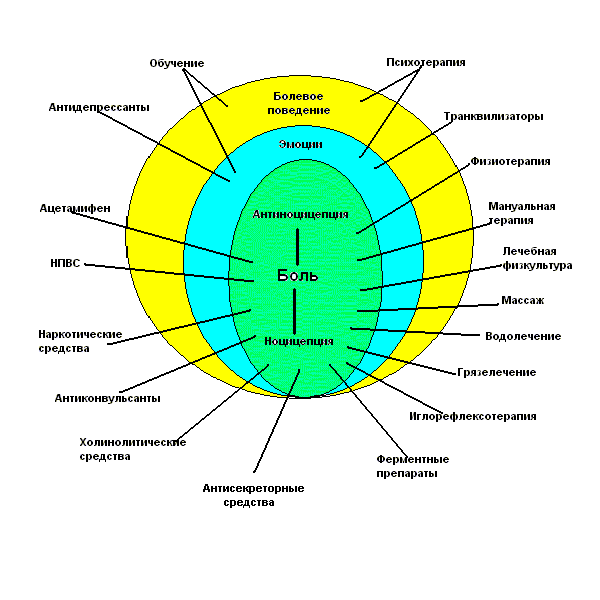
Первый круг или овал - это ноцицепция, импульсация болевых сигналов и их восприятие рецепторами. Далее импульсы передаются в центры спинного мозга, по восходящим путям в лимбическую систему и воспринимаются на уровне центральной нервной системы как ощущение боли. В ответ на боли активизируется антиноцицептивная система. Основными ее медиаторами являются эндогенные опиоиды - эндорфины, энкефалины, которые воздействуют на опиоидные рецепторы в тканях и вызывают аналгезию, уменьшают боли.
Второй овал - это эмоциональное восприятие боли в виде страдания, которое в свою очередь повышает тревожность, вызывает депрессию, психологический стресс. Если боль наслаивается на уже существующие аффективные расстройства, они, несомненно, усугубляют ее.
Третий овал - болевое поведение. При хронических болевых синдромах оно проявляется в нарушениях качества жизни больных. Характерны пониженное (угнетенное) настроение, усталость, ослабление либидо, снижение работоспособности, чрезмерное использование лекарств, иногда алкоголя. Ограничиваются возможности полноценного отдыха, проведения досуга.
При лечении хронических болевых синдромов наибольшие возможности открываются для воздействия на первичные механизмы боли. Здесь можно влиять на факторы, вызывающие раздражение болевых рецепторов (ноцицепторов), ограничивать поступления импульсов из болевых рецепторных зон в центральную нервную систему и, наконец, стимулировать действие противоболевой (антиноцицептивной) системы.
При заболеваниях опорно-двигательного аппарата в возникновении болей, их инициации играют роль механические факторы - перегрузка суставов и мышц, растяжение сухожильно-связочного аппарата, раздражение синовиальной оболочки; микроциркуляторные расстройства; обменные нарушения в костном скелете, развитие в суставе воспалительных и дегенеративных изменений. Вследствие этих процессов в тканях суставов накапливаются вещества-алгетики (тканевые протеазы, кинины, простагландины, гистамин, серотонин), которые раздражают болевые рецепторы и дают начало дуге болевого рефлекса. Ноцицепторы находятся в адвентиции микрососудов, фиброзной капсуле суставов, периосте костей, связках и сухожилиях. Их нет в синовиальной оболочке, хряще и менисках.
Боли при заболеваниях органов брюшной полости обусловлены, как правило, нарушениями двигательной функции - спазмом мускулатуры этих органов, их растяжением вследствие повышения внутриорганного давления, изменением тонуса. Роль ноцицепторов в этих ситуациях играют интерорецепторы, в частности, механорецепторы. Другие виды интерорецепторов - осморецепторы, хеморецепторы могут раздражаться и давать начало болевой рефлекторной дуге при нарушениях питания внутренних органов, ишемии вследствие сосудистых нарушений. При перипроцессах, образовании спаек боли обусловлены раздражением рецепторов брюшины, перикарда.
Можно выделить две группы методов воздействия на первый круг боли - медикаментозные и немедикаментозные.
Медикаментозные методы.
Ацетаминофен (парацетамол) - эффективный препарат, механизм действия которого еще точно не установлен. Предполагают, что он повышает порог восприятия боли в центральных структурах нервной системы. Обычная дозировка 500-1000мг 3-4 раза в день, не более 4 г в сутки. В больших дозах парацетамол вызывает повреждение почек и печени, особенно в сочетании с алкоголем. Парацетамол входит в состав многочисленных комплексных лекарственных средств, применяемых как обезболивающие и жаропонижающие.
Наиболее часто применяются для лечения боли нестероидные противовоспалительные средства (НПВС). Основной механизм их действия заключается в подавлении синтеза простагландинов (циклооксигеназы-2 - ЦОГ-2) - основных алгетиков, раздражающих ноцицепторы. Предполагается также, что НПВС воздействуют на таламические центры болевой чувствительности, снижая их чувствительность. Приводим таблицу распространенных и относительно новых НПВС и их синонимы.
|
Препарат |
Синонимы |
Дозы в мг |
|
Аспирин |
Аспро-500, ацилпирин, картия, алька сельтцер |
1000 мг 4 раза |
|
Диклофенак |
Вольтарен, ортофен, абитрен, бетарен |
50-75 мг 2 раза |
|
Ибупрофен |
Бруфен, ипрен, адекс, ибуфен, нурофен |
400 мг 4 раза |
|
Индометацин |
Метиндол, индоцин, индотард, индовис, индомед |
25 мг 3-4 раза |
|
Кетопрофен |
Профенид, кетонал, оруваил |
75 мг 3 раза |
|
Напроксен |
Напросин, апонацин, нароцин, наксин |
250-500 мг 2 раза |
|
Пироксикам |
Пирокс, эразон, фельден, эксипан |
20 мг 1 раз |
|
Дипирон |
Метапирин, анальгин, опталгин, новалгин, фаналгин |
500 мг 3 раза |
|
Ацетомифен (парацетамол) |
Акамол, дексамол |
500 мг 3-4 раза |
|
Кеторолак |
Топадол |
10 мг 3-4 раза |
|
Мелоксикам |
|
15 мг в сутки однократно |
|
Нимесулид |
|
200 мг 2 раза |
|
Целекоксиб |
|
200 мг 2 раза |
Самым неприятным и опасным побочным действием НПВС является их влияние на слизистую желудка - образование эрозий и язв, опасность развития гастродуоденальных кровотечений, поскольку вместе с ЦОГ-2 ингибируется простагландин ЦОГ-1, являющийся цитопротектором слизистой желудка. Эти побочные действия можно предупредить или смягчить, назначая больному вместе с НПВС антисекреторные препараты - ранитидин, омепразол или препараты простагландинов - мизопростол. Синтезированы препараты мелоксикам, нимесулид, целекоксиб - селективные ингибиторы ЦОГ-2.
Для ограничение болевой импульсации из очага повреждения НПВС при умеренно выраженных болях применяются местно в виде кремов, мазей, спреев. Эффективны в этом плане кетопрофен, диклофенак, ибупрофен и пироксикам. Одним из наиболее результативных методов обезболивания при заболеваниях суставов, мышц, связок является местное введение глюкокортикоидов - кеналога, бетаметазона, гидрокортизона.
При абдоминальных хронических болевых синдромах традиционные анальгетические средства, в частности НПВС, мало эффективны. Болевую импульсацию могут прерывать или ослаблять лекарственные препараты, модулирующие двигательную активность органов пищеварения - желудка, кишечника, желчных путей. Здесь используются четыре группы лекарственных средств - холинолитики и спазмолитики, антисекреторные препараты и ферментные средства.
Холинолитики. Это препараты, которые блокируют действие ацетилхолина на холинорецепторы, тем самым, снижая выделение желудочного сока и соляной кислоты. Они снижают тонус желудка, кишечника, желчного пузыря и протоков, устраняют спастические сокращения этих органов. Таким образом, уменьшается раздражение интерорецепторов и болевые ощущения. Применяются атропин, препараты красавки. Относительно новым средством из этой группы является пирензепин (гастроцепин, ульцепин). Побочные действия: сухость во рту, нарушения зрения. Холинолитики противопоказаны в 1 триместре беременности, при глаукоме, гипертрофии простаты.
Спазмолитические средства. Они эффективны при повышенной двигательной активности желудка, кишечника, желчного пузыря, уменьшают спастические сокращения этих органов и, таким образом, оказывают противоболевое действие.
Препараты, их синонимы, средние дозы и области применения
|
Название препарата |
Синонимы |
Средние суточные дозы |
При каких состояниях применяются |
|
Дицикломин |
Нотенсил |
В таблетках по 10 мг 2-3 раза |
Спастические боли в желудке, кишечнике |
|
Мебеверин |
Колотал |
В таблетках по 135 мг 2-3 раза |
Спастические боли в желудке, кишечнике |
|
Пропантелин бромид |
Пробантин |
В таблетках по 15 мг 2-3 раза |
Спастические боли в желудке, кишечнике |
Антисекреторные препараты. Получили такое название в связи со способностью массивно подавлять секрецию в желудке. Параллельно с этим эти средства нормализуют моторику желудка, устраняя, таким образом, источник болей. Опосредовано уменьшается секреция панкреатических ферментов, снижается их агрессивное действие на паренхиму железы, что является одной из важных причин наиболее тяжелого абдоминального болевого синдрома при панкреатите.
Антисекреторные средства - Н-2-гистаминовые блокаторы. Имеется несколько поколений этой группы антисекреторных средств. Представитель I поколения циметидин (гистадил, тагамет, беломет, нейтронорм, цемидин, циметаг, цими), эффективная суточная доза которого составляет 800-1000 мг. Препарат II поколения ранитидин (зантак, ранитин, ранисан, улькосан, алозан, зантаб) - суточная доза 300 мг. Препарат III поколения фамотидин (гастросидин, квамател, ульфамид, гастро, рогасти, фамо) - суточная доза 40 мг. Низатидин (аксид) по дозировке близок к ранитидину - 300 мг/сутки. Роксатидин (роксан) - суточная доза 150 мг. Каждое последующее поколение Н-2-гистаминовых блокаторов дает возможность применять меньшие дозы, и снижает вероятность побочных эффектов. Побочные эффекты более всего выражены у циметидина. Могут быть малокровие, снижение количества лейкоцитов и тромбоцитов, повышается активность трансаминаз, отмечаются гормональные нарушения - гинекомастия и снижение потенции у мужчин. У ранитидина и фамотидина побочные явления минимальные.
Антисекреторные средства - блокаторы протоновой помпы. По современным представлениям это самые сильные антисекреторные средства, они подавляют конечные этапы синтеза соляной кислоты, действуют длительно, поэтому применять их можно 1 раз в сутки. Основные препараты омепразол, ланзопразол, пантопразол. Омепразол (лозек, омепрол, омез, оцид) назначается в суточной дозе 20-40 мг; ланзопразол (ланзал) - суточная доза 30 мг; пантопразол (контролок) - суточная доза 40 мг. Побочные эффекты наблюдаются нечасто, Это поносы, боли в животе типа кишечной колики, головные боли, головокружения.
Ферментные препараты. Современные ферментные препараты, применяемые в гастроэнтерологической практике, содержат ферменты поджелудочной железы - амилазу, трипсин и липазу, которые способствуют гидролизу основных компонентов пищи - белков, жиров и углеводов. Есть препараты, не содержащие добавок: панкреатин, мезим-форте, трифермент, панцитрат, креон, панкреофлат. Дигестал, фестал, энзистал, фестизим, котазим, энципальмед содержат дополнительно компоненты желчи и гемицеллюлазу; панзинорм-форте и меркензим - бромелин и соляную кислоту. Большинство из этих средств выпускается в виде драже или таблеток в оболочках, которые растворяются только в тонкой кишке. Два препарата - панцитрат, креон - выпускаются в виде микротаблеток и микросфер, что значительно повышает их эффективность. В ферментных средствах обнаружены эндорфины и энкефалины, а также представители некоторых гастроинтестинальных гормонов, модулирующих двигательную активность органов пищеварительной системы. Последнее обстоятельство позволило объяснить противоболевой эффект ферментных препаратов и влияние их на нарушения моторики кишечника. Они, таким образом, воздействуют на механизмы ноцицепции и антиноцицептивную систему. Обычно ферментные препараты поджелудочной железы назначаются по 2-3 таблетки или драже 3-4 раза в день во время еды. Можно выделить две основных схемы назначения этих средств. При использовании их с заместительной целью при недостаточности тонкой кишки или поджелудочной железы ферменты назначаются на достаточно длительный срок - 3-4 недели и даже более. Для воздействия на нарушения моторики кишечника, болевой синдром целесообразен эпизодический прием ферментных препаратов в течение 1-2 дней до улучшения состояния. При необходимости длительного приема рекомендуется периодически менять препараты.
Наркотические анальгетики. Большинство лекарственных средств, входящих в эту группу, обладают сильным болеутоляющим эффектом. Они воздействуют на противоболевую систему, связываясь с опиоидными рецепторами тканей. Но их применение при хронических болевых синдромах ограничено, поскольку длительный прием наркотиков вызывает болезненное привыкание к ним. Исключение составляют такие лекарства как кодеин, оксикодон и трамадол. Чаще всего они используются в комплексных препаратах в комбинации с НПВС и парацетамолом.
Антиконвульсанты. Препараты этой группы в основном применяются при судорожных состояниях. Некоторые из них оказались эффективными при лечении болей, обусловленных поражением периферических нервов (нейропатических) - финлепсин, габапентин. В механизме их действия предполагается влияние на антиноцицептивную систему через рецепторы гаммаоксимасляной кислоты.
Немедикаментозные методы.
Немедикаментозные методы играют важную роль в реабилитационных программах для лиц с хроническими болевыми синдромами, особенно при поражениях опорно-двигательного аппарата.
Иглорефлексотерапия (акупунктура). Один из эффективных методов аналгезии. Механизмы этого благоприятного действия, как впрочем, и для других немедикаментозных методов, точно не установлены. Можно предположить два пути ослабления болей под влиянием введения игл. Первый объясняется воротной теорией боли, выдвинутой Мелзак. Согласно этой теории нейроны задних рогов спинного мозга могут избирательно пропускать импульсы от рецепторов боли, то открывая 'ворота', то закрывая их. Слабые болевые импульсы от введения игл в биологически активные точки, способствуют закрытию 'ворот' для импульсов, исходящих из очагов поражения при хронических болевых синдромах. Второй путь - выделение под воздействием слабых импульсов от введенных игл эндогенных опиатов - эндорфинов и энкефалинов, которые воздействуют на опиоидные рецепторы. Следует лишь подчеркнуть, что акупунктура дает эффект в руках специалистов, владеющими знаниями о расположении биологически активных точек и правильном их выборе.
Мануальная терапия. Мануальная терапия- система приемов, которые руками проводит специалист - мануальный терапевт с целью устранения или облегчения болезненных явлений, вызванных изменениями в опорно-двигательном аппарате (позвоночнике, суставах, мышцах и связках и связках). Высокая эффективность мануальной терапии при некоторых видах хронических болевых синдромов никем не отрицается. Но в трактовке механизма лечебного действия нет единства. Считается также, что мануальная терапия эффективна не столько для исправления уже развившихся, выраженных структурных изменений в позвоночнике и суставах, сколько снимает функциональную, по сути временную, блокаду этих органов, восстанавливает нарушенный объем движений и тем самым способствует снятию боли и нормализации функций многих систем и органов. Таким образом, точкой приложения приемов мануальной терапии следует считать болевые рецепторные поля.
Грязелечение. Лечебные грязи или пелоиды - пластичные массы, состоящие из органических и минеральных компонентов, содержащие также вещества, подобные гормонам и витаминам человека. В настоящее время грязелечение проводится в виде грязевых аппликаций, когда грязь относительно тонким слоем накладывается на отдельные ограниченные участки тела. Считается, что такого рода толщина слоя грязи полностью обеспечивает проявления ее теплового и других видов воздействия. Общие грязевые ванны практически не применяются из-за очень большой нагрузки на сердечно-сосудистую систему. Точно также в современных условиях не применяются грязи высокой температуры (более 44оС), время одного сеанса обычно 15 минут. Курс грязевых аппликаций состоит обычно из 8-10 процедур. Они назначаются через день, тогда общий курс лечения составляет примерно 20-22 дня. Не менее эффективно назначение грязей 2 дня подряд и перерыв на третий день, тогда курс лечения составляет 13-15 дней. Механизм благоприятного действия достаточно сложный. Грязи отличаются высокой теплоемкостью. Это означает, что, будучи нагреты до определенной температуры, они в течение длительного времени (до30-40 минут) ее сохраняют в отличие, например, от парафина, озокерита, которые также применяются для теплолечения. Такое свойство грязей обеспечивает глубокое прогревание участков тела, на которые накладывается грязь. Расширяются кровеносные сосуды кожи и прилегающих внутренних органов, происходит активизация кровоснабжения и процессов обмена веществ. Химическое воздействие грязи оказывают теми веществами, которые находятся в их составе. Исследования последних лет показали, что эти вещества весьма активны и по своему составу близки некоторым гормональным субстанциям, которые вырабатываются в организме человека. Так, в частности, в грязях были обнаружены биологически активные вещества, близкие к естественным обезболивающим продуктам - эндорфинам. Противовоспалительное, обезболивающее и рассасывающее действие грязелечения обусловило применение грязей в первую очередь у больных заболеваниями опорно-двигательного аппарата (суставов, мышц, позвоночника) с хроническими болями. Кроме того, грязи с успехом применяются для восстановления здоровья (реабилитации) больных с заболеваниями центральной и периферической нервной системы, после травм. Есть методики применения лечебных грязей у больных заболеваниями пищеварительной системы, мочевыводящих путей, предстательной железы, женских половых органов.
Физиотерапия. Здесь имеются в виду различные методы аппаратного лечения. Каждый из методов физиотерапии, применяемый при хронических болевых синдромах имеет те или иные особенности механизма действия. Но чаще всего физиотерапия действует как противовоспалительный фактор, при этом уменьшается выделение в очаге воспаления алгетиков - веществ, действующих на болевые рецепторы. Такого рода эффектом обладает ряд методов физиотерапии - электро - и ультрафонофорез лекарственных препаратов в зону воспаления, диадинамические токи и амплипульс, магнитотерапия, сверхвысокочастотная терапия сантиметровыми и дециметровыми волнами, терапия крайневысокочастотными волнами, виброакустическое воздействие, магнитолазерная терапия. Противоболевой эффект достигается также с помощью метода электростимуляции. Пластинчатые электроды накладываются на кожу в области наиболее сильных болевых ощущений, и на них подается слабый импульсный ток. Слабые токи как бы "блокируют" поступление более мощных болевых раздражителей из очага поражения и дают достаточно сильный и продолжительный, особенно при курсовом лечении, обезболивающий эффект. Чрезкожная электростимуляция применяется при болях у больных радикулитами, остеохондрозом позвоночника, а также при заболеваниях желудка, желчного пузыря, поджелудочной железы.
Массаж. Применяется, главным образом, при болевых синдромах мышечного происхождения. Массаж усиливает тонус мышц и в то же время снижает их повышенную чувствительность, предупреждает спазм в различных мышечных группах. Под влиянием массажа укрепляются связки, улучшается функция суставов. Опосредовано уменьшается болевая импульсация от пораженных органов.
Лечебная физкультура (ЛФК). Используется, как правило, в сочетании с другими методами лечения. Особенностью метода является активное участие больного в лечебном процессе, что мобилизует его на преодоление болезненных проявлений. ЛФК стимулирует функциональную деятельность практически всех систем организма, повышает жизненный тонус организма. Стимулируется, в частности, антиноцицептивная система. При любой болезни в действие вступают механизмы компенсации, ЛФК прямо способствуют формированию этих механизмов.
Водолечение. Современное водолечение или бальнеотерапия для лечения хронической боли при заболеваниях опорно-двигательного аппарата включает применение минеральных ванн. Механизм благоприятного воздействия ванн на организм человека комплексный и достаточно сложный. Три фактора воздействуют на организм во время приема практически любой ванны - давление воды (гидростатический), температура (термический) и состав воды (химический). Теплые ванны способствуют лучшему проникновению в кожу и внутренние органы растворенных в минеральной воде химических веществ, кислорода, оказывающих лечебный эффект. Минеральные вещества из ванн проникают в кожу человека и там депонируются (накапливаются), количество этих веществ невелико. Но, как доказано в настоящее время, низкие дозы минералов, газов и даже радиации оказывают стимулирующее влияние на различные системы и органы организма. Особенно благоприятно действую при заболеваниях органов движения сероводородные, сернистоводородные и радоновые ванны.
Минеральные воды, принимаемые внутрь, применяются для лечения хронических болевых синдромов, обусловленных заболеваниями пищеварительной системы. Противоболевой эффект реализуется благодаря нормализующему влиянию на двигательную активность органов желудочно-кишечного тракта. Всасываясь в кишечнике, минеральные воды оказывают благоприятное действие на различные виды обмена, а также, что очень важно, на регулирующие центры жизнедеятельности организма, располагающиеся в головном мозгу и железах внутренней секреции - щитовидной железе, надпочечниках.
Воздействие на второй и третий круг болей - аффективные и поведенческие аспекты боли.
Здесь также можно выделить медикаментозные и немедикаменозные методы.
Транквилизаторы. Назначаются больным хроническими болевыми синдромами с аффективными нарушениями, которые проявляются эмоциональной напряженностью, тревогой, страхами и нередко бессонницей. Основные представители этой группы:
- Альпразолам (альпрокс, апокс, альзолам, ксанакс)
- Бромазепам (ленитил, лексотанил, бромазел)
- Диазепам (валиум, дизопам, седуксен, сибазон)
- Клобазам (фрисиум)
- Клоразепат (транксал)
- Лоразепам (лориван, лорам, трапекс)
- Медазепам (глориум, рудотель)
- Оксазепам (вабен, нозепам, тазепам)
- Хлордиазепоксид (сервиум, элениум).
Хотя указанные средства применяются часто, но следует соблюдать осторожность при их назначении. Это вызвано достаточно частыми побочными эффектами препаратов и нередко привыканием к ним. Побочные эффекты, по сути, в большинстве своем представляют излишне сильное основное действие препарата - заторможенность, снижение адекватности реакции на изменение жизненных ситуаций, повышенная сонливость, может снижаться половая функция, появляться неприятные явления со стороны желудочно-кишечного тракта - снижение аппетита, тошнота, рвота. В силу этого транквилизаторы не следует назначать на длительное время, дозы должны быть минимальными для данного конкретного больного.
Антидепрессанты. Эта группа лекарств применяется при депрессивных тенденциях в психологическом статусе больных, страдающих длительными болями. Антидепрессанты повышают угнетенное, пониженное настроение. Чувства тоски, подавленности, безнадежности сменяются спокойным ровным настроением, желанием работать, адекватно оцениваются перспективы. Дозы препаратов обычно меньше, чем при лечении эндогенной депрессии. Назначаются обычно следующие препараты:
- Амитриптилин (элатрол, триптал, амизол, амирол)
- Нортриптилин (памерол)
- Флюоксетин (афектин, флютин, прозак, продел, портал)
- Сертралин (золофт)
- Пароксетин (паксил)
Антидепрессанты с осторожностью следует использовать у больных с заболеваниями сердца, нарушениями сердечного ритма, при увеличении предстательной железы, повышении внутриглазного давления, атонии кишечника.
К немедикаментозным методам относятся различные программы обучения больных с хронической болью, направленные на модификацию, изменение его поведения, адаптацию к новым условиям, профессиональную адаптацию. Применяются методы психотерапии - аутотренинг, обратная биологическая связь.
Литература.
Woodside D. Chronic pain clinics. Schmerz . Pain. Douleus.-1988.-P.9.-p.296-300
Loeser J. Concepts of Pain. N-Y.-1982.- p.145-148
Chronic Pain syndrome. Text book of Physical Medicine and Rehabilitation
Л.П.Ананьева. Симптоматическая терапия боли при ревматических заболеваниях. Журнал "Consilium Medicum" Том 4 N 8
Обратная связь: jak_rut@hotmail.com
Посетите наш сайт: http://support-doctor.narod.ru/
|
Адрес страницы в сети: http:// www.rmj.ru / rmj/ t11/ n5/ 250.htm |
|
||
|
|
Главная страница С о д е р ж а н и е Редколлегия » РМЖ, Том 11 № 5, 2003 Основные принципы лечения болевых синдромов К.м.н. В.В. Алексеев ММА имени И.М. Сеченова Боль изначально является жизненно важным защитным биологическим феноменом, в нормальных условиях играющим роль основного физиологического механизма защиты. Она мобилизует все необходимые для выживания организма функциональные системы, позволяющие преодолеть вредоносные воздействия, спровоцировавшие боль, или избежать их. Около 90% всех заболеваний связано с болью. По данным разных исследователей, от 7 до 64% населения периодически испытывают чувство боли, а от 7,6 до 45% страдают рецидивирующей или хронической болью. Терапия болевых синдромов предусматривает определение и устранение источника или причины, вызвавшей боль, определение степени вовлечения различных отделов нервной системы в формирование болевого ощущения и снятие или подавление самой боли. Начальным, или самым периферическим, звеном системы восприятия боли является раздражение болевых рецепторов (ноцицепторов), представляющих собой свободные нервные окончания афферентных волокон. Различают три типа рецепторов боли: мономодальные А-d ноцицепторы, реагирующие на механическое и термическое раздражение; полимодальные С–ноцицепторы, раздражаемые механическими, тепловыми и химическими стимулами, и так называемые «спящие» ноцицепторы. Эти ноцицепторы активизируются только во время воспаления. Анатомически первый тип ноцицепторов представлен свободными нервными окончаниями, разветвленными в виде дерева (миелинизированные волокна). Они представляют собой быстрые А-d – волокна, проводящие раздражение со скоростью 6–30 м/с. Эти волокна возбуждаются высокоинтенсивными механическими и иногда термическими раздражениями кожи. Другой тип ноцицепторов (С–ноцицепторы и молчащие ноцицепторы) представлен плотными некапсулированными гломерулярными тельцами. Их афферентные волокна (немиелинизированные С–волокна, проводящие раздражение со скоростью 0,5–2 м/с) у человека и других приматов представлены полимодальными ноцицепторами, поэтому реагируют как на механические, так и на температурные и химические раздражения. С–волокна распределяются во всех тканях за исключением центральной нервной системы, они присутствуют и в периферических нервах (nervi nervorum). Рецепторы кожи связаны с обоими видами нервных волокон, а глубокие ткани, внутренние органы в основном иннервируются наиболее медленно проводящими безмиелиновыми С–волокнами. Волокна, связанные с рецепторами, воспринимающими повреждение тканей, содержат так называемые сенсорные нейротрансмиттеры, к которым относят субстанцию Р (СР, от английского рain – боль) и кальцитонин ген–связанный пептид (КГСП), а волокна из внутренних органов – вазоактивный интестинальный пептид. Возникшие при возбуждении ноцицепторов нерв ные импульсы по периферическим отросткам попадают через узел заднего корешка (УЗК) в спинной мозг. Первым центральным звеном, воспринимающим разномодальную афферентную информацию, является нейрональная система заднего рога спинного мозга. Она представляет собой цитоархитектонически весьма сложную структуру, которую в функциональном отношении можно рассматривать, как своеобразный первичный интегративный центр сенсорной информации. После весьма сложной обработки болевой афферентации в сегментарном аппарате спинного мозга, где на нее воздействуют возбуждающие и тормозные влияния, исходящие из периферических и центральных отделов нервной системы, ноцицептивные импульсы через интернейроны передаются в клетки передних и боковых рогов, вызывая рефлекторные моторные и вегетативные реакции. Другая часть импульсов возбуждает нейроны, аксоны которых формируют восходящие проводящие пути. Ноцицептивная афферентация направляется к головному мозгу по спиноталамическому, спиноретикулярному, спиномезэнцефалическому путям. Внутри спиноталамического тракта выделяют латеральный – неоспиноталамический и медиальный – палеоспиноталамический пути. Неоспиноталамический путь проводит нервные импульсы с большой скоростью, заканчивается в вентролатеральном ядерном комплексе таламуса, откуда после переключения в нейронах этого ядра импульсы приходят в соматосенсорную кору. Спиноретикулярный и спиномезэнцефалический пути проецируются в ретикулярную формацию, околоводопроводное серое вещество, гипоталамус и в медиальные и интраламинарные таламические ядра, связываясь далее со структурами лимбической системы и диффузно распространяясь в мозге. Латеральная система обеспечивает быстрое проведение болевой импульсации с четкой ее локализацией и оценкой характера и длительности раздражения. Проведение по медиальной мультисинаптической системе происходит с гораздо меньшей скоростью, но при этом происходит широкое вовлечение различных структур мозга, связанных с мотивационно–аффективным и вегетативно–гуморальным сопровождением боли. Входными воротами и релейным центром для всей афферентной импульсации, поступающей от нижележащих отделов к коре головного мозга, является зрительный бугор. Функционально и анатомически таламус подразделяется на филогенетически более старые отделы – палеоталамус и новые структуры – неоталамус. Палеоталамус соматотопически не дифференцирован, и пути от него диффузно проецируются на лобные, теменные, височные отделы коры, а также на лимбические структуры. Неоталамус образован вентробазальными ядрами, имеющими строгую соматотопическую организацию. Афферентная информация поступает в неоталамус по неоспиноталамическим и неотригеминоталамическим трактам и отсюда к постцентральным отделам теменной коры. В опытах на лабораторных животных было показано, что ретикулярные таламические ядра, состоящие в основном из ГАМК (g-аминомасляной кислоты)–ергических нейронов, тесно связаны с вентробазальными ядрами и могут играть модулирующую ингибирующую роль в таламической ноцицептивной системе. На уровне гипоталамуса и образований лимбического комплекса происходит формирование эмоциональных и поведенческих реакций, вегетативных и эндокринных сдвигов, сопровождающих боль. Окончательный анализ поступающей ноцицептивной информации осуществляется корой теменных, лобных и височных долей головного мозга. К соматосенсорной коре афферентная информация поступает от ипсилатеральных отделов таламуса. Кортико–фугальные волокна идут от постцентральных отделов теменной коры к тем же ядрам зрительного бугра и частично входят в состав кортикобульбарных и кортикоспинальных нисходящих трактов. На уровне соматосенсорной коры осуществляется пространственно–временной анализ болевой информации. Кортикофугальные волокна от лобной коры направляются как к этим же таламическим структурам, так и к нейронам ретикулярной формации ствола, образованиям лимбической системы (поясная извилина, гиппокамп, свод, перегородка, энторинальная кора) и гипоталамусу. Таким образом, фронтальные отделы коры наряду с обеспечением когнитивных и поведенческих компонентов интегративной реакции на боль участвуют в формировании мотивационно–аффективной оценки болевого ощущения. Височные отделы коры играют важную роль в формировании сенсорной памяти, что позволяет головному мозгу проводить оценку актуального болевого ощущения, сравнивая его с предыдущими. Таким образом, состояние надсегментарных структур ЦНС – коры, лимбической системы, стволово–диэнцефальных образований, формирующих мотивационно–аффективные и когнитивные компоненты болевого поведения, активно влияет и на проведение болевой афферентации. Нисходящий ингибиторный цереброспинальный контроль над проведением болевой импульсации является функцией антиноцицептивной системы, осуществляется структурами коры мозга, диэнцефального уровня, околожелудочкового и околоводопроводного серого вещества, богатых энкефалиновыми и опиатными нейронами, некоторыми ядрами ретикулярной формации мозгового ствола, главным из которых является большое ядро шва, в которых основным нейротрансмиттером является серотонин. Аксоны нейронов этого ядра направляются вниз по дорсолатеральному канатику спинного мозга, заканчиваясь в поверхностных слоях заднего рога. Некоторая их часть, как и большая часть аксонов из ретикулярной формации, являются норадренергическими. Участие серотонина и норадреналина в функционировании антиноцицептивной системы объясняет ослабление боли, вызываемое трициклическими антидепрессантами, основным свойством которых является подавление обратного захвата в серотонинергических и норадреналинергических синапсах и, тем самым, усиление нисходящего тормозного влияния на нейроны заднего рога спинного мозга. Важнейшее значение в функционировании антиноцицептивной системы имеют опиаты. Опиатные рецепторы расположены на окончаниях С–волокон в заднем роге спинного мозга, в нисходящих ингибирующих путях от головного к спинному мозгу и в участках головного мозга, которые передают болевые сигналы. Существуют три основных типа опиатных рецепторов: m- (мю), k- (каппа) и d- (дельта) рецепторы. Эти основные типы опиатных рецепторов также подразделяются, а на каждый подтип воздействуют различные эндо– и экзогенные опиаты. Распределение опиатных пептидов и опиатных рецепторов наблюдается на разных уровнях ЦНС. Плотное размещение рецепторов обнаружено в задних рогах спинного мозга, в среднем мозге и таламусе. Высокая плотность опиатных рецепторов обнаружена также в срединной части зрительного бугра и в лимбических структурах переднего мозга; эти структуры могут играть дополнительную важную роль в болеутоляющем ответе на вводимые наркотики и в механизме привыкания к ним. Наибольшая концентрация спинальных опиатных рецепторов наблюдается в поверхностных слоях задних рогов спинного мозга. Эндогенные опиатные пептиды (энкефалин, эндорфин, динорфин) взаимодействуют с опиоидными рецепторами всякий раз, когда в результате преодоления болевого порога возникают болевые раздражения. b-эндорфин обладает равным аффинитетом к m- и d-рецепторам, в то время как динорфины А и В имеют высокий аффинитет к k-рецепторам. Энкефалины обладают высоким аффинитетом к d-рецепторам и сравнительно небольшим аффинитетом к k-рецепторам. Волокна типа С могут контактировать с тормозными энкефалинергическими интернейронами, ингибирующими проведение болевой импульсации в задних рогах и ядре спинномозгового пути тройничного нерва. При этом энкефалин может действовать, тормозя активность спиноталамических нейронов и ингибируя высвобождение в задних рогах возбуждающих нейромедиаторов из центральных терминалей аксонов нейронов УЗК. Торможение выделения возбуждающих трансмиттеров обеспечивается также другими ингибиторами боли – это ГАМК и глицин, обнаруженные во вставочных нейронах спинного мозга. Эти эндогенные вещества модулируют активность ЦНС и ингибируют передачу болевою сигнала. Серотонин и норадреналин, как часть нисходящего пути от головного к спинному мозгу, контролирующего механизм боли, также ингибируют болевой ответ. Таким образом, в нормальных условиях существует гармоничное взаимоотношение между интенсивностью стимула и ответной реакцией на него на всех уровнях организации болевой системы. Однако длительные повторяющиеся повреждающие воздействия часто приводят к изменению функционального состояния (повышенной реактивности) болевой системы, что приводит к ее патофизиологическим изменениям. С этой точки зрения выделяют ноцицептивную, невропатическую и психогенную боль. Ноцицептивная боль возникает при любом повреждении ткани, вызывающем возбуждение периферических болевых рецепторов и специфических соматических или висцеральных афферентных волокон. Ноцицептивная боль, как правило, транзиторная или острая, болевой раздражитель очевиден, боль обычно четко локализована и хорошо описывается больными. Исключение составляют висцеральные боли и отраженные боли. Для ноцицептивной боли характерен быстрый регресс после назначения короткого курса болеутоляющих средств, в том числе наркотических анальгетиков. Невропатическая боль обусловлена повреждением или изменением состояния соматосенсорной (периферических и/или центральных отделов) системы. Невропатическая боль может развиваться и сохраняться при отсутствии явного первичного болевого раздражителя, проявляется в виде ряда характерных признаков, часто плохо локализована и сопровождается различными нарушениями поверхностной чувствительности: гипералгезией (интенсивная боль при легком ноцицептивном раздражении зоны первичного повреждения, либо соседних и даже отдаленных зон); аллодинией (возникновение болевого ощущения при воздействии не болевых, различных по модальности раздражителей); гиперпатией (выраженная реакция на повторные болевые воздействия с сохранением ощущения сильной боли после прекращения болевой стимуляции); болевой анестезией (ощущение боли в зонах, лишенных болевой чувствительности). Невропатическая боль мало восприимчива к морфину и другим опиатам в обычных анальгетических дозах, что свидетельствует об отличии ее механизмов от ноцицептивной боли. Невропатическая боль может быть спонтанной или индуцированнной. Спонтанная боль может иметь качество жжения, определяемое обычно на кожной поверхности и отражающее активацию периферических C–ноцицепторов. Такая боль может быть и острой, когда она вызывается возбуждением маломиелинизированных A-d ноцицептивных афферентов кожи. Простреливающие боли, подобные электрическому разряду, иррадиирующие в сегмент конечности или лицо – обычно результат эктопической генерации импульсов на путях маломиелинизированных C–волокон мышечных афферентов, отвечающих на повреждающие механические и химические стимулы. Активность этого типа афферентных волокон воспринимается, как «крампиподобная боль». По отношению к степени вовлечения симпатической нервной системы спонтанные боли можно разделить на симпатически независимые и симпатически обусловленные. Симпатически независимая боль связана с активацией первичных ноцицепторов в результате повреждения периферического нерва и исчезает (или значительно регрессирует) после местной блокады анестетиком поврежденного периферического нерва или пораженного участка кожи. Болевой синдром такого типа связан с высвобождением медиаторов воспаления, в этом его сходство с болевым синдромом, развивающимся при воспалении в отсутствие повреждения периферического нерва. Симпатически независимая боль, как правило, носит острый (стреляющий) характер. Индуцированная невропатическая боль, как правило, сопровождается аллодинией и гипералгезией. Аллодиния вызывается активацией низкопороговых миелинизированных А-b волокон в центральной нервной системе или снижением порога чувствительности ноцицептивных окончаний на периферии. Гипералгезия обычно вызывается механическими и термическими стимулами. Психогенные боли возникают в отсутствие какого–либо органического поражения, которое позволило бы объяснить выраженность боли и связанные с ней функциональные нарушения. Вопрос о существовании болей исключительно психогенного происхождения является дискуссионным, однако те или иные особенности личности пациента могут влиять на формирование болевого ощущения. Психогенные боли могут быть одним из множества нарушений, характерных для соматоформных расстройств. Любое хроническое заболевание или недомогание, сопровождающееся болью, влияет на эмоции и поведение личности. Боль часто ведет к появлению тревожности и напряженности, которые сами усиливают восприятие боли. Психофизиологические (психосоматические) механизмы, воздействуя через кортикофугальные системы, изменяют состояние внутренних органов, поперечнополосатой и гладкой мускулатуры, стимулируют выделение альгогенных субстанций и активацию ноцицепторов. Возникающая боль, в свою очередь, усиливает эмоциональные нарушения, замыкая таким образом порочный круг. Среди других форм психических расстройств наиболее тесно связанной с хронической болью является депрессия. Возможны различные варианты временных взаимоотношений этих нарушений – они могут возникать одновременно или одно опережать проявления другого. В этих случаях депрессия чаще имеет не эндогенный, а психогенный характер. Взаимоотношения боли и депрессии довольно сложны. У больных с клинически выраженной депрессией снижается болевой порог, и боль считается обычной жалобой у больных с первичной депрессией. У больных с болевым синдромом, обусловленным хроническим соматическим заболеванием, часто также развивается депрессия. Наиболее редкой формой боли при психических заболеваниях является ее галлюцинаторная форма, что наблюдается у больных эндогенными психозами. Психологические механизмы боли включают также и когнитивные механизмы, связывающие боль с условными социальными выгодами, получением эмоциональной поддержки, внимания, любви. Классификация временного аспекта боли различает транзиторную, острую и хроническую боль. Транзиторная боль провоцируется активацией ноцицептивных преобразователей рецепторов кожи или других тканей тела при отсутствии значимого повреждения ткани. Функция такой боли обусловливается скоростью возникновения после стимуляции и скоростью устранения, что указывает на отсутствие опасности повреждающего воздействия на организм. В клинической практике, например, транзиторная боль наблюдается во время внутримышечной или внутривенной инъекции. Предполагается, что транзиторная боль существует для защиты человека от угрозы физического повреждения внешнесредовыми факторами в форме своеобразного обучения. Острая боль – необходимый биологический приспособительный сигнал о возможном (в случае наличия болевого опыта), начинающемся или уже произошедшем повреждении. Развитие острой боли связано, как правило, с вполне определенными болевыми раздражениями поверхностных или глубоких тканей и внутренних органов или нарушением функции гладкой мускулатуры внутренних органов без повреждения тканей. Длительность острой боли ограничивается временем восстановления поврежденных тканей или продолжительностью дисфункции гладкой мускулатуры. Неврологическими причинами острой боли могут быть травматические, инфекционные, дисметаболические, воспалительные и другие повреждения периферической и центральной нервной системы, мозговых оболочек, непродолжительные невральные или мышечные синдромы. Острую боль разделяют на поверхностную, глубокую, висцеральную и отраженную. Эти виды острой боли различаются по субъективным ощущениям, локализации, патогенезу и по причинам. Хроническая боль в неврологической практике – состояние значительно более актуальное. Международная ассоциация по изучению боли рассматривает хроническую боль, как «...боль, которая продолжается сверх нормального периода заживления». На практике это может занимать несколько недель или больше шести месяцев. К хроническим болям можно отнести и повторяющиеся болевые состояния (невралгии, головные боли различного генеза и др.). Дело, однако, заключается не столько во временных различиях, сколько в качественно различающихся нейрофизиологических, психологических и клинических особенностях. Главное в том, что острая боль – всегда симптом, а хроническая боль может становиться по существу самостоятельной болезнью. Понятно, что и терапевтическая тактика при устранении острой и хронической боли имеет существенные особенности. Хроническая боль в своей патофизиологической основе может иметь патологический процесс в соматической сфере и/или первичную, или вторичную дисфункцию периферической или центральной нервной системы, она также может быть вызвана психологическими факторами. Механизмы хронической боли в зависимости от преимущественной роли в ее генезе разных отделов нервной системы разделяют на периферические, центральные, сочетанные периферически–центральные и психологические (Bonica J., 1990). Под периферическими механизмами имеется в виду постоянное раздражение ноцицепторов внутренних органов, сосудов, костно–мышечной системы, самих нервов (ноцицепторы nervi nervorum) и др. Как синоним периферических болей, используется термин «ноцицептивная боль». В этих случаях устранение причины – эффективная терапия ишемического и воспалительного процесса, артропатического синдрома и др. так же, как и местная анестезия, приводит к избавлению от боли. Периферически–центральный механизм наряду с участием периферического компонента предполагает связанную с ним (и/или им обусловленную) дисфункцию центральных ноцицептивных и антиноцицептивных систем спинального и церебрального уровня. При этом длительно продолжающаяся боль периферического происхождения может быть причиной дисфункции центральных механизмов, что обусловливает необходимость максимально эффективного устранения периферической боли. Общие принципы лечения боли предусматривают клиническую оценку состояния нейрофизиологических и психологических компонентов ноцицептивной и антиноцицептивной систем и воздействие на все уровни организации этой системы. 1. Устранение источника боли и восстановление поврежденных тканей. 2. Воздействие на периферические компоненты боли – соматические (устранение воспаления, отека и др.) и нейрохимические стимуляторы болевых рецепторов; наиболее отчетливый эффект при этом имеют препараты, влияющие на синтез простагландинов (ненаркотические анальгетики, парацетамол, нестероидные противовоспалительные средства) и обеспечивающие снижение концентрации вещества P в терминалях волокон, проводящих болевую импульсацию (препараты стручкового перца для наружного применения). 3. Торможение проведения болевой импульсации по периферическим нервам и в УЗК (введение локальных анестетиков, алкогольная и феноловая денервация, перерезка периферических нервов, ганглиэктомия). 4. Воздействие на процессы, происходящие в задних рогах. Кроме аппликаций препаратов стручкового перца, снижающих концентрацию СP в задних рогах, используют ряд других способов терапии: а) введение опиатов системно или локально (эпидурально или субдурально), что обеспечивает усиление энкефалинергического торможения болевой импульсации; б) электростимуляция и другие методы физической стимуляции (физиопроцедуры, акупунктура, чрескожная электронейростимуляция, массаж и др.), вызывающие торможение ноцицептивных нейронов заднего рога путем активации энкефалинергических нейронов; в) применение препаратов, воздействующих на ГАМК–ергические структуры; г) применение противосудорожных препаратов (карбамазепин, ламотриджин, вальпроаты и бензодиазепины), тормозящих проведение нервных импульсов по чувствительным нервам и обладающих агонистическим действием на ГАМК–ергические рецепторы нейронов задних рогов и клеток ядра спинномозгового пути тройничного нерва. Эти препараты особенно эффективны при невралгиях; д) применение препаратов агонистов a2– адренорецепторов – клонидин и др.; е) использование блокаторов обратного захвата серотонина, повышающих концентрацию этого нейротрансмиттера в ядрах ретикулярной формации мозгового ствола, от которых исходят нисходящие тормозящие пути, воздействующие на интернейроны заднего рога (флуоксетин, амитриптилин). 5. Воздействие на психологические (и одновременно на нейрохимические) компоненты боли с применением психотропных фармакологических препаратов (антидепрессанты, транквилизаторы, нейролептики); использование психотерапевтических методов. 6. Устранение симпатической активации при соответствующих хронических болевых синдромах (симпатолитические средства, симпатэктомия). Лечение болей подразумевает применение четырех основных классов препаратов: опиатов, нестероидных противовоспалительных препаратов (НПВП), простых и комбинированных анальгетиков. Для купирования болевого синдрома используются опиатные анальгетики: морфина гидрохлорид, бупринорфин, буторфанол, меперидин, налбуфин и др. Для консервативного лечения болевых синдромов широко используется трамадол (Трамал). Препарат относится к категории неселективных агонистов опиоидных m-, k- и d- рецепторов в ЦНС с наибольшим сродством к m-рецепторам, однако слабее, чем у морфина. Поэтому в рекомендуемых в инструкции дозах препарат не приводит к угнетению дыхания и кровообращения, нарушению моторики ЖКТ и мочевыводящих путей, а при длительном применении не вызывает угнетения дыхания, кровообращения и не приводит к развитию лекарственной зависимости. Кроме того, Трамал обладает свойством обратного захвата норадреналина и усиления высвобождения серотонина, благодаря чему нарушается передача болевых импульсов в желатиновую субстанцию спинного мозга. Согласно критериям ВОЗ о трехступенчатой терапии боли, препарат находится на второй ступени и является особо эффективным для купирования умеренных и сильных болей различного генеза (в т.ч. при злокачественных опухолях, остром инфаркте миокарда, невралгиях, травмах). Используется в инъекционной форме (для взрослых в/в или в/м разовая доза – 50–100 мг), для орального применения (разовая доза 50 мг) и в форме ректальных свечей (100 мг). Максимальная суточная доза препарата 400 мг. В остром периоде болевого синдрома наиболее эффективным является сочетанное применение НПВП и опиатов (трамадол). Кроме того, применение трамадола показано при противопоказаниях или отсутствии эффекта НПВП. При лечении хронических болевых синдромов препаратами первого ряда являются трициклические антидепрессанты, среди которых наибольшее распространение получил неселективный ингибитор обратного захвата амитриптилин. Препаратами следующего ряда являются антиконвульсанты ГАМК–агонисты: производные вальпроевой кислоты, габапентин, ламотриджин и др. Применение ансксиолитиков производных фенатиозина потенцирует действие опиатов; бензодиазепинов – способствует миорелаксации. Указанные препараты и методы могут применяться в зависимости от конкретной клинической ситуации отдельно или, что бывает чаще, при неврогенных болях, сочетанно. Отдельным аспектом проблемы боли является тактика ведения больных. Имеющийся на сегодня опыт доказал необходимость обследования и лечения больных с острыми и особенно хроническими болями в специализированных центрах стационарного или амбулаторного типа. В связи с большим разнообразием видов и механизмов болей даже при аналогичном основном заболевании реально существует необходимость участия в их диагностике и лечении различных специалистов – неврологов, анестезиологов, психологов, клинических электрофизиологов, физиотерапевтов и др. Только комплексный междисциплинарный подход к изучению теоретических и клинических проблем боли может решить назревшую задачу нашего времени – избавление людей от страданий, связанных с болью. |
|
|
Вестник Смоленской медицинской академии, 2003, № 4
ДЛЯ СТУДЕНТОВ, АСПИРАНТОВ, ОРДИНАТОРОВ
УДК 612 (075.8)
ФИЗИОЛОГИЯ БОЛИ и ОБЕЗБОЛИВАЮЩЕЙ СИСТЕМЫ ОРГАНИЗМА
В. А. Правдивцев, С. Б. Козлов, С. В. Ефременков, Л. П. Нарезкина, Н. М. Осипов, А. В. Евсеев, Л. Ю. Путенкова, В. М. Остапенко
Смоленская государственная медицинская академия
Болевой анализатор – комплекс периферических и центральных структур нервной системы, обеспечивающий восприятие, переработку болевой импульсации, а также инициирующий приспособительные реакции, направленные на устранение или минимизацию действия боли на организм. В целостной болевой реакции можно выделить относительно самостоятельные компоненты (Р. Шмидт, Л. В. Калюжный). Прежде всего, это перцептуальный (сенсорный, или сенсорно-дискриминативный) компонент, отражающий возникновение ощущения боли. Далее, это – негативно-эмоциональный компонент в виде страдания, тягостных переживаний, формирующихся на основе распространения генерализованных возбуждений подкорковых гипоталамо-ретикулярных образований к структурам лимбической, лобной и теменной коры головного мозга. Далее, вегетативный компонент, отражающий активированный статус основных вегетативных центров ствола мозга, проявляющийся в изменениях деятельности почти всех вегетативных эффекторов. Наконец, двигательный компонент, выступающий в виде рефлекса избегания, локального или генерализованного напряжения определенных групп мышц, в других формах двигательной активности организма.
Причины возникновения болевой реакции. Боль у человека возникает всякий раз, когда сверхсильные механические, термические раздражители, действуя на живые ткани, разрушают или создают угрозу разрушения целостности их защитных покровных оболочек. Второй причиной возникновения боли является нарушение процессов тканевого дыхания. Например, боль всегда сопровождает ишемию, при этом она тем сильнее, чем выше уровень функциональной активности ткани. Так, в сокращающихся скелетных мышцах верхних конечностей при пережатии их артериальных сосудов манжеткой боль появляется через 15-25 с. В отсутствии сокращений боль появляется через 3-4 мин. Причиной возникновения боли при остром нарушении кровообращения являются расстройство микроциркуляции, кислородное голодание клеток, активация циклов анаэробного дыхания, постепенное накопление в межклеточном пространстве органических кислот, разрушение клеток, появление в межклеточном пространстве протеолитических ферментов, биологически активных веществ тканевого или плазменного происхождения. Как выяснилось, многие химические вещества, постепенно накапливающиеся в тканях при кислородном голодании, оказывают прямое раздражающее влияние на тканевые образования, вызывая у человека ощущения боли.
Типы болевых ощущений и их характеристика. По критерию места возникновения боль разделяют на соматическую и висцеральную. Боль, возникающая в коже, получила название соматической поверхностной боли. Её примером является боль, вызываемая введением инъекционной иглы под кожу человека. В чувственной картине такой боли выделяют два компонента. Первый – «быстрый», непродолжительный, легко локализуемый компонент, отражающий ощущение четкой, яркой боли, возникающей с латентным периодом порядка 0,1 с. Второй – «медленный», поздний, плохо локализуемый компонент, отражающий ощущение тупой боли, возникающей с латентным периодом порядка 1 с и более, постепенно увеличивающейся по выраженности в течение нескольких секунд или минут.
Боль, возникающая в мышцах, суставах, суставных связках, костных образованиях, получила название соматической глубокой боли. Типичным примером такой боли является зубная (дентальная) боль. Глубокая боль почти всегда плохо локализуется. Так, зубная боль, вызванная развитием патологического процесса в зубе, может обнаруживать себя первично в различных участках лица, шеи, головы.
Висцеральная боль по своим качественным характеристикам во многом совпадает с глубокой соматической болью. Основные причины ее возникновения: 1) ишемия тканей, приводящая к накоплению метаболитов и нарушению тканевого дыхания; 2) выход содержимого полых органов при повреждении целостности их стенок (например, выход содержимого аппендикса в брюшную полость при его воспалении и разрыве); 3) cильные тонические сокращения или растяжения мышц желудка, желчного пузыря, кишечника, мочевого пузыря, мочеточников.
По критерию продолжительности во времени различают боль острую, подострую и хроническую. Острая – внезапно возникающая боль. В практике врача-стоматолога острую боль можно вызвать у больного в ходе обследования кариозной полости пораженного зуба металлическим зондом. Острая боль обычно имеет предупредительное, т. е. сигнальное значение. Хроническая – длительная, долго сохраняющаяся или регулярно повторяющаяся боль разной интенсивности. Примером такой боли могут служить определенного вида головные боли, боли в спине при остеохондрозе, при опухолях на поздних стадиях их развития. Подострая боль – занимает промежуточное положение по своим характеристикам между острой и хронической видами боли. Здесь же отметим мгновенную, приступообразную, непрерывную, пульсирующую виды боли, отражающие субъективное качественное восприятие интенсивности боли в пределах некоторого временного интервала.
По критерию отношения боли к причинным факторам ее возникновения – различают боль физическую и психогенную. Физическая боль возникает в результате влияния на тканевые структуры организма неких конкретных внешних или внутренних факторов различной природы. В отличие от физической психогенная боль является следствием нарушения психических функций человека, возникая как страдание по поводу некоего «болящего» органа (Р. Шмидт), функциональные характеристики которого при объективной оценке не выходят за пределы физиологической нормы.
Рецепторные аппараты, воспринимающие боль. Представления о неспецифической природе болевых ощущений, в соответствии с которыми боль возникает при «чрезмерном раздражении любых сенсорных рецепторов», в настоящий момент практически оставлены, т. к. получены убедительные доказательства того, что боль возникает в результате воздействия раздражителей на специализированные высокопороговые болевые рецепторы, или ноцицепторы (от латинского nocere - разрушать).
Гистологически ноцицепторы кожи, слизистых, фасций, сухожилий, скелетных мышц, надкостницы, суставных поверхностей, адвентициальной оболочки мелких кровеностных и лимфатических сосудов (близ просвета), эндоневрия нервных стволов, мозговых оболочек, тканей внутренних органов представляют собой свободные – неинкапсулированные окончания нервных волокон, имеющие разнообразную форму волосков, сплетений, спиралей, пластинок.
Большое число ноцицепторов – «болевых точек» можно насчитать на поверхности кожи. Оно намного превышает число рецепторов прикосновения, тепла, холода. Наибольшая плотность кожных ноцицепторов у человека отмечается в паховой области – 100-200 на 1 см2 , на ладони, кончике носа, на поверхности уха их меньше – всего 40-70 на 1 см2 . Очень много свободных нервных окончаний сосредоточено в пульпе зуба. Не случайно, даже не очень сильная электрическая или механическая стимуляция пульпы зуба у человека сопровождается отчетливыми болевыми ощущениями. В целом количество ноцицепторов в тканях зуба достигает очень больших величин. Так, в пересчете на 1 см2 на границе соприкосновения эмали и дентина располагается примерно 75000 ноцицепторов. Интересно, что на слизистой полости рта есть участок, практически не имеющий ноцицепторов. Он тянется от второго коренного зуба к углу рта на внутренней поверхности щеки в виде узкой полосы. Топография болевой чувствительности слизистой оболочки полости рта представлена на рис. 1.
Физиологические свойства ноцицепторов. Большинство ноцицепторов реагируют на механические, термические и химические раздражители. Обычно «быстрая» боль вызывается механическими и термическими болевыми раздражителями. «Медленная» боль вызывается тремя видами болевых раздражителей – механическими, термическими и химическими болевыми раздражителями. Функционально основная часть болевых рецепторов различных тканевых структур человека представляет собой мультимодальные ноцицепторы (Л. Н. Смолин). К ним относятся кожные механотермоноцицепторы, подкожные механотермоноциценторы, механотермохемоноцицепторы, механохемоноцицепторы мышц, внутренних паренхиматозных органов. Мономодальные ноцицепторы (механоноцицепторы, термоноцицепторы) встречаются редко.
Электрофизиологический механизм возникновения рецепторных потенциалов ноцицепторов изучен недостаточно. Высказываются предположения, что в случае механического воздействия на мембрану ноцицептора рецепторный потенциал возникает в результате деформации и растяжения фрагмента мембраны, активирующих перенос катионов натрия внутрь ноцицептора. Возможна и иная схема возникновения рецепторного потенциала. Предполагается, что под влиянием механического воздействия из терминалей сенсорной клетки выделяется медиаторное вещество. В последующем оно реагирует со специфическими хеморецепторами мембраны ноцицептора, запуская генерацию рецепторного потенциала (рис. 2). В случае термического воздействия – формирование рецепторных потенциалов протекает, очевидно, также с участием медиаторного вещества, выделяющегося из терминалей сенсорной клетки в ответ на изменение интенсивности метаболических реакций под влиянием температуры. Медиаторное вещество вступает в реакцию с хеморецепторами, запуская генерацию рецепторного потенциала, при этом динамика развития рецепторного потенциала, отражающая скорость взаимодействия медиаторного вещества с хеморецепторами и предопределяющая частоту возникающих потенциалов действия, по-видимому, модулируется температурным воздействием на ноцицептор (А. Гайтон, Дж. Холл).
Рис. 1. Топография болевой чувствительности слизистой полости рта. 1– участок максимальной чувствительности верхней челюсти; 2 – участок отсутствия болевой чувствительности; 3 – участок максимальной чувствительности нижней челюсти.
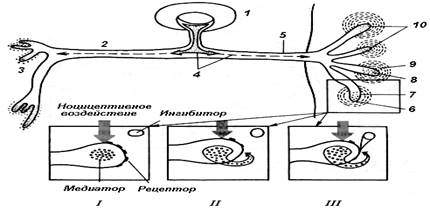
Рис. 2. Механизм возможной активации ноцицептора под влиянием сильного механического воздействия. (По Ф. Лембеку, П. Холтону, Дж. Генри, В. Г. Зилову, В. И. Бадикову и др., с изменениями).
В теле сенсорного нейрона (1) синтезируется нейротрансмиттер (вещество П), доставляемый по центральному отростку (2) и периферическому отростку (5) сенсорного нейрона к центральным синапсам (3) и к периферическим свободным нервным окончаниям (6), выполняющих функцию ноцицепторов. Под влиянием сильного механического стимула происходит выделение нейротрансмиттера (8) из нервных окончаний (10) с последующим взаимодействием с рецепторами (7) их мембраны. Возникающие потенциалы действия передаются в ЦНС, фермент-ингибитор (9) разрушает нейротрансмиттер. I, II, III – этапы взаимодействия нейротрансмиттера и фермента-ингибитора.
При воспалительных реакциях ощущение боли у человека обычно возникает в результате активации ноницепторов химическими веществами – алгогенами, действующими, как выяснилось, и на ноцицептор, и на проводниковую мембрану сенсорного нейрона в составе своеобразного химического конвейера. В него входят тканевые алгогены, появляющиеся в результате разрушения тканевых структур (гистамин, серотонин, простагландины, катионы калия и т. д.), а также плазменные алгогены, появляющиеся в результате выхода в межклеточное пространство компонентов крови, катализирующих механизм образования кининов – в первую очередь каллидина и брадикинина, в значительной степени усиливающих активацию ноцицепторов. Подчеркнем, что алгогены всех типов отчетливо угнетают клеточное дыхание. Это обстоятельство допускает возможность существования некоего общего механизма раздражающего влияния алгогенов на ноницепторы избыточными концентрациями катионов водорода.
Несмотря на то, что при экспериментальном изучении электрофизиологической активности ноцицепторов иногда удается показать феномен их адаптации (Л. Н. Смолин) к действию болевого раздражителя, субъективный опыт, клиническая практика, свидетельствуют о том, что практически адаптации к боли не наблюдается. В частности, головная боль, зубная боль могут длиться часами без малейших признаков видимого изменения.
Передача болевой импульсации от ноцицепторов в ЦНС осуществляется тонкими миелинизированными волокнами типа Аδ (группа III) и тонкими немиелинизированными волокнами типа С (группа IV) – по классификации Гассера. Скорость проведения возбуждения по Аδ–волокнам составляет 2,5–30 м/с, скорость проведения возбуждения по С–волокнам составляет 0,5–2 м/с. Общее число волокон типа Аδ намного меньше волокон типа С, что свидетельствует о том, что последним отводится главная роль в обеспечении связи ноцицепторов с ЦНС.
Доказательства участия волокон Аδ и С в передаче болевой импульсации были получены в ходе оценки ощущений у испытуемых при градуальной электрической стимуляции кожных нервов. Оказалось, что возбуждение низкопороговых миэлинизированных волокон типа Аβ не сопровождается возникновением ощущения боли, тогда как отчетливые болевые ощущения появляются при усилении воздействия, достаточного для возбуждения волокон типа Аδ и С. В таких опытах удалось показать, что «быстрая», точно локализованная поверхностная кожная боль обеспечивается проведением возбуждения по Аδ–волокнам, тогда как «медленная», тупая, субъективно неприятная боль обеспечивается проведением возбуждения по С– волокнам. Ноцицепторы лица, туловища, скелетных мышц, сухожилий, суставных сумок передают импульсацию в ЦНС по волокнам Аδ и С. Большинство волокон ноцицепторов внутренних органов, пульпы зуба передают импульсацию в ЦНС исключительно по волокнам типа С.
Проводящие пути болевой чувствительности. Болевая импульсация по волокнам Аδ поступает в задние рога спинного мозга (рис. 3), где в поверхностном слое (краевая зона) происходит переключение на нейрон второго порядка. Предполагается, что передача возбуждения здесь обеспечивается глютаминовой кислотой – одним из наиболее распространенных медиаторов ЦНС. Далее, аксоны нейронов второго порядка переходят на противоположную сторону, направляясь в ствол мозга в составе переднего спиноталамического (неоспиноталамического) тракта. На своем пути в стволе мозга волокна переднего спиноталамического тракта отдают коллатерали к ядрам стволовой ретикулярной формации. В дальнейшем они вступают в таламус, где происходит переключение на нейроны специфического сенсорного комплекса ядер вместе с волокнами дорзальных столбов, формирующих медиальную петлю и обеспечивающих передачу возбуждения от проприорецепторов, а также рецепторов прикосновения кожи лица, туловища, конечностей.
С–волокна вступают в задние рога спинного мозга в составе задних корешков (рис. 3). В области желатинозной субстанции меньшая часть волокон переключается на вставочные нейроны, тогда как большая часть направляется дальше, переключаясь на нейроны задних рогов, аксоны которых переходят на противоположную сторону, направляясь в ствол мозга в составе латерального спиноталамического (палеоспиноталамического) тракта. Предполагается, что окончания С–волокон, контактирующие с нейронами спинного мозга, выделяют два медиаторных вещества – глютаминовую кислоту и субстанцию Р. Глютаминовая кислота действует исключительно быстро, реализуя свой специфический эффект на клетку-мишень в течение нескольких миллисекунд, тогда как, субстанция Р реализует свои эффекты весьма медленно из-за того, что наращивание ее эффективной концентрации осуществляется в течение секунд или даже минут (А. Гайтон, Дж. Холл).
Волокна латерального спиноталамического тракта на уровне ствола мозга вступают в контакт с различными нейронными структурами. Среди них – серое околоводопроводное вещество, ядра тектальной области, ядра ретикулярной формации продолговатого мозга, моста, среднего мозга. Многократно переключаясь на ретикулярных нейронах с короткими аксонами, возбуждения в последующем направляются преимущественно в неспецифические (интраламинарные) ядра таламуса. Частично эти возбуждения направляются в специфические (вентролатеральные) ядра таламуса, а также в структуры гипоталамуса и других подкорковых образований мозга. 10-20% волокон латерального спиноталамического тракта вступают в неспецифические ядра таламуса, проходя ствол мозга транзитом – без переключений.
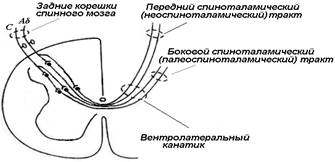
Рис. 3. Передача болевых возбуждений по волокнам типа Аδ и С на уровне нейронов спинного мозга.
Проводящие пути болевой чувствительности от органов челюстно-лицевой области. Болевая импульсация от кожи лица, слизистой полости рта, периодонта, пульпы зуба (рис. 4) по волокнам Аδ («быстрая» боль) и С («медленная» боль) в составе тройничного нерва направляется в продолговатый мозг, где они в основном заканчиваются на нейронах ядра спинального тригеминального тракта. Часть волокон подходит к ядрам ретикулярной формации продолговатого мозга, а также к ядрам шва. Выходные нейроны ядра спинального тригеминального тракта образуют несколько восходящих трактов. Их них «быстрая» болевая импульсация, возникающая при действии механических раздражителей на ноцицепторы самых различных структур челюстно-лицевой области, проводится по вентральному и дорзальному тригемино-таламическим трактам, заканчивающихся на нейронах специфических ядер и, частично, на нейронах неспецифических ядер таламуса. Главная роль в проведении «медленной» болевой импульсации от органов челюстно-лицевой области отводится тригемино-ретикуло-таламическому тракту, обеспечивающего генерализованную передачу болевой импульсации через нейронные сети ретикулярной формации к ядрам неспецифического таламуса, а также к структурам лимбико-гипоталамической области головного мозга. Таким образом, можно отметить, что принципиальных различий в организации проведения болевой импульсации от органов челюстно-лицевой области и прочих участков тела человека не имеется.
Участие коры больших полушарий в формировании болевых ощущений. На основании ряда экспериментальных данных казалось очевидным, что ведущими центрами болевой чувствительности организма являются ретикулярная формация ствола мозга, гипоталамус. Конечной собирательной инстанцией болевой импульсации рассматривался таламус, а не кора головного мозга. Один из аргументов в пользу таких представлений основывался на результатах наблюдений над животными, у которых полностью удалялись соматосенсорные корковые поля. Как выяснилось, животные после операции в ответ на действие болевых раздражителей демонстрировали признаки «переживания» боли почти во всех компонентах. В дальнейшем было показано, что электрическая стимуляция ядер ретикулярной формации, неспецифических ядер таламуса усиливают вегетативные, гормональные, соматические проявления болевой активации оперированных животных. Следовательно, можно было заключить, что корковые структуры в реакциях организма на болевые раздражители функционально выполняют преимущественно вспомогательные функции выделения участков тела, выступающих источником болевой импульсации, оценки качества боли, ее специфического «портрета». Тщательное изучение вопроса привело к пониманию того, что роль коры головного мозга оказывается гораздо сложнее.
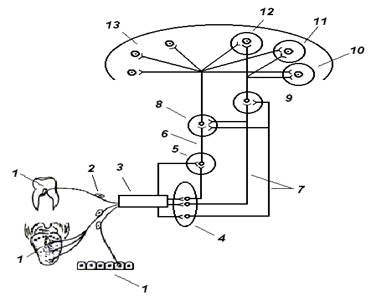
Рис. 4. Схема, иллюстрирующая восходящие болевые (ноцицептивные) пути (волокна типа С) от органов челюстно-лицевой области (По Ю. П. Лиманскому, С. М. Будылиной, В. П. Дегтяреву, с изменениями).
1– ноцицепторы пульпы, языка, слизистой оболочки, кожи лица; 2 – сенсорные клетки гассерова ганглия; 3 – сенсорный корешок тройничного нерва; 4 – ядро спинального тригеминального тракта; 5 – ретикулярная формация; 6 – тригемино–ретикуло–таламический тракт; 7 – вентральный и дорзальный (ипсилатеральный) тригемино-таламические тракты; 8 – неспецифические ядра таламуса; 9 – специфические ядра таламуса; 10 – орбитофронтальная область коры; 11 – поле С1; 12 – Поле С2; 13 – генерализованные (неспецифические) таламо-кортикальные проекции.
В частности, было установлено, что изолированное повреждение корковых областей в глубине теменной части центральной борозды человека вызывает устойчивую нечувствительность к боли (частичную или полную) в контралатеральной половине тела (Р. Шмитд). Эти данные совпали с данными, полученными при проведении нейрохирургических вмешательств, сопровождавшихся локальной электрической стимуляцией глубинных участков теменной части центральной борозды. Оказалось, что такая стимуляция всегда сопровождалась отчетливыми ощущениями боли, что ранее отрицалось. Таким образом, стало ясным, что полноценное чувственное восприятие боли организмом без участия коры головного мозга является невозможным. Этот вывод представляется важным в контексте приоритетной роли коры головного мозга в привязке биологически отрицательных эмоциональных состояний к организации целенаправленных поведенческих актов, освобождающих организм от такого рода состояний (К. В. Судаков).
С точки зрения имеющейся на сегодняшний день информации частные функции корковых проекционных полей болевого анализатора сводят к следующему.
Первичное соматосенсорное проекционное поле (С1) – обеспечивает восприятие «быстрой» боли, идентификацию места ее возникновения на теле. Интересно, что абсолютно точная идентификация участка кожной поверхности, на которую действует болевой раздражитель, требует параллельного вовлечения в процесс кожных тактильных рецепторов. Показано, что без подключения кожных тактильных рецепторов показатели идентификации болевого участка на коже значимо ухудшаются. Полю С1 отводится ведущая роль в экстренном включении моторной защитной реакции организма в ответ на действие болевого раздражителя. Морфологически и функционально соответствующие моторные реакции обеспечиваются прямыми синаптическими связями нейронов поля С1 с нейронами моторной коры. Ощущения «медленной» боли обычно идентифицируются плохо. Испытуемый в опыте или пациент в клинике чаще всего сообщают, что боль возникает в «руке», в «ноге», в «затылке» и т. д. Невозможность четко локализовать «медленную» боль объясняется тем, что пути ее проведения представляют в основном мультисинаптические нейронные цепи ретикулярной формации, неспецифических ядер таламуса, генерализованно передающие возбуждения в самые различные корковые поля, в том числе в поля С1 и С2 болевого анализатора.
Вторичное соматосенсорное проекционное поле С2 располагается на границе пересечения центральной борозды с верхним краем височной доли. Нейроны данного поля имеют двусторонние связи с ядрами таламуса. Это позволяет полю С2 избирательно фильтровать проходящие через таламус возбуждения, прежде всего болевого происхождения. После их выделения, представления в специфических паттернах импульсной активности входных нейронов выходные нейроны поля С2 в дальнейшем вовлекаются в многостадийные процессы системной деятельности мозга, связанные с извлечением из памяти энграммы потребного поведенческого акта, его реализации на эффекторах, оценки качества достигнутого в поведении полезного результата.
Антиноцицептивная (обезболивающая) система. В ходе алгезиметрии – выведения зависимости между силой потенциально болевого раздражителя, действующего на человека, и характером вызываемой у него субъективной реакции было показано, что ощущения боли впервые обнаруживаются при некоторой минимальной силе раздражителя, получившей название болевого порога. Сила раздражителя, при которой испытуемый просит прекратить его действие из-за невыносимой боли, получила название порога болеустойчивости.
Детальное изучение вопроса о способности испытуемых переносить болевые воздействия в разных вариантах опытов по алгезиметрии, психологические, клинические наблюдения представили убедительные доказательства того, что при некоторых изменениях общего состояния испытуемых у них наблюдается варьирование болевых порогов, а также порогов болеустойчивости. В ряде случаев это – гипералгезия, характеризующаяся снижением болевого порога, порога болеустойчивости, но часто это – гипоалгезии, характеризующаяся повышением болевого порога, порога болеустойчивости вплоть до аналгезии, т. е. полной нечувствительности к боли. Исследования, проведенные на животных и человеке с целью уточнения функциональных особенностей различных подкорковых образований ЦНС при электрической стимуляции ядер промежуточного, среднего, продолговатого мозга показали, что часто следствием стимуляции подкорковых ядер была достоверная гипоалгелзия или аналгезия. Собранные воедино факты позволили высказать предположения, что активность структур, относящихся к болевому анализатору, может изменяться некими центральными механизмами, обладающими способностью редуцировать болевые импульсации, перемещающиеся в ЦНС, вплоть до низведения их на уровень, при котором возникают состояния гипоалгезии и аналгезии. Соответствующий комплекс механизмов получил название эндогенной антиноцицептивной (обезболивающей) системы.
В течение последних 35 лет накопилось большое количество данных, продемонстрировавших актуальность нового направления в физиологии, связанного с рассмотрением вопросов функционирования антиноцицепивной системы. Дополнительным толчком к изучению частных принципов ее работы, внутренней архитектоники явилось открытие в ЦНС опиатных рецепторов – участков связывания препаратов опия. Было известно, что препараты опия (морфин, его производные), взаимодействуя с опиатными рецепторами, вызывают состояние аналгезии. Открытие опиатных рецепторов интенсифицировало поиск эндогенных, т. е. естественных, аналогов морфина, вырабатываемых клетками самого организма. В конечном итоге эндогенные опиоиды были обнаружены. Ими оказались пептиды – продукты протеолиза гипофизарного гормона бета-липотропина, получившие название эндорфинов (альфа, бета, гамма), энкефалинов (метионин-энкефалин, лейцин-энкефалин), динорфинов. Анализ свойств эндорфинов, энкефалинов, динорфинов показал, что они, как и морфин, угнетают действие веществ (простагландины, брадикинин и др.), вызывающих активацию ноцицепторов, уменьшают возбудимость и проводимость проводников болевой импульсации, угнетают вызванную реакцию нейронов, находящихся в составе цепей, опосредующих передачу болевой импульсации. Наряду с констатацией уникальных свойств эндогенных опиоидов, получением доказательств того, что они выделяются в окончаниях пептидергических нейронов, в разных экспериментах была установлена причастность к антиноцицептивным механизмам серотонинергических, норадренергических, дофаминергических нейронов, а также нейротензина, ангиотензина, окситоцина, холецистокинина, других биологически активных веществ. Все вместе взятое подтвердило правильность исходных гипотез об антиноцицептивной системе как совокупности гетерогенных механизмов ЦНС, фактически выступающих составной частью ноцицептивной системы организма, т. е. системы болевого анализатора.
Стволовые механизмы антиноцицептивной системы. В первую очередь к стволовым механизмам антиноцицептивной системы относятся механизмы центрального серого околоводопроводного вещества (ЦСОВ) и ядер шва (ЯШ), образующие единый функциональный блок. Доказано, что изолированная электрическая стимуляция ЦСОВ–ЯШ блокирует прохождение болевой импульсации на уровне релейных нейронов ядер задних рогов спинного мозга, а также релейных нейронов сенсорных ядер тройничного нерва.
Специфические влияния ЦСОВ-ЯШ на ядра–мишени (рис. 5) реализуются нисходящими волокнами, большинство из которых в своих окончаниях выделяют серотонин (СТ), вызывающий ТПСП на релейных нейронах и ВПСП на энкефалинергических вставочных нейронах ядер–мишеней. Вовлечение энкефалинергических нейронов, располагающихся в непосредственной близости от релейных, включает дополнительные механизмы пост– и пресинаптического торможения, что приводит к существенному удлинению тормозного состояния релейных нейронов в сравнении с тем, что обеспечивается серотонином.
Отметим, что пусковые угнетающие влияния ЦСОВ-ЯШ на передачу болевой импульсации не сводятся исключительно к серотонинергическим механизмам, т. к. около 15% нейронов ЦСОВ-ЯШ в окончаниях своих аксонов выделяют не серотонин, а энкефалины (Эн), вещество П (ВП), ацетилхолин (АХ), другие вещества, очевидно выполняющих функции модуляторов синаптической передачи в нейронных объединениях ядер–мишеней. Кроме ЦСОВ-ЯШ в состав антиноцицептивных механизмов стволового уровня входят крупноклеточное, парагигантоклеточное ядра ретикулярной формации продолговатого мозга и голубое пятно. Все они морфологически связаны между собой, с комплексом ЦСОВ-ЯШ прямыми и обратными связями.
Необходимо подчеркнуть, что хотя аксоны ядер ретикулярной формации, голубого пятна обнаруживаются в задних рогах спинного мозга, наибольшая их плотность наблюдается в местах расположения сенсорных ядер тройничного нерва. Показано, что стимуляция парагигантоклеточного ядра ретикулярной формации, стимуляция голубого пятна подавляют ответы нейронов тройничных сенсорных ядер, вызванных болевыми стимулами. Механизмы подавления ответов – пост– и пресинаптические за счет энкефалинергических (со стороны аксонов парагигантоклеточного ядра) и норадренергических (со стороны аксонов голубого пятна) влияний на рецепторы соматической мембраны нейронов, а также рецепторы мембраны пресинаптических С–волокон. Особенностью норадренергических антиноцицептивных механизмов ствола мозга является привнесение большей избирательности в процесс угнетения передачи болевой импульсации в сравнении с качеством угнетения за счет ЦСОВ-ЯШ. Последние блокируют импульсации не только болевого, но и неболевого характера.
Каким образом в обычных условиях активируются стволовые механизмы антиноцицептивной системы, какова их функциональная роль? Одна из гипотез приспособительную активность стволовых механизмов антиноцицепции связывает с управлением интенсивности восходящего болевого потока в условиях усиления его на входе в ЦНС. Так, в случаях возрастания силы болевого воздействия усиливающийся поток импульсаций по волокнам спинно-таламических, тригемино-таламичесих трактов активирует за счет коллатералей нейроны гигантоклееточного ядра ретикулярной формации (рис. 5). Последнее возбуждает почти весь комплекс антиноцицептивных механизмов ствола мозга. В итоге – включаются нисходящие механизмы ограничения поступления избыточной болевой импульсации в ЦНС. Фактически в данной ситуации мы сталкиваемся с проявлением модуляции физиологического процесса отрицательной обратной связью (Р. Шмидт).
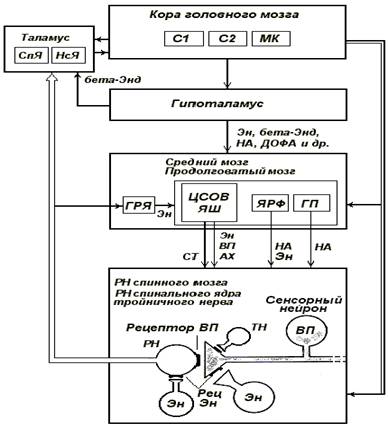
Рис. 5. Упрощенная схема, иллюстрирующая основные механизмы антиноцицептивной системы.
С1, С2 – соматосенсорные проекционные поля коры 1 и 2; МК – моторная область коры; СпЯ – специфические ядра таламуса; НсЯ – неспецифические ядра таламуса; ГРЯ – гигантоклеточное ядро ретикулярной формации; ЦСОВ – центральное серое околоводопроводное вещество; ЯШ – ядра шва; ЯРФ – ядра ретикулярной формации продолговатого мозга; ГП – голубое пятно; АХ – ацетилхолин; бета-Энд –бета-эндорфин; ВП – вещество П; ДОФА – дофамин, НА– норадреналин; СТ – серотонин; РН – релейный нейрон; РецЭн – рецептор Эн (опиатный рецептор); ТН – тормозные нейроны, реализующие постсинаптическое торможение под влиянием серотонина, норадреналина и т. д. ; Эн – энкефалинергический нейрон;
Гипоталамические механизмы антиноцицептивной системы. Гипоталамические механизмы – с одной стороны функционируют самостоятельно, с другой – выступают как надстройка, контролирующая и регулирующая антиноцицептивные механизмы стволового уровня за счет связей гипоталамических нейронов разной ядерной принадлежности и разной нейрохимической специфичности. Среди них идентифицированы нейроны, в окончаниях аксонов которых выделяются энкефалины, бета-эндорфин, норадреналин, дофамин.
Известно, что многие гипоталамические ядра входят в зоны, стимуляция которых вызывает эмоционально окрашенные состояния – положительные и отрицательные (Дж. Олдс, Ю. А. Макаренко). Как оказалось, раздражение зон положительного подкрепления (дорзомедиальное ядро гипоталамуса) вызывает гипоалгезию – частично, за счет энкефалинергических влияний, повышающих активность антиноциптивных механизмов стволового уровня, частично за счет бета-эндорфинергических влияний, угнетающих передачу болевой импульсации через неспецифические ядра таламуса. Раздражение зон отрицательного подкрепления (вентромедиальное ядро), как и натуральные состояния агрессии, тоски, страха (стрессовые состояния) также сопровождаются гипоалгезией, в ряде случаев – аналгезией. Показано, что применительно к этим ситуациям первостепенная роль в возникновении состояний гипоалгезии, аналгезии отводится активации норадренергических и дофаминергических механизмов. Интересно, что всегда отмечаемый при стрессе выброс в кровь из передней доли гипофиза АКТГ, всегда сопровождается параллельным выбросом также из передней доли гипофиза бета-эндорфина (Ф. Блюм). Бета-эндорфин, реализуя свои влияния гуморально, оказывает угнетающее влияние на активность ноцицепторов, а также нейронов большинства каналов передачи болевой импульсации в ЦНС, внося дополнительный вклад в поддержание гипоалгезии или аналгезии гипоталамического происхождения при стрессе.
Корковые механизмы антиноцицептивной системы. Нисходящие волокна коркового контроля болевой чувствительности, направляющиеся к задним рогам спинного мозга, сенсорным ядрам тройничного нерва, берут начало в различных областях моторной, орбитальной коры, в полях С1, С2, при этом наибольшее число волокон составляют аксоны нейронов, локализованных в поле С2.
В целом кортикофугальные влияния на ядра-мишени проявляют себя по-разному. Они могут оказывать возбуждающие моносинаптические влияния на выходные нейроны ядер-мишеней, однако преобладают пост- и пресинаптические тормозные влияния на эти нейроны, в особенности на нейроны, контактирующие с афферентами С–типа. Помимо прямых влияний на ядра спинного мозга, тройничного нерва, поле С2 контролирует их активность опосредованно, видоизменяя активность стволового комплекса антиноцицептивной системы. Нельзя не отметить специфическую роль моторных, соматосенсорных полей коры мозга в контроле проведения афферентных импульсаций через таламус. В экспериментах, проведенных многими исследователями, было установлено, что пропускная активность таламических ядер всегда организуется с учетом функционального состояния организма и направлена на изменение «удельного веса» определенных импульсаций, проходящих в кору (П. Г. Костюк, Т. Цумото, С. Накамура, К. Ивама). Например, в условиях обычного состояния организма под влиянием фазной активности кортикальных нейронов приоритетно пропускается импульсация от кожных неболевых рецепторов. При выполнении моторных движений преимущественно пропускается кинестетическая импульсация, при действии болевых раздражителей на организм – из общего потока возбуждений на уровне таламуса начинают дозировано выделяться болевые импульсации, направляющиеся в ассоциативные, орбито-фронтальные поля, поля С1, С2 – для всесторонней оценки и анализа. Физиологические механизмы выделения возбуждений той или иной модальности, в частности, болевой – пост- и пресинаптические виды торможения, реализуемые вставочными нейронами, контактирующие с кортикальными нейронами.
Помимо таламуса, корковые влияния, регламентирующие прохождение болевых импульсаций в ЦНС, проявляют себя в гипоталамусе, а также в связанных с ним функционально образованиях лимбического мозга, ретикулярной формации.
Ведущая роль в обеспечении кортико-гипоталамических влияний отводится нейронам лобной коры. Характер корковых влияний на гипоталамус – модулирующий, имеющий результатом в одних случаях усиление активности гипоталамических ядер, участвующих в обработке болевых импульсаций, в других – их угнетение. Знак влияний зависит от многих факторов, вытекающих, в основном, из складывающейся наличной ситуации в отношении целей и задач подготавливаемых корой поведенческих актов. Примером чисто корковой коррекции реагирования организма на болевой раздражитель за счет первоочередного изменения гипоталамической активности являются опыты, проведенные в лаборатории И. П. Павлова, по выработке пищевого условного рефлекса у собак на болевой раздражитель в качестве условного сигнала. Как оказалось, реакция на боль у собаки в виде генерализованных движений, учащенного дыхания, голосовых реакций и т. п., свидетельствующих об очевидном проявлении эмоционального переживания боли в результате вовлечения в процесс гипоталамических эмоциогенных центров, наблюдалась только в первых предъявлениях условного болевого сигнала. В дальнейшем эта реакция исчезала, а в ответ на предъявление условного болевого сигнала у собаки отмечалось выделение слюны. Ч. Шеррингтон, когда ему продемонстрировали данный опыт, сказал: «Теперь я понимаю психологию мучеников».
В заключение раздела отметим, что субъективное восприятие боли человеком не определяется одной лишь силой экзогенного или эндогенного болевого воздействия. Во многом оно зависит от баланса активностей ноцицептивной и антиноцицептивной систем организма. Повышение функциональной активности ноцицептивной системы или снижение активности антиноцицептивной системы приводит к уменьшению болевого порога. Наоборот, снижение активности ноцицептивной системы при одновременном повышении активности антиноцицептивной системы приводит к повышению болевого порога. Подобного рода сочетанные изменения тонической активности двух систем имеют приспособительное значение. Так, в случае преодоления человеком кризисных ситуаций адаптивным фактором выступает аналгезия, помогая ему поддержать избыточный уровень физической активности, не обращая внимание на объективные ограничения, связанные с травмами или даже с серьезными ранениями. В других случаях адаптивным фактором может быть гипералгезия, позволяя человеку, например, в процессе ожидания воздействия на него губительных раздражителей, быстро выделить начальные, ранние проявления воздействия таких раздражителей, что повышает вероятность успешного уклонения человека от соприкосновения с этими раздражителями.
Физиологические механизмы обезболивания. Проведение болевой импульсации на уровне ноцицепторов, периферических нервных волокон можно предотвратить, используя местную инфильтрационную анестезию. При этом ткань (например, мышца) инфильтрируется анестезирующим веществом. В случае применения проводниковой анестезии анестезирующее вещество подводят в область расположения того или иного нервного ствола. Продолжительность местной анестезии зависит от вида анестетика, обычно длится 20-60 мин, используется при вмешательствах малого объема и продолжительности (удаление зуба). Местные анестетики (новокаин) блокируют реакции воротного механизма натриевых потенциал-управляемых каналов нервных волокон на изменения мембранного потенциала. Это приводит к тому, что распространяющиеся потенциалы действия в зоне обработанного анестетиком волокна оказываются неспособными открыть натриевые каналы и запустить регенеративную деполяризацию. Именно поэтому в обработанном участке нервные волокна временно теряют возбудимость и проводимость.
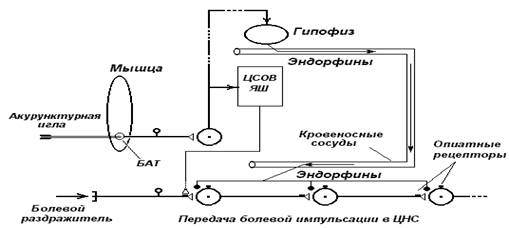
Рис. 6. Схема возможного механизма акупунктурной аналгезии (По Б. Померанцу, с изменениями). Описание в тексте. БАТ – биологически активная точка; ЦСОВ-ЯШ – ядра центрального серого околоводопроводного вещества, ядра шва.
Общая анестезия – используется при выполнении сложных, длительных оперативных вмешательств. Достигается применением особых наркотических препаратов, которые вводятся ингаляционно, внутривенно, прерывая проведение болевой импульсации преимущественно на подкорковом уровне.
В последние годы для борьбы с болью широкое распространение получили нетрадиционные методы обезболивания. Среди них отметим метод механического воздействия на биологически активные точки тела (скопление сенсорных рецепторов) с помощью специальных игл – иглоукалывание, или акупунктура. Разновидностью акупунктуры является электроакупунктура – метод электрического воздействия на биологически активные точки. В обоих случаях стимуляция биологически активных точек в течение 20-30 мин вызывает эффект аналгезии. Физиологический механизм акупунктурной аналгезии объясняется рефлекторным выбросом в кровь из гипофиза во время проведения сеанса иглоукалывания эндорфинов (рис. 6). В последующем эндорфины возвращаются в мозг, связываются с опиатными рецепторы, нарушая синаптическую передачу болевой импульсации в ЦНС (Б. Померанц). Подтверждением данной гипотезы являются опыты с удалением гипофиза у крыс. Как выяснилось, после гипофизэктомии акупунктурная аналгезия не наступает.
Боль с позиции теории функциональной системы. С позиций теории функциональной системы (П. К. Анохин, К. В. Судаков) боль выступает как сигнал опасности для нормального функционирования целого организма. Производными поступления в ЦНС болевой (ноцицептивной) импульсации, последующего возникновения чувства боли, являются реакции разного уровня сложности. В наборе эфферентных звеньев представленной на рис. 7 схемы функциональной системы, сформированной на базе развернутого болевого статуса человека, следует отметить поведенческий акт, имеющий целью устранение причин, вызвавших и поддерживающих состояние боли. В качестве компонента развивающегося поведенческого акта необходимо выделить специальные виды моторной активности, обеспечивающие процесс щажения поврежденного органа.
Далее следует указать на активацию защитных сил – эндогенных механизмов, препятствующих возникновению или развитию возможных патологических процессов в результате пролонгированных влияний болевых раздражителей на организм человека. К ним следует отнести перестройки в работе вегетативной нервной системы, желез внутренней секреции (гипофиза, надпочечников), изменения в работе аппарата внешнего дыхания, ускорение свертывания крови, повышение ее фагоцитарной активности, лейкоцитоз, усиление выработки антител, системное усиление кровотока, местное расширение сосудов в болевом очаге, улучшающее трофику тканей, доставку клеткам кислорода и т.д. Наконец, необходимо отметить особую роль механизмов антиноцицептивной системы, ограничивающей в определенных объемах избыточное поступление болевой (ноцицептивной) импульсации в ЦНС как на уровне входных нейронов, так и на уровне промежуточных инстанций ЦНС. Весь комплекс представленных реакций, интегрированных в составе специализированной функциональной системы, совокупно ориентирован на обеспечение целостности покровных оболочек организма, поддержание стабильности процессов клеточного дыхания тканей – абсолютно необходимых условий нормальной жизнедеятельности организма в среде его естественного обитания.

Рис. 7. Функциональная система, обеспечивающая поддержание целостности покровных оболочек тканей, уровня окислительных процессов тканевых структур организма с участием боли (По Л. В. Калюжному, с изменениями).
Рекомендуемая литература
1. Гельгорн Э., Луфборроу Дж. Эмоции и эмоциональные расстройства. М.: Мир.1966. 642 с.
2. Основы физиологии функциональных систем. Под ред. К. В. Судакова. М.: Медицина. 1983. 270 с.
3. Физиология человека. Под ред. В. М. Смирнова. М:Медицина. 2000. 605 с.
4. Физиология, основы и функциональные системы. Под ред. К. В. Судакова. М.: Медицина. 2000. 781 с.
5. Физиология челюстно-лицевой области. Под ред. С. Будылиной, В. Дегтярева.. 2000. М: Медицина. 348 с.
6. Физиология человека. Т. 2. Под ред. В. М. Покровского, Г. Ф. Коротько. М: Медицина. 1998. 355 с.
7. Физиология человека. Т. 1. Под ред. Р. Шмидта, Г. Тевса. М: Мир. 1996. 323 с.
8. Эндорфины. Под ред. Э. Коста, М. Трабукки. М: Мир. 1981, 366 с.
9. Лиманский Ю. П. Рефлексы ствола головного мозга. Киев: Наукова Думка. 1987. 240 с.
10. C. Guyton, J. E. Hall. Textbook of medical physiology – 10th ed. 2001. 1064 p.
Ноцицептивный флексорный рефлекс
Якупов Р.А.
Кафедра неврологии и рефлексотерапии Казанской государственной медицинской академии
Ноцицептивный флексорный рефлекс является классическим сгибательным рефлексом, вызываемым с короткой головки двуглавой мышцы бедра при электрической стимуляции икроножного нерва (Wilier J.C., 1979).
Сгибательные рефлексы представляют собой четко дифференцированные, мощные рефлекторные реакции, которые хорошо развиты у всех наземных позвоночных животных. Все сгибательные рефлексы имеют сходное функциональное значение - это рефлексы защитного типа, направленные на удаление животного от сильных повреждающих раздражений (отдергивание лапы) или на сбрасывание с поверхности тела источников таких раздражений.
Ноцицептивный флексорный рефлекс имеет два последовательных компонента: RII и RIII. Латенция RII ответа короткая (40-70 мс при стимуляции икроножного нерва). Этот ответ можно получить только при неболевой стимуляции, воспринимаемой как легкое покалывание. Латенция RIII ответа более длинная (90-130 мс) и его появление связано с локальным болевым ощущением в месте стимуляции. Ответ RII появляется обычно первым, при последующем увеличении силы тока появляется ответ RIII (см. рис.).
|
|
Ноцицептивные флексорные рефлексы связаны главным образом с активацией А - дельта волокон (Willer J., 1993). Тем не менее при определенных модальностях стимула А - альфа и А - бета волокна также могут проводить стимулы, вызывающие ноцицептивные рефлексы.
Ноцицептивный рефлекс по уровню замыкания являются спино - бульбо - спинальным. Его R2 компонент реализуется интернейронными сетями на спинальном уровне, причем количество вовлеченных сегментов пропорционально силе раздражающих стимулов и возбудимости нейронных ансамблей, тогда как R3 компонент замыкается через ретикулярную формацию ствола мозга, а именно, ретикулярное гигантоклеточное ядро (высокопороговый, ноцицептивный) (Гокин А.П., Карпухина М.В., 1985; Карпухина М.В., 1985).
У здоровых лиц пороги боли и рефлекса обычно совпадают или первый несколько ниже второго. Для точного определения соотношения между болью и порогом рефлекса вычисляют коэффициент порог боли/порог рефлекса (Пб/Пр), который у здоровых лиц равен примерно 0,9-1,0. Снижение этого соотношения указывает на несоответствие между субъективной оценкой боли и активностью ноцицептивных и антиноцицептивных механизмов (Данилов А.Б., Данилов Ал.Б., Вейн А.М., 1996).
Пороговыми величинами, согласно Wilier J. (1983), являются 5,0±0,6 мА для RII и 10,0±1,0 мА для RIII ответов (Пр); согласно Sandrini и др., - 9,6±0,6 мА для RII и 13,1±4,4 мА для RIII (Пр) (Sandrini G., Arrigo A., Bono G. et al., 1993). Указывается, что различия в данных могут объясняться различиями в методике проведения.
Для вызова ноцицептивного рефлекса требуется интенсивная электрическая стимуляция пачками импульсов продолжительностью 25 - 50 мс при частоте 100-300 Гц и длительности импульсов 0,2 - 1 мс., указанное может обусловливать дистресс у обследуемого, что в свою очередь активирует опиоидные системы, ингибирующие рефлекторный ответ (Вейн А.М., Данилов А.Б., 1999).
Установлены достоверно более низкие пороги ноцицептивного рефлекса у женщин, обусловленные по мнению авторов исследования меньшей активностью антиноцицептивной системы у женщин, чем у мужчин (Danilov A., Sandrini G., Antonaci F., 1993; Данилов А.Б.,. Тутер Н.В., 1997).
По мнению большинства современных исследователей ноцицептивный флексорный рефлекс важен прежде всего тем, что позволяет объективно количественно оценить порог боли у человека (Sandrini G., Arrigo A., Bono G. et al., 1993). Ноцицептивный флексорный рефлекс позволяет определять состояние ноцицептивных и антиноцицептивных систем, а также изучать роль и влияние различных медиаторов, вовлеченных в контроль боли. Кроме того, он может быть использован для изучения патофизиологии различных клинических синдромов, характеризующихся хронической болью или измененной болевой перцепцией (Данилов А.Б., Данилов Ал.Б., Вейн А.М., 1996).
|
Каменсков М. Ю. Динамика болевого порога у студентов с различной выраженностью латерального фенотипа |
|
|
Эффективность обезболивающей терапии определяется генезом болевого возбуждения и индивидуальными особенностями организма. Болевое возбуждение формируется на базе взаимодействия ноцицептивной и антиноцицептивной систем, и это взаимодействие обусловливается активацией каждой из них в данный промежуток времени. Существует множество индивидуальных характеристик деятельности структур центральной нервной системы. Примером может служить выраженность ее функциональной асимметрии, возбудимость, подвижность. Выделяют три вида функциональной асимметрии: моторная, сенсорная и психическая. Моторная асимметрия носит непостоянный характер, так как структурные перестройки, происходящие на уровне коры головного мозга, определяются деятельностью периферии в ранние периоды онтогенеза (Краев, 1978). В то время как сенсорная – является более постоянной и четкой характеристикой асимметрии центральной нервной системы. К сенсорной асимметрии относят: асимметрия органов зрения, слуха, обоняния, тактильной чувствительности и др. Существует несколько гипотез о причинах возникновения функциональной асимметрии. Асимметрия обусловлена генетически, социально, а так же формируется под действием факторов окружающей среды, таких как электромагнитное поле земли. В последнее время исследователями были получены данные в области асимметрии распределения нейромедиаторов в структурах правого и левого полушария (Вартанян, 1996). Известно, что структуры, ответственные за формирование болевого порога – структуры ноцицептивной и антиноцицептивной систем, представлены как в правом, так и в левом полушарии. Например, при воздействии болевого раздражителя на человека информации, передаваемая от ноцицепторов кожи по восходящим путям, поступает в вышележащие структуры головного мозга, где ощущение боли формируется преимущественно в правом полушарии, особенно при фантомных болях. Выявлена асимметрия в распределении опиатных рецепторов, участвующих в деятельности антиноцицептивной системы. Этих рецепторов в 2,5 раз больше локализуется в коре правого полушария у черепах (Кобылянский, 1996). В связи со сказанным, цель настоящей работы заключалась в изучении особенностей динамики болевого порога у правшей и левшей. Эксперимент проводился на 24 студентах 2 курса лечебного и стоматологического факультетов в возрасте 18 – 21 года. Постановка опыта осуществлялась в стандартных условиях. У испытуемых определялась ведущая рука с помощью пробы «поза Наполеона». Так же проводилась динамометрия обеих рук, в результате которой ведущей определялась более сильная. С помощью пробы Розенбаха выявляли доминирующий глаз. Измерялось время простой зрительно-двигательной реакции для каждой руки в отдельности. Регистрировали как на правой, так и на левой руке артериальное давление, уровень болевого порога на обеих руках, который определялся с помощью аппликаторов Кузнецова, моделирующих болевое механическое раздражение, частоту сердечных сокращений, измеряемую на правой руке. Фиксировали температуру кожи правой и левой половины лица в области нулевой точки уха, которая располагается в основания противозавитка. Определение всех этих показателей производили до и после десяти минутной болевой стимуляции. В соответствии с полученными данными обследуемых разделили на две группы - по ведущему глазу - на правшей, с доминирующим левым полушарием, и левшей, с доминирующим правым полушарием. Установлено, что болевой порог у правшей выше на правой руке, а у левшей - на левой, и его асимметрия более четко выражена у правшей. Известно, что правое и левое полушария участвуют в деятельности антиноцицептивной и ноцицептивной систем. Однако, активность левого полушария выше активности правого полушария у правшей, и оно же имеет более прочные связи со средним и продолговатом мозгом, чем правое полушарие (Балонов, 1967). Это определяет большею величину болевого порога у правшей на правой руке. У левшей же доминирующим является правое полушарие, его активность выше активности левого полушария. Поэтому величина болевого порога у левшей выше на левой руке. Температура у правшей и левшей выше на коже левой части головы. Систолическое, диастолическое артериальное давление, ВПДР у правшей и левшей значительно не различаются. Корреляционный анализ показал, что до болевой стимуляции у правшей величина болевого порога имеет высокий коэффициент корреляции с САД (0,49), ДАД (0,48), а так же с температурой левого уха (0,63). У левшей эти взаимоотношения другие: величина болевого порога справа имеет высокий отрицательный коэффициент корреляции с САД (-0,6), и температурой правого уха (0,6). Эти результаты позволяют говорить о том, что механизмы участвующие в формировании болевого порога у правшей и левшей различны (об это говорят различные величины болевого порога, а так же его асимметрия). Для более подробного рассмотрения взаимодействия антиноцицептивной и ноцицептивной систем у правшей и левшей производили десяти минутную болевую стимуляцию. Были получены данные: болевой порог у правшей значительно больше возрос, чем у левшей. Систолическое давление у правшей незначительно увеличилось на правой руке и уменьшилось на левой. Диастолическое давление у левшей возросло на ведущей руке. Температура у правшей и левшей увеличилась на коже правой и левой половины головы. Корреляционные взаимоотношения показали, что у правшей величина болевого порога по-прежнему тесно коррелирует с систолическим артериальным давлением и коэффициент корреляции возрос (БПп-0.63САДп, 0.48САДл, БПл-0.55САДп). У левшей происходят изменения корреляционных связей: величина болевого порога коррелирует после болевой стимуляции с другими вегетативными показателями и имеет высокий коэффициент корреляции с систолическим артериальным давлением (0.4), и состоит в обратной зависимости с ЧСС и ВПДР (-0,4 и -0,48 соответственно). Таким образом, болевая стимуляция у правшей ведет к значительному увеличению болевого порога, а так же к упрочнению взаимоотношений болевого порога с вегетативными показателями. У левшей происходят незначительные изменения болевого порога наряду с изменением картины корреляционных взаимоотношений. После разделения правшей и левшей на три группы по динамике болевого порога, оказалось, что в группе, в которой увеличился болевой порог, наблюдается уменьшение ВПДР на ведущей руке, в группе с не изменившемся болевым порогом изменений во ВПДР не обнаружено, и в группе, в которой уменьшается болевой порог – ВПДР увеличивается. Так изменения этого показателя тесно связаны с изменением активности антиноцицептивной системы. Итак, механизмы участвующие в формировании болевого порога у правшей и левшей различны. Вероятно, это обусловлено вовлечением в его формирования различных структур антиноцицептиной и ноцицептивной системы. Исходя из того, что динамика ВПДР тесно связано с изменениями болевого порога после болевой стимуляции мы можем предположить, что в формировании болевого порога у правшей принимают в основном 1 и 2 уровень антиноцицептивной системы, а у левшей 1 уровень, безусловно, активация третьего уровня антиноцицептивной системы, которую отражает ВПДР, так же участвует в формирование болевого порога, но механизмы лежащие в основе этих изменений на третьем уровне как у правшей, так и у левшей одинаковые, об этом нам говорят однонаправленные изменения ВПДР у правшей и левшей. Таким образом, при выборе адекватных аналгетических препаратов необходимо учитывать выраженность правшества и левшества. |
|
Список используемой литературы 1. Брагина Н. Н., Доброхотова Т. А. Функциональные асимметрии человека. М.: Медицина, 1981. – 288 с. 2. Вартанян Г.А., Клементьев Б.И. Химическая симметрия и асимметрия головного мозга. М.: Медицина, 1991. – 190 с. 3. Краев А.В. Анатомия человека. - Т. 4. М.: Медицина, 1978. – 352 с. 4. Ножье П. Аурикулотерапия. Пер. с франц. М., 1975. – 134 с. 5. Балонов С.Н. Особенности эмоционального статуса больных, страдающих эпилепсией М., 1976 |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|
Содержание |
||||||||||||||||||||||||||
|
1. Авруцкий Г. Я; Недува А. А. Лечение психически больных.-М.: Медицина, 1981. - 496 с. 2. Акимов Г. А., Команденко Н. И. К вопросу о церебральном арахноидите/Журн. невропатол. и психиатр.- 1982.- N2.- С. 200-203. 3. Акимов Г. А.. Лобзин В. С.. Михайленко А. А. и др. Противовирусная терапия герпетических поражений нервной системы / Жури. невропатол. и психиатр.- 1978.- N2.- С.191 - 196. 4. Александровский Ю. А. Клиш1ческап фармакология транквилизаторов,- М.: Медицина, 1973--335с. 5. Бабчин А. И. Патогенез острых и подострых травматических субдуральных гематом/3-й Всесоюан. съезд нейрохирургов; Тез. докл. - М., 1982, с. 17- 18. 6. Бадалян Л. О., Горлина И. С. Эпилепсия и мигрень//Клин. мед.- 1969.-N1.-С. 48-54. 7. Балуда 3. П. Биологические ритмы гомеостаза //Гомеостаз/ Под ред. П. Д. Горизонтова.-М.: Медицина, 1981,-С. 461-489. 8. Бахур В. Т. Неврозы и эндокринные функции организма //Журн. невропатол. и психиатр.- 1977.-N3.-С. 448-456. 9. Боева Е. М. Очерки по патофизиологии острой закрытой травмы мозга.-М.: Наука, 1968.-221 с. 10. Вирксман А. М. Периартериит коротидного сифона (синдром Толоза Хаята)//Журн. невропатол. и психиатр.- 1981.-N9.-С. 1297- 1300. 11. Вальдман А. В., Игнатов Ю. Д. Центральные механизмы боли.- Л.: Наука, 1976.- 191 с. 12. Васин Н. Я., Потапов А. А., Исхаков О. С. и др. Влияние осмотических диуретиков и салуретиков на ВЧД при посттравматическом отеке мозга//Вопр. нейрохнр.- 1984,-N 6.-С. 21-28. 13. Вейн А. М., Соловьева А. Д., Колосова О. Л. Вегетососудистая дистония.- М.: Медицина, 1981.-318 с. 14. Вейн А. М., Яхно Н. Н., Куликовский В. В. и др. К характеристике состояний неспецифических систем мозга при церебральных вегетативно-сосудистых кризах и неврогенных обмороках //Журн. невропатол. и психиатр.- 1981.-N7.-С. 988-994. 15. Гавура В. В. О патогенезе поражений центральной нервной системы при серозных менингитах и менингоэнцефалитах вирусной этиологии//Журн. невропатол. и психиатр.,- 1983--N7.-С. 1084- 1092. 16. Гогин Е. Е., Сененко А. Н., Тюрин Е. И. Артериальные гипертензии.- Л.: Медицина. 1983.-272 с. 17. Гусева Л. Л. Неврологические изменения при системной красной волчанке//Журн. невропатол. и психиатр.-1978,-11.-С.1616- 1620. 18. Дорофеева М. Ю. Компьютерная томография мозга при мигрени (обзор) //Журн. невропатол. и психиатр.- 1983.- 83,- N4,-С.604 - 606. 19. Дуринян Р. А. Физиологические основы боли и рефлекторного обезболивания//Вестн. АМН СССР.- 1980.-N9.-С. 38-44. 20. Ерохина Л. Г. Лицевые боли.- М.: Медицина, 1973.- 176 с. 21. Ерохина Л. Г., Гельфанд В. Б. Болезни нервной системы/Руководство для фельдшеров,- 3-е изд.. перераб. и доп.- Л.: Медицина, 1984.- 360 с. 22. Завьялов А. В., Дяченко В. К. О корреляционной связи острых нарушений мозгового кровообращения с изменениями магнитного поля земли//Журн. невропатол. и психиатр.-1984.-N8.-С. 1137- 1140. 23. Закусав В. В., Булаев В. М., Островская Р. У. Влияние простагландинов, циклических нуклсотидов, ионов на анальгетический эффект аналогов энкефалинов//Бюлл. экспер. биол. и мед.- 1982.- Вып. 94.-N12.-С. 51-53. 24. Заноздра И. С.. Кращук А. А. Мозговое кровообращение у больных гипертонической болезнью при физической нагрузке //Врач. дело.- 1984.- N1,- С. 71 - 75. 25. Зограбян С. Г. Черепно-мозговая травма.-.М.: Медицина, 1965.- 248 с. 26. Калюжный Л. В. Физиологические механизмы регуляции болевой чувствительности.-М.: Медицина, 1984.-215 с. Карвасарский Б. Д. Головные боли при неврозах и пограничных состояниях.-Л,: Медицина, 1969.- 192 с. 27. Карвасарский Б. Д. Неврозы.-М.: Медицина, 1980.-448 с. 28. Карлов В. А. К вопросу о взаимоотношении эпилепсии и мигрени// Журн. невропатол. и психиат.- 1963.-N11.-С. 1643- 1650. 29. Карлов В. А., Савицкая О. Н. О принципиальных особенностях патогенеза и патогенетического лечения некоторых невралгических синдромов области лица//Журн. невропатол. н психиатр.- 1980.-N5.- С. 676-679. 30. Карлов В. А., Савицкая О. X., Вишнякова М. А. Невралгия тройничного нерва.- М.: Медицина, 1980.- 150 с. 31. Каспаров С. А. О влиянии наркотических анальгетиков на передачу ноцицептивного возбуждения в спинном мозге //Фармакол. и токсикол.- 1982.- N2,- С. 30 - 35. 32. Коновалов А. Н. Хирургическое лечение артериальных аневризм головного мозга.-М.: Медицина, 1973.-328 с. 33. Коновалов А. Н., Самотокин Б. А., Васин Н. Я. и др. Градации тяжести состояния пострадавших с черепно-мозговой травмой и унифицированные критерии для их определения//Вопр. нейрохир.- 1982.-N5.-С. 11-16. 34. Кургаев В. И. О дегидратирующем эффекте глицерина, маннитола и лазикса в острейшем периоде мозгового инсульта //Журн. невропатол. и психиатр.- 1978.-N8.-С. 1137- 1140. 35. Лебедева Н. В. Геморрагический инсульт.- М.: Медицина, 1978.- 160 с. 36. Лесницкая В. Л: Яровая И. М., Петровский И. Н. и др. Венозная система головного и спинного мозга в норме и патологии.- М.: Медицина, 1970.- 224 с. 37. Лобзин В. С. Менингиты и арахноидиты.-Л.: Медицина, 1983.- 191 с. 38. Лукачер Г. Я. Неврологические проявления остеохондроза позвоночника.-М.: Медицина, 1985.-238 с. 39. Макаров А. Ю. Клиническая ликворология. - Л.: Медицина, 1984.- 215 с. 40. Максименко И. М. Реографическое исследование сосудистой системы// Неврологические и психические синдромы при коллагенозах у детей/Под ред. В. В. Михеева,-М.: Медицина, 1977, с. 248- 255. 41. Машковский М. Д., Андреева Н. И., Полежаева А. И. Фармакология антидепрессантов.- М.: Медицина, 1983.-240 с. 42. Мельничук П. В., Ильина Н. А., Штульман Д. Р. Неотложная помощь при неврологических заболеваниях.-М.: Медицина, 1978.- 184 с. 43. Мисюк Н. С., Кургаев В. И. О влиянии глицерина, маннитола и лазикса на ликворное давление в остром периоде мозгового инсульта//Журн. невропатол. и психиатр.- 1981.- 8.- С. 1149 - 1152. 44. Мисюк Н. С., Пригун П. П. Головные боли.- Минск: Беларусь, 1984.- 144 с. 45. Михеев В. В. Коллагенозы в клинике нервных заболеваний.- М.: Медицина, 1971.- 192 с. 46. Михеев В. В., Рубин Л. Р. Стон атон ев рол огня.-М.: Медгиз, 1958.- 263 с. 47. Михеев В. В., Гиттик Л. С. Современные аспекты нейроревматизма// Журн. невропатол. и психиатр.- 1982.-N7--С. 68-73. 48. Мягер В. К. Диэнцефальные нарушения и неврозы.- Л.: Медицина, 1976.- 166 с. 49. Насонова В. А: Бронзов И. А. Ревматизм.- М.: Медицина, 1978.- 192 с. 50. Неймарк Е. 3. Тромбозы внутричерепных синусов и вен.- М.: Медицина, 1975.- 184 с. 51. Неймарк Е. 3., Васильева А. Ф., Быкова Ю. П. и др. О клиникопатогенетическом полиморфизме синдрома Толосы-Ханта//Журн. невропатол. и психиатр.- 1985--N3.-С. 337-340. Нейроэндокринная патология в гинекологии /Под ред. 3. Ш. Гилязутдиновой.- Казань; Изд-во Казанского университета, 1982.-127 с. 52. Панкова О. Ф. Клиника и особенности динамики вегетативных кризов у больных с невротическими расстройствами /Журн. невропатол. и психиатр.- 1983.- N11.- С. 1681 - 1686. 53. Парменов-Трефилов Б. И., Шаповалов С. Л., Лысенко А. С. О состоянии медиаторного обмена у больных неврастенней//Военно-мед. журн.- 1972. N6.-С. 76-82. 54. Перли П. Д., Чукуре Э. А. К патогенезу мигрени //Журн. невропатол. и психиатр.- 1981.-4.-С. 529-534. 55. Пиль Б. Н. Диагностика хронических воспалительных заболеваний оболочек головного мозга.-Л.: Медицина, 1977.- 168 с. 56. Потапов А. А., Доброхотова Т. А., Шарова Е. В. и др. Интенсивная терапия при травматических внутричерепных кровоизлняниях//Всесоюзн. съезд нейрохир./Тез. докл.-М., 1982, с. 90-92. 57. Рахимджанов А. Р., Аскаров Ш. А. Ревматические заболевания нервной системы.-Ташкент: Медицина, 1978.-207 с. 58. Руководство по нейротравматологии. Черепно-мозговая травма/Под ред. А. И. Арутюнова. Ч. 1.-М.: Медицина, 1978.-583 с. 59. Савицкая О. Н., Карлов В. А. О проблеме невралгий и прозопалгий//Журн. невропатол. и психиатр.- 1983.- N4.- С. 499 - 503. 60. Саратиков А. С., Плотникова Т. М., Плотников М. Б. Глицерин как противотечное средство при поражениях центральной нервной системы//Журн. невропатол. и психиатр.- 1977.-N4.- С. 51. 61. Свядощ А. М. Неврозы.- М.: Медицина, 1982.- 366 с. 62. Сергиенко В. Б., Бабенков Н. В., Щмырев В. И. и др.- Однофотонная компьютерная томография головного мозга в неврологической клинике//Журн. невропатол. и психиатр.-1984.-N12.-С. 1779- 1783. 63. Серов В. И. Послеродовые нейроэндокринные заболевания.-М.: Медицина. 1978.- 144 с. 64. Смулевич А. Б., Пантелеева Г. П. Некоторые актуальные проблемы клинической психофармакологии//Журн. невропатол. и психиатр.- 1983.- 9.- С. 1345 - 1351. 65. Стрелкова Н. И. Физические методы лечения в неврологии.- М.: Медицина, 1983.-272 с. 66. Судаков К. В. Церебральные механизмы боли и обезболивання//Вестн. АМН СССР.- 1980.-N9.-С. 17-22. 67. Табеева Д. М. Руководство по иглорефлексотерапии.- М.: Медицина, 1980.- 560 с. 68. Тареев Е. М. Коллагенозы: эволюция учения и современные концепции//Ревматология.- 1984.- N1.- С. 70 - 76. 69. Толубеев Н. С. Клинические формы поражений системы при системной красной волчанке//Врач. дело.- 1983.- N10.- С. 31 - 33. 70. Уманский К. Г. Вирусные энцефалиты //Журн. невропатол. и психиатр. - 1977.-N11.-С. 1665- 1673. 71. Уманский К. Г. Вирусные нейроинфекции (к проблеме патологии адаптации) //Журн. невропатол. и психиатр.- 1980.- N8.- С. 1235 - 1240. 72. Фарбер М. А., Левин Ю. С. О состоянии желудочной системы мозга при церебральных вегетативно-сосудистых пароксизмах//Журн. невропатол. и психиатр.- 1982.-N2.-С. 217-220. 73. Фоломеева О. М., Буланова Т. Д., Березова Н. Ю. Лимфоцнтотоксические и антимозговые антитела у больных СКВ с поражением нервной системы//Тер. архив.- 1983.- N7.- С.28 - 32. 74. Харкевич Д. А. Фармакология.-М .: Медицина, 1981.-455 с. 75. Харкевич Д. А., Каспаров С. А. О спинальном компоненте в болеутоляющем действии опиоидных пептидов и наркотических анальгетиков//Фармакология нейропептидов.-М., 1982, с. 69-79. 76. Хаютин В. М. Механизмы ноцицепции и антиноцицептивная система ромбовидного мозга//Вести. АМН СССР.- 1980.- N9.- С. 26 - 33. 77. Цукер М. Б. Менингиты и энцефалиты у детей.- М,: Медицина, 1975. 344 с. 78. Цукер М. Б. Клиническая невропатология детского возраста.- М.: Медицина, 1978.-462 с. 79. Частная сексопатология/Под ред. Г. С. Васильченко//Т. 1.-М.: Медицина, 1983.-301 с. 80. Чеботарев Д. Ф., Коркушко О. В., Маньковский Н. Б. и др.- Атеросклероз и возраст.-Л.: Медицина, 1982.-296 с. 81. Шмидт Е. В. О диагностике сосудистых поражений мозга.- Неврологические и психиатрические аспекты ранних форм цереброваскулярной патологии//Тез. докл. Пленума Всесоюзн. общ. невропатологов и психиатров. Т. 2.- Киев, 1983, с- 3-8. 82. Шток В. Н. Дегидратирующее действие мочевины//Вопр. нейрохир.- 1962-N 2-С. 43-47. 83. Шток В. Н. Дегидратирующее действие маннитола//Вопр. нейрохир.- 1964.-6.-С. 48-50. 84. Шток В. Н. Повышение внутричерепного давления и диагностические возможности РЭГ//Вопр. нейрохир.-1971.-N 2.-С. 21-24. 85. Шток В. Н. Лекарственные средства в ангионеврологии.-М.: Медицина, 1984.-304 с. 86. Шток В. Н.. Пигарев В. А. Лечение мигрени//Клин. мед.- 1979.- N 12.-С. 17-22.
|
4. Боль
Боль сопровождает многие двигательные расстройства, иногда она сама манифестирует эти нарушения. Часто об эффекте мануальной терапии судят по исчезновению боли в позвоночнике, мускулатуре, суставе и др. Таким образом, следует считать, что мануальная терапия может быть представлена как один из способов устранения периферического фактора боли и активации антиноцицептивной системы. С понятием "боль" знакомы все. При всей обыденной простоте понятия научное определение этого специфического чувства встречает значительные трудности гносеологического характера. Боль - состояние, часто определяемое как реакция на вредное воздействие (ноцицептивное раздражение) не отражает в полной мере сущность феномена. Известны многие клинические и физиологические состояния, когда ноцицептивный раздражитель продолжает оказывать вредное действие, а реакция системы или целого организма отсутствует. Другое распространенное мнение, что боль является сигналом опасности, отражает лишь одну сторону общей проблемы. В этом плане можно задаться вопросом, почему продолжается боль, если сигнал о вредоносном агенте уже поступил в центры регистрации? Клиническое определение боли, в основном, сводится к регистрации ее дезадаптирующего значения как абсолютно вредного биологического явления. По-видимому, разное толкование боли связано с тем, что в ее определении не оговаривается принцип классификации. Наиболее удачный подход в многосторонней характеристике боли осуществлен Гедом (1881), разделившим ее на протопатическую и эпикритическую. В последующем эта классификация легла в основу деления на первичную и вторичную виды боли. В принципе, такое разделение тождественно разделению ее на острую и хроническую.
По мнению Л.В.Калюжного (1984) боль как интегративная функция организма является отрицательной биологической потребностью, ответственной за формирование функциональной системы по сохранению гомеостаза.
Острая (первичная) или эпикритическая боль имеет физиологическое значение, она направлена на восстановление нарушенного гомеостаза. Эта боль короткая, подвергается адаптации через 1-2 с, сопровождается фазическим сокращением мышц (вздрагивание, отдергивание конечностей от источника боли), активирует воспалительные процессы, не нарушает трофику тканей, не вызывает их гипоксию, стимулирует пролиферативные процессы. Таким образом, первичная боль имеет адаптационное значение. Считается, что она возникает при раздражении специфических рецепторов.
Хроническая (вторичная, протопатическая, патологическая) боль, появляющаяся через 20-30 секунд от момента раздражения, суммируется в интенсивности, расширяется зона ее восприятия. Следует сказать, что для появления вторичной боли требуется более интенсивное раздражение, хотя не обязательно повреждение целости покровных тканей. В результате вторичной боли возникает тоническое сокращение мышц, тормозится активность репаративных процессов, развитие коллатералей, развивается тканевая гипоксия и ацидоз, изменяется трофика тканей. Хроническая боль является дезадаптирующей, дезинтегрирующей в деятельности многих функциональных систем. Представление об абсолютно патологической роли вторичной боли неправильное. Следует подчеркнуть, что первичная боль является предупреждающей о наступившем повреждении, а вторичная - регистрирующей и напоминающей о состоявшемся повреждении. Тем самым устанавливается роль вторичной боли в активации тех механизмов, которые устраняют последствия повреждения.
Сигналы первичной боли проводятся миелинизированными Аб -волокнами со скоростью 4-20 м/с до самых разнообразных центров обработки (перцепции) сенсорных сигналов. Вторичная боль передается по тонким безмиелиновым волокнам типа С со скоростью 0,4-2 м/с при большой задержке на различных уровнях нервной системы.
Первичная боль воспринимается специфическими А - ноцицепторами, в основном, механорецепторами, расположенными в коже, в суставных сумках и др. Вторичная же боль регистрируется С - полимодальными рецепторами, т.е. воспринимающими различные раздражители как по качеству, так и по интенсивности (механические, термические, химические); обнаруживаются они в большинстве тканей.
В клинической практике принято разделение чувствительности на поверхностную и глубокую. Путями проведения болевой чувствительности являются спино - таламический, спино - ретикулярный, спино - мезэнцефалический. Спино - таламический путь (Говерса - Бехтерова) является филогенетически новым и проводит первичную боль. Состоит он из трех нейронов. Тело первого нейрона расположено в межпозвонковом ганглии, на периферии он заканчивается рецептором. Центральный конец первого нейрона заканчивается в заднем роге сегмента спинного мозга (1 слой Рекседа). Здесь берет начало второй нейрон спино - таламического пути, совершает переход на другую сторону сегмента и формирует восходящий спино -таламический путь в составе боковых столбов спинного мозга. На своем пути этот путь отдает коллатерали в стволе головного мозга ретикулярной формации, ядрам черепных нервов, гипоталамусу. Большая часть волокон второго нейрона заканчивается в заднем вентролатеральном ядре зрительного бугра (VPL). Второй нейрон тройничного нерва заканчивается в заднем вентромедиальном ядре (VPM). Берущий начало в этом ядре третий нейрон заканчивается в задней центральной извилине (соматосенсорная зона С1). Считается, что эта зона ответственна в тонком дискриминационном анализе болевого сигнала.
Вторичная боль проводится полинейрональными афферентными путями, организованными не по проекционному принципу. Периферическими афферентами путей проведения вторичной боли могут быть как соматические, т.е. общие с первичной, так и вегетативные волокна типа В. Остальные восходящие афференты вторичной боли структурно не выделены из-за их непостоянства и неспецифичности. Предполагается, что они проходят на границе с серым веществом сегмента и устанавливают многосторонние связи в стволе головного мозга.
Каким образом возникает болезненная афферентация и как обрабатывается этот сенсорный поток?
В классической неврологии существовало противопоставление двух точек зрения: теории интенсивности и теории специфичности. Согласно первой, боль может восприниматься любыми рецепторами при превышении интенсивности раздражителя определенного уровня. Согласно другой, болевой сигнал может генерироваться только специализированными рецепторами. В настоящее время установлено, что эпикритическая боль является результатом активации специфических рецепторов. Вторичная, протопатическая боль по своим нейрофизиологическим механизмам соответствует как теории специфичности, так и теории интенсивности. В любой ситуации болевого реагирования имеет место как первичная, так и вторичная боль. Отличие заключается в том, что первичная боль через небольшой интервал времени уступает вторичной, которая может сохраняться долго - хронически. Правда, химические повреждения вызывают сразу же вторичную боль.
В результате преобразования в рецепторе энергии раздражителя в нервный импульс возникает сигнал опасности. Сигналы эпикритической боли, "предупреждающие" проводятся тонкими миелинизированными Аб-волокнами, передающими без задержки информацию о повреждении, его размерах и локализации. Тонкие немиелинизированные С-волокна передают сигналы медленной диффузной, особенно неприятной боли, постоянно напоминающей организму, что есть повреждение и следует ограничить движение. Первичная боль адаптируется после повторных болевых раздражителей. Она генерируется меньшими интенсивностями, чем вторичная. Специфическими в возникновении первичной боли считают механические и термические раздражители. Вторичная же боль возникает при таких интенсивностях, которые приводят к повреждению ткани, включая химические агенты. Следует подчеркнуть, что первичная боль генерируется преимущественно поверхностными рецепторами, а вторичная - рецепторами, расположенными как поверхностно, так и во внутренних органах.
Таким образом, в мануальной терапии вторичная боль определяет клиническую структуру болевого синдрома. Это значит, что она должна быть устранена или максимально ослаблена.
Первая релейная станция обработки ноцицептивного сигнала - сегментарный аппарат спинного мозга, его задние рога. Здесь сигнал может быть усилен или ослаблен, переключаясь на соседние нейроны. Следует выделить 2 группы нейронов, деятельность которых имеет физиологический антагонизм. Группа клеток, ориентированных на проведение и усиление ноцицептивных сигналов (I-IV слои по Рекседу) получили название полимодальных или нейронов широкого динамического ряда (ШДР). На них конвергируют афференты, несущие импульсы из самых различных отделов человеческого тела. Они способны возбуждаться под влиянием разнообразных - полимодальных - сигналов и обеспечивают многократное усиление сенсорного потока. Такие клетки имеются не только в сегменте. Они составляют структурную основу обработки сенсорного потока в стволе мозга. Другая группа клеток, расположенная по ходу ШДР нейронов в виде отдельных скоплений, называется островковыми или специфическими. На них заканчиваются толстые миелинизированные волокна. Они оказывают на клетки ШДР тормозящее влияние. В свою очередь, они активируются проприоцептивными афферентами. Клиницистами (М.И.Аствацатуров, 1938) установлено, что достаточный уровень проприоцепции является необходимым условием торможения ноцицептивных сигналов. Этот принцип заложен в последствии в основу так называемого воротного контроля по R.Melzack и P.Wall (1964).
На уровне сегментарного аппарата спинного мозга возможна интрасегментарная обработка ноцицептивного сигнала. В результате активации ШДР клеток возможны перетоки болевых сигналов нейронов различного назначения - моторные, вегетативные, дермальные. В результате этого могут быть установлены висцеро-дермальные, висцеро-моторные, висцеро-висцеральные, дермато-моторные, дермато-висцеральные функциональные связи, часто имеющие патологический характер. Восходящий поток ноцицептивной импульсации организован двумя основными путями - неоспино-таламическим и палеоспино-таламическим. Обработка сенсорного потока на уровне ствола мозга - процесс многосторонний. Ноцицептивная информация включает системные реакции: сосудодвигательные, дыхательные, поведенческие, гуморальные. Она же является активатором антиноцицептивных структур (АНЦС) этой локализации (центральное серое вещество, ретикулярную формацию, гипоталамус). Причем АНЦС этого уровня реализуется как нейрональными механизмами (торможение восходящего потока), так и гуморальными (эндогенные опиаты). Основной поток сенсорной, в том числе и ноцицептивной афферентации, обрабатывается в неспецифических ядрах зрительного бугра (75-80%). До коры головного мозга доставляется информационно значимая доля, подвергаемая сознательной переработке. Установлено, что дискриминационно-сенсорная часть анализируется в соматосенсорной зоне С1 и С2, а также в теменной доле, преимущественно справа. В результате этого анализа создается сознательная оценка качества, места, величины и иных характеристик боли. Эмоционально-мотивационную оценку опасности осуществляют передние отделы левого полушария на стыке лобной доли и лимбической системы. Кора головного мозга обеспечивает сознательные реакции на боль. Известны наблюдения, когда волевым усилием удается задержать защитную сознательную реакцию на боль, тогда как вегетативные и гуморальные реакции сознательному контролю практически недоступны.
Таким образом, обзор клинико-нейрофизиологической организации ноцицептивной афферентации показывает системно-функциональную структуру для каждой ее слагаемой.
Структура болевого синдрома аппарата движения
Теперь нам следует рассмотреть структуру болевого синдрома двигательного аппарата. К сожалению, в существующей отечественной литературе по мануальной терапии акцент производится на структуру болевого синдрома позвоночника в связи с дистрофическим поражением позвоночника - остеохондроз, межпозвонковый артроз и др. Между тем, практический опыт вертеброневрологов, ортопедов и специалистов по мануальной терапии ставит под сомнение структурный дегенеративный принцип подхода к клинической характеристике боли не только в позвоночнике, но и в других элементах опорно-двигательного аппарата. Известны многочисленные клинические наблюдения, когда у больных с выраженными рентгенологическими дегенеративными изменениями нет жалоб на боль. В то же время при "рентгенонегативных" остеохондрозах позвоночника интенсивность болевого синдрома может быть значительной.
Несостоятельность попыток связывания болевых синдромов мышц, связок, суставов конечностей с дистрофическим поражением позвоночника очевидна. Эту связь можно отчетливо проследить лишь в отношении некоторых синдромов дискогенного поражения периферической нервной системы. В таких случаях дискорадикулярный конфликт (диско-каудальный) проявляет себя проводниковыми болями по ходу нервных стволов вдоль конечности. Эта ситуация, клинически тяжелая, к счастью встречается намного реже, чем диагностируется на самом деле. Расхожий диагноз "остеохондроз с корешковым синдромом" наглядно демонстрирует сложившуюся точку зрения установления патогенетической связи болевых проявлений в первую очередь с патологией позвоночника.
Клиническая практика располагает многочисленными наблюдениями, когда без участия позвоночника, тем более дистрофического происхождения, в паравертебральных тканях, конечностях, отдаленных суставах формируются болезненные зоны, самостоятельное происхождение которых определяется иными патогенетическими факторами. В части случаев патологические алгические процессы позвоночника и других тканей являются параллельными или же имеют другое направление: первоначальные изменения обнаруживаются далеко от позвоночника, а позвоночные боли появляются позже без какой-либо патогенетической связи в силу развития собственных механизмов заболевания. Тем не менее, по принципу "после этого - вследствие этого" диагностируется поражение позвоночника. Признание дискогенной концепции пояснично-крестцовых радикулитов было крупным шагом в развитии взглядов на природу этого частого недуга человечества. Был выдвинут существенный контраргумент против инфекционной природы радикулитов.
Очередные издержки хирургического увлечения дискогенной теорией тоже хорошо известны, когда при поясничных болях предпринимались обширные вмешательства на позвоночнике по удалению грыж. В результате этого в 1930-1940 годы накопился такой материал, из чего следовало, что часто после операций развивается функциональная или статическая неполноценность позвоночника. Интенсивность же алгических проявлений часто не менялась или же увеличивалась. Эти сведения послужили разработке другого направления в вертебрологии - рефлекторным проявлениям остеохондроза позвоночника. Фундаментальные исследования в этом отношении были проведены крупным неврологом - проф. Я.Ю.Попелянским (1962-1995). В принцип патогенетической классификации клинических проявлений положен постулат обязательного поражения позвоночника в виде дистрофического поражения - остеохондроза диска. Автором выделены две группы синдромов: компрессионные и рефлекторные. В свою очередь, компрессионные синдромы включают корешковые, сосудистые, спинальные. Группа рефлекторных синдромов содержит рефлекторные мышечно-тонические, сосудистые и дистрофические поражения. Логическим продолжением этого направления следует считать появление теории миоадаптивных синдромов (В.П.Веселовский, 1977), сопровождающих как компрессионные, так и рефлекторные синдромы. Согласно представлениям автора, миоадаптивные синдромы возникают как тоническая реакция на перегрузку некоторых мышечных групп при измененной осанке (постуральные миоадаптивные синдромы) и в условиях компрессионной корешковой патологии, когда сохранившаяся часть мышц берет на себя функции ослабленных мышц (викарные миоадаптивные синдромы). В последующем концепция приуроченности многих алгических и мышечных - дистонических синдромов к патологии позвоночника стала вызывать сомнения вплоть до полного отрицания такой связи (Е.С.Заславский, 1976).
Остеохондроз позвоночника, представленный в качестве универсального субстрата алгических синдромов, с точки зрения мануальной терапии перестал играть роль ведущего фактора патогенеза. Структура болевого синдрома спины оказалась намного сложнее, чем она представлялась с позиции структурного вертеброгенного происхождения. Клинический подход, пытавшийся все же связывать происхождение этого синдрома в связи с первичной патологией позвоночника, постулировал так называемый предостеохондроз, латентный остеохондроз (О.Г.Коган, 1990). С другой стороны, диффузные болезненные проявления в спине, в конечностях стали связывать с "распространенным остехондрозом" позвоночника (Г.С.Юмашев, М.Е.Фурман, 1973). Тщательный анализ возможных патогенетических связей в этих случаях обнаружил их искусственность и тенденциозность - многие болезненные проявления, в том числе и биохимические расстройства, в причинно-следственных отношениях не находились. Выявленный остеохондроз диска, наоборот, служил фактором ортопедической компенсации.
Таким образом, значимость остеохондроза позвоночника как облигатного этиологического фактора болей в спине и нарушений функций позвоночника нуждается в уточнении и в новой трактовке остеохондроза как патогенетического фактора.
В настоящее время накопился солидный клинический материал, подкрепленный нейрофизиологическими и нейрорентгенологическими методиками исследований, а так же опытом нейрохирургов. Согласно этому, остеохондроз позвоночника следует рассматривать как процесс перестройки структуры ПДС, прежде всего диска, направленный на увеличение функциональных возможностей позвоночного столба в целом. В этом смысле этот тяжелый патологический процесс перестройки хрящевых и костных структур ПДС может быть условно сравнен с асептическим некрозом апофизов различных костей, сопровождающихся распадом нормально организованной кости и последующим замещением ее костной тканью другой структуры. В результате этой мучительной перестройки увеличивается опорная способность пораженной кости, т.е. возникает ортопедическая компенсация. Наиболее иллюстративно компенсирующее значение остеохондроза диска при истинном спондилолистезе ПДС L5-S1. Подвижный здоровый диск этого сегмента при грубой несостоятельности суставно-связочного аппарата не способен удержать пораженный сегмент в нормальном положении. Только быстрая дегенерация диска с последующей оссификацией является необходимой мерой ортопедической компенсации неминуемых грозных неврологических осложнений при подвижности этого отдела. В данном случае, остеохондроз имеет оздоравливающее значение, направление его развития имеет компенсаторное назначение. Остеохондроз диска как полифакториальный процесс выключает из биомеханики позвоночника дефектный позвоночно-двигательный сегмент. Не останавливаясь на многочисленных концепциях, касающихся этиологических и патогенетических факторов, следует все же признать, что они в полной мере отражают разные аспекты остеохондроза как процесса, но игнорируют общебиологическое его значение. Остеохондроз - не хроническое бесконечное заболевание, не раннее старение, не изнашивание диска; это проводимый природой процесс выключения из движения сегмента позвоночника, это естественный спондилодез. Поэтому обозначать остеохондроз как безусловно патологический и безусловно саногенетический процессы следует проводить с большой оговоркой. В своем развитии остеохондроз диска имеет критические этапы, сопровождающиеся срывами компенсаторных возможностей. Клинические проявления их детально изучены, классифицированы, разработаны способы лечения и меры профилактики следующего обострения. Не следует понимать эту оговорку буквально: чаще остеохондроз как процесс саногенетический даже в критические этапы своего развития никаких беспокойств больному не доставляет или они минимальны.
Какие же факторы способствуют развитию остеохондроза? В наиболее общем смысле это все патологические ситуации, возникающие в разных возрастных аспектах человека.
Первая группа причин - это дезонтогенетические причины: аномалии развития отдельных позвонков, их соединений, аномалии суставного тропизма, недоразвитие отдельных элементов позвонка, дуг, диска и др.
Вторая группа причин - потеря диском эластических (рессорных) функций при перегрузках отдельных сегментов. Как правило, это диски наиболее напряженных отделов - нижнешейного и нижнепоясничного. Известно, что неблагоприятные статикодинамические условия функционирования отдельных позвоночно-двигательных сегментов приводят к деполимеризации мукополисахаридов коллагена и эластических волокон диска, тем самым уменьшается гидрофильность тканей и снижается их упругость. Этот процесс хорошо изучен биохимическими, иммунологическими и другими методиками, все они характеризуют деструкцию диска как необходимый этап развития репаративных процессов, каким является остеохондроз. Из-за резкой потери механической прочности диска и еще не развившегося фиброза (оссификации) диска создаются условия его прорыва с формированием протрузии или даже пролапса.
Третья группа причин - травматические поражения позвоночника. В этом отношении наиболее значимы поражения диска (грыжа Шморля), переломы дужек, истинный травматический спондилоз, переломы тел и др.
Четвертая группа - дисметаболические поражения костной ткани, включающие достаточно большую группу заболеваний с разной этиологией. Объединяет их механизм перестройки структуры костной ткани - формирование кости с измененной архитектоникой. К этой группе заболеваний можно отнести остеохондропатии (Шоерман-Мау, Кальве и др.), гормональные спондилопатии, мукополисахаридозы и пр. Остеохондроз в группе этих заболеваний выступает в качестве стабилизирующего фактора - способствует ограничению экскурсий в целом блоке ПДС.
В наиболее общем виде основные этапы функционально-структурной перестройки ПДС в ответ на воздействие указанных этиологических факторов можно представить в виде следующего алгоритма.
1. Гиперфункция ПДС - реализация мер защиты в ответ на изменение функции ПДС. Это включение физиологических мер защиты (по И.П.Павлову) или саногенетических реакций (по современной терминологии). Проявляется изменением физиологического состояния активных элементов локомоторной системы, частью которых, естественно, является ПДС. Проявляется гипертрофией мышц, изменением возбудимости нейромоторной системы, ограничением двигательной активности, перестройкой и формированием нового паттерна движений в пораженной зоне (т.е. изменения некоторых слагаемых двигательного стереотипа) и другими реакциями, являющимися подвижными слагаемыми. Возможная перестройка костной ткани по типу реализации гипертрофических (гиперпластических) процессов без изменения нормальной структуры тоже является проявлением саногенетических реакций. Продолжительность этого этапа может быть значительной (несколько лет и десятилетий). Если этих мер достаточно, то пациент в течение всей жизни особых проблем по поводу болей в позвоночнике вряд ли будет иметь. Понятно, что в проведении лечебных мероприятий, включая мануальную терапию, нет необходимости.
2. Дисфункция ПДС реализуется качественным изменением саногенетических реакций. Этот этап изменений наступает вследствие недостаточности саногенетических процессов при превышении активности патологических факторов, т.е. при узости диапазона саногенетических реакций. Этот этап условно патологический. Проявляется он перегрузками сегментарной и регионарной мускулатуры, формированием миогенных, фасциальных, связочных триггерных пунктов. В результате действия этих факторов меняется патологическим образом комплекс двигательных штампов, появляются несвойственные паттерны движений - формируется порочный двигательный стереотип. Формирование функциональных блокад ПДС как меры неспецифической некачественной защиты является характерным. Продолжительность этого этапа несколько лет. Следует иметь в виду, что 1) граница между первым и вторым этапами является условной; 2) что между ними имеется подвижное равновесие; 3) возможно обратное развития патологических накоплений второго этапа. На этом этапе наиболее эффективны различные методики мануальной терапии.
3. Дистрофия ПДС - декомпенсация саногенетических реакций, т.е. этап патогенетических процессов. Развертывается он по механизму структурной перестройки элементов локомоторной системы при декомпенсации физиологических мер защиты. Представлен этот этап дегенеративными изменениями ПДС и позвоночного столба. Наиболее распространенный процесс - остеохондроз диска, имеющий две основные разновидности в своем течении: осложненную и неосложненную. А. Осложненная - разрушение диска с грыжеобразованием и формированием компрессионных и рефлекторных синдромов остеохондроза, сопровождающаяся массивной клинической симптоматикой. Продолжительность 0,5-1,5 года. Б. Неосложненная - фиброз и оссификация диска без неврологических нарушений и без существенных клинических проявлений. Продолжительность - 3-5 лет. Кроме остеохондроза позвоночника, дистрофическим процессом поражается сустав, связочный аппарат, костная ткань. В результате завершения этих процессов возникает новая структура, соответствующая патологической функциональной перестройке. Соответствующие клинические синдромы хорошо известны.
4. Консолидация ПДС: оссификация диска с выключением ПДС из движения. Полная ортопедическая компенсация функций пораженного сегмента с возложением их на соседний ПДС. Это означает, что соседний сегмент оказывается в условиях первого этапа перегрузок, что может быть причиной развития остальных этапов перестройки. Таким образом мы могли бы проследить за развитием последовательных патологических процессов в различных звеньях позвоночного столба. Конечно же, жизнь намного сложнее всяких схем и патогенетические циклы могут измениться в зависимости от конкретных условий.
Естественно, лечебные мероприятия каждого этапа принципиально отличаются друг от друга. Первый этап в проведении лечебных мероприятий не нуждается. Проведение общих реабилитационных мероприятий будет профилактическим в отношении перехода первого этапа во второй. На втором этапе патогенетически обоснованы ЛФК, массаж, мануальная терапия, сенсомоторная активация. Третий этап включает комплекс лечебных приемов по патогенетическому принципу. Четвертый этап в лечении не нуждается, но неминуемая перегрузка соседнего сегмента требует особой деликатности врача в рекомендациях по физической активности пациента.
Возникает закономерный вопрос: есть ли необходимость в детализации клинических проявлений остеохондроза, если этот процесс в конечной стадии развития имеет саногенетическую направленность и критический этап в его развитии чаще происходит без манифестации? Во всяком случае, следует иметь в виду, что этот этап может быть достаточно длительным с недостаточной компенсацией, с частыми ее срывами. Понятно, что эта ситуация создает в жизни пациента драматические ситуации, требующие проведения трудоемких лечебных мероприятий. Существующие схемы лечения, основывающиеся на клинической классификации остеохондроза позвоночника, в критический момент предусматривают разные варианты развития патологического процесса. Ремиссии болевого синдрома и других клинических проявлений в этой схеме лечебных мероприятий не исключают проведения профилактических мероприятий в отношении предотвращения обострений.
К сожалению, клиническая практика не располагает нацеленными лечебными средствами на ускорение фибротизации и оссификации диска для завершения спондилодеза. Наоборот, некоторые лекарственные препараты, применяемые на этапе обострения остеохондроза, способны задержать процесс стабилизации структуры диска.
Каким образом, с точки зрения специалистов мануальной терапии, выглядит структура болевого синдрома? Необходимо заметить, что за рубежом проведено большое количество конференций, конгрессов по данной проблеме. В нашем изложении будут приведены обобщенные сведения о патологических факторах, вызывающих болезненные ощущения в позвоночнике, паравертебральных структурах и конечностях.
В основу этих представлений положен функциональный принцип классификации синдромов. Наиболее динамичными, как известно, являются функциональные сдвиги, приводящие в последующем к структурным изменениям. Этот принцип оказался плодотворным с нескольких принципиальных позиций. Во-первых, учитывался "функциональный" вес разных тканей, составляющих кинематическую цепь "позвоночник - конечности". Во-вторых, изначальный динамизм тканей определял этапы происхождения алгических синдромов. Как известно, наиболее динамичной структурой является мускулатура, определяющая активную кинематику всех элементов кинематической цепи. Наиболее статичной структурой, естественно, является костно-хрящевая. В-третьих, логика патогенетических связей соотнесена с принципом системной организации функции и детерминированием внутрисистемных патологических звеньев.
Тем самым определена взаимосвязь и взаимовлияние патологических сдвигов как в сторону позвоночника, так и от "него". Таким образом, в порядке убывающей частоты структуру болевого синдрома двигательного аппарата составляют миогенный, артрогенный, связочно-фасциальный и дискогенный факторы. Иначе говоря, миогенная боль сопровождает все виды болезненности, т.е. включается в оформление суставной, связочной и дискогенной боли. Это основа боли в двигательной системе, но она может быть представлена в "чистом" виде, т.е. без участия остальных трех факторов.
Соответственно, артрогенная боль всегда сопровождается миогенной, но участие связочного и дискогенного факторов не обязательно.
Таким же образом, связочная боль строится на основе мышечной и суставной, но может "обойтись" без дискогенной.
Дискогенная боль, как правило, сопровождается изменениями в мышечной, суставной и связочной структурах и несет в своей структуре все виды болезненности. Правда, при острой грыжевой компрессии в течение короткого времени (этап первичной боли) дискогенная боль может сопровождаться корешковой болью проводникового характера.
В этой связи подчеркнем, что боль при спондилогенных заболеваниях носит характер хронической, т.е. вторичной, дезадаптирующей боли.
Мышечная боль
Декларативный подход о признании активной роли мышц в биомеханике позвоночника оказался в разрыве от патогенетической роли мышечного фактора в заболеваниях позвоночника, в частности, в оценке боли. Активность мышц оценивалась с точки зрения возможности дефанса в стабилизации положения позвоночника (сколиоз) и тонических изменений при хронических заболеваниях позвоночника. С другой стороны, мышечная болезненность в "чистом" виде рассматривалась часто в отрыве от биомеханики позвоночника в структуре других заболеваний: миозит, миалгия, миопатоз и др. По существу, понятие миогенной боли было удобным с точки зрения терапевтического прагматизма, допускавшего применение различных лечебных средств, преимущественно местного характера, с целью устранения мышечной болезненности.
Миогенная боль может быть генерализованной и локальной. Патогенетической основой миогенной боли является контрактильный патологический механизм вообще, локальный мышечный гипертонус в том числе выступает в качестве генератора патологической рефлекторной системы. Генератор патологической активности в качестве ведущего механизма детерминантной системы в патологической регуляции мышечного тонуса способен навязывать свою активность не только отдельной мышце, но и целому региону, вплоть до всей мускулатуры спины. Следует подчеркнуть, что контрактильный фактор мышечной боли является ведущим.
Рассмотрим патогенез локального мышечного гипертонуса (ЛМГ) и этапы формирования мышечной боли.
Начальная стадия - остаточное напряжение мышцы. Пусковым моментом ЛМГ является статическая (изометрическая) работа минимальной интенсивности в течение длительного времени, в результате чего может произойти пространственная перегруппировка сократительного субстрата. При сильных и кратковременных нагрузках (динамическая работа) в мышце не происходит перегруппировка ткани, наступающее утомление мышцы препятствует этим двум изменениям. Итак, работа минимальной интенсивности может быть обусловлена рефлекторным напряжением мышцы при хронической патологии внутреннего органа, воздействии холода на кожу (рефлекторное напряжение), при дефектном моторном стереотипе, поражении позвоночника и пр. При длительной статической работе минимальной интенсивности (позно-тоническая, установочная активность) происходит сложная перестройка в функциональной деятельности нейромоторной системы. Прежде всего это пространственная деформация работающей мышцы. Наиболее сильная часть мышцы растягивает наименее тонкую и слабую - известный физиологический феномен (Беритов И.С., 1947). Более того, медленные мышцы, обеспечивающие статические функции, являющиеся низкопороговыми, вовлекаются первыми. По представлениям D.Simons (1995), это место соответствует зоне концевой пластинки (end plate zone) - месту наибольшего скопления нервно-мышечных соединений. Автор в этой зоне обнаружил "шум концевой пластины" (end place noise), соответствующий биоэлектрической активности двигательной точки мышцы. Вследствие этого менее иннервируемые участки растягиваются больше, чем "сильные" участки, хотя сократительный процесс охватил все участки в одинаковой степени. В мышечных волокнах конической и перистой формы наиболее толстая, сильная часть при возбуждении сокращается, а тонкий сухожильный конец растягивается. При снятии напряжения эта деформация исчезает в силу естественной эластичности мышцы. Расслабление мышцы, как известно, - акт пассивный, обусловленный ее физико-химическими свойствами и состоянием антагониста. Период расслабления используется для отдыха мышцы, т.е. для восстановления энергетического резерва, лабильности, систем торможения и др. Это и есть физиологическая мера (саногенетическая реакция) адаптации двигательного аппарата в естественных условиях деятельности по И.П.Павлову.
При продолжительной работе, даже минимальной по интенсивности, резервные возможности, особенно при кратковременной паузе, не успевают обеспечить исходные физиологические параметры моторного субстрата. Остаточное напряжение - сформированная пространственная деформация части мышцы в ее слабой части - сохраняется. Это происходит по мере продолжающейся статической работы. Не исключаются и другие сопутствующие механизмы - биомеханические, биофизические, морфологические, иммунные, развертывающиеся в тканях. Особо следует отметить нарушение кальциевого обмена. По представлениям G.Simons (1995) и S.Mense (1995), избыточное содержание ионов кальция в пресинаптической щели и саркоплазме мышцы поддерживает сократительный процесс. Нарушение кальциевой помпы, поддерживающей физиологическое равновесие ионов синаптической щели и саркоплазмы, способствует усугублению первоначальных патологических сдвигов сократительной активности. Вторично возникающие нарушения микроциркуляции подкрепляют возникшее патологическое кольцо изменений биохимических реакций. Таким образом, возникшие нейрональные и биохимические сдвиги на местном, тканевом, уровне могут взаимно патологическим образом усилить друг друга вследствие суммации наступающих изменений. Разумеется, этот процесс может явиться местным лишь на короткий отрезок времени.
Таким образом, в результате этих процессов, при возникновении новой волны возбуждения сложившаяся деформация мышцы не только сохраняется, но и подкрепляется. Это, в свою очередь, приводит к дальнейшим пространственным искажениям в архитектонике не только сократительного субстрата, но и рецепторного аппарата, в первую очередь, мышечных проприорецепторов. В этих условиях создаются условия для рассогласования проприоцептивной импульсации с последовательных участков мышцы, имеющей растянутую и сжатую части. Этот участок является наиболее напряженным с точки зрения морфологической ориентации мышцы и афферентной иннервации при прочих условиях функционального состояния. Рецепторный аппарат в этой зоне может оказаться в сложных условиях функционирования - перерастяжение одних участков при относительном сжатии других, находящихся в зоне формирующегося гипертонуса. Это вызывает разнонаправленную деформацию рецепторов, принадлежащих одному и тому же афференту группы Iа или II.
Основное направление афферентной дезорганизации заключается в дефиците и дисбалансе импульсации динамической и статической модальности. Неадекватная импульсация, преодолевая контроль на входе в сегментарный аппарат вследствие своей продолжительности (импульсация по нейронам типа Iа практически интрасегментарно не тормозится) способна вызвать длительную активность aльфа-мотонейронов. Эфферентная импульсация, поддерживаемая этим процессом, способствует усугублению местных пространственных изменений архитектоники мышцы.
Изменившиеся условия деятельности периферического аппарата нейромоторной системы закономерно влияют на функциональное состояние сегментарных систем обеспечения движения. Вероятно, они в первую очередь направлены на восстановление физиологических и морфологических параметров этой мышцы. Исчерпывание ресурса по восстановлению исходного состояния двигательной единицы означает включение механизмов, направление действия которых следует обозначить как патологическое. Начало этого процесса лежит в искажении проприоцептивной импульсации на границе участка мышцы с остаточной деформацией и нормальной структурой.
В условиях постоянной искаженной афферентации прежде всего ослабляются тормозные процессы, снижается лабильность нервно-мышечного аппарата. Итогом сложных нейродинамических процессов, которые происходят в сегментарном аппарате, является рефлекторное повышение тонуса всей мышцы, содержащей ЛМГ. Это лежит в основе дезорганизации коррекционного (кольцевого) типа построения движений (по Н.А.Бернштейну). Суммарная афферентация из пораженного позвоночника и внутренних органов способствует межсегментарному взаимодействию с рефлекторным повышением мышечного тонуса и с изменением координационных отношений мышц-антагонистов, способствующих развертыванию патологического динамического стереотипа.
Таким образом, проторяется путь проприоцептивного постоянного рефлекса, имеющего явно патологическое значение в деятельности мышцы. Искажение архитектоники терминалей двигательных единиц в зоне гипертонуса является следствием этого патологического рефлекса и причиной последующих пространственных перестроек мышечного пучка - фасцикула.
Очевидно, что афферентная дезорганизация деятельности сегмента меняет также вегетативное обеспечение движения вследствие изменения тонуса симпатических центров бокового рога. Накладываясь на изменение нейротрофического контроля мышц со стороны нейрона, т.е. трофических функций нейрона, оба этих механизма способны обусловить новое звено в патогенезе миогенных триггерных пунктов. В общем виде можно представить этот процесс как сочетание первоначальных патологических нейрональных и последующих биомеханических изменений в структуре контрактильного аппарата. В этой связи как естественное звено патогенеза миогенных триггерных пунктов выступает нарушение функции Ca - помпы в поддерживании нормальной контрактильной активности саркоплазмы (D.Simons, 1984). Напомним, что по представлениям D.Simons, в результате повреждения саркоплазматического ретикулума в мышечном волокне возникает область локального повышения концентрации ионов кальция, которые, используя энергию АТФ, вызывают сокращение отдельных саркомеров, формирующих участок устойчивой контрактуры. В зону микротравмы (?!) выделяется большое количество тромбоцитов - источников серотонина и других биологически активных веществ, способствующих спазму и химической сенсибилизации свободных нервных окончаний.
Сведение всей сложности описываемых процессов лишь к патологии местных и спинально-сегментарных механизмов обеспечения движения было бы явным упрощением проблемы. Сложность ее заключается не только в многокомпонентности заинтересованных структур и определении связи явлений, но и в том, что описанные процессы находятся под сильным влиянием супрасегментарных структур. Очевидно, что в патогенезе гипертонуса реализованы все системы управления движением. Учет множества функциональных уровней, задействованных в патогенезе миофасцикулярного гипертонуса, позволяет считать локальное повышение мышечного тонуса как проявление установочной активности, т.е. позно - тонической функции в патологических условиях.
Таким образом, прослеживаются пути рефлекса, включающего деформированный проприоцептивный аппарат, пути глубокой чувствительности, сегментарный аппарат спинного мозга и структуры головного мозга, эфферентные нисходящие пути (ретикулоспинальный, руброспинальный, пирамидный), передний и боковой рога спинного мозга, двигательный нейрон с деформированной территорией двигательной единицы. Устойчивое патологическое состояние этой системы знаменует собой завершение формирования периферической детерминантной структуры, генератором которой является миофасцикулярный гипертонус. Патофизиологическая активность гипертонуса характеризуется триггерным феноменом, являющегося показателем клинической активности патологического субстрата.
Указанные особенности ЛМГ позволяют считать его генератором периферической детерминантной структуры. По мере формирования генератора патологического возбуждения в сегментарном аппарате спинного мозга облегчение рефлексов может быть значительным и превышать нормальное значение в 5-10 раз. В свою очередь, сами гипертонусы формируются при средней форме детерминации в условиях сравнительно небольшой мощности генератора и при относительно небольшом ослаблении тормозного контроля в регуляции собственной активности структур спинного мозга. Неполное детерминирование лежит в основе постуральных мышечно-тонических синдромов.
При полном детерминировании в условиях наличия мощного генератора и существенного снижения тормозных процессов формируются синдромы, в основе которых лежат нарушения реципрокных взаимоотношений мышц-антагонистов, являющихся основой патологического динамического стереотипа. Примерами этой формы являются плече-лопаточный периартроз в начальных проявлениях (до присоединения тканевых дистрофических процессов), так называемые синдромы перетруживания, мышечно-тонические синдромы при спастической кривошее и пр.
Особое место в патогенезе отводится механизмам формирования болезненности и уплотнения. Формирование локальной боли и мышечного напряжения следует считать процессом взаимообусловленным. Нарушение соотношения проприоцептивной и экстрацептивной (интрацептивной) импульсации в работе заднего рога, как известно, является одним из важных звеньев в формировании боли. С точки зрения нейрофизиологии следует говорить об ослаблении пресинаптического торможения клеток широкого динамического ряда (2-4 слои Рекседа) специфическими нейронами, которые в свою очередь снабжены проприоцептивными афферентными влияниями. При дефиците проприоцепции, как и при диссоциации модальностей, пропускная способность клеток ШДР импульсов, доставляемых с кожи, внутренних органов, аппарата движения (фоновый сенсорный поток) повышается, тем самым эффективность воротного контроля снижается. Этот механизм хорошо известен в клинической практике: протопатическая, вторичная боль обязана своим происхождением нарушению проприоцепции. Такие условия создаются при полном или частичном выпадении глубокой чувствительности при поражениях спинного мозга и периферических нервов. В нашем случае дефицит проприоцепции и ее искажение формируются вследствие деформации рецепторного аппарата и изменения условий рецепции. Ослабление сегментарных механизмов торможения афферентации из участка деформации мышцы означает преобразование этого потока в ноцицептивный, т.е. его качественное изменение без повышения общего уровня. Тем самым продолжается образование детерминантной системы восходящего направления. Результатом соподчинения релейных станций различного уровня, ответственных за обработку афферентации ноцицептивного характера и активацию соответствующих механизмов антиноцицептивной системы, является патологическая устойчивая алгическая система.
Заинтересованность самых высоких уровней центральной нервной системы прослеживается многочисленными клиническими фактами. Болезненность миофасцикулярных гипертонусов находится в большой зависимости от эмоционального состояния пациента. Депрессивные и фобические реакции, как правило, усиливают местную мышечную боль. Известны псевдокардиалгии, обусловленные гипертонусами мышц передней стенки грудной клетки, усиливающиеся в покое, ночью, а не в период физической и психической активности пациента. Очевидно, что уровень эмоциональной аффективной окраски локального гипертонуса в покое совершается более интенсивно в состоянии физического и психического покоя, т.е. в условиях освобождения афферентных каналов от импульсации отдыхающего локомоторного аппарата. Вероятно, снижение порога возбудимости надсегментарных структур может объяснить феномены усиления мышечной боли при тревоге, фобиях и других эмоциональных реакциях негативного характера.
Предположение об образовании в зоне гипертонуса биологически активных веществ, ответственных за происхождение местной болезненности, оказывается малоубедительным с точки зрения быстроты исчезновения болезненности при проведении мануальной терапии (релаксации). Достигаемый аналгетический эффект в течение нескольких секунд с одновременной миорелаксацией не может быть обусловлен нормализацией биохимического состава в зоне гипертонуса. Тем более, многочисленные гистологические и гистохимические исследования, предпринятые в нашей стране и за рубежом, не позволили утвердительно доказать наличие специфических дистрофических изменений как в мышцах, так и в соединительнотканных элементах. При гипертонусах, существующих продолжительное время, были обнаружены реакции тканей в виде фибротизации, пространственной абберации сократительного субстрата.
Суставная боль
К сожалению, участие суставов в механизмах болезненности рассматривалось в плоскости структурных (воспалительных, дистрофических) изменений в капсуле соприкасающихся поверхностей и околосуставных тканей. В последнее время, в связи с успехами мануальной терапии, роль суставов в происхождении болезненности пересматривается. Переоценка роли якобы дистрофических изменений оказалась перспективной в оценке роли остеохондроза диска, соотношения суставного и дискогенного компонентов в этой проблеме. Обнаруживаемые на рентгенограммах изменения суставов в виде субхондрального склероза, деформации суставных поверхностей, изменения некоторых анатомических пропорций, как бы привлекательно не объясняли некоторые клинические феномены, однако не смогли в полной мере представить динамику функциональных и последующих структурных изменений биомеханики позвоночника. Сказанное выше о несоответствии выраженности структурных изменений диска и клинических проявлений является справедливым и по отношению к суставам. Выход из этой ситуации виделся в приписывании дистрофических изменений периартикулярным тканям, являющихся по представлению авторов (Попелянский А.Я., 1980; Веселовский В.П., 1991) рентгенонегативными. Таким образом, понятие периартроза явилось попыткой установления функциональных расстройств суставов без видимых структурных изменений в патогенезе алгических синдромов. Представление о механизмах периартикулярных изменений, напоминающих трупное окоченение, в происхождении плече-лопаточного периартроза явилось конструктивным в установлении примата функциональных изменений над структурными в генезе боли (Попелянский Я.Ю., 1975). С установлением роли менискоидов в биомеханике сустава радикально изменилось представление о патогенезе ограничения функции суставов. Работами чешских исследователей J.Wolf, J.Kos (1946) было показано, что особые части синовиальной оболочки выполняют функции обеспечения трофики конгруентности сочленяющихся поверхностей. Они плотно прижимаются к соприкасающимся поверхностям вследствие отрицательного внутрисуставного давления (при вскрытии сустава менискоиды спадаются). Гистологически менискоиды представлены рыхлой волокнистой соединительной тканью с большим содержанием эластических волокон, покрытых эпителиальной тканью. Большая упругость менискоидов позволяет им быстро менять пространственное расположение вслед за суставными поверхностями. "Притирание" их осуществляется лишь за счет отрицательного внутрисуставного давления. Оно же бывает патогенетически важным во внезапных ущемлениях менискоида между суставными поверхностями при очень быстром снижении и восстановлении внутрисуставного давления после растяжения сустава. В таких условиях боковые поверхности менискоида оказываются втянутыми в свободное пространство между свободными поверхностями суставов. При быстром восстановлении исходного состояния суставных поверхностей упругость менискоидов не обеспечивает быстрый возврат тканей в нормальное состояние, и часть менискоида оказывается ущемленной. Эта ситуация патогенетически важна тем, что интенсивная афферентация из суставных тканей (суставные поверхности, менискоиды) вызывает реакцию периартикулярных мышц в виде немедленной контракции, что часто сопровождается отчетливым хрустом вследствие взаимного удара суставных поверхностей. Это состояние больные описывают как внезапное "заклинивание", "вступило в спину" и, как правило, отмечают этот звуковой феномен. Резко возникающая боль и ограничение движения знаменуют собой формирование суставной блокады - блокирования ПДС. На уровне блокады ПДС пальпаторно определяется дефанс глубокой мускулатуры в виде болезненного "желвака" самой разной протяженности, простирающийся до уровня соседних ПДС. При интенсивной ноцицептивной афферентации возможна генерализованная реакция длинной мускулатуры спины, что проявляется массивным дефансом.
В каких отделах чаще возникают блокады и всегда ли они являются патологическими?
Очевидно, что блокированию подвержены те ПДС, которые испытывают наибольшие физиологические нагрузки и перегрузки - это нижнешейные и нижнепоясничные ПДС, включая зоны переходов. Конечно, это не исключает возможности блокад в любом сегменте, где вообще возможны движения. Формирование блокировок - широко распространенное явление. Подавляющая часть их спонтанно разрешается без видимых клинических последствий. Лечебная гимнастика, массаж, растяжение мышц, тепловые процедуры и другие неспецифические воздействия способствуют ликвидации этих патологических состояний.
В ряде случаев блокировки суставов носят преимущественно саногенетический характер: они ограничивают движения в биомеханически неблагополучном ПДС. Под неблагополучными сегментами следует понимать аномалии суставного тропизма, псевдоспондилолистез вследствие гипермобильности, сужения позвоночного канала (особенно опасное при гипермобильности ПДС) и другие состояния. При развивающемся дегенеративном процессе в диске и нестабильности ПДС вследствие потери упругости формирующиеся блокировки носят защитный характер, ограничивая подвижность пораженного диска. В свою очередь, длительно существующие функциональные блокады суставов способствуют развитию остеохондроза. Следует подчеркнуть, что ограничение подвижности происходит не только за счет блокированной суставной пары, но и за счет локального дефанса, всегда сопровождающего функциональную блокаду. Остеохондроз диска как структурный процесс, направленный на стабилизацию ПДС, на его выключение из биомеханики, таким образом, подкрепляется стабилизирующими механизмами функционального генеза. Причинно-следственные же между ними отношения могут принять характер патологически устойчивой связи по типу "порочного кольца". В этом отношении разрешение функциональной блокады является полезным лечебным приемом. Трудность заключается в определении показаний и оценке характера блокады - не произойдет ли активация патогенетических циклов? Клиническое мастерство заключается не столько в прямом проведении технического приема (эта часть мануальной терапии, к сожалению, считается самой важной), сколько в чувстве меры, так необходимой в определении необходимости мобилизации и даже в отказе от нее. Увлечение техникой манипуляций с обязательным хрустом, якобы, показателем удачного "лечения", может в конце концов в описанной ситуации закончиться протрузией или пролапсом диска со всеми симптомами поражения. В этом одна из причин дискредитации мануальной терапии.
Фасциально - связочная боль
Доказано, что алгические триггерные участки могут локализоваться в этих отнюдь не пассивных образованиях. Они могут совершенно изолированно, реализовать свои контрактильные свойства без участия мышц, формируя локальные участки уплотнения. Скорость формирования локального связочного фасциального гипертонуса не соответствует скорости образования локального мышечного гипертонуса, но оба этих процесса являются нейрофизиологической и клинической реальностью (Reynolds M., 1961,.Лиев А.А, Иваничев Г.А., 1994). Известны алгические синдромы, связанные с укорочением (гипертонусом) связок таза (бугрово-остистой, бугрово-крестцовой), крестцово-подвздошного сустава, люмбодорзальной фасции, фасций отдельных мышц и др. (Веселовский В.П., 1991). Часто обнаруживаемые локальные гипертонусы люмбодорзальной фасции в области задней верхней ости таза ошибочно принимаются за дистрофические изменения (многочисленные гистологические исследования не обнаружили какие-либо специфические находки). Понятно то удивление, которое испытывает врач, сторонник подобных взглядов, как быстро исчезает дистрофия после проведения однократной лечебной релаксации, сопровождающейся полным исчезновением как уплотнения, так и болезненности. Аналогичные же лечебные эффекты достигаются после пункций иглой или насечки скальпелем.
Внимание к триггерным феноменам фасциально - связочного происхождения возникло сравнительно недавно (Reynolds M., 1961; Попелянский Я.Ю., 1974; Лиев А.А., 1990).
Первоначальные представления их приуроченности к сопутствующим изменениям мышц оказались справедливыми лишь отчасти. Более того, гипертонусы - триггерные пункты - могут формироваться и в надкостнице, где, как известно, мышечная ткань не представлена. Болевой рисунок, оформленный триггерными пунктами периостального происхождения, не имеет существенных отличий от фасциальной боли, за исключением, пожалуй, большего вегетативного компонента при этом виде боли.
Нейрофизиологические аспекты происхождения триггерных пунктов фасциально-связочно-надкостничного происхождения могут быть рассмотрены в двух аспектах.
Естественно, один из механизмов должен быть связан с естественной функцией этих тканей - с контрактильностью. Возможность укорочения и расслабления связок как рефлекторный процесс давно известна клиницистам. Физиологами этот процесс рассматривается как активный, реализуемый аналогичными структурами, какие имеются в мускулатуре. Только эти механизмы по длительности занимают несравненно большие интервалы, чем процессы мышечного сокращения (Reynolds M.D, 1981, 1983). Очевидно, что реализация контрактильности может быть в изолированных условиях, т.е. без участия мышц - к примеру, связки таза, конечностей, рубцы. Инициатором этих изменений могут быть тканевые биологически активные, часто алгогенные вещества. Происхождение их может быть связано с выделением их во время локальных воздействий на фасцию (связку, надкостницу), биохимических сдвигов в результате локальных метаболических нарушений и др. Этот вид фасциальных триггерных феноменов можно обозначить как первичный триггерный пункт. Очевиден и другой процесс, когда медленное укорочение фасций может изменить пространственное расположение интимно связанной с ней мышцы. В таких случаях гипертонус мышцы сопровождает первичное укорочение фасции. Такими фасциями являются люмбодорзальная, илиотибиальный тракт и некоторые другие.
По-видимому, описанный механизм в общей структуре формирования фасциально-связочной боли является не ведущим. В этом отношении определяющим является механизм сопутствующей мышечной активности. Это означает, что деформация фасциальных (связочных) элементов происходит вследствие изменения архитектоники, неизбежно сопровождающей локальный мышечный гипертонус. Поэтому патогенез локального мышечного гипертонуса следует считать ведущим в формировании фасциального гипертонуса, условно выделенного нами как вторичный фасциальный триггерный пункт. Естественно, фасциальный компонент этого процесса несравненно продолжительнее, чем мышечный. В этой связи нелишне подчеркнуть, что фасциальные структуры, как мягкий скелет, сопровождают многие мышцы за некоторым исключением (мимическая мускулатура, миокард). Справедливость этого предположения подкрепляется результатами проводимого лечения. Как известно, после постизометрической релаксации локальный мышечный гипертонус исчезает, но часто в толще расслабленной мускулатуры прощупывается уплотнение, являющееся частым объектом биопсий. Это уплотнение исчезает медленно после нескольких процедур ПИР или после применения специальных приемов (фасциотомия, оперативное удаление, фонофорез лекарственных веществ). Гистологическим доказательством соединительнотканного происхождения этих образований являются данные многочисленных исследований.
В результате световой (Целлариус С.Ф., Целлариус Ю.Г., 1979) и ультраструктурной микроскопии (Simons D., 1981) обнаружены неспецифические изменения сократительного субстрата, т.е. мышц, но на стадии длительно существующих уплотнений. В то же время в фасциально-связочных структурах какие-либо специфические изменения отсутствовали, за исключением анатомических находок, свидетельствующих об усилении фибропластических процессов.
В патогенезе первичного фасциально-связочного триггерного пункта решающую роль играет контрактильность самой фасции. Мы уже отметили, что в составе фасции содержатся активные элементы контрактильности (актин, миозин), существенно влияющие на функциональное состояние "пассивных" элементов - эластических и коллагеновых волокон. Сокращение участков фасции, апоневроза, связки может осуществляться как местный контрактильный процесс под влиянием биологически активных веществ, прежде всего ионов кальция, брадикинина, гистамина и др. Особую роль в этом процессе играют ионы кальция, которые могут появиться в результате микротравм, воспалительных процессов, аллергических реакций. Отсутствие эффективного гемато-фасциального барьера делает особо уязвимым этот вид тканей по отношению к агрессивному влиянию активных биологических факторов. Указанная особенность фиброзных структур позволяет понять стереотипность возникающих реакций. Функция раздражимости соединительной ткани, естественно, реализуется сократимостью отдельных участков или всего фасциального ложа. Как показано в эксперименте (Татьянченко В.К.,.Лиев А.А, 1992), наиболее активными участками этого процесса являются "ворота", т.е. места наибольшего скопления нервно-сосудистых структур и сократительных элементов, играющих роль своеобразных сфинктеров. На этом, начальном, этапе структурная перестройка фасций отсутствует, и болевые феномены, включая триггерные, слабо выражены и нестойки или практически не встречаются. Следующий этап формирования первичных ФСТП характеризуется нарастанием структурных изменений. Эта стадия соответствует развернутым клиническим симптомам - локальному уплотнению фасций, местным и отраженным болевым феноменам, включая триггерные, а также комплексу разнообразных вегетативных нарушений. Алгический рисунок при ФСТП имеет все признаки вторичной боли. При этом болезненность ФСТП имеет несколько аспектов: 1) раздражение ноцицепторов биологически активными веществами в триггерной зоне, т.е. теми агентами, которые его вызвали. Но действие этих агентов ограничено временем: тканевые буферные системы вызывают нейтрализацию этих веществ, сводя их активность к минимуму. 2) Участие механизмов взаимодействия различных афферентных систем. Участок гипертонуса фасции становится местом стойкой деформации проприорецепторной системы с изменением качественных характеристик афферентного взаимодействия в сегменте спинного мозга. В результате этого взаимодействия формируется детерминантная алгическая система, генератором которой является фасциальный триггерный пункт. Есть основания полагать, что патологическая афферентация по волокнам типа Iб и III (проприоцепция из фасциально-связочных структур) вызывает в сегментарном аппарате спинного мозга сходные патологические изменения, описанные нами в разделе "мышечная боль". Детерминантная система с ее периферическим фасциальным гипертонусом является патологической устойчивой системой, способной реализовать свое влияние как на спинальном уровне, так и в восходящем направлении. Результаты отдаленных рефлекторных и нерефлекторных взаимодействий могут включаться в эту патологическую систему по типу функционирования порочного круга, усугубляя первичные изменения. Участие сегментарных структур контроля боли выражается в формировании вторичных или третичных генераторов патологически усиленного возбуждения в нейронных группах ствола мозга. Следствием этого может являться как активация антиноцицептивной системы этого уровня, так и колебание интенсивности болезненных проявлений от минимальных до значительных. Таким образом, фасциально-связочный триггерный пункт, как и миогенный, является многоуровневой патологической устойчивой системой, включающей местные, сегментарные и супрасегментарные звенья.
Вторичные ФСТП формируются, в основном, в тех структурах, которые являются динамической принадлежностью мышечной ткани (фасциальные отроги, листки, апоневрозы). Они возникают вслед за формированием миогенного триггерного пункта, о механизмах которого речь шла выше. В патогенезе миогенных триггерных пунктов участвуют фасциальные структуры, составляющие кинематическое единство с сократительным субстратом мышечной ткани. На начальном этапе превалируют местные изменения фасциальных отрогов, сопутствующие активности мышцы. Надо полагать, что режим работы мышцы (изометрический или изотонический), в отличие от описанного выше процесса, принципиального значения не имеет. Важна остаточная деформация мышцы по всей длине футляра. Она как более инертный элемент нейромоторной системы реагирует на деформацию мышцы позднее и "расправляется" при исчезновении мышечного уплотнения в результате деятельности физиологических мер защиты. Продолжение этого "десинхроноза", а так же кумуляция остаточных деформаций фасции создает базу для грубого искажения проприоцепции из фасциальных отрогов. Тем самым получает подкрепление дисфункция систем построения движения и коррекции движений на уровне сегментарного аппарата спинного мозга. Результатом этой дисфункции является не только боль, но и изменение нейротрофического контроля зоны деформации. В хроническом эксперименте (Татьянченко В.К., Лиев А.А., 1991) доказано, что нарушение трофики фасций наступает в 2-2,5 раза раньше, чем это совершается в мышцах, имеющих большой диапазон адаптационно-компенсаторных возможностей. В этом состоит принципиальное отличие формирования ФСТП от МТП. Изменение нейротрофического контроля сегментарного аппарата спинного мозга в свою очередь совершается путем патологической реализации моторно-висцеральных рефлексов. Известно, что для поддерживания тонуса вегетативных центров спинного мозга, так и для активности мотонейронов, необходим достаточный в количественном и качественном отношении уровень проприоцепции. Нарушение этого принципа ведет к хорошо известным синдромам гипокинезии. В нашем же случае, речь идет не о тотальных, глобальных нарушениях проприоцепции, а о фрагментарных. Таким образом, в наиболее общем виде дисфункция сегментарного аппарата вызывает локальное уплотнение, локальную боль и локальную дистрофию. В последующем весь спектр очерченных нами патологических изменений получает то развитие, о чем мы уже писали.
Дискогенная боль
Этот раздел вертеброневрологии наиболее изучен. К сожалению, существует тенденция к упрощенному расширению понимания роли диска в формировании многочисленных клинических синдромов ("распространенный" остеохондроз). Все болевые проявления рассматривались как результат множественных дископатий соответственно всем болевым зонам. Тем самым, очевидны надуманность, преувеличение дискогенной боли. С другой стороны, существует другая точка зрения - полное отрицание роли диска в происхождении боли. Основой такого подхода является клиническое несоответствие значительных структурных изменений диска и отсутствие соответствующих симптомов его поражения. Этот "нигилизм" в отрицании роли диска так же непродуктивен, как переоценка его роли в генезе боли спины. Логика развития рентгенологических изменений и клинических синдромов совпадает лишь на коротком отрезке времени. На начальных этапах патологического процесса при отсутствии рентгенологических находок болевые и другие проявления ПДС создают видимость грубого поражения диска. В таких случаях обычно выставляется диагноз "рентгенонегативный" остеохондроз. На следующем этапе заболевания выраженности клинических проявлений и рентгеновских изменений совпадают, и для этой стадии разработаны многочисленные алгоритмы диагностики, классификационные признаки, схемы лечения.
Третий этап процесса характеризуется несоответствием клинических и рентгенологических характеристик: грубые дегенеративно-дистрофические проявления не сопровождаются болью.
Внутренняя связь этого явления может быть понята лишь с позиций признания возможности перехода функциональных изменений в структурные. Этот подход предопределяет развитие и взаимообусловленность факторов, вызывающих болевые синдромы, от наименее легких до значительных. Так, миалгия, локальная и генерализованная, не сопровождается первоначальными структурными изменениями в мышцах, т.е. в самом контрактильном аппарате, а создает предпосылки к дисфункции и последующим структурным изменениям как в самой мускулатуре, так и биомеханически соответствующих суставах. Функциональные блокады суставов, возникающие при дисфункции сегментарной мускулатуры, вызывают морфологические изменения суставных поверхностей, которые вначале носят характер дистрофических изменений, в последующем компенсаторно склерозируются. Эти функционально-структурные изменения создают основу дегенеративно-дистрофического характера поражения диска, т.е. остеохондроз. Биологическое значение этого локального процесса конкретно: выключение пораженного ПДС из движения. В этом смысле остеохондроз позвоночника является саногенетическим процессом, имеющим в своем развитии критические этапы, когда фибропластические процессы отстают от процессов деструкции диска. Иначе, клиническая актуальность остеохондроза определяется протрузией (пролапсом) диска и ирритативными процессами, источник которых может быть как в пределах позвоночного канала, так и вне его. Выключение диска из движения осуществляется окончательной его оссификацией, экзостозами между телами позвонков, т.е. грубыми структурными изменениями, являются свидетельством "выздоровления" ПДС - ортопедической компенсацией его функций. Таким образом, цепь структурных изменений, определенная первоначальными функциональными нарушениями, обрывается.
Кожные гипералгетические зоны
Естественно, гипералгезия кожи в области позвоночника и близлежащих областей как боль в спине больными не оценивается. Часто эти зоны по интенсивности значительны и могут стать причиной серьезных изменений в эмоционально-аффективной сфере. Многим хорошо знакомая, но плохо диагностируемая гиперестезия кожи в зоне наружного кожного бедренного нерва может быть настолько сильной, что больные теряют трудоспособность. Следует заметить, что кожная гипералгетическая зона (КГЗ) своей необычностью и стойкостью, отличающихся от онемения и парестезий при "пересидении" в сочетании с локальным уплотнением кожи являются фактором невротизации и ипохондрических изменений личности.
Клиническая идентификация этих участков достаточно проста. Зона КГЗ может быть самой разной величины и формы, часто не совпадающая с территорией чувствительной иннервации. В клинической практике больше известны описанные в прошлом столетии Гедом и Захарьиным участки КГЗ при заболеваниях внутренних органов. Особую популярность эти зоны приобрели в диагностике кардиальной патологии.
Происхождение зон Захарьина-Геда довольно простое. Сегментарное соответствие афферентных входов из внутреннего органа или его части и дерматома создают нейрофизиологическую основу КГЗ. При избытке интероцептивной афферентации, т.е. перегрузке клеток заднего ряда ноцицептивными сигналами и ослаблении их торможения, часть этих импульсов "перетекает" в расположенные рядом группы нейронов, ответственные за проведение чувствительности из соответствующего дерматома. В итоге в зону этого дерматома проецируется боль, интенсивность которой зависит от интенсивности ноцицепции из пораженного органа. Следует отметить, что гипералгезия часто не испытывается в зоне всего дерматома, а на ограниченном участке, что может создать трудности в интерпретации полученных данных.
Совершенно не изученным в вертеброневрологии явлением остается роль КГЗ в диагностике поражений позвоночника и паравертебральной мускулатуры. Очевидно, что формирование КГЗ должно подчиняться тем же закономерностям, которые лежат в основе висцерально-дермальной боли. Клиническое значение КГЗ в диагностике острой вертебральной боли, естественно, ничтожно в сравнении с массивными мышечно-тоническими и нейродистрофическими нарушениями.
Совершенно иная ситуация складывается при хронической боли позвоночника и его мягких тканей. Часто обнаруживаемые КГЗ могут иметь топическое значение в локализации патологического процесса, что важно в диагностике уровня не только пораженного ПДС, но и сопутствующих изменений соседних, а так же удаленных ПДС и мышц. Эти зоны пациентами могут определяться как болезненные выбухания кожи. Они располагаются обычно вдоль позвоночника на участке кожи, соответствующем зоне мышцы-разгибателя спины. Иногда КГЗ располагаются точно над участком триггерного пункта глубоких мышц.
Диагностика указанных зон проводится методикой скользящей поверхностной пальпации кожи с обнаружением феномена "прилипания" скользящих пальцев к коже. Объясняется названный феномен пиломоторным эффектом в зоне КГЗ. Локально определяемая шероховатость кожи и сопротивление скольжению создают впечатление "шагреневой кожи". Особенно полезно использование этого теста в предварительной диагностике по выявлению зон возможных функциональных блокад ПДС и гипертонусов паравертебральной мускулатуры.
Триггерные феномены в медицине
В последнее время в представление клиницистов включаются те понятия, которые считались чисто теоретическими. Одно из них - концепция генераторных систем. Их роль достаточно подробно изучена в эпилептологии, в генезе некоторых болевых синдромов, нарушений поведения. К сожалению, существующая терминологическая разница (устойчивое патологическое состояние, генератор детерминантной системы, ауторитмика нейронов, триггерные пункты и др.) создает видимость принципиальных отличий в сути. На самом же деле роль идет о нейрофизиологических феноменах возбудительного процесса, характеризующихся патологической устойчивостью, повторяемостью, подчиняемостью нейронных центров при слабости тормозных процессов с соответствующими им клиническими синдромами. Если в патологии центральной нервной системы роль генераторных структур в развитии болезненных состояний изучена экспериментально и в условиях клиники, то в патологии органов локомоции им незаслуженно не уделяется должного внимания. К сожалению, признание наличия триггерных пунктов периферической локализации ограничилось чисто клиническими рамками. Установлены их локализация, симптоматика, динамика признаков, в ряде случаев предпринимались морфологические исследования. Понятия типа фиброзит, периостит, фиброз, нейродистрофия и др. (более 25 названий) отражали несовершенство классификационного признака, а также патогенетической интерпретации наблюдений клинических феноменов.
Естественно, клиническая классификация триггерных зон должна основываться на схеме распределения чувствительности, существующей в классической неврологии. Исходя из этого можно выделить экстрацептивные, проприоцептивные и интрацептивные триггерные зоны.
Экстрацептивными триггерными зонами являются кожные гипералгетические зоны, характеризующиеся уплотнением кожи, снижением электрокожного сопротивления, локальными вазомоторными расстройствами.
Триггерные зоны на слизистых оболочках могут располагаться в полости рта, конъюнктивы. Клинические проявления их достаточно изучены в клинике тригеминальной невралгии.
Проприоцептивные триггерные зоны - мышечные (миофасцикулярные), сухожильные, фасциальные и надкостничные.
Интероцептивные триггерные зоны (сосудистые, бронхиальные, кишечные). Разумеется, что речь идет об интерорецепторах и их совокупностях, приобретших свойство самовозбуждения и параксизмальности, что имеет принципиальное значение в разделении сегментарной и триггерной боли.
Экстрацептивные триггерные пункты структурно представлены группами рецепторов кожи и слизистых. В нейрофизиологическом отношении они характеризуются повышенной электрической проводимостью, низким порогом возбуждения и способностью к серии разрядов (повторная деполяризация мембраны рецептора после однократного раздражения). В строгом смысле термин "экстрацептивный триггерный участок кожи" характеризует периферическую сенсорную систему, активируемую раздражителями любого качества - специализированные рецепторы принимают характер полимодальных рецепторов.
Как уже говорилось, в патогенезе миогенного триггерного пункта основное место отводится статической (позно-тонической) работе мышц минимальной интенсивности в течение длительного времени. В результате этого происходит пространственная перестройка сократительного субстрата мышц с изменением проприоцепции, в результате чего происходит общее снижение уровня проприоцепции и ее диссоциация в афферентации статических и динамических характеристик движения. Ослабление тормозных механизмов в сегментарном аппарате создает нейрофизиологическую основу самовозбуждающейся гиперактивной системы, поддерживаемой с периферии искаженной проприоцепцией. Так возникает миогенный генератор патологической активности, т.е. миогенный триггер.
Напомним основные клинико-нейрофизиологические свойства миогенных триггерных пунктов. Прежде всего, уплотнение мышечной ткани самой разной формы и величины (от нескольких мм до см). Локальная болезненность может быть выражена в виде боли, провоцируемой растяжением или давлением, вплоть до выраженных спонтанных алгий, лишающих пациента трудоспособности.
Патогенез триггерных механизмов соединительнотканного происхождения принципиальных отличий от патогенеза миогенного триггера не имеет. Разница заключается в скорости образования местного уплотнения фасции, связок, надкостницы. Известно, что скорость сокращения контрактильного субстрата фасций значительно уступает скорости сокращения мышц. Во-вторых, следует учесть, что сокращение мышцы сопровождается не только деформацией мышечного контрактильного субстрата, но и фасциального каркаса мускулатуры. Естественно, когда остаточная деформация мышцы сохраняется на длительный срок, она сопровождается деформацией ее соединительнотканного (опорного) аппарата. Основное же отличие в клинике заключается в том, что сформированный фасциальный триггер обладает значительной интенсивностью, стойким уплотнением (не исчезающим после обычных приемов релаксации мышц), локализацией, часто не соответствующей мышечным пучкам и местам их прикрепления. Трудные для лечения ситуации складываются в случаях расположения фасциальных триггеров в глубине мышечных групп, в межфасциальных перемычках или на внутреннем листке собственной фасции.
К сожалению, клиническая и нейрофизиологическая идентификация висцеральных триггерных пунктов представляет собой большую методическую трудность. Дело заключается не только в отсутствии надежных пальпаторных методик выявления, но и в крайней вариабельности их как по интенсивности, локализации, а также перекрыванию (мультипликации) проявлений триггеров различной локализации. Возникающие очаги висцеральной патологии ирритации, несомненно, генераторного характера, не всегда манифестируют себя болью, тем более локальной. Зато хорошо известны результаты взаимодействия триггеров висцерального происхождения в образовании миофасцикулярных гипертонусов скелетных мышц. Это взаимодействие развертывается на базе нормальных висцеро-моторных соотношений. Висцеральный афферентный поток, конвергируя с проприоцептивным на входе в сегмент, существенно меняет рефлекторные механизмы сокращения скелетной мускулатуры. В итоге этого длительного взаимодействия в поперечно-полосатой мускулатуре запускается цикл формирования миофасцикулярного гипертонуса, о механизмах которого уже говорилось.
В нейрофизиологическом отношении в характеристике триггерных пунктов периферической локализации следует добавить следующее.
Во-первых, триггерные пункты периферической локализации в составе сенсорных структур характеризуются низким порогом возбудимости. В результате этого активация сенсорной системы может происходить при воздействии адекватных раздражителей минимальной интенсивности. По этой же причине теряется специфичность рецептора-триггера: он способен возбуждаться в результате воздействия различных стимулов, которые в норме рецепторами этой группы мышц не воспринимаются. Крайним выражением этого патологического процесса является самовозбуждение рецепторов, что может быть только в результате значительного уменьшения величины критического порога деполяризации мембраны и увеличения времени следовой деполяризации.
Во-вторых, сама клетка сенсорного нейрона, находясь в условиях повышенной функциональной активности под влиянием гиперактивной рецепции, реализует свою активность единственно возможным путем - проведением возникшего потока импульсов на другие нейронные группы. Это является свидетельством снижения, прежде всего, пресинаптического торможения в самой клетке, т.е. в первичном афференте. Как показано Г.Н.Крыжановским (1980), это является условием формирования патологической генераторной системы в районе заднего рога. Возникший генератор способен навязывать свою активность другим нейронам, находящимся с ним во внутрисистемных отношениях; складывается детерминантная система восходящего направления алгического характера.
В-третьих, иррадиация возбуждения из генератора не только восходящего характера, но и поперечного направления создает условия патологического межсистемного взаимодействия. Это значит, что под влиянием сенсорного генератора модулируется активность мото-, вегетативных и тормозных нейронов в пределах сегментарного аппарата. В клиническом отношении это означает возникновение патологических мышечно-вегетативных рефлекторных реакций ("гусиная" кожа на ограниченном участке тела, нарушение потоотделения, терморегуляции, изменение электрокожного сопротивления и пр.), мышечно-мышечных патологических взаимодействий с появлением генерализованных тонических реакций и др. Основной результат деятельности этой патологической системы, прежде всего, заключается в существенном ослаблении активности антиноцицептивной системы (АНЦС) на уровне входа в сегментарный аппарат - снижение активности механизмов "воротного контроля". По-видимому, этот механизм не является единственным. Формирование генератора патологического усиления в нейронах заднего рога спинного мозга знаменует собой качественно иную стадию снижения активности АНЦС этой локализации. По нашим представлениям, активирующим и поддерживающим механизмом этого процесса является дисбаланс проприоцептивной афферентации из триггерных пунктов в мышцах, фасциях и др. Доказательством тому служит наличие мышечной болезненности у больных сирингомиелией, где при абсолютном дефиците экстрацептивной импульсации сохраненная проприоцепция должна бы обеспечить эффективную активность "воротного контроля", однако этого не происходит. Нами показано, что в зоне мышечного гипертонуса-триггера выявляется диссоциация проприоцепции статической и динамической модальности. Восстановление исходного уровня проприоцепции в результате релаксации гипертонуса устраняет и местную боль. Дисбаланс проприоцепции на фоне общего снижения ее уровня мы считаем существенным элементом в механизмах поддерживания активности генераторов патологического усиленного возбуждения, каким являются триггерные пункты в пределах периферической нервной системы. Физиологической основой снижения общего уровня проприоцепции и ее качественного изменения является пространственная абберация проприорецепторов в зоне гипертонуса в мышце, фасции, надкостнице. Очевидно, что ослабление эффективности АНЦС других уровней способствует формированию алгических синдромов перманентного или пароксизмального характера.
Личностно-эмоциональное оформление болевых проявлений, в том числе и триггерных, как известно, формируется при участии лимбической системы. Клинических иллюстраций тому множество. Это, прежде всего, увеличение болезненности мышечных участков в покое, при эмоциональных реакциях негативного характера, тревоге, ипохондрических реакциях. В состоянии покоя, естественно, общий уровень проприоцепции резко уменьшается, что сказывается снижением активности АНЦС сегментарной и супрасегментарной локализации, когда порог возбудимости этих систем может быть и не изменен. В условиях же изменения центральной регуляции активности АНЦС при невротических реакциях даже измененный проприоцептивный поток с периферии может существенно исказить личностную оценку мышечной и другого вида боли.
Даже простой перечень разновидностей триггерных пунктов показывает обширность возможных лечебных приемов. Снижение возбудимости или выключение рецепторных элементов достигается применением средств, повышающих порог критической деполяризации мембраны и блокирующих проведение возникшего сенсорного импульса. Эти средства хорошо известны: местные аналгетики, охлаждающие, обволакивающие препараты, "мягкая техника" мануальной терапии, некоторые виды электропроцедур. В нашу задачу не входит обзор механизмов лечебного действия различных веществ и средств. Сосредоточимся лишь на нейрофизиологических механизмах периостальной акупунктуры (фасциотомии), привлекающей в последнее время большой интерес как практиков, так и теоретиков мануальной терапии и акупунктуры. Суть дела заключается в том, что глубокий укол или надрез специальным скальпелем (диаметр лезвия 1,5 мм) кожи и глубоких тканей (иногда в результате биопсии), часто не соответствующих классическим точкам акупунктуры, вызывает более или менее продолжительную аналгезию этого места. Надежная аналгезия достигается при точном надрезе наиболее активного триггерного пункта.
Во время процедуры игла (лучше толстая) или специальный скальпель встречает довольно интенсивное сопротивление ткани, надрез в глубине тканей сопровождается отчетливым хрустом. Следует отметить, что предварительное введение местных аналгетиков уменьшает длительность последующей аналгезии. Неточность в выборе места надреза, промах при фасциотомии также уменьшают эффект процедуры.
Нейрофизиологический анализ эффекта аналгезии позволяет предположить несколько механизмов. Во-первых, активация АНЦС происходит естественным путем - нанесением ноцицептивного раздражителя как на кожу, так и глубокие ткани. Известно, что избыток ноцицептивной афферентации вызывает активацию пресинаптического торможения на входе в сегментарный аппарат спинного мозга (торможение клеток "широкого динамического ряда"). Реализуется этот вид торможения, по-видимому, с использованием механизмов возвратного торможения сенсорного потока в полимодальных клетках заднего рога. Этим объясняется быстро возникающий эффект местной аналгезии. Но она так же быстро проходит. Это нейрональная фаза аналгезии. Более длительная аналгезия достигается при формировании очага вторичной боли в месте триггерного пункта, что активизирует механизмы гуморального компонента АНЦС за счет повышения активности эндогенных опиатов как на уровне сегментарного аппарата, так и ствола головного мозга.
Однако, как мы полагаем, эта схема недостаточно полно раскрывает суть развертывающихся процессов. Дело, по-видимому, заключается и в том, что происходит прирост вклада проприоцептивной афферентации в активацию АНЦС. Происходит это вследствие активации проприоцепторов в результате изменения их пространственной архитектоники - рассечение фиброзных тканей меняет их расположение. Кроме того, сопутствующая ограниченная гематома (отек) в области триггерного пункта как источник вторичной боли, оказывает давление на барорецепторы, вызывая их активацию.
Таким образом, "примитивный" надрез в глубине тканей вызывает целый ряд нейрофизиологических и нейрохимических процессов, последовательно проявляющихся нейрональной (кратковременной) и гуморальной (длительной) аналгезией триггерного пункта.
Естественно, разрушение восходящей детерминантной системы алгического характера возможно путем активации супраспинальных структур АНЦС. Прежде всего это относится к стволовым системам. Как известно, традиционная и современная медицина располагают для этого достаточными возможностями. Это акупунктура, особенно аурикулярная, являющаяся мощным фактором активации тригемино-корпорального сенсорного взаимодействия, центрального серого вещества и др. Фармакотерапия располагает возможностями как стимуляции, так и подавления функций отдельных элементов, а так же комплексов этой системы.
Подводя итог, подчеркнем, что мануальная терапия располагает значительными возможностями в снижении и уменьшении активности механизмов гипервозбудимых алгических структур. В нейрофизиологическом отношении постизометрическая релаксация и реципрокное расслабление предполагают наиболее эффективное воздействие на патологические механизмы, реализуемые сегментарно-периферическими структурами. Речь идет о стабилизации афферентного (прежде всего проприоцептивного) потока из триггерного участка и восстановлении активности АНЦС в сегментарном аппарате. В то же время, следует отметить, что технические приемы МТ возможностями активации АНЦС других уровней не обладают. Это предполагает использование других лечебных приемов, имеющих "адресатом" другие уровни АНЦС. Более подробно это положение будет развито в соответствующем разделе, посвященном принципам сочетания МТ и других методов лечения.
Конец формы
|
|||||||||||||||||||||||
|