Содержание
1. Межмолекулярные
взаимодействия. Виды взаимодействий и механизм их образования, отличие от
обычной химической связи. Роль в природе. 2
2. Понятие энтальпии. Экзо-и эндотермические
реакции. Закон Гесса и его следствия. 4
Задача 1. 6
Задача 2. 7
Задача 3. 7
Список литературы.. 8
1. Межмолекулярные
взаимодействия. Виды взаимодействий и механизм их образования, отличие от
обычной химической связи. Роль в природе.
Как и всюду в природе, между молекулами действуют силы
тяготения, прямо пропорциональные произведению масс взаимодействующих тел и
обратно пропорциональные квадрату расстояния между их центрами (закон
всемирного тяготения). Однако из-за ничтожности масс молекул силы эти настолько
малы, что ими практически можно пренебречь. Между тем уже из наличия твердого и
жидкого агрегатных состояний веществ вытекает, что взаимное притяжение молекул
несомненно существует.
Межмолекулярное взаимодействие осуществляется благодаря
действию между молекулами, независимо от того, являются они полярными или нет,
сил Ван-дер-Ваальса. Эти силы названы так, потому что впервые межмолекулярное
взаимодействие стал учитывать голландский физик Ван-дер-Ваальс (1873 г.) при объяснении
свойств реальных газов и жидкостей. Межмолекулярное взаимодействие нейтральных
частиц вещества (молекул, атомов) имеет электрическую природу и заключается в
электростатическом притяжении между полярными или неполярными частицами.
Притяжение между полярными частицами достигается разделением электрических
эффективных зарядов внутри этих частиц, т.е. наличием у этих частиц постоянных
электрических диполей. В неполярных частицах диполи индуцируются (так
называемые наведенные временные диполи), что также обусловливает притяжение
этих частиц. Постоянные и наведенные диполи возникают вследствие движения
электронов внутри электронной оболочки атомов и молекул. Поэтому все
нейтральные частицы в реальных газах, жидкостях и твердых веществах оказывают
взаимное влияние друг на друга и не являются независимыми.
Поляризация полярной молекулы, т.е. общий результат
воздействия на нее электрического поля, складывается из двух эффектов –
ориентации молекулы и ее деформации:
Поляризация = ориентация + деформация
Относительное значение каждого вида для того ил иного случая
зависит, в основном, от двух свойств взаимодействующих молекул – их полярности
и деформируемости. Чем выше полярность, тем
значительнее деформируемость. Тем значительнее роль
дисперсионных сил. Индукционные силы зависят от обоих факторов, но сами обычно
играют лишь второстепенную роль[1].
По общему характеру проявления межмолекулярные силы
принципиально отличаются от кулоновских своей однозначностью. Если кулоновское
взаимодействие может выражаться и в притяжении (при разноименных зарядах
частиц) и в отталкивании (при одноименных), то межмолекулярные силы проявляются
только в притяжении. Однако при очень тесном сближении любых частиц начинает
резко сказываться взаимное отталкивание их внешних электронных слоев.
Возникающие подобным образом силы отталкивания, чрезвычайно значительные в
условиях непосредственного контакта частиц, вместе с тем ослабевают по мере
увеличения расстояния гораздо быстрее сил притяжения. В результате общее
взаимодействие частиц при сближении выражается сначала все возрастающим
взаимным притяжение, которое затем ослабевает и, наконец, переходит в
отталкивание. Расстояние между центрами частиц, при котором притяжение
уравновешивается отталкиванием, отвечает устойчивому равновесию и является
характерным для пространственной структуры соответствующего вещества.
2. Понятие энтальпии. Экзо-и эндотермические реакции. Закон Гесса и его
следствия.
Энтальпия H [энергия,
моль-1 (Дж. моль-1, кал. моль-1)] - функция состояния термодинамической
системы, равная сумме внутренней энергии и произведения объема на давление[2]:
H = U + PV
Теплота [Дж. моль-1,
кал. моль-1] Q - форма передачи энергия от более нагретого тела к менее
нагретому, не связанная с переносом вещества и совершением работы.
Теплота химической реакции при
постоянном объеме или давлении (т.е. тепловой эффект химической реакции) не
зависит от пути проведения процесса, а определяется только начальным и конечным
состоянием системы (закон Гесса)[3]:
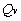 =
= 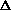 U,
U, 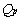 =
= 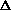 H.
H.
Разность тепловых эффектов при
P = const (QP) и V = const (QV) равна работе, которая совершается системой (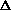 V>0)
или над системой (
V>0)
или над системой (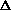 V<0)
за счет изменения ее объема при завершении изобарно-изотермической реакции[4]:
V<0)
за счет изменения ее объема при завершении изобарно-изотермической реакции[4]:
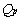 -
- 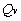 =
= 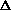 n RT.
n RT.
Стандартная теплота реакции 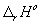 может быть
рассчитана через стандартные теплоты образования (
может быть
рассчитана через стандартные теплоты образования (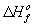 ) или
сгорания (
) или
сгорания (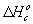 ) веществ:
) веществ:
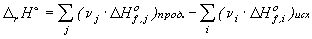
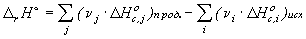
где n i,j - стехиометрические коэффициенты в уравнении химической
реакции.
Для идеальных газов при
T,P = const: 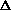 rH =
rH = 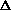 rU +
rU + 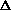 n RT.
n RT.
Экзотермической реакцией
называется химическая реакция, протекающая к выделением теплоты (∆Н<0,
Q>0),
эндотермической реакцией называется химическая реакция, протекающая с
поглощением теплоты (∆Н>0, Q<0).
Задача 1
Указать электронные конфигурации
основного и возбужденных состояний атома хлора.
Электронная конфигурация атома
хлора:
17Cl ~ 1s22s22p63s23p5
Cl 3d
3p

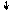


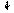







 3s
3s

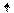
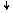
Переход атома хлора в возбуждённое состояние сопровождается
разъединением спаренных электронов 3s- и 3p-орбиталей и перемещением их на
близкую по энергии свободную M-орбиталь. В результате
этого количество неспаренных электронов в атоме хлора
увеличивается от одного в невозбуждённом атоме до трех, пяти или семи в возбуждённом:
Cl* 3d Cl** 3d

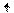

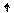


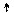





 3p 3p
3p 3p
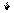


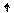

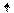

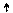




 3s
3s
3s
3s


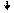

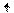
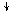




 Cl*** 3d
Cl*** 3d
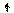
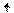
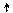 3p
3p




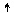
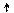 3s
3s

Электронные формулы:
Cl* ~ 1s22s22p63s23p43d1
Cl** ~ 1s22s22p63s23p33d2
Cl*** ~ 1s22s22p63s13p33d3
Поэтому атом хлора, в отличие от атома фтора, может
принимать участие в образовании не только одной, но также трёх, пяти или семи
ковалентных связей. Так, в молекуле хлорноватистой кислоты HClO
атом хлора образует одну ковалентную связь, в хлористой кислоте HClO2
¾
три, в хлорноватой кислоте HClO3 ¾ пять, а в молекуле
хлорной кислоты HClO4 ¾ семь ковалентных связей[5].
Задача 2
Как изменится скорость реакции 2
СО + О2 → 2 СО2 если концентрацию исходных веществ
увеличить в 4 раза
Решение:
Скорость данной реакции
выражается формулой[6]:
v = k [CO]2
[O2]
Пусть концентрация [CO] = [O2] = х
Начальная скорость реакции равна:
v1 = k х3
Скорость реакции после увеличения
концентрации исходных веществ:
v2 = k [4x]2[4x]
= k 64х3
Тогда v2/ v1 = k 64х3/ k х3
= 64, т.е. скорость данной реакции при увеличении концентрации исходных веществ
возрастет в 64 раза.
Задача 3
Рассчитать молярную массу газа,
если известно, что при температуре 20 ºС и
давлении 0,253*105 Па образец этого газа массой 7 г занимает объем
22,18 л.
Решение:
Уравнение Менделеева - Клапейрона для произвольной массы газа имеет вид[7]:
pV = m/M * RT
Выражаем из уравнения М:
M = m R T / pV
М = 7 * 8,314 * (273 + 20) /
0,253*105 * 22,18*10-3 = 30,38 г/моль
Список литературы
1. Воронин Г.Ф.
Основы термодинамики. М.: Изд-во Моск. ун-та, 1987.
2. Герасимов
Я.И. Курс физической химии. Т.1, 2. М.: Химия, 1969.
3. Горшков В.И.,
Кузнецов И.А. Основы физической химии. М.: Изд-во Моск.
ун-та, 1993.
4. Химия
/ Под ред. В. Шретера . – М.: Химия, 1986. – 648 с.
5. Ходаков
Ю.В., Цветков Л.А. Химия – М.: Государственное учебно-педагогическое
издательство министерства просвещения РСФСР, 1961. – 424 с.
6. Некрасов Б.В. Учебник общей химии. – М.: Химия, 1972. –
472 с.
[1] Химия / Под ред. В. Шретера . – М.: Химия, 1986. – 648 с.
[2] Воронин
Г.Ф. Основы термодинамики. М.: Изд-во Моск. ун-та,
1987.
[3] Горшков В.И., Кузнецов И.А. Основы
физической химии. М.: Изд-во Моск. ун-та, 1993.
[4] Герасимов Я.И. Курс физической
химии. Т.1, 2. М.: Химия, 1969.
[5] Некрасов Б.В. Учебник общей химии. –
М.: Химия, 1972. – 472 с.
[6]
Ходаков Ю.В., Цветков Л.А. Химия – М.: Государственное учебно-педагогическое
издательство министерства просвещения РСФСР, 1961. – 424 с.
[7]