Задача № 20
На нейтрализацию 0,938 г фосфорной кислоты Н3РО4
израсходовано 1,291 г КОН. Вычислите эквивалент, молярную массу эквивалентов
кислоты и ее основность.
Решение. По закону эквивалентов:
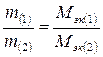 ,
,
где: m1 и m2 – масса веществ 1 и 2, г;
Мэк (1) и Мэк (2)
– молярная масса эквивалентов веществ 1 и 2, г/моль.
Молярная масса эквивалентов КОН равна его молярной массе,
т.е. 56 г/моль. Отсюда находим молярную массу эквивалентов кислоты:

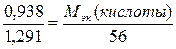 ;
; 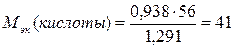 г/моль.
г/моль.
Молярная масса фосфорной кислоты Н3РО4
равна 98 г/моль. Следовательно, основность данной кислоты равна 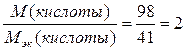 .
.
Эквивалент кислоты равен 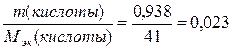 моль.
моль.
Задача № 21
Вычислите молярную концентрацию и молярную концентрацию
эквивалентов кальция дихлорида в растворе с массовой долей CaCl2 20% (плотность раствора
1,178 г/см3).
Решение. Примем массу раствора кальция дихлорида
равной 100 г. Отсюда масса растворенного
вещества CaCl2
равна:
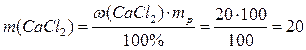 г.
г.
По известной массе и плотности раствора найдем его объем:
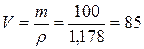 мл или 0,085 л.
мл или 0,085 л.
Определим молярную концентрацию (Св) кальция
дихлорида в растворе по формуле:
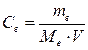 ,
,
где: mв – масса растворенного
вещества, г;
Мв – молярная масса
растворенного вещества;
V – объем раствора, л.
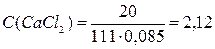 моль/л.
моль/л.
Вычислим молярную концентрацию эквивалентов (Сэк)
кальция дихлорида в растворе по формуле:
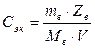 ,
,
где: Zв – эквивалентное число,
которое для CaCl2
равно 2.
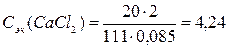 моль/л.
моль/л.
Задача № 42
Какое значение рН (>7<) имеют растворы солей MnCl2, Na2CO3, Ni(NO3)2? Составьте
ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
Решение. а) хлорид марганца MnCl2 – соль слабого
многоосновного основания Mn(ОН)2
и сильной кислоты НCl. При
растворении в воде молекулы MnCl2
полностью диссоциируют на катионы Mn2+ и анионы Cl-. Анионы Сl- не могут связывать ионы Н+ воды, так как
HCl – сильный
электролит. Катионы Mn2+
связывают ионы ОН- воды, образуя катионы основной соли MnOH+, а не
молекулы Mn(ОН)2,
так как ионы MnOH+
диссоциируют гораздо труднее, чем молекулы Mn(ОН)2. В обычных условиях гидролиз идет по первой
ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Mn2+ + H2O ↔ MnOH+ + H+
или в молекулярной форме
MnCl2
+ H2O ↔ MnOHCl + HCl
В растворе появляется избыток ионов H+, поэтому раствор MnCl2 имеет кислую
реакцию (рН < 7).
б) карбонат натрия Na2CO3
– соль слабой многоосновной кислоты H2СО3 и сильного основания NaOH. В этом случае анионы СО32-
связывают водородные ионы воды, образуя катионы кислой соли HСО3-. Образование
молекул H2СО3
не происходит, так как ионы HСО3-
диссоциируют гораздо труднее, чем молекулы H2СО3. В обычных условиях гидролиз идет по первой
ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
СО32- + H2O ↔ HСО3- + ОH-
или в молекулярной форме
Na2CO3 + H2O ↔ NaHСО3 + NaOH
В растворе появляется избыток ионов ОH-, поэтому раствор Na2CO3 имеет щелочную
реакцию (рН > 7).
в) нитрат никеля Ni(NO3)2
– соль слабого многоосновного основания Ni(ОН)2 и сильной кислоты НNO3. В этом случае катионы Ni2+ связывают
гидроксильные ионы воды, образуя катионы основной соли NiОН+. Образование молекул Ni(ОН)2 не
происходит, так как ионы NiОН+
диссоциируют гораздо труднее, чем молекулы Ni(ОН)2. В обычных условиях гидролиз идет по первой
ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Ni2+
+ H2O ↔ NiOH+ + H+
или в молекулярной форме
Ni(NO3)2 +
H2O ↔ NiOHNO3 + НNO3
В растворе появляется избыток ионов водорода, поэтому
раствор Ni(NO3)2 имеет кислую реакцию (рН < 7).
Задача № 63
Дайте общую характеристику строения и свойств
α-аминокислот, входящих в состав белков.
Для изучения аминокислотного состава белков пользуются
сочетанием (или одним из них) кислотного (НСl), щелочного (NaOH)
и реже ферментативного гидролиза. Точно установлено, что при гидролизе чистого
белка, не содержащего примесей, высвобождается 20 различных α-аминокислот.
Все другие открытые в тканях животных, растений и микроорганизмов аминокислоты
(более 200) существуют в природе в свободном состоянии или в виде коротких
пептидов или комплексов с другими органическими веществами.
α-Аминокислоты представляют собой производные карбоновых
кислот, у которых один водородный атом, у
α-углерода, замещен на аминогруппу
(—NH2).
Для α-аминокислот, как и для других встречающихся в
природе аминокислот, общим свойством является их амфотерность (от греч. amphoteros—двусторонний), т.
е. каждая из них содержит как минимум одну кислотную и одну основную группу
(исключение составляет пролин и его производное гидроксипролин, являющиеся
иминокислотами). Общий тип строения α-аминокислот поэтому может быть
представлен в виде следующей формулы:
R
│
H─C─
NH2
│
COOH
Как видно из этой общей формулы, аминокислоты отличаются
друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты,
связанную с α-углеродным атомом и не участвующую в образовании пептидной
связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы
участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои
специфические для свободных аминокислот кислотно-основные свойства. Поэтому все
разнообразие особенностей структуры и функции белковых тел связано с химической
природой и физико-химическими свойствами радикалов аминокислот. Именно
благодаря им белки наделены рядом уникальных функций, не свойственных другим
биополимерам.
Кислотно-основные свойства аминокислот определяют многие
физико-химические и биологические свойства белков. На этих свойствах основаны,
кроме того, почти все методы выделения и идентификации аминокислот.
Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных
растворов в форме биполярных (амфотерных) ионов, а не в виде недиссоциированных
молекул.
Если кристаллическую аминокислоту, например аланин, растворить
в воде, то она может реагировать или как кислота (донатор протона), или как
основание (акцептор протона). В частности, как кислота:
+NН3СН(СН3)
СОО- ↔ Н+ + NН2СН(СН3) СОО-,
как основание:
+NH3CH(CH3)COO-
+ H+ ↔ +NН3СН(СН3)
СООН.
Весьма существенным свойством аминокислот, освобождающихся в
процессе гидролиза природных белков в условиях, исключающих рацемизацию,
является их оптическая активность. Будучи растворенными в воде (или НСl), они способны вращать
плоскость поляризованного луча (исключение составляет глицин). Это свойство
связано с наличием в молекуле всех природных аминокислот (за исключением
глицина) в α-положении асимметрического атома углерода (т.е. атома
углерода, все четыре валентные связи которого заняты различными заместителями).
Задача № 84
Нативная конформация белков. Глобулярные и фибриллярные
белки.
Конформация, т.е. та или иная пространственная форма молекул
биополимера, определяется их первичной структурой. В зависимости от химического
строения и внешних условий молекулы биополимера могут находиться либо в одной
или в нескольких преимущественных конформациях (обычно встречающиеся в
природных условиях нативные состояния биополимеров: например, глобулярное
строение белков, двойная спираль ДНК), либо принимать многие более или менее
равновероятные конформации.
Белки делят по пространственной структуре на фибриллярные
(нитевидные) и глобулярные (корпускулярные).
Фибриллярные белки
характеризуются очень высоким отношением b/а (несколько десятков единиц), их молекулы нитевидны и обычно
собраны в пучки, которые образуют далее волокна. К числу фибриллярных белков
принадлежат фиброин шелка, кератин волоса, коллаген кожи и др.
Белки, имеющие невысокое отношение b/а (в пределах нескольких единиц)
и, следовательно, палочкообразную форму молекулы, называют корпускулярными
(корпускула – частица) или глобулярными. Подавляющее число природных белков
относится к корпускулярному типу. Белки-ферменты, белки-переносчики, иммунные и
некоторые другие имеют, как правило, глобулярную структуру. Для ряда белков -
гемоглобин, миоглобин, лизоцим, рибонуклеаза и др. - эта структура установлена
во всех деталях (с определением при помощи рентгеноструктурного анализа
расположения каждого атома). Она определяется последовательностью
аминокислотных остатков и образуется и поддерживается относительно слабыми
взаимодействиями между мономерными звеньями полипептидных цепей в водно-солевом
растворе (кулоновские и дипольные силы, водородные связи, гидрофобные
взаимодействия), а также дисульфидными связями. Глобула белка формируется так,
что большинство полярных гидрофильных аминокислотных остатков оказывается
снаружи и контактирует с растворителем, а большинство неполярных (гидрофобных)
остатков находится внутри и изолировано от взаимодействия с водой. Молекулы
белка, обладающие избытком неполярных групп, когда часть из них оказывается на
поверхности глобулы, образуют высшую, так называемую четвертичную структуру,
при которой несколько глобул агрегируют, взаимодействуя между собой в основном
неполярными участками. Пространственная структура каждого белка-фермента
уникальна и обеспечивает необходимое для его функционирования расположение в
пространстве всех звеньев биополимера, в особенности так называемых активных
центров. В то же время она не абсолютно жестка и допускает необходимые в
процессе функционирования (при взаимодействии с субстратами, ингибиторами и
другими веществами) конформационные сдвиги и изменения.
Задача № 105
Какие нуклеотиды входят в состав ДНК? Их строение, название,
роль. Образование нуклеозидди- и нуклеозидтрифосфатов.
Из гидролизатов нуклеиновых кислот составляющие их структурные единицы были впервые
выделены в 1908 г. П. Левиным и Дж. Манделем, которые назвали их нуклеотидами. При гидролизе РНК
образуются рибонуклеотиды,
при гидролизе ДНК – дезоксирибонуклеотиды.
Пуриновые или
пиримидиновые основания, рибоза или дезоксирибоза и фосфорная кислота связаны в
молекулах нуклеотидов совершенно однотипно. Химическое строение нуклеотидов,
входящих в состав ДНК и их
полные и сокращенные названия таковы:
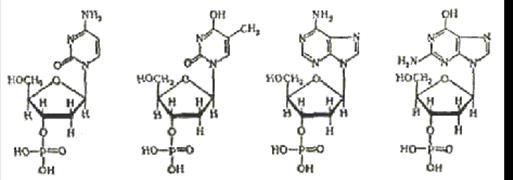
При отщеплении от нуклеотида остатка фосфорной кислоты
получается еще более простое соединение – нуклеозид. Этот термин был впервые
предложен П. Левиным и В Джекобсом в 1909 г. для обозначения углеводных
производных пуринов, выделенных из РНК. Впоследствии он был распространен на
соединения углеводов с пиримидинами. Наименования нуклеозидов складываются из
названий пуриновых или пиримидиновых оснований и соответствующих окончаний. В
приведенных выше структурных формулах нуклеотидов легко найти части,
соответствующие нуклеозидным остаткам, а в названиях нуклеотидов – отличить ту
часть, которой обозначен остаток нуклеозида. Следовательно, нуклеотиды являются
фосфорными эфирами нуклеозидов.
Мононуклеотиды и их производные, а также динуклеотиды
присутствуют в клетках в свободном виде и играют важную роль в обмене веществ.
В частности, нуклеотидную структуру имеют многие коферменты, включая коферменты
оксидоредуктаз. Мононуклеотиды, присоединяя остаток фосфата, образуют
фосфоангидридную связь (наподобие связи, имеющейся у пирофосфата) и
превращаются в нуклеозиддифосфаты; последние, присоединяя еще один остаток
фосфата, образуют нуклеозидтрифосфаты (НТФ).
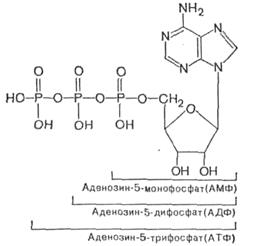
Свободные НТФ в клетках являются предшественниками при
ферментативном синтезе ДНК и РНК. Они служат переносчиками ряда
химических веществ при синтезе других биополимеров (например, уридиндифосфат в
переносе глюкозы). Одной из важнейших функций нуклеозидди- и
нуклеозидтрифосфатов и в особенности АТФ является участие в энергетическом
обмене.
Задача № 126
Как изменится скорость реакции, протекающей в газовой фазе,
при повышении температуры на 600 , если температурный коэффициент
скорости данной реакции равен 2?
Решение. Согласно правилу Вант-Гоффа
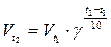 ,
,
где: V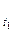 и V
и V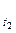 - скорости химической
реакции при температурах t1
и t2;
- скорости химической
реакции при температурах t1
и t2;
γ – температурный коэффициент
скорости.
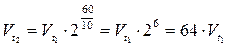 .
.
Следовательно, при повышении температуры на 600,
скорость реакции возрастет в 64 раза.
Задача № 148
Константа равновесия гомогенной системы N2 + 3H2 ↔ 2NH3 при температуре 4000
С равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны
0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрации азота.
Решение. Константа равновесия данной системы
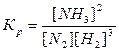
В
выражение Кр входят только равновесные концентрации всех веществ системы.
Отсюда определим равновесную концентрацию азота:
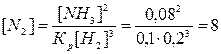 моль/л.
моль/л.
По уравнению системы число молей образовавшегося аммиака
относится к числу молей азота как 2 : 1, следовательно, концентрация прореагировавшего
азота ([N2]прор)
равна ½ [NH3]р,
т.е. 0,04 моль/л. Отсюда исходная концентрация азота равна: 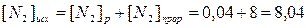 моль/л.
моль/л.
Задача № 166
В чем заключается специфичность ферментов? Назовите виды
специфичности и приведите примеры.
Специфичность
– одно из наиболее выдающихся качеств ферментов. Это свойство их было открыто еще в прошлом столетии, когда было сделано
наблюдение, что очень близкие по структуре вещества – пространственные изомеры
(α- и β-метилглюкозиды) расщепляются по эфирной связи двумя
совершенно разными ферментами.
Под специфичностью понимают свойство фермента участвовать в
превращении (распаде или синтезе) одного или нескольких веществ, близких по
структуре. Без специфичности действия ферментов был бы невозможен упорядоченный
обмен веществ в клетках, а, следовательно, и сама жизнь.
Таким образом, ферменты могут различать химические
соединения, отличающиеся друг от друга очень незначительными деталями
строения, такими, например, как пространственное расположение метоксильного
радикала и атома водорода при 1-м углеродном атоме молекулы метилглюкозида.
По образному выражению, нередко употребляемому в
биохимической литературе, фермент
подходит к субстрату, как ключ к замку. Это знаменитое правило было
сформулировано Э. Фишером в 1894 г. исходя из того, что специфичность действия
фермента предопределяется строгим соответствием геометрической структуры
субстрата и активного центра фермента.
В 50-е годы нашего столетия это статическое представление
было заменено гипотезой Д. Кошланда об индуцированном соответствии субстрата и фермента. Сущность ее сводится к
тому, что пространственное соответствие структуры субстрата и активного центра
фермента создается в момент их взаимодействия друг с другом, что может быть
выражено формулой «перчатка – рука». При этом в субстрате уже деформируются
некоторые валентные связи и он, таким образом, подготавливается к дальнейшему
каталитическому видоизменению, а в молекуле фермента происходят конформационные
перестройки.
В настоящее время гипотеза Кошланда постепенно вытесняется
гипотезой топохимического соответствия.
Сохраняя основные положения гипотезы взаимоиндуцированной настройки субстрата
и фермента, она фиксирует внимание на том, что специфичность действия ферментов
объясняется в первую очередь узнаванием той части субстрата, которая не
изменяется при катализе. Между этой частью субстрата и субстратным центром
фермента возникают многочисленные точечные гидрофобные взаимодействия и
водородные связи.
Несомненно, что специфичность ферментов объясняется в первую
очередь совпадением пространственных конфигураций субстрата и субстратного
центра фермента. Видимо, только тогда, когда совпадение это достаточно полно,
может образоваться фермент-субстратный комплекс и, следовательно, начаться
процесс ферментативного катализа.
В настоящее время гипотеза Кошланда постепенно вытесняется
гипотезой топохимического соответствия.
Сохраняя основные положения гипотезы взаимоиндуцированной настройки субстрата
и фермента, она фиксирует внимание на том, что специфичность действия ферментов
объясняется в первую очередь узнаванием той части субстрата, которая не
изменяется при катализе. Между этой частью субстрата и субстратным центром
фермента возникают многочисленные точечные гидрофобные взаимодействия и
водородные связи.
Несомненно, что специфичность ферментов объясняется в первую
очередь совпадением пространственных конфигураций субстрата и субстратного
центра фермента. Видимо, только тогда, когда совпадение это достаточно полно,
может образоваться фермент-субстратный комплекс и, следовательно, начаться процесс
ферментативного катализа.
Детальное изучение специфичности ферментов показало, что
пределы ее у разных ферментов различны. Различают абсолютную, относительную
(групповую), а также стереохимическую специфичность. Примерами абсолютной специфичности
могут служить: фермент сахараза (инвертаза), расщепляющая только дисахарид
сахарозу, мальтаза, действующая лишь на мальтозу, а лактаза—только на лактозу.
Указанные выше дисахариды — мальтоза, лактоза и сахароза, хотя и имеют одинаковую
эмпирическую формулу C12H22О11,
расщепляются под влиянием трех различных ферментов, так как различаются по
структуре и составу входящих в них моносахаридов.
Примером относительной (групповой) специфичности может
служить действие фермента пепсина. Этот фермент расщепляет самые различные
белковые вещества пищи: белки мяса, молока, растений. Попадая в желудок,
белковые вещества будут расщепляться ферментом пепсином, независимо от
качества и количества входящих в них аминокислот, благодаря тому, что
аминокислоты соединены пептидной связью, которую и расщепляет пепсин (этот
фермент расщепляет пептидные связи между ароматическими аминокислотами).
Следовательно, действие пепсина относительно специфично. Большинство ферментов
обладает абсолютной специфичностью, так как ускоряют какую-либо одну реакцию.
Примером стереохимической специфичности могут служить
ферменты, расщепляющие какой-либо изомер α или β, сюда относятся α-
и β-гликозидазы.
Задача № 190
Тепловой эффект реакции горения жидкого бензола с
образованием паров воды и углерода диоксида равен -3135,58 кДж. Составьте
термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6
(ж).
Решение. Составим термохимическое уравнение данной реакции:
С6Н6
(ж) + 7½О2 (г) = 6СО2 (г) + 3Н2О
(г); ΔНх.р. = -3135,58
кДж.
Для
решения задачи применим вывод из закона Гесса:
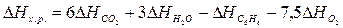
Используя
табличные данные, определим теплоты образования СО2 (г), Н2О
(г):
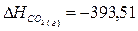 кДж;
кДж;
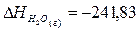 кДж;
кДж;
Учитывая,
что теплоты образования простых веществ условно приняты равными нулю
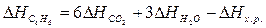
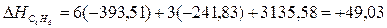 ;
;
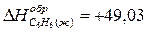 кДж/моль.
кДж/моль.
Задача № 206
Чем можно объяснить, что при стандартных условиях невозможна
экзотермическая реакция Н2 (г) + СО2 (г) = СО (г) + Н2О
(ж), ΔНх.р.
= -2,85 кДж. Зная тепловой эффект реакции и абсолютные стандартные энтропии
соответствующих веществ, определите ΔG0 этой реакции.
Решение. При стандартных
условиях данная экзотермическая реакция невозможна, т.к. уменьшается энтропия
ΔS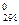 < 0, вследствие
того, что уменьшается количество молекул газа, возможность хаотического
движения меньше.
< 0, вследствие
того, что уменьшается количество молекул газа, возможность хаотического
движения меньше.
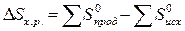
Используя табличные данные, определим стандартные энтропии Н2
(г), СО2 (г), СО (г) и Н2О (ж):
Н2 (г) = 130,59 Дж/(моль*К);
СО2 (г) = 213,65 Дж/(моль*К);
СО (г) = 197,91 Дж/(моль*К);
Н2О (ж) = 69,94 Дж/(моль*К).
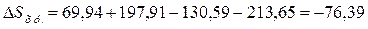 Дж/К или -0,07639 кДж/К.
Дж/К или -0,07639 кДж/К.
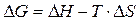
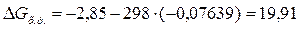 кДж.
кДж.
Список литературы
1.
Березов Т.Т., Коровкин Б.Ф. Биологическая химия: Учебник. –
М.: Медицина, 1982.
2.
Глинка Н.Л. Общая химия, 2000.
3.
Добрынина В.И. Биологическая химия. – М.: «Медицина», 1976.
4.
Суворов А.В. и др. Общая химия. – СПб: Химия, 1995.
5.
Угай Я.А. Общая химия. – М.: Высшая школа, 1984.
6.
Филлипович Ю.Б. Основы биохимии: Учебник. – М.: изд-во
«Агар», 1999.