Задача № 23
Дайте определение и рассчитайте массовую долю и массовую
концентрацию растворённого вещества, его молярную и моляльную концентрации,
молярную концентрацию эквивалентов и титр раствора на основании данных:
|
Формула вещества
|
Масса вещества, г
|
Масса воды, г
|
Плотность раствора,
г/мл
|
|
H2SO4
|
20
|
597
|
1,02
|
Решение:
Раствор - это гомогенная система, состоящая из растворенного
вещества, растворителя и продуктов их взаимодействия.
Простейшие составные части раствора (компоненты) обычно
могут быть выделены в чистом виде; их смешением можно вновь получить раствор
любого допустимого состава. Количественное соотношение компонентов определяется
их концентрациями. Обычно основной компонент называют растворителем, а
остальные компоненты - растворенными веществами. Если одним из компонентов
является жидкость, а другим - газы или твёрдые вещества, то растворителем
считают жидкость.
Важнейшей количественной характеристикой раствора является
его концентрация, которая показывает содержание растворенного вещества в определённом
количестве раствора или растворителя.
1. Определим массу раствора (m(р-ра)):
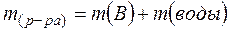 ,
,
где: m (В) - масса растворенного вещества В,
г;
m (воды) – масса воды, г.
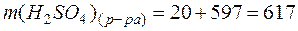 г.
г.
2. Рассчитаем массовую долю растворенного вещества (ω
(В)):

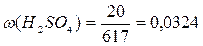 или 3,24%
или 3,24%
3. Вычислим объем раствора (V), используя формулу:
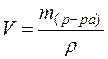 ,
,
где: ρ – плотность раствора,
г/мл.
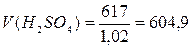 мл.
мл.
4. Определим массовую концентрацию растворённого вещества
(γ (В)):
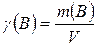 ,
,
где: V – объем раствора, л; 604,9 мл = 0,6049
л
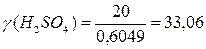 г/л.
г/л.
5. Вычислим молярную концентрацию вещества (С (В)):
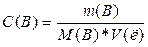 ,
,
где: М (В) - молярная масса вещества
В, г/моль; М (H2SO4) = 1*2 + 32 +
16*4 = = 98 г/моль.
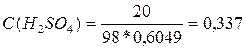 моль/л.
моль/л.
6. Рассчитаем моляльную
концентрацию вещества (Cm (В)):
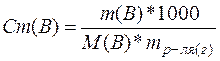 ,
,
где: mр-ля – масса растворителя, в
нашем случае воды, г.
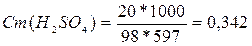 моль/кг.
моль/кг.
7. Вычислим молярную массу эквивалентов растворенного вещества
(Мэк (В)):
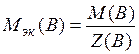 ,
,
где: Z (В) - эквивалентное число.
Z
кислоты равно числу ионов Н+: для H2SO4
Z = 2.
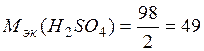 г/моль.
г/моль.
8. Определим молярную
концентрацию эквивалентов вещества (Сэк (В)):
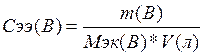
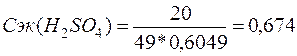 моль/л.
моль/л.
9. Вычислим титр раствора (Т (В)):
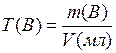 ,
,
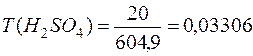 г/мл.
г/мл.
Ответ:
ω (H2SO4) = 0,0324; γ
(H2SO4) = 33,06 г/л; С
(H2SO4) = 0,337 моль/л;
Cm (H2SO4) = 0,342
моль/кг; Сэк (H2SO4)
= 0,674 моль/л;
Т (H2SO4) = 0,03306г/мл.
Список литературы
1.
Алексеев В.Н. Количественный анализ. – М.: «Химия»,
1972.
2.
Алексеев В.Н. Теоретические основы физико-химических
методов анализа. – М.: Высшая школа, 1979.
3.
Здешнева А.М. Сборник задач и упражнений по
аналитической химии. – М.: Высшая школа, 1979.
4.
Крешков А.П. Основы аналитической химии. Т. 2. – М.:
«Химия», 1976.
5.
Крешков А.П., Ярославцев А.А. Курс аналитической химии.
Качественный анализ, книга первая. – М.: «Химия», 1975.