Задача № 77
Адсорбционная хроматография. Уравнения изотерм адсорбции, их анализ и области применимости.
Адсорбция (от лат. ad - на, при и sorbeo - поглощаю), поглощение какого-либо вещества из газообразной среды или раствора поверхностным слоем жидкости или твёрдого тела. Например, если поместить в водный раствор уксусной кислоты кусочек угля, то произойдёт адсорбция - количество кислоты в растворе уменьшится, молекулы кислоты сконцентрируются на поверхности угля.
Адсорбция из растворов находит важное применение в хроматографическом методе разделения веществ, открытом русским ученым М. С. Цветом в 1906 г.
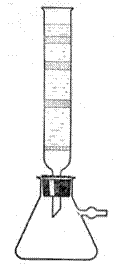
В этом методе адсорбент, например, специально приготовленный оксид алюминия, в виде порошка помещается в вертикальную стеклянную колонку, где он тщательно утрамбовывается. Хроматографическая колонка Цвета представлена на рисунке 3. Смесь веществ, подвергаемая хроматографическому разделению, растворяется в соответствующем растворителе. Раствор пропускается через колонку, заполненную адсорбентом. В верхней части колонки адсорбируется компонент, адсорбционная способность которого наиболее велика. По ходу растворителя сверху колонки вниз на оксиде алюминия адсорбируются вещества в порядке уменьшения их адсорбционной способности. Однако полное разделение адсорбируемых компонентов при этом не достигается. Поэтому после адсорбции компонентов смеси через колонку пропускается чистый растворитель, что обеспечивает разделение адсорбированных веществ по слоям, более удаленным друг от друга, иными словами, достигается более четкое их разделение.
|
Рис. 3. Хроматографическая колонка |
Если разделению подвергаются окрашенные вещества, то слои адсорбента окрашиваются и разделены бесцветными промежутками одного адсорбента. Этим методом М. С. Цвет доказал, что природный хлорофилл состоит из нескольких компонентов. Для выделения адсорбированных веществ колонка адсорбента может быть целиком или по частям извлечена из стеклянной трубки и разделена на части, на которых адсорбирован только один из компонентов смеси. Выделение индивидуальных адсорбированных компонентов можно осуществить также путем элюирования, т.е. последовательным вымыванием отдельных слоев адсорбированных веществ, пропуская соответствующие растворители порциями через колонку. В настоящее время применяется много вариантов хроматографического метода. В органической химии и в биохимии широкое применение нашла бумажная хроматография, в которой в качестве адсорбента применяются полоски из бумаги, специально приготовляемой для этой цели (хроматографическая бумага). Разработаны также хроматографические методы разделения газовых смесей, что привело к значительному улучшению методов газового анализа.
Величина адсорбции зависит от природы поверхности адсорбента, природы адсорбата и его концентрации (давления), температуры и др. Графическая зависимость адсорбции от концентрации адсорбируемого вещества в объемной фазе при данной температуре называется изотермой адсорбции.
Адсорбция из предельно разбавленных растворов или смесей газов подчиняется закону Генри:
![]() или
или ![]()
где: А – величина адсорбции;
![]() и
и ![]() — константа Генри;
— константа Генри;
с — концентрация адсорбата в объемной фазе;
р — давление пара адсорбата.
Аналитическим выражением изотермы мономолекулярной адсорбции при более высоких концентрациях и на ровной поверхности является уравнение изотермы Ленгмюра:
![]() или
или ![]()
где: ![]() — предельная
мономолекулярная адсорбция -
емкость монослоя;
— предельная
мономолекулярная адсорбция -
емкость монослоя;
К и К' — константы адсорбционного равновесия, характеризующие энергию адсорбции.
Для высоких давлений пара изотерма адсорбции описывается общим уравнением обобщенной теории Ленгмюра — уравнением полимолекулярной адсорбции БЭТ (Брунауэра, Эммета и Теллера):
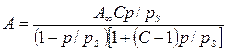
где: С — константа, характеризующая энергию взаимодействия сконденсированного адсорбата с поверхностью адсорбента;
ps — давление насыщенного пара адсорбата.
Уравнение Ленгмюра и уравнение БЭТ широко используются для определения удельной поверхности адсорбентов, катализаторов и других дисперсных систем.
Эмпирическое уравнение Фрейндлиха:
![]()
где: Г - величина адсорбции, кмоль/кг (кмоль/м2);
n - количество вещества-адсорбтива, кмоль;
m - масса адсорбента, кг;
К - константа. При С = 1 кмоль / м3: К = Г;
1/а - константа (адсорбционный показатель) зависит от природы адсорбента и температуры 1/а = 0,1 - 1.
Это уравнение хорошо описывает адсорбцию для интервала средних концентраций растворов (или давлений газа).
Задача № 92
Порог коагуляции. Правило Шульце – Гарди.
Самопроизвольные процессы, идущие с уменьшением площади поверхности, называются коагуляцией.
Многочисленные исследования явления коагуляции показали, что почти все электролиты, взятые в достаточном количестве, способны коагулировать коллоидные растворы.
Прибавление к коллоидному раствору электролита влечет за собой увеличение концентрации противоионов во всех слоях и в том числе в слое адсорбционных (связанных) противоионов, что ведет к уменьшению дзэта-потенциала.
Связь мицелл с окружающей их дисперсионной средой при этом уменьшается и наступает коагуляция. Явная коагуляция наступает, когда концентрация электролита начинает превышать некоторую минимальную величину Наименьшая концентрация электролита, вызывающая коагуляцию за определенный промежуток времени и выраженная в миллимолях на 1 л (ммоль/л), называется порогом коагуляции золя данным электролитом.
Коагулирующей частью электролита является один из его ионов — тот, который несет заряд, противоположный по знаку заряду коллоидной частицы. Например, для коагуляции гидрозоля гидроксида железа (III), частицы которого несут положительный заряд, коагулирующим ионом электролита является его анион. Величина заряда коагулирующего иона обусловливает порог коагуляции данного коллоида. При этом величина порога коагуляции тем меньше, чем выше заряд коагулирующего иона. Другими словами, коагулирующее действие электролита возрастает с увеличением заряда иона, знак которого противоположен знаку заряда коллоидной частицы.
В таблице 2 приведены некоторые данные для двух золей: отрицательно заряженного сульфида мышьяка — концентрация As2S3 1,85 г/л и положительно заряженного гидроксида железа (III) — концентрация Fe(ОН)3 0,823 г/л.
Таблица 2.
Коагуляция золей As2S3 и Fe(OH)3 электролитами
|
Золь As2S3 |
Золь Fe(OH)3 |
||||
|
Электролит |
Коагулирующий ион (катион) |
Концентрация электролита в ммоль/л |
Электролит |
Коагулирующий ион (анион) |
Концентрация электролита в ммоль/л |
|
NaCl |
Na+ |
51 |
КСl |
С1- |
9,0 |
|
КСl |
К+ |
49,5 |
КВr |
Вr- |
12,5 |
|
MgCl2 |
Mg2+ |
0,72 |
KI |
I- |
10,0 |
|
СаСl2 |
Ca2+ |
0,65 |
KNO3 |
NO3- |
12,0 |
|
ВаСl2 |
Ba2+ |
0,69 |
К2SO4 |
SO42- |
0,205 |
|
А1Сl3 |
Al3+ |
0,092 |
К2Сг2O7 |
Cr2O72- |
0,195 |
Таблица показывает, что коагулирующая способность ионов растет с увеличением заряда, как это имеет место и при адсорбции их.
Если коагулирующее свойство иона считать обратно пропорциональным концентрации и принять коагулирующее действие однозарядного катиона (например, Na+) за единицу, то в отношении двух- и трехзарядных катионов можно сделать следующее сопоставление: М3+ — 1; М2+ —10-50; М+ —500-1000.
Приведенное сопоставление указывает на значительный рост коагулирующей способности ионов с повышением их зарядности.
Таким образом, коагулирующее действие электролита возрастает с увеличением зарядности иона, знак заряда которого противоположен знаку коллоидной частицы — правило значности Шульце — Гарди.
Список литературы
1. Балезин С.А. и др. Основы физической и коллоидной химии. – М.: «Просвещение», 1985.
2. Гамеева О.С. Сборник задач и упражнений по физической и коллоидной химии: Учебное пособие. – М.: Высшая школа, 1980.
3. Лабораторные работы и задачи по коллоидной химии. / Под ред. Ю. Г. Фролова. – М.: «Химия», 1986.
4. Физическая и коллоидная химия: Учебное пособие. / Под ред. Добычина Д.П. – М.: Просвещение, 1986.
5. Фридрихсберг Д.А. Курс коллоидной химии: Учебник. – Л.: Химия, 1984.