Задача № 7
Типы химических связей. Агрегатное состояние вещества, их
общая характеристика.
Химическая связь – это связь между атомами в молекуле
вещества и между молекулами. В зависимости от характера распределения
электронной плотности в веществе различают три основных типа химической связи:
ковалентную, ионную и металлическую.
Ковалентная связь
– связь между атомами в молекуле, которая осуществляется за счет общих
электронных пар. Выделяют:
·
ковалентная неполярная связь – связь, в которой
нет смещения электронной плотности к одному из атомов;
·
ковалентная полярная связь – связь, в которой
общие электронные пары смещены к более электроотрицательному атому.
Ионная связь –
связь, которая осуществляется за счет электростатического притяжения
разноименно заряженных частиц – ионов.
Металлическая связь –
связь, которая образуется в результате взаимодействия относительно свободных
электронов с ионами металлов. Этот тип связи характерен для простых веществ-
металлов.
Агрегатные состояния вещества - состояния (фазы) одного и того же вещества,
переходы между которыми сопровождаются скачкообразным изменением ряда
физических свойств (плотности, энтропии и др.). Обычно рассматривают
газообразное, жидкое и твердое агрегатные состояния (иногда еще плазменное).
Существование у вещества нескольких агрегатных состояний обусловлено различиями
в тепловом движении его молекул (атомов) и в их взаимодействии
Газ - агрегатное
состояние вещества, в котором кинетическая энергия теплового движения его
частиц (молекул, атомов, ионов) значительно превосходит потенциальную энергию
взаимодействий между ними, в связи с чем частицы движутся свободно, равномерно
заполняя в отсутствие внешних полей весь предоставленный им объем.
Жидкость -
агрегатное состояние вещества, сочетающее в себе черты твердого состояния
(сохранение объема, определенная прочность на разрыв) и газообразного
(изменчивость формы). Для жидкости характерны ближний порядок в расположении
частиц (молекул, атомов) и малое различие в кинетической энергии теплового
движения молекул и их потенциальной энергии взаимодействия. Тепловое движение
молекул жидкости состоит из колебаний около положений равновесия и сравнительно
редких перескоков из одного равновесного положения в другое, с этим связана
текучесть жидкости.
Твердое тело - агрегатное
состояние вещества, отличающееся стабильностью формы и характером теплового
движения атомов, которые совершают малые колебания вокруг положений равновесия.
Различают кристаллические и аморфные твердые тела. В первых существует
пространственная периодичность в расположении равновесных положений атомов. В
аморфных твердых телах атомы колеблются около хаотически расположенных точек.
Устойчивым состоянием твердых тел является кристаллическое.
Баллон емкостью 30 л содержит 1 кг СО2. Вычислите
давление в баллоне при 200 С.
|
Дано:
V = 30 л
m = 1 кг
t = 200 С
М (СО2) = 44 г/моль
|
V = 30 · 10-3 м3
Т = 273 + 20 = 293 К
М = 44 · 10-3 кг/моль
R = 8,31 Дж/(моль·К)
|
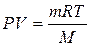
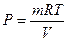
|
|
P
- ?
|
P - ?
|
|
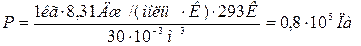
Ответ: давление в баллоне равно 0,8 · 105 Па.
Задача № 14
Скорость химической реакции. Влияние природы реагирующих
веществ, площади поверхности на скорость реакции.
Скорость химической реакции – это величина,
характеризующая интенсивность реакции химической. Скоростью образования
продукта реакции называется количество этого продукта, возникающее в результате
реакции за единицу времени в единице объёма (если реакция гомогенна) или на
единице площади поверхности (если реакция гетерогенна). Для исходных веществ
аналогичным образом определяется скорость их расходования.
Скорость химической реакции может варьировать в чрезвычайно
широких пределах - от очень малой (в случае геологического процессов, длящихся
миллионы лет) до очень большой (в случае ионных реакций, завершающихся за
миллионные доли секунды).
Скорость химической реакции зависит от природы реагирующих
веществ и условий протекания реакции. Чем более реакционноспособные вещества
участвуют в реакции, тем скорость реакции больше. Например, рассмотрим реакцию
взаимодействия металлов различной активности с водой:
Н2О + Аu → реакция не идет;
Н2О + Fe → реакция идет медленно;
Н2О + Na → реакция идет очень быстро.
Для веществ в твердом состоянии, на скорость реакции влияет площадь
поверхности. В этом случае скорость реакции прямопропорциональна поверхности
реагирующих веществ. Например:
Zn
(кусочками) + HCl
→ реакция идет медленно;
Zn
(порошок) + HCl →
реакция идет быстро.
Вычислите, во сколько раз увеличится скорость реакции,
протекающей в газовой фазе, при повышении температуры от 30 до 800
С, если температурный коэффициент равен 2.
|
Дано:
t1 = 300 C
t2 = 800 C
γ = 2
|
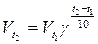 ; ; 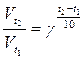
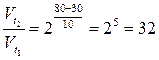
|
|
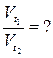
|
Ответ: скорость реакции, при повышении температуры от 30 до
800 С увеличится в 32 раза.
Задача № 24
Диффузия. Зависимость скорости диффузии от температуры,
размера частиц, вязкости среды, степени невыравненности концентраций. Влияние
скорости диффузии на количество экстрактивных веществ, выделяемых мясом, рыбой,
овощи при различных технологических режимах обработки, возможность управления
технологическими процессами.
Диффузия (от лат. diffusio распространение,
растекание, рассеивание) - это движение частиц среды, приводящее к переносу
вещества и выравниванию концентраций или к установлению равновесного
распределения концентраций частиц данного сорта в среде. В отсутствие макроскопического
движения среды диффузия молекул (атомов)
определяется их тепловым движением (молекулярная диффузия). В неоднородной
системе (газ, жидкость) при молекулярной диффузии в отсутствие внешних
воздействий диффузионный поток (поток массы) пропорционален градиенту его
концентрации. Коэффициент пропорциональности называется коэффициентом диффузии
(D), который
определяется следующим выражением:
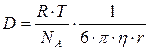 ,
,
где: R – универсальная
газовая постоянная; Т – температура; NА – постоянная Авогадро; η – вязкость среды; r – средний радиус частиц.
Из этого выражения видно, что чем больше температура, и
меньше вязкость и радиус частиц, тем скорость диффузии больше.
Осмотическое давление раствора, содержащего 7,5 г сахара в
625 см3 раствора, 8,307 · 104 Па при 120 С.
Определите молярную массу сахара.
|
Дано:
V = 625 см3 =
625·10-6 м3
m = 7,5 г = 7,5· 10-3 кг
Росм = 8,307·104
Па
t = 120 С или Т = 285 К
|
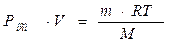 ; ; 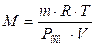
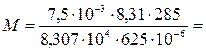 0,3421 кг/моль 0,3421 кг/моль
или 342,1 г/моль
|
|
М - ?
|
Ответ: молярная масса сахара равна 342,1 г/моль.
Задача № 34
Адсорбция на поверхности раствор – газ. Уравнение Гиббса,
его анализ. Поверхностно-активные и поверхностно-неактивные вещества.
Адсорбция
(от лат. ad - на, при и sorbeo -
поглощаю), поглощение какого-либо вещества из газообразной среды или раствора поверхностным слоем жидкости
или твёрдого тела. Например, если поместить в водный раствор уксусной кислоты
кусочек угля, то произойдёт адсорбция - количество кислоты в растворе
уменьшится, молекулы кислоты сконцентрируются на поверхности угля. Учение об адсорбции
является частью более общей теории многокомпонентных гетерогенных систем,
основы которой заложены У. Гиббсом (1876). Явление адсорбции тесно связано с
особыми свойствами вещества в поверхностном слое. Например, молекулы, лежащие
на поверхности раздела фаз жидкость - пар, втягиваются внутрь жидкости, так как
испытывают большее притяжение со стороны молекул, находящихся в объёме
жидкости, чем со стороны молекул пара, концентрация которых во много раз меньше
концентрации жидкости. Это внутреннее притяжение заставляет поверхность
сокращаться и количественно характеризуется поверхностным натяжением. По той же
причине молекулы какого-либо другого вещества, оказавшиеся вблизи поверхности,
притянутся к ней и произойдёт адсорбция. После адсорбции внутреннее притяжение
частично компенсируется притяжением со стороны адсорбционного слоя и
поверхностное натяжение уменьшается. Гиббс вывел формулу, связывающую значение адсорбции
с изменением поверхностного натяжения.
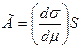 ,
,
где: Г – фундаментальная гиббсовая
адсорбция; σ – поверхностное натяжение; μ – химический потенциал; S – площадь
адсорбента.
Поверхностно-активные вещества (ПАВ) – это вещества, которые
снижают поверхностное натяжение (см. рис. 1)
Поверхностно-неактивные (поверхностно-инактивные) вещества
(ПИВ) – это вещества, которые повышаю поверхностное натяжение (см. рис. 1).
Рис. 1. Зависимость
поверхностного натяжения от концентрации веществ:
1 – органические ПАВ; 2, 3 – ПИВ
(неорганические соли).
Выбрать правильный ответ и пояснить его:
|
Вопрос
|
Ответ
|
|
Для ПАВ является верным выражение:
|
1. 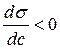 ; r
> 0 ; r
> 0
2. 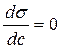 ; r
= 0 ; r
= 0
3. 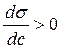 ; r
< 0 ; r
< 0
|
По графику видно, что С2 – С1 > 0
(приращение концентраций больше нуля), σ2 – σ1 <
0 (приращение поверхностного натяжения меньше нуля), следовательно верным
выражением является 1.
Задача № 44
Электрокинетические явления. Электроосмос и электрофорез, их
использование.
Электрокинетические
явления - группа явлений, наблюдаемых в дисперсных
системах и капиллярах и выражающихся либо в возникновении движения одной из фаз
по отношению к другой под действием внешнего электрического поля (электроосмос,
электрофорез), либо в возникновении разности потенциалов в направлении
относительного движения фаз, вызываемого механическими силами (седиментационный
потенциал, или эффект Дорна, потенциал течения). Они обусловлены существованием
на границе фаз избыточных зарядов, располагающихся в виде двух противоположно
заряженных слоев, называемых двойным электрическим слоем. Внешнее электрическое
поле, направленное вдоль границы фаз, вызывает смещение одного ионного слоя по
отношению к другому, что приводит к относительному перемещению фаз, т.е. к
электроосмосу или электрофорезу. Аналогичным образом при течении жидкости или
оседании частиц дисперсной фазы наблюдаются явления, обратные электроосмосу и
электрофорезу, - относительное движение ионных слоев и пространственное
разделение зарядов (поляризация) в направлении движения фаз, т.е. возникновение
соответственно потенциалов течения или седиментации.
Электроосмос – это движение жидкости через капилляры или
пористые диафрагмы при наложении внешнего электрического поля. Электроосмос
используют для удаления избыточной влаги из почв при прокладке транспортных
магистралей и гидротехническом строительстве, для сушки торфа, а также для
очистки воды, технических жидкостей и др.
Электрофорез – это направленное движение коллоидных частиц
или макроионов под действием внешнего электрического поля. Электрофорез
используют в электрохимии для изучения двойного электрического слоя, адсорбции
ионов на поверхности, в медицине.
В промышленности электрофорез используют для выделения каучука из латекса,
очистки воды, отделения каолина от песка и др. В биохимии электрофорез служит
для анализа, разделения и очистки биополимеров (главным образом белков),
бактериальных клеток, вирусов, а также аминокислот, витаминов и др.
Написать мицеллу золя сульфида цинка, реакция обмена между
сульфатом цинка и сероводородом, если в избытке сероводород.
Известно, что вещество, которое берется в избытке, является
стабилизатором, в данном случае им будет H2S.
Пишем реакцию обмена:
ZnSO4
+ H2S = ZnS + H2SO4.
При данных условиях молекулы ZnS образуют ядро золя.
По правилу Пескова – Фаянса на любой твердой поверхности
адсорбируются родственные ионы, находящиеся
в избытке и имеющие общую атомную группировку с ядром. По условию в
избытке - H2S, который диссоциирует на
ионы H+ и S2-. Согласно правилу Пескова – Фаянса на ядре m [ZnS] будут адсорбироваться ионы S2-. Эти ионы называются потенциалопределяющими. Они
образуют неподвижную часть двойного электрического слоя и определяют
направление движения коллоидной частицы при электрофорезе.
Отрицательно заряженные ионы S2- притягивают из раствора
часть находящихся в избытке ионов H+. Образуется адсорбционный слой противоионов 2(n – x) H+.
Ядро [ZnS],
адсорбционный слой ионов n S2-
и противоионов 2(n – x) H+ образуют частицу, несущую
отрицательный заряд, так как ионов S2- больше числа x:
{m [ZnS] · n S2- · 2(n - x) H+}2x-
коллоидная частица - гранула
Другая часть противоионов 2x H+ образует
диффузную часть двойного слоя.
Таким образом, мицелла – это агрегат молекул и ионов,
состоящих из ядра и двойного электрического слоя, который, в свою очередь,
состоит из адсорбционного слоя ионов и противоионов и диффузионного слоя
противоионов. Мицелла нейтральна, так как число положительных ионов H+ равно числу
отрицательных ионов S2-:
n S2- = 2(n - x) H+ + 2x
H+ = (2n – 2x + 2x) H+
n S2- = 2n H+
Формула мицеллы золя:
 {m [ZnS] · n S2- · 2(n - x) H+}2x-·2х Н+
{m [ZnS] · n S2- · 2(n - x) H+}2x-·2х Н+
Задача № 54
Аэрозоли, дымы, туманы: понятие. Значение аэрозолей в
пищевой промышленности. Загрязнение окружающей среды эмульсиями, пенами,
аэрозолями; их разрушение.
Аэрозоли –
это системы, состоящие из твёрдых или жидких частиц, взвешенных в газообразной
среде.
Дым - устойчивая
дисперсная система, состоящая из мелких твёрдых частиц, находящихся во
взвешенном состоянии в газах. Дым - типичный аэрозоль с размерами твёрдых
частиц от 10-7 до 10-5 м. В отличие от пыли - более грубодисперсной системы, частицы дыма
практически не оседают под действием силы тяжести.
Туман – это скопление
мелких водяных капель или ледяных кристаллов, или тех и других в приземном слое
атмосферы (иногда до высоты в несколько сотен м), понижающее горизонтальную видимость до 1 км и менее. Туман образуется в
результате конденсации или сублимации водяного пара на аэрозольных (жидких или
твёрдых) частицах, содержащихся в воздухе (так называемых ядрах конденсации).
Аэрозоли
играют большую положительную роль в жизни человека. Облака - важнейшее звено в
круговороте воды в природе; поглощая солнечные лучи и тепловое излучение Земли,
они умеряют и жару, и холод. Опыление многих растений, в том числе злаков,
осуществляется аэрозолями из цветочной пыльцы. Всё жидкое и почти всё твёрдое
топливо сжигается ныне в виде аэрозолей. Борьба с вредителями и болезнями
культурных растений и лесов ведётся с помощью аэрозолей из ядохимикатов. Многие важные технические
материалы, например, сажу, получают в виде аэрозоля. Большое значение
приобретает аэрозольтерапия и аэрозольная иммунизация людей и домашних животных
аэрозоли успешно применяют для борьбы с градобитием.
Вместе с тем
некоторые аэрозоли приносят большой вред. Огромную опасность представляют
радиоактивные аэрозоли, образующиеся при атомных взрывах, при добыче и
переработке расщепляющихся материалов. Пыль, содержащая кремнезём, вызывает
тяжёлое заболевание лёгких - силикоз, не менее опасна бериллиевая, свинцовая,
хромовая пыль. Поэтому борьба с производственной пылью - одна из важнейших
задач промышленной гигиены. Бактериальные аэрозоли, содержащие болезнетворные
микроорганизмы и образующиеся при кашле и чихании больных, могут служить
источником инфекционных болезней, в том числе гриппа. Природные туманы
препятствуют посадке самолётов. Пыльные бури - настоящее бедствие для жарких,
сухих безлесных местностей. Борьба с аэрозольным загрязнением атмосферы в
промышленных центрах - одна из важных проблем.
Загрязнение
окружающей среды эмульсиями можно рассмотреть на примере нефти. При попадании
нефти в воду нарушается газообмен, планктон может включать эти вещества в свой
метаболизм, в следствии чего наносится вред рыбам, водоплавающим птицам
(нарушаются физиологические процессы, снижается плодовитость и т.д.).
Нефтепродукты являются наиболее опасными загрязнителями вод, так как токсичны и
долго разрушаются.
Список литературы
1.
Балезин С.А. и др. Основы физической и коллоидной
химии. – М.: «Просвещение», 1985.
2.
Гамеева О.С. Сборник задач и упражнений по физической и
коллоидной химии: Учебное пособие. – М.: Высшая школа, 1980.
3.
Лабораторные работы и задачи по коллоидной химии. / Под
ред. Ю. Г. Фролова. – М.: «Химия», 1986.
4.
Физическая и коллоидная химия: Учебное пособие. / Под
ред. Добычина Д.П. – М.: Просвещение, 1986.
5.
Фридрихсберг Д.А. Курс коллоидной химии: Учебник. – Л.:
Химия, 1984.