Содержание
Задача 11. 3
Задача 36. 3
Задача 57. 4
Задача 96. 5
Задача 112. 6
Задача 127. 7
Задача 172. 7
Задача 217. 8
Задача 228. 8
Задача 258. 9
Список литературы.. 11
Задача 11
Масса 2*10-
Решение:
Количество вещества газа равно:
n = V/ Vm = 2/22.4 = 0.089 моль
Молярная масса газа находится из выражения:
М = m/n = 2.35/0.089 = 26.4 г/моль
1 моль газа содержит 6*1023 молекул (Закон Авогадро)
N = Na * n = 0.089*6*1023 = 0,534 *1023 молекул
Масса одной молекулы газа равна:
2,35 / 0,523*1023 = 4,49 * 10-
Ответ: М = 26,4 г/моль; масса одной молекулы равна 4,49 * 10-
Задача 36
Сколько протонов и нейтронов содержат ядра изотопов? Составьте электронную формулу данного атома, подчеркните валентные электроны. Распределите электроны этого атома по квантовым ячейкам. К какому электронному семейству относится этот элемент? 2143Sc и 2144Sc
Решение:
2143Sc и 2144Sc
Число нейтронов в ядре атома элемента равно разности округленного до целого значения атомной массы Аr и числа протонов (порядкового номера)[1]. Таким образом, число нейтронов в 2143Sc равно:
43 – 21 = 22
Число нейтронов в 2144Sc равно:
44 – 21 = 23
Электронная формула элемента:
1s22s2 2p63s23p64s23d1
Распределение электронов по квантовым ячейкам выглядит следующим образом (рис.1):
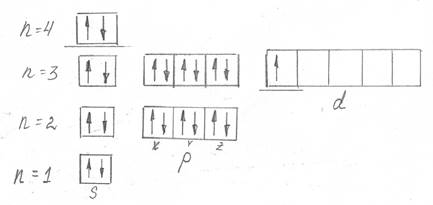
Рисунок 1 – Распределение электронов по квантовым ячейкам в атоме элемента Sc
У рассматриваемого элемента три валентных электрона.
Данный элемент относится к семейству d- элементов.
Задача 57
Назовите высшие степени окисления титана и германия, хрома и селена, хлора и марганца. Составьте формулы оксидов данных элементов, отвечающих высшим степеням окисления.
Решение:
Высшая степень окисления соответствует номеру группы Периодической системы элементов, в которой находится данный элемент[2].
Таким образом, высшая степень окисления титана и германия равна 4 (IV группа), высшая степень окисления хрома и селена равна 6 (VI группа), высшая степень окисления хлора и марганца равна 7 (VII группа).
Формулы оксидов данных элементов:
ТiO2, GeO2, СrO3, SeO3, Cl2O7 и Mn2O7.
Задача 96
Горение ацетилена протекает по уравнению:
С2Н2 (г) + 5/2 О2 (г) = 2 СО2(г) + Н2О (г)
Исходя из значений ∆Нº298 и Sº298 соответствующих веществ, вычислите ∆Gº298 данной реакции.
Решение:
∆Gº298 = ∆Нº298 – Т * Sº298
∆Нº298 = Σ∆Нºпрод - ∆Нºреаг =2∆Нº(СО2)+∆Нº(Н2О)-5/2∆Нº(О2) - ∆Нº (С2Н2)
∆Нº(СО2) = - 393, 51 кДж
∆Нº(Н2О) = -241, 81 кДж
∆Нº (О2) = 0
∆Нº (С2Н2) = 226, 75 кДж
Тогда ∆Нº298 = 2*(-393,51) + (-241,81) - 226,75 = -1255,58 кДж
Sº298 = ΣSºпрод - Sºреаг
Sº (СО2)[3] = 213, 66 Дж/ моль*К
Sº (Н2О) = 188, 72 Дж/ моль*К
Sº (О2) = 205,04 Дж/ моль*К
Sº (С2Н2)[4] = 200.82 Дж/ моль*К
Sº298 = 2 * 213,66 + 188,72 - 205,04 – 200,82 = 210,18 Дж
∆Gº298 = ∆Нº298 – Т * Sº298 = -1255,58 *10 3– 298 * 210,18 = -1318213, 64Дж = -1318,2
Задача 112
Приведите формулировку закона действующих масс. Определите, как изменится скорость гетерогенной реакции:
С2Н5ОН (ж) + 3 О2 (г) = 2 СО2 + 3 Н2О (ж)
если увеличить давление в три раза.
Количественное описание обратимых реакций можно проводить с
помощью закона действующих масс (закона действия масс), который был открыт в
химическая реакция находится в состоянии равновесия, если отношение произведения концентраций продуктов к произведению концентраций реагентов достигает постоянного значения, характерного для этой реакции при данной температуре. Закон действующих масс выражается уравнением[5]:
с С с D / с А с В = Кс
Скорость данной реакции выражается уравнением:
vпр = к * с (О2)3
При увеличении давления системы в системе в три раза:
vпр 1 = к * 3 с (О2)3
Тогда vпр 1 / vпр = к * (3 с (О2)3 / к * с (О2)3 = 27
Ответ: при увеличении давления в системе в 3 раза скорость данной реакции возрастет в 27 раз.
Задача 127
Константа равновесия реакции N2 + 3H2 ↔2NH3 равна 0,1 (при температуре 400 ºС). Равновесные концентрации [H2] = 0.2 моль/дм3. [NH3] = 0.08 моль / дм3. Вычислите начальную и равновесную концентрации азота.
Решение:
vпр = к1 [N2] [H2]3
vобр = к2 [NH3]2
Кр = [NH3]2 / [N2] [H2]3
Тогда [N2] = 0,082 / 0,23 * Кр
[N2] = 8 моль / л
1 моль N2 соответствует 2 моль NH3
х мол соответствует 0,08 моль NH3
Исходная концентрация находится из соотношения:
Сисх = [N2] + Сизрасх = 8 + 0,04 = 8,04 моль/дм3
Задача 172
Подберите по два молекулярных уравнения реакции, которые выражаются следующими ионно-молекулярными уравнениями:
Сu2+ + 2 ОН- = Сu(OH)2
Ва2+ + SO42- = ВаSO4
Решение:
Соли подбираем в соответствии с таблицей растворимости
Первое уравнение реакции:
СuCl2 + 2KOH = Сu(OH)2 + 2 KCl
СuSO4 + 2 NaOH = Сu(OH)2 + Na2 SO4
Второе уравнение реакции:
ВаCl2 + Na2 SO4 = ВаSO4 + 2 NaCl
Ва (NO3)2 + K2 SO4 = ВаSO4 + 2KNO3
Задача 217
Закончите уравнения реакций, в которых окислителей служит азотная кислота:
Сu + НNO3 (конц.) →
Zn + НNO3 (разб.) →
Решение:
Концентрированная азотная кислота, содержащая значительные количества молекул НNO3, действует как сильный окислитель, но по мере разбавления ее водой, образующейся при реакции, окислительная активность кислоты снижается. Продуктом восстановления азотной кислоты являются нитрозные газы. Концентрированная азотная кислота «растворяет», превращает в соли и такие металлы, которые в ряду активности расположены после водорода, за исключением золота и платины.
Сu + НNO3 (конц.) → Сu (NO3)2 + NO2 + H2O
Сu + 4 НNO3 (конц.) → Сu (NO3)2 + 2 NO2 + H2O
В сильно разбавленной азотной кислоте уже нет молекул (существуют только ионы Н3О+ и NO3-), поэтому такая кислота НNO3 уже не переводит в раствор медь и другие благородные металлы.
Реакции многих металлов с разбавленной азотной кислотой протекают по обычному типу, т.е. с вытеснением водорода. Однако последний не выделяется, а расходуется на восстановление избытка НNO3 до производных более низкой валентности вплоть до аммиака.
4 Zn +10 HNO3(разб.) = 4 Zn (NO3)2 + NH4NO3 + 3H2O
Задача 228
В какой пробирке происходит реакция при внесении кадмиевых пластинок в растворы хлорида железа (II) и кобальта (II)?
Решение:
В задаче требуется определить какая из реакций возможна:
FeCl2 + Cd → (1)
CoCl2 + Cd→ (2)
Каждый металл вытесняет из солей все другие металлы, стоящие правее его в электрохимическом ряду напряжений.
Кадмий в ряду напряжений стоит правее железа, значит, способен вытеснить железо из раствора. Таким образом, реакция протекает в соответствии с уравнением:
FeCl2 + Cd = СdCl2 + Fe
Кадмий в ряду напряжений металлов стоит левее кобальта, значит, не может вытеснить его из раствора соли и реакция (2) не идет.
Задача 258
В раствор соляной кислоты опустили кусочек чистого железа и железа, частичного покрытого оловом. Масса железа в обоих случаях одинакова. В каком случае железо растворится быстрее? Напишите электронные уравнения анодного и катодного процессов коррозии железа.
Решение:
Если взаимодействию с кислотой подвергается химически чистый металл, то выделяющийся первоначально водород в большей или меньшей степени удерживается его поверхностью и предохраняет последнюю от дальнейшей коррозии. При наличии контакта двух разнородных металлов создается гальваническая пара, причем водород выделяется на менее активном металле, который тем самым и предохраняется от коррозии. Напротив, более активный металл в этом случае разрушается быстро. При коррозии луженого железа, начиная от поврежденного места, происходит дальнейшее ржавление железа под остающимся неизменным слоем олова.
Луженое железо (железо, покрытое слоем олова)
Sn | H+ | Fe
Анодный процесс:
Fe – 2 e- = Fe2+ (в результате взаимодействия с водой впоследствии образуется гидроксид железа, т.е. ржавчина).
Катодный процесс (в кислой среде):
2Н+ + 2 е = Н2 (восстановление)
Вывод: коррозия луженого железа проихсодит быстрее, чем коррозия чистого железа.
Список литературы
1. Химия / Под ред. В. Шретера . – М.: Химия, 1986. – 648 с.
2. Ходаков Ю.В., Цветков Л.А. Химия – М.: Государственное учебно-педагогическое издательство министерства просвещения РСФСР, 1961. – 424 с.
3. Рабинович В.А., Хавин З.Я. Краткий химический справочник. – Л.: Химия, 1977. – 376 с.
4. Краткий справочник физико-химических величин. – Л.: Химия, 1983. – 232 с.
5. Некрасов Б.В. Учебник общей химии. – М.: Химия, 1972. – 472 с.
[1] Химия / Под ред. В. Шретера . – М.: Химия, 1986. – 648 с.
[2] Ходаков Ю.В., Цветков Л.А. Химия – М.: Государственное учебно-педагогическое издательство министерства просвещения РСФСР, 1961. – 424 с.
[3] Рабинович В.А., Хавин З.Я. Краткий химический справочник. – Л.: Химия, 1977. – 376 с.
[4] . Краткий справочник физико-химических величин. – Л.: Химия, 1983. – 232 с.
[5] Некрасов Б.В. Учебник общей химии. – М.: Химия, 1972. – 472 с.