Задача № 1
Образование мочевины протекает по уравнению:
2NH3 (г) + CO2 (г) = (NH2)2CO(г) + H2O(г)
Константа скорости прямой реакции равна 0,5, начальные
концентрации аммиака и оксида углерода (IV) – 2 и 1,5 моль/л соответственно. Вычислить скорость реакции в
момент времени, когда образовалось 0,5 моль/л воды.
Решение. Согласно
закону действия масс скорость данной реакции равна
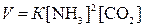
Когда образовалось 0,5 моль/л
воды было
израсходовано 0,5 моль/л углекислого газа и 1 моль/л аммиака (так как по
уравнению реакции n(H2O) : : n(CO2) : n(NH3) как 1: 1: 2). Следовательно, концентрация аммиака
стала равной (2 – 1) = 1 моль/л, а углекислого газа – (1,5 – 0,5) = 1 моль/л. Отсюда
скорость реакции равна
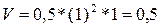
Ответ: V = 0,5.
Задача № 2
Реакция выражается уравнением
Н2 (г) + Вr2 (ж) = 2НВr(г)
Начальная концентрация водорода составляет 0,03 моль/л,
константа скорости прямой реакции равна 0,5, обратно – 0,4. Рассчитайте
начальную скорость прямой реакции и скорость обратной реакции в тот момент,
когда в реакционной смеси останется 60% водорода.
Решение. Согласно
закону действия масс скорость данной реакции равна
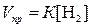 ;
; 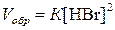
Подставляя известные значения, получим
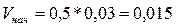
Когда в реакционной смеси
осталось 60% водорода, его
концентрация стала 0,03 * 0,6 = 0,018 моль/л, т.е. в реакцию вступило
(0,03 – 0,018) = 0,012 моль/л водорода. По уравнению реакции n(H2) : n(HBr) как 1 : 2, следовательно, концентрация бромоводорода
равна 2 * 0,012 = 0,024 моль/л. Отсюда скорость реакции равна
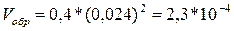
Ответ: Vнач = 0,015, Vобр = 2,3 * 10-4
Задача № 3
Для реакции
2СuО(т) + СО(г) = Сu2О(т)
+ СО2 (г)
Начальная концентрация оксида углерода (II) равна 3,21 моль/л, константа равновесия
равна 15,89. Рассчитайте равновесные концентрации газообразных веществ.
Решение. Константа равновесия данной
системы
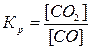
В
условии задачи дана исходная концентрация, тогда как в выражении Кр
входят только равновесные концентрации всех веществ системы. Предположим, что к
моменту равновесия концентрация [СО2]р = х моль/л.
Согласно уравнению системы столько же молей (х моль/л) СО расходуется для
образования по х молей СО2. Следовательно, равновесные концентрации
веществ
[СО2]р
= х моль/л;
[СО]р
= (3,21 – х) моль/л.
Зная
константу равновесия, находим значение х, а затем искомые концентрации всех
веществ
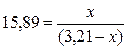 ;
; 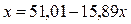 ;
; 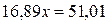 ;
;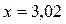 моль/л.
моль/л.
Таким
образом, искомые равновесные концентрации:
[СО2]р
= 3,02 моль/л;
[СО]р = 3,21 – 3,02 = 0,19 моль/л.
Ответ: [СО2]р
= 3,02 моль/л, [СО]р = 0,19 моль/л.
Задача № 4
Реакция протекает по уравнению:
СО2 (г) +
2N2 (г) = С(т)
+ 2N2О(г)
Константа равновесия для данной реакции равна 2,5,
равновесные концентрации диоксида азота и азота равны 1моль/л. Рассчитайте
исходные концентрации реагентов. Увеличится ли выход продуктов реакции при
одновременном понижении температуры и давления в системе?
Решение. Константа равновесия данной
системы
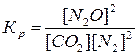
Отсюда равновесная концентрация оксида углерода (IV) равна
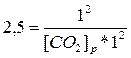 ;
; 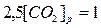 ;
; 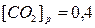 моль/л.
моль/л.
По уравнению реакции n(N2O) : n(СО2) : n(N2) как 2 : 1 : 2 или 1 : ½ : 1, следовательно, концентрация
прореагировавшего оксида углерода равна ½ *1 = = 0,5 моль/л, а азота
- 1 моль/л. Отсюда исходные
концентрации реагентов равны
[СО2]исх = [СО2]р + [СО2]прор
= 0,4 + 0,5 = 0,9 моль/л;
[N2]исх = [N2]р + [N2]прор = 1 + 1 = 2
моль/л.
Данная реакция является эндотермической, т.е. идет с
поглощением тепла, следовательно, при уменьшении температуры выход продуктов
уменьшится. При понижении давления выход продуктов также уменьшится. Отсюда, при
одновременном понижении температуры и давления в системе выход продуктов
реакции не увеличится.
Ответ: [СО2]исх
= 0,9 моль/л; [N2]исх = 2 моль/л.
Задача № 5
В какой массе Н2SО4 содержится столько же эквивалентов, сколько в 140
г Cr(OH)3?
Решение. Эквивалентная масса Cr(OH)3
равна ⅓ его мольной массы, т.е. 103 / 3 = 34,3 г/моль. Следовательно, в
140 г Cr(OH)3 содержится 140 / 34,3 = 4,1 эквивалента.
Эквивалентная масса Н2SО4 равна ½ его массы, т.е. 98 / 2 = 49 г/моль.
Отсюда 4,1 эквивалента составляют 49 * 4,1 = 200,9 г.
Ответ: m(Н2SО4) = 200,9 г.
Задача № 6
Рассчитайте массу образовавшегося сульфата алюминия по
уравнению
2Аl2О3 (т) + 6SО2 (г) + 3О2
(г) = 2Аl2(SО4)3 (т)
если в процессе выделилось 5000 кДж
теплоты.
Решение. Составим термохимическое
уравнение данной реакции:
Аl2О3 (т) + 3SО2 (г) + 1,5О2
(г) = Аl2(SО4)3 (т); ΔНх.р. =?
Для
решения задачи применим вывод из закона Гесса:
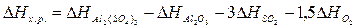
Используя
табличные данные, определим теплоты образования Аl2О3 (т), SО2 (г), Аl2(SО4)3 (т):
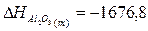 кДж;
кДж;
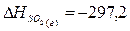 кДж;
кДж;
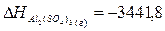 кДж.
кДж.
Учитывая,
что теплоты образования простых веществ условно приняты равными нулю
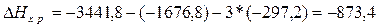 кДж.
кДж.
Масса 1 моль Аl2(SО4)3
равна его молярной массе, т.е. 342 г.
При образовании 342 г Аl2(SО4)3
выделяется 873,4 кДж теплоты, следовательно, если выделяется 5000 кДж теплоты,
масса сульфата алюминия равна
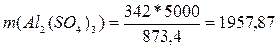 г
г
Ответ: m (Аl2(SО4)3) = 1957,87
г.
Задача № 7
При восстановлении 1 моль диоксида кремния магнием
выделяется 350,7 кДж теплоты. Определите стандартную энтальпию образования
оксида магния, если известно, что 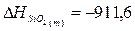 кДж.
кДж.
Решение. Если в результате реакции
выделяется теплота, то ΔН < 0. Учитывая сказанное, составим
термохимическое уравнение данной реакции:
SiО2 (т)
+ 2Mg (т) = 2MgО (т) + Si (т); ΔНх.р. = -350,7 кДж.
Для
решения задачи применим вывод из закона Гесса:
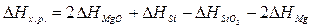
Учитывая,
что теплоты образования простых веществ условно приняты равными нулю
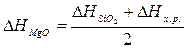
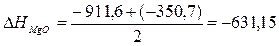 ;
;
Ответ: 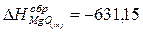 кДж/моль.
кДж/моль.
Задача № 8
Какая из реакция более вероятна при 8000 С (или
1073 К)
3Fe2O3 (т) + Н2 (г) =
2Fe3О4
(т) + Н2О(г)
Fe2O3 (т) + 3Н2 (г) =
2Fe (т) + 3Н2О(г)
Решение. Для
решения задачи применим вывод из закона Гесса:
а)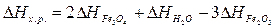 ;
;
б) 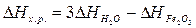
Используя табличные данные, определим теплоты
образования Fe2O3 (т), Fe3О4 (т), Н2О(г):
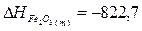 кДж;
кДж;
 кДж;
кДж;
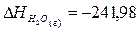 кДж.
кДж.
а) 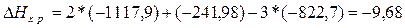 кДж;
кДж;
б) 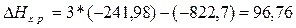 кДж.
кДж.
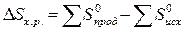
Используя табличные данные, определим стандартные
энтропии Fe2O3 (т), Н2 (г), Fe3О4 (т),
Fe (т), Н2О(г):
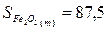 Дж/(моль*К);
Дж/(моль*К);
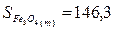 Дж/(моль*К);
Дж/(моль*К);
 Дж/(моль*К);
Дж/(моль*К);
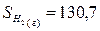 Дж/(моль*К);
Дж/(моль*К);
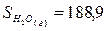 Дж/(моль*К).
Дж/(моль*К).
а) 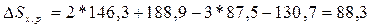 Дж/(моль*К) или 0,0883
кДж/(моль*К);
Дж/(моль*К) или 0,0883
кДж/(моль*К);
б) 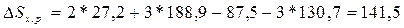 Дж/(моль*К) или 0,1415
кДж/(моль*К).
Дж/(моль*К) или 0,1415
кДж/(моль*К).
Энергию Гиббса находим из соотношения
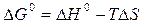
а) 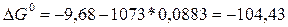 кДж;
кДж;
б) 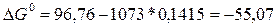 кДж.
кДж.
Следовательно, при 8000 С более
вероятна первая реакция, т.е.
3Fe2O3 (т) + Н2
(г) = 2Fe3О4
(т) + Н2О(г)
Список литературы
1.
Ахметов Н.С. Общая и неорганическая химия: Учебник для вузов.
– М.: Высшая школа, 1981.
2.
Вовченко Г.Д. Третьяков Ю.Д. Общая химия, 1980.
3.
Глинка Н.Л. Общая химия, 2000.
4.
Суворов А.В. и др. Общая химия. – СПб: Химия, 1995.
5.
Угай Я.А. Общая химия. – М.: Высшая школа, 1984.