Содержание
Задача 3. 2
Задача 12. 3
Задача 27. 7
Задача 35. 9
Задача 48. 15
Задача 58. 18
Список литературы.. 20
Задача 3.
1. Термохимия: экзо- и эндотермические реакции.
Термохимические уравнения, их особенности.
2. Определите какая из данных реакций экзо- , а какая
эндотермическая? Ответ обоснуйте.
N2
+ O2 ↔
2 NO ∆H = + 80 кДж
N2
+ 3Н2 ↔ 2NH3 ∆H = -88 кДж
Решение:
1. Химические реакции,
сопровождающиеся выделением теплоты в окружающую среду, называются
экзотермическими (Qp меньше нуля). Для экзотермических реакций ∆U < 0, т.е. запас энергии
продуктов оказывается меньшим, чем запас энергии реагентов. Аналогично,
энтальпия экзотермических реакций меньше нуля (отрицательно), ∆ Н < 0;
другими словами, реакционная система в целом (реагенты в зависимости от
обратимости или необратимости уменьшает свой запас энергии, что проявляется в
нагревании сначала реакционной смеси, а затем и окружающей среды.
Химические реакции,
сопровождающиеся поглощением теплоты из окружающей среды, называются
эндотермическими (Qp больше нуля). Для эндотермических реакций ∆U >
0, т.е. запас энергии продуктов оказывается большим, чем запас энергии
реагентов. Аналогично, энтальпия экзотермических реакций больше нуля
(положительно), ∆ Н > 0; другими словами, реакционная система в целом
(реагенты в зависимости от обратимости или необратимости увеличивает свой запас
энергии, что проявляется в охлаждении сначала реакционной смеси, а затем и
окружающей среды[1].
2. Реакция N2
+ O2 ↔
2 NO ∆H = + 80 кДж является эндотермической,
т.к. ∆ Н > 0.
Реакция N2
+ 3Н2 ↔ 2NH3 ∆H = -88 кДж является
экзотермической, т.к. ∆ Н < 0.
Задача 12
1. Вязкость жидкостей, ее
зависимость от различных факторов. Метод определения относительной вязкости.
Влияние вязкости на качество (в том числе консистенцию) пищевых продуктов:
супов, студней, желированных блюд, каш, пюре, изделий из теста.
2. Вычислите вязкость оливкового
масла при 20º С, если оно протекает через вискозиметр за 5 мин 49 секунд,
а для того же объема воды при тех же
условиях требуется 4 секунды. Плотность оливкового масла 914,18 кг/м3,
вязкость воды 0,01 Пз [1 * 10-3 кг/мс].
Решение:
1. Вязкостью жидкости называется
сопротивление передвижению одного слоя жидкости относительно другого слоя.
Единицей вязкости, или пуазом, характеризуется вязкость жидкости, в которой
слои в 1 см находящиеся на расстоянии 1 см, движутся относительно друг друга со
скоростью 1 см/сек под действием силы в 1 дан.
При достаточно высоких скоростях
течения слоистое, или ламинарное, течение жидкости сменяется вихревым, или
турбулентным.
Вязкость обычно измеряют в
пределах ламинарного течения. Если при изменении скорости течения в пределах
ламинарности вязкость жидкости остается постоянной, т. е. скорость течения
прямо пропорциональна приложенной силе, жидкость называется ньютоновской, если
же вязкость при этом изменяется и скорость течения жидкости не пропорциональна
приложенной силе, Жидкость называется неньютоновской. Чистые жидкости и
разбавленные растворы коллоидов со сферическими частицами характеризуются
ньютоновской вязкостью.
Вязкость обычно измеряют в
капиллярных вискозиметрах, в которых точно фиксируется время истечения объема
жидкости между метками вискозиметра под
действием собственного веса столба жидкости или приложенного к одному из колен
прибора определенного давления Р; измерения производят при строго постоянной
температуре[2].
Истечение в капиллярных
вискозиметрах подчиняется закону Пуазейля
η = π r4
P t /
8 v l
где l – длина
капилляра и r – радиус капилляра.
Иногда исследуют движение
жидкости в зазоре между двумя вложенными вдруг в друга цилиндрами (коаксиальные
вискозиметры).
При высокой вязкости жидкости
(касторовое масло, глицерин) ее измеряют по скорости падения шарика выбранного
размера на определенном отрезке пути в жидкости (шариковые вискозиметры).
Оседание круглых пигментных включений
в протоплазме и центрифуге используется для определения вязкости протоплазмы.
Основы теории вязкости
разбавленных лиозолей (суспензий) были заложены Эйнштейном. Он исходил из
гидродинамических уравнений для макроскопических твердых сферических частиц,
которые при сдвиге приобретают дополнительное, вращательное движение. Рассеяние
энергии при этом является причиной возрастания вязкости Эйнштейном была
установлена связь между вязкостью дисперсной системы η и объемной долей,
дисперсной фазы φ:
η = η0 (1+
2,5 φ )
(1)
где η0 —
вязкость дисперсионной среды.
При выводе этого уравнения
предполагалось, что система несжимаема, отсутствуют скольжение между частицами
и жидкостью, турбулентность и взаимодействие между частицами. Неоднократные
экспериментальные проверки уравнения Эйнштейна в основном подтвердили его
справедливость. Было установлено, что коэффициент при φ зависит от формы частиц. Поэтому уравнению
Эйнштейна можно придать более общий вид:
η = η0 (1+
αφ )
где — α - коэффициент зависящий от формы
частиц дисперсной фазы.
Для относительной и удельной
вязкости дисперсной системы уравнение переходит в следующие соотношения;
ηотн =
η / η0 = 1+
αφ
ηуд =
(η - η0 ) / η0
= ηотн - 1 = αφ
Из теории
Эйнштейна следует, что разбавленные и устойчивые дисперсные системы являются
ньютоновским жидкостями, что их вязкость линейно связана с объемной долей
дисперсной фазы и не зависит от дисперсности.
Коэффициент α для частиц, форма которых отличается
от сферической, как правило, больше 2,5. Это объясняют тем, что объем вращения частицы несферической
формы больше объема самой частицы, а также больше сопротивление ее движению,
что должно увеличивать вязкость системы в большей степени, чем это следует из
уравнения (1). При значительных отклонениях от сферичности частиц система может
превратиться в неньютоновскую кость, вязкость которой зависит от напряжения
сдвига (и скорости течения). Например, частицы в виде вытянутых палочек ориентируются
в потоке, и поэтому вязкость системы уменьшается с увеличением скорости
течения.
Формула Эйнштейна не учитывает
наличия у частиц поврхностных слоев, таких, как адсорбционные, сольватные и
двойные электрические. Увеличение вязкости, обусловленное наличием слоев,
называют адсорбционным, сольватным и электровязкостным эффектами. Так как
поверхностные слои не изменяют частиц, то их влияние можно учесть, увеличив
объемной долю на объем слоев. Такой подход иногда используют для определении толщины поверхностных слоев. Если объемную
долю слоев обозначить через φδ, а φδ/
φ = К, то
ηуд = 2,5 (1+ К) φ
Так как объем поверхностных
слоев линейно связан с удельной поверхностью дисперсной системы, то вязкость в
системе должна расти с увеличением удельной поверхности дисперсной фазы с
дисперсностью (при постоянной объемной доле дисперсной фазы). При наличии
двойных электрических слоев их объемная доля зависит от электрокинетического
потенциала. Электровязкостный эффект можно уменьшить введением в систему
электролитов: они уменьшают толщину двойного электрического слоя.
Теория Эйнштейна была
использована Штаудингером для
установления формулы вязкости разбавленных растворов полимеров. По
Штаудингеру для растворов, содержащих палочкообразные макромолекулы, должно
соблюдаться соотношение
ηуд = К М с
(6)
где К - константа,
характерная для данного
полимергомологического ряда в данном растворителе; М — молекулярная
масса полимера; С — массовая концентрация полимера.
По представлениям Штаудингера,
чем больше длина молекулы полимера, тем больший объем вращения она имеет и тем
больше вязкость раствора (при одной и
той же концентрации с). Из уравнения (6) следует, что удельная вязкость,
отнесенная к единице концентрации (приведенная вязкость), не зависит от
концентрации раствора полимера с и пропорциональна его молекулярной массе:
ηуд / с = К М
Уравнение Штаудингера
справедливо только для растворов полимеров с короткими и жесткими цепями,
которые могут сохранять палочкообразную форму.
2. Вязкость находится по формуле:
η = π r4
P t /
8 v l
Для воды уравнение вязкости
будет иметь вид:
0,01 = 4 π r4 P
/ 8 v l, откуда
v = 4 π r4 P
/ 0,08 l
Так как по условию задачи объемы
масла и воды равны, то
349
π r4
P / 8 η l = 4 π r4 P
/ 0,08 l
Тогда η = 349 * 0,08 / 8 * 4 = 0,8725 Пз
Ответ: вязкость масла равна 0,8725 Пз
Задача 27
1. Замерзание и кипение растворов. Второй закон Рауля.
2. В 100 г бензола растворено 2,56 г нафталина С10Н8,
рассчитайте понижение температуры замерзания этого раствора, если
криоскопическая константа бензола равна 5,2 ºС.
Решение:
1. Закон
Рауля выражается следующим образом. Для предельно
разбавленных растворов:
понижение
температуры замерзания 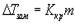 ,
,
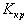 - криоскопическая постоянная;
- криоскопическая постоянная;
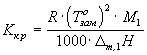 ,
, 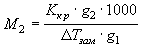 ,
,
где 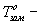 температура
замерзания чистого растворителя,
температура
замерзания чистого растворителя, 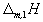 - молярная
теплота плавления чистого растворителя,
- молярная
теплота плавления чистого растворителя, 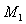 -
молекулярная масса растворителя,
-
молекулярная масса растворителя, 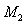 -
молекулярная масса растворённого вещества,
-
молекулярная масса растворённого вещества, 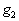 - масса
растворённого вещества,
- масса
растворённого вещества, 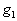 - масса
растворителя;
- масса
растворителя;
повышение
температуры кипения 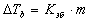 ,
, 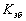 - эбулиоскопическая
постоянная:
- эбулиоскопическая
постоянная:
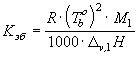 ,
, 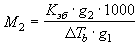 ,
,
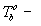 температура
кипения чистого растворителя, К,
температура
кипения чистого растворителя, К, 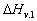 - молярная
теплота испарения чистого растворителя;
- молярная
теплота испарения чистого растворителя;
2. Найдем понижение температуры раствора из формулы:
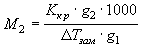 ,
,
где
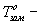 температура
замерзания чистого растворителя,
температура
замерзания чистого растворителя, 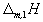 - молярная
теплота плавления чистого растворителя,
- молярная
теплота плавления чистого растворителя, 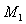 -
молекулярная масса растворителя,
-
молекулярная масса растворителя, 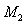 -
молекулярная масса растворённого вещества,
-
молекулярная масса растворённого вещества, 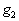 - масса
растворённого вещества,
- масса
растворённого вещества, 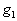 - масса
растворителя;
- масса
растворителя;
Откуда
∆Тзам = М2 *
g1/ 1000 * Ккр * g2 ,
подставляя исходные данные, получаем:
∆Тзам
= 128 * 100 / 1000 * 5,2 *
2,56 = 0,96 º С.
Задача 35
1. Адсорбция газов и растворенных веществ твердыми
адсорбентами. Строение твердой поверхности, примеры адсорбентов. Зависимость
адсорбции от величины поверхности адсорбента, его природы.
2. Выбрать правильный ответ и пояснить его:
Какие вещества энергично абсорбирует уголь?
1. воду;
2. бензол;
3. оба ответа правильные
Решение:
1. Адсорбция - изменение
концентрации вещества на границе раздела фаз по сравнению с объемом. В
настоящее время этим термином обозначают также и процесс поглощения, и
количество поглощенного вещества Г, отнесенного к единице площади поверхности
или массы адсорбента [ммоль/м2 или в ммоль/г].
Адсорбент - вещество, на поверхности которого
происходит процесс адсорбции.
Адсорбат - адсорбирующееся вещество.
Адсорбция
физическая - адсорбция,
обусловленная силами межмолекулярного взаимодействия; как правило - обратима.
Хемосорбция - поглощение газов, паров или
растворенных веществ твердыми или жидкими поглотителями, сопровождающееся
образованием химических соединений. В отличие от физической адсорбции теплоты хемосорбции близки к теплотам
химических реакций ~ 40-400 кДж/моль (см. также теплота адсорбции).
Изотерма
адсорбции - функциональная зависимость
количества адсорбированного поверхностью вещества от давления или концентрации
этого вещества в другой фазе Г = f(P)T=const, Г = f(c)T=const.
При монослойной локализованной адсорбции на однородной поверхности
Г = f(P) описывается изотермой Лэнгмюра:
 ,
, 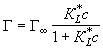 , при с << 1
, при с << 1 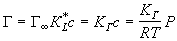
при с >> 1 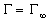 ,
, 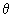 =1,
=1,
где q - степень заполнения, Г -
предельная адсорбция, КL -
константа адсорбционного равновесия в первом слое (т.е. адсорбция по Лэнгмюру),
KГ - константа
Генри. Если поверхность энергетически неоднородна, используют эмпирическое уравнение Френдлиха:
-
предельная адсорбция, КL -
константа адсорбционного равновесия в первом слое (т.е. адсорбция по Лэнгмюру),
KГ - константа
Генри. Если поверхность энергетически неоднородна, используют эмпирическое уравнение Френдлиха:
Г = x/m = kcn,
где x -
количество адсорбированного вещества, m
- масса адсорбента, k,n - аппроксимационные параметры.
При многослойной адсорбции изотерма
описывается уравнением БЭТ:
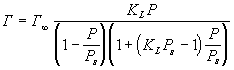
где Ps
- давление насыщенного пара адсорбата.
Никаких особых сил, за счет
которых происходит адсорбция, согласно современным представлениям, не
существует. Адсорбционные силы—это химические силы, действующие между атомами,
или межмолекулярные силы, с той лишь разницей, что эти молекулы или атомы
принадлежат разным фазам и взаимодействие происходит в поверхностном слое,
которому присуща своя специфика.
Адсорбция веществ из газовой
(или жидкой) фазы на твердых телах определяется в значительной степени силовым
полем твердой поверхности. Здесь, как и при изучении пленок на твердых телах
необходимо иметь в виду реальную твердую поверхность, ее состав и структуру.
Поверхность всегда неровна; шлифовка и полировка оставляют выступы и впадины
высотой в единицы и десятки нм.
На монокристаллах разные грани
обладают различной адсорбционной активностью, разными значениями поверхностного
натяжения.
Локальные напряжения в твердом
теле, также как и грани, обладающие наибольшими значениями о чаще всего
являются центрами адсорбции. Наряду с гранями большое значение для адсорбции
имеют дефекты структуры реальных кристаллов.
Адсорбция растет с увеличением
дисперсности, поэтому важнейшим параметром является удельная поверхность s0 – доступная площадь, приходящаяся на единицу массы.
Для хороших абсорбентов s0 составляет сотни м2/ г.
Адсорбция на ровной поверхности
зависит в основном от природы адсорбента и адсорбата, от их взаимного сродства.
Необходимо различать влияние этих факторов на величину адсорбции А и на
константу адсорбционного равновесия К. Чем сильнее взаимодействие адсорбент —
адсорбат, тем больше К и тем большая величина мономолекулярной адсорбции А
достигается при тех же равновесных давлениях или концентрациях. Обычно считают,
что сродство адсорбента к адсорбату (или К) тем сильнее, чем больше их
склонность к образованию связей одной природы, например, к дисперсионному
взаимодействию, или к диполь-дипольному или к образованию водородных связей,
или к сильным химическим взаимодействиям.
Ровная поверхность
графитированной сажи склонна к дисперсионным взаимодействиям, поэтому на ней
сильнее адсорбируются неполярные органические соединения, и тем лучше, чем
больше их молекулярная масса (благодаря аддитивности дисперсионных сил).
Поверхности ионных кристаллов имеют большое сродство к соединениям, молекулы
которых обладают диполями. Чем более полярны вещества, тем они сильнее
адсорбируются на поверхности ионных кристаллов. На поверхности оксидов
элементов обычно имеются гидроксильные группы, которые способны образовывать
водородные связи. Поэтому такие поверхности прочно удерживают воду, спирты,
амины и др. Гидроксилированные поверхности обладают сильными поляризующими
свойствами. Например, они проявляют специфическое сродство к ароматическим и
непредельным соединениям, которые склонны к образованию л-связей.
Константа адсорбционного
равновесия К и величина адсорбции А зависят от когезионного взаимодействия
между молекулами адсорбата. Чем оно больше, тем слабее взаимодействие адсорбат—
адсорбент (т. е. меньше К) и соответственно изменяется величина А при
мономолекулярной адсорбции. При полимолекулярной адсорбции величина адсорбции А
может увеличиться с усилением взаимодействия адсорбат— адсорбат. При
значительных когезионных взаимодействиях конденсация адсорбированного вещества
на поверхности наступает при меньших давлениях, чем для веществ, имеющих малые
когезионные силы. В связи с этим возможны случаи, когда константа
адсорбционного равновесия для одного вещества больше, чем для другого, а
величина полимолекулярной адсорбции А, начиная с некоторых давлений, для
первого вещества меньше, чем для другого. Таким образом, изотермы адсорбции
этих веществ будут пересекаться.
Химическая адсорбция, или
хемосорбция, отличается от физической адсорбции тем, что первая обусловлена
силами химической природы между адсорбентом и адсорбатом. При химической
адсорбции может теряться индивидуальность исходных компонентов. Энергия
взаимодействия при хемосорбции составляет 40 -
400 кДж/моль, т. е. на 1 - 2 порядка больше этой величины, для
физической адсорбции (10—40 кДж/моль)
Если хемосорбция происходит с
малым тепловым эффектом, то это часто означает, что параллельно идет процесс,
который требует затраты энергии (например, диссоциация молекул адсорбата на
поверхности). В то же время не всегда можно провести четкую границу между
физической и химической адсорбциями, особенно при слабой хемосорбции, так же
как вообще между физическим и химическим взаимодействиями. Хемосорбция
характеризуется специфичностью взаимодействия, приводящего обычно к образованию
поверхностного химического соединения. Сильная хемосорбция часто необратима,
вместо адсорбированного вещества может десорбироваться другое соединение.
Одна из важнейших характеристик
адсорбентов – пористость. В зависимости от размера частиц структуры адсорбентов
могут быть макро- и микропористыми. Типы адсорбентов и их характеристики
приведены в табл.[3]
Таблица – Типы адсорбентов и их
характеристики
|
Тип частиц
|
S0, см2/г
|
Дисперсность и
структура
|
Представители
|
|
Непористые
|
104
- 105
|
Грубодисперсные
(макропористые частицы)
|
Окислы, соли
|
|
106
|
Высокодисперсные
(микропористые структуры)
|
Графитированная
сажа, белая сажа, аэросил
|
|
Пористые
|
106
- 107
|
Корпускулярные,
губчатые
|
Силикагель,
алюмогель, активный уголь, пористые стекла
|
|
Кристаллические
|
Цеолиты
|
2. Активные угли применяют для рекуперации растворителей:
ацетона, бензола, ксилола, сероуглерода, хлороформа и других. Степень
извлечения при адсорбции на активных углях составляет 95-99%. Таким образом,
можно сделать вывод, что уголь наиболее активно адсорбирует бензол.
Ответ: 2 – бензол.
Задача 48
1. Эмульсии: понятие, классификация. Строение эмульсий.
Устойчивость, природа и роль эмульгатора.
1. Эмульсии — это дисперсные
системы образованные двумя несмешивающимися жидкостями. Их получают как
конденсационными, так и диспергационными методами. На практике чаще используют
диспергирование. Как и суспензии, эмульсии обычно подразделяют по размерам
частиц и концентрациям дисперсной фазы.
Дисперсность эмульсий может
изменяться в широких пределах вплоть до истинно коллоидной (диаметр частиц
менее 100 нм). Большинство эмульсий принадлежит к микрогетерогенным системам
(размер частиц 100 им), и их частицы хорошо просматриваются в обычном
микроскопе. Для эмульсий характерна коалесценция капель, т. е. их
самопроизвольное слияние. Чтобы получить высокодисперсные и устойчивые
эмульсии, в систему добавляют стабилизаторы, называемые в данном случае
эмульгаторами.
Для того чтобы различать, какая
из жидкостей эмульсии диспергирована, а какая является дисперсионной средой,
принято полярную жидкость условно называть «водой», а неполярную — «маслом». В
соответствии с этим эмульсии делят на два типа: прямые.— «масло в воде» (м/в) и
обратные —«вода в масле» (в/м). Тип эмульсии определяют по свойствам
дисперсионной среды. Например, прямые эмульсии (м/в) смешиваются с водой
(полярными жидкостями), имеют большую электропроводность, плохо смачивают
гидрофобную поверхность. Противоположными свойствами обладают обратные эмульсии
(в/м).
В зависимости от концентрации
дисперсной фазы эмульсии делят на разбавленные, концентрированные и
высококонцентрированные. Разбавленные эмульсии, имеющие концентрацию дисперсной
фазы до 0,1% (об.), отличаются высокой дисперсностыо (размер капель может быть
менее 100 нм). Концентрация дисперсной фазы в концентрированных эмульсиях не
превышает 74 (об.). Эта максимальная концентрация соответствует плотной
упаковке сферических капель одинакового размера при отсутствии их
деформирования. В концентрированных капли постоянно находятся в контакте, и
поэтому они устойчивы только в присутствии эмульгатора. Если концентрация
дисперсной фазы превышает 74%, то эмульсию называют высококонцентрированной. В
таких эмульсиях движение капель почти отсутствует, они существенно
деформированы, а дисперсионная среда приобретает вид тонких прослоек —
эмульсионных пленок.
Агрегативная устойчивость
эмульсий может обусловливаться многими факторами устойчивости. Для них
характерно и самопроизвольное диспергирование при определенных условиях. Они
могут самопроизвольно образовываться в двухкомпонентной гетерогенной системе
(без эмульгатора) при температуре смещения, близкой к критической.
Сильное понижение поверхностного
натяжения при добавлении ПАВ (третьего компонента) в систему позволяет получить
термодинамически устойчивые (самопроизвольно образующиеся) эмульсии и в обычных
условиях, а не только при критических температурах смещения.
Агрегативная устойчивость
эмульсий количественно характеризуется скоростью их расслоения, или временем
жизни отдельных капель в контакте с другими. Чаще пользуются первой
характеристикой. Известны методы стабилизации эмульсий с помощью ПАВ, ВМС,
порошков. Стабилизация эмульсий с помощью ПАВ обеспечивается благодаря
адсорбции и определенной ориентации молекул ПАВ, что вызывает снижение
поверхностного натяжения. Ориентирование ПАВ в эмульсиях следует правилу
уравнивания полярностей Ребиндера: полярные группы ПАВ обращены, к полярной фазе, а неполярные радикалы — к
неполярной фазе.
Замена эмульгатора может
привести к обращению эмульсии. Например, если к эмульсии м/в (например,
дисперсная среда — оливковое масло), стабилизированной натриевым мылом,
добавлять раствор хлорида кальция, то эмульгатор переходит в кальциевую форму и
эмульсия обращается, т. е. масляная фаза становится дисперсионной средой.
Объясняется это тем, что кальциевое мыло значительно больше растворимо в масле,
чем в воде.
2. Выбрать правильный ответ и пояснить его:
Для каких эмульсий белки являются эмульгаторами?
- масло в воде;
- вода в масле;
- оба ответа правильные;
- правильного ответа нет.
Для того, чтобы различать, какая из
жидкостей эмульсии диспергирована, а какая является дисперсионной средой, принято полярную жидкость условно называть
«водой», а неполярную – «маслом». В соответствии с этим эмульсии делят на два
типа: прямые – «масло в воде» и обратные – «вода в масле». Прямые эмульсии
стабилизируют гидрофильными веществами, обратные – гидрофобными. Белки являются эмульгаторами для эмульсий
типа масло в воде.
Задача 58
1. Набухание
полимеров. Факторы, влияющие на набухание. Значение набухания. Использование
набухания при замесе теста.
Процесс поглощения ВМС больших
объемов низкомолекулярной жидкости, сопровождающейся значительным увеличением
объема ВМС, называется набуханием. На первой стадии взаимодействия ВМС и
низкомолекулярной жидкости, образуется Гетерогенная система, состоящая из ВМС и
свободной низкомолекулярной жидкости. Процесс проникновения молекул
растворителя в макромолекулы ВМС приводит к тому, что при набухании объем
полимера всегда увеличивается, а объем всей системы уменьшается. Уменьшение
объема системы при набухании, называемая контракцией. При набухании происходит
диффузия молекул растворителя в высокомолекулярное вещество.
Это обусловлено двумя факторами:
1. Достаточно большими промежутками между макромолекулами
ВМС.
2. Большей подвижностью маленьких, по сравнению с
макромолекулами ВМС, молекул растворителя.
В результате поглощения растворителя
макромолекулами ВМС, увеличивается плотность системы.
Процесс растворения ВМС можно
разделить на четыре стадии:
1. Начальная стадия. Система
гетерогенна и двухфазна. Представляет собой чистую низкомолекулярную жидкость и
чистый полимер Ж1 + Ж2.
2. Стадия набухания. На этой стадии
система расслаивается на две жидкие фазы. Одна фаза – раствор
низкомолекулярного компонента в компоненте ВМС. Вторая фаза - чистая
низкомолекулярная жидкость. Ж1 + Ж2, где Ж2 – набухший ВМС, а Ж1 чистая
низкомолекулярная жидкость.
3. Стадия образования второго
раствора Ж2 + Ж1. Жидкий растворитель диффузирует в полимер.
4. Стадия полного растворения –
превращение гетерогенной (двухфазной) системы в галогенную Ж1 + Ж2.
Процесс набухания характеризуется
увеличением объема набухшего тела. Если создать препятствие увеличению объема
набухающего тела, то при этом развивается давление, давлением набухания pH .
Существуют ограниченное и
неограниченное виды набухания.
Ограниченное – набухание не переходит
со временем в полное растворение, а останавливается на второй или третьей
стадии. Примером может служить набухание при комнатной температуре желатина.
Неограниченное набухание представляет
непрерывный процесс, переходящий через все четыре стадии и заканчивающийся
полным растворением. Образуется однофазная система. Например, так набухают
каучуки в бензоле, нитроцеллюлоза в ацетоне, белок в воде, целлюлоза в ацетоне[4].
2. Выбрать правильный ответ и пояснить его:
Как кислая среда влияет на набухание пищевых полимеров?
У амфотерных полиэлектролитов степень
набухания зависит от рН раствора. Наименьшее набухание и растворимость отвечают
изоэлектрической точке (значение рН), при котором средний суммарный заряд
макромолекул полиамфолита равен нулю. Выше и ниже этой точки набухание и
растворимость увеличиваются; заражение макромолекул приводит к расталкиванию одноименно
зараженных частиц, что способствует набуханию полимера.
Список литературы
1. Химия / Под. ред. В. Шретера . – М.:
Химия, 1989. – с.62-63.
2. Пасынский А.Г. Коллоидная химия. –
М.: Высшая школа, 1968. – 231с.
3. Фролов Ю.Г. Курс коллоидной химии. –
М.: Химия, 1982. – 400с.
4. Фридрихсберг
Д.А. Курс коллоидной химии. – Л.: Химия, 1984. - 368 с.
[1] Химия
/ Под. ред. В. Шретера . – М.: Химия, 1989. – с.62-63.
[2]
Пасынский А.Г. Коллоидная химия. – М.: Высшая школа, 1968. – 231с.
[3]
Фролов Ю.Г. Курс коллоидной химии. – М.: Химия, 1982. – 400с.
[4]
Фридрихсберг Д.А. Курс коллоидной химии. – Л.: Химия, 1984. - 368 с.