Задача № 6
Классификация анионов по растворимости солей бария и серебра.
Как было указано ранее, для обнаружения катионов обычно применяют качественные реакции, основанные на взаимодействии обнаруживаемых катионов с анионами и сопровождаемые образованием соединений, которые обладают характерными свойствами. Естественно предположить, что для обнаружения анионов можно применять растворы солей катионов, которые с анионами образуют соответствующие характерные соединения.
Особое значение имеют реакции анионов с катионами бария и серебра, с которыми они образуют малорастворимые соли – это лежит в основе классификации анионов, по которой все анионы подразделяются на три аналитические группы.
К первой группе относятся анионы, образующие не растворимые в воде соли бария и серебра: SO42-, SO32-, CO32-, PO43-, AsO33-, AsO43- и др.
Ко второй группе относятся анионы, образующие не растворимые в воде соли серебра: Cl-, Br-, I-, S2-.
К третьей группе относятся анионы, образующие растворимые в воде соли бария и серебра: NO3-, NO2-, CH3COO-.
Задача № 12
Ионы: Na+, Fe2+, CO32-.
Вопросы заданий
1. Укажите, к каким аналитическим группам относятся перечисленные ионы.
2. Отметьте групповые реагенты и покажите их действие на примере приведенных ионов.
3. Составьте уравнения реакций обнаружения указанных ионов, отметьте типы реакций, условия их проведения и аналитические эффекты.
Решение:
Ион Na+
1. Na+ - катион первой аналитической группы.
2. Групповой реагент на катионы этой группы отсутствует.
3. Уравнение реакции обнаружения аниона Na+:
NaCl + KH2SbO4 = NaH2SbO4↓ + KCl.
белый крист.
Условия проведения реакции: температура (15 – 200 С), раствор СН3СООNa, отсутствие ионов аммония и магния, осаждение ведут из концентрированных растворах, чтобы ускорить выпадение осадка нужно потирать стеклянной палочкой о стенки пробирки.
Аналитический эффект реакции: выпадение белого кристаллического осадка.
Тип реакции: реакция обмена.
Ион Fe2+
1. Fe2+ - катион пятой аналитической группы.
2. Групповой реагент на катионы этой группы - избыток NaOH (2 Н).
Уравнение реакции действия группового реагента:
2 NaOH + FeCl2 = Fe(OH)2↓ + 2 NaCl
салатный
3. Уравнение реакции обнаружения аниона Fe2+:
3 FeCl2 + 2 K3[Fe(CN)6] = Fe3[Fe(CN)6]2↓ + 6 KCl
синий
Условия проведения реакции: температура (комнатная), раствор HCl (2 Н), отсутствие окислителей или восстановителей.
Аналитический эффект реакции: образование осадка турнбулевой сини.
Тип реакции: реакция обмена.
Ион CO32-
1. CO32- - анион первой аналитической группы.
2. Групповой реагент на анионы этой группы – раствор BaCl2.
Уравнение реакции действия группового реагента:
Na2СO3 + BaCl2 = BaСО3↓ + 2 NaCl.
белый крист.
3. Уравнение реакции обнаружения аниона CO32-:
K2CO3 + 2 HCl = CO2↑ + 2 KCI + H2O
Ca(OH)2 + CO2 = CaCO3↓ + H2O
Условия проведения реакции: температура (комнатная), раствор HCl (2 Н), отсутствие сульфитов и тиосульфатов.
Аналитический эффект реакции: образование белого осадка или мути.
Тип реакции: реакция обмена и разложения.
Задача № 23
Дайте определение и рассчитайте массовую долю и массовую концентрацию растворённого вещества, его молярную и моляльную концентрации, молярную концентрацию эквивалентов и титр раствора на основании данных:
|
Формула вещества |
Масса вещества, г |
Масса воды, г |
Плотность раствора, г/мл |
|
H2SO4 |
20 |
597 |
1,02 |
Решение:
Раствор - это гомогенная система, состоящая из растворенного вещества, растворителя и продуктов их взаимодействия.
Важнейшей количественной характеристикой раствора является его концентрация, которая показывает содержание растворенного вещества в определённом количестве раствора или растворителя.
1. Определим массу раствора (m(р-ра)):
![]() ,
,
где: m (В) - масса растворенного вещества В, г;
m (воды) – масса воды, г.
![]() г.
г.
2. Рассчитаем массовую долю растворенного вещества (ω (В)):
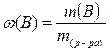
![]() или 3,24%
или 3,24%
3. Вычислим объем раствора (V), используя формулу:
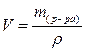 ,
,
где: ρ – плотность раствора, г/мл.
![]() мл.
мл.
4. Определим массовую концентрацию растворённого вещества (γ (В)):
![]() ,
,
где: V – объем раствора, л; 604,9 мл = 0,6049 л
![]() г/л.
г/л.
5. Вычислим молярную концентрацию вещества (С (В)):
![]() ,
,
где: М (В) - молярная масса вещества В, г/моль; М (H2SO4) = 1*2 + 32 + 16*4 = = 98 г/моль.
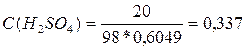 моль/л.
моль/л.
6. Рассчитаем моляльную концентрацию вещества (Cm (В)):
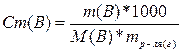 ,
,
где: mр-ля – масса растворителя, в нашем случае воды, г.
![]() моль/кг.
моль/кг.
7. Вычислим молярную массу эквивалентов растворенного вещества (Мэк (В)):
![]() ,
,
где: Z (В) - эквивалентное число.
Z кислоты равно числу ионов Н+: для H2SO4 Z = 2.
![]() г/моль.
г/моль.
8. Определим молярную концентрацию эквивалентов вещества (Сэк (В)):
![]()
![]() моль/л.
моль/л.
9. Вычислим титр раствора (Т (В)):
![]() ,
,
![]() г/мл.
г/мл.
Ответ: ω (H2SO4) = 0,0324; γ (H2SO4) = 33,06 г/л; С (H2SO4) = 0,337 моль/л; Cm (H2SO4) = 0,342 моль/кг; Сэк (H2SO4) = 0,674 моль/л; Т (H2SO4) = 0,03306г/мл.
Задача № 38
Общая характеристика метода йодометрии. Рабочие растворы метода, их приготовление и стандартизация. Индикатор метода. Особенность определения окислителей.
Йодометрический метод анализа основан на окислительно-восстановительных процессах, связанных с восстановлением I2 до I--ионов или с окислением I--ионов до I2:
I2 + 2ē ↔ 2 I-
Стандартный потенциал пары I2/2I- сравнительно невелик, он равен +0,54в.
Положение пары I2/2I- примерно в середине таблицы окислительных потенциалов показывает, что: а) существует ряд восстановителей, способных окисляться свободным йодом (имеющие Е° < +0,54 в); б) имеется также ряд окислителей, способных восстанавливаться I--ионами (имеющие Е° > +0,54 в).
Отсюда возникает возможность двоякого использования окислительно-восстановительных свойств пары I2/2I- в титриметрическом анализе: для определения восстановителей — окислением их раствором йода и для определения окислителей — восстановлением I--ионами.
Рассмотрим обе группы йодометрических определений.
Определение восстановителей. Если на раствор тиосульфата натрия действовать свободным йодом, то происходит реакция:
2 S2O32- + I2 → 2 I- + S4O62-
Из ионного уравнения реакции видно, что два тиосульфат-иона S2O32- превращаются в один тетратионат-ион S4O6-. Следовательно, два иона S2O3- отдают молекуле I2 два электрона согласно схеме:
2 S2O32- - 2ē ↔ S4O62-
При титровании раствора Na2S2O3 раствором qода присущая qоду темно-бурая окраска моментально исчезает. Когда же весь Na2S2O3 будет окислен, одна лишняя капля раствора qода окрасит титруемую жидкость в бледно-желтый цвет. Здесь, следовательно, как и в перманганатометрии, можно титровать без индикатора. Однако окраска йода, получающаяся в конце титрования, слаба, и это затрудняет фиксирование точки эквивалентности. Поэтому гораздо удобнее применять в качестве индикатора чувствительный реактив на йод — раствор крахмала, образующий с йодом смешанное комплексно-адсорбционное соединение интенсивно синего цвета. При титровании в присутствии крахмала конец реакции определяют по появлению синей окраски, не исчезающей от одной лишней капли йода. Можно также титровать раствор йода тиосульфатом до обесцвечивания синего раствора от одной капли последнего. В этом случае раствор крахмала прибавляют в самом конце титрования, когда йода останется очень мало и титруемый раствор будет иметь бледную (соломенно-желтую) окраску. Если прибавить крахмал раньше, когда йода в растворе еще много, то образующееся в большом количестве соединение йода с крахмалом медленно реагирует с тиосульфатом, поэтому раствор легко перетитровать.
Зная нормальность раствора йода и затраченные на титрование объемы растворов его и тиосульфата, можно найти нормальность и титр раствора Na2S2O3. Наоборот, по известной нормальности или титру раствора Na2S2O3 можно подсчитать нормальность и титр раствора йода.
Аналогично определяют ряд других восстановителей, способных восстанавливать I2 до I--иона.
Определение окислителей. Поскольку при определении восстановителей титруют раствором йода, естественно ожидать, что при определении окислителей, основанном на восстановлении их ионами I-, придется титровать раствором KI. Однако в действительности такое титрование провести нельзя ввиду невозможности фиксировать точку эквивалентности. В самом деле, при титровании раствором KI какого-нибудь окислителя, например К2Сr2О7:
Сr2О72- + 6 I- + 14 Н+ → 3 I2 + 2 Сr3+ + 7 Н2О
конец реакции характеризовался бы прекращением образования свободного йода. Но этот момент, очевидно, заметить нельзя. Действительно, выше указывалось, что, пользуясь крахмалом в качестве индикатора, легко заметить момент появления в растворе I2 (посинение) или момент его исчезновения из раствора (обесцвечивание синего раствора), но не момент прекращения образования I2.
Поэтому в рассматриваемом случае применяют косвенный метод— метод замещения. К смеси растворов иодида калия и кислоты (взятых в избытке) прибавляют точно отмеченный пипеткой объем раствора определяемого окислителя, например К2Сr2О7.
Схема йодометрического определения окислителей такова:
а) кислота + KI (избыток в колбе) + определяемый окислитель, отмеренный пипеткой (или навеска) → выделение I2 (при стоянии);
б) I2 + 2 Na2S2O3 →2 NaI + Na2S4O6 (титрование I2 тиосульфатом).
Понятно, что когда Н+-ионы в реакции между окислителем и KI не участвуют, подкисление раствора на стадии (а) излишне. Избыток же KI необходим для растворения I2 и предупреждения его улетучивания.
По этой схеме можно йодометрически определять многие окислители, способные окислять I- до I2.
Определение кислот. Йодометрический метод применяют также для определения кислот:
IО3- + 5 I- + 6 Н+ → 3 I2 + 3 Н2О
Как видно из уравнения, при реакции расходуются Н+-ионы и выделяется эквивалентное количество йода. Выделившийся йод оттитровывают тиосульфатом и по затраченному объему и нормальности раствора его вычисляют нормальность и титр соответствующего раствора кислоты.
Из сказанного видно, что йодометрический метод титриметрического анализа имеет весьма широкое применение. Важным преимуществом его является большая точность, связанная с высокой чувствительностью применяемого индикатора — раствора крахмала.
Условия проведения йодометрических определений.
1. Потенциал пары I2/2I- невелик, и потому многие йодометрические реакции обратимы и до конца не доходят; только при создании надлежащих условий они протекают практически до конца.
2. Йод — вещество летучее, поэтому титрование ведут на холоду. Это необходимо также и потому, что с повышением температуры понижается чувствительность крахмала как индикатора.
3. Йодометрическое титрование нельзя проводить в щелочной среде, так как йод реагирует со щелочами:
I2 + 2ОН- → IO- + I- + Н2О
Присутствие же гипоиодида IO- недопустимо, так как, являясь более сильным окислителем, чем I2, он окисляет тиосульфат частично до сульфата. Чем больше концентрация ОН- в растворе, тем большее количество тиосульфата превращается в сульфат. Из-за этой побочной реакции точное вычисление результатов анализа становится невозможным. Поэтому необходимо следить за тем, чтобы рН раствора не превышал 9.
В тех случаях, когда при реакции образуются Н+-ионы, для практически полного протекания ее в нужном направлении приходится эти ионы связывать, что достигается прибавлением NаНСО3.
4. Растворимость йода в воде мала, поэтому при йодометрических определениях окислителей необходимо применять значительный избыток KI. Это способствует растворению выделенного при реакции йода, который с KI образует нестойкий комплексный ион [I3]-. Кроме того, избыток KI способствует ускорению реакции между I- и определяемым окислителем и более полному течению ее в нужном направлении.
5. Скорость реакции между определяемым окислителем и I--ионами оказывается обычно недостаточной. Поэтому к титрованию выделившегося йода приступают лишь через некоторое время после прибавления окислителя.
6. Реакционную смесь сохраняют в темноте, так как свет ускоряет в кислых растворах побочную реакцию окисления I--ионов до I2 кислородом воздуха:
4 I- + 4 Н+ + О2 ↔ 2 I2 + 2 Н2О
Приготовление рабочих растворов.
· Раствор тиосульфата. Высокая чувствительность йод-крахмальной реакции обусловливает вполне отчетливое посинение 50 мл раствора от одной капли 0,01 н. раствора йода. Исходя из этого, титрованные растворы йода и тиосульфата можно готовить не 0,1 н., а 0,02 и 0,05 н.
Тиосульфат натрия Na2S2O3·5H2O представляет собой кристаллическое вещество. Хотя при надлежащих условиях он может быть получен химически чистым, приготовлять титрованный раствор тиосульфата по точной навеске нельзя, так как тиосульфат не удовлетворяет всем требованиям, предъявляемым к исходным веществам. Он является соединением сравнительно неустойчивым: например, реагирует с угольной кислотой, растворенной в воде.
Вследствие этого нормальность раствора тиосульфата сначала несколько возрастает. Отсюда ясно, что: а) не имеет смысла брать точную навеску Na2S2O3·5H2O; б) к установке титра раствора его следует приступать не сразу, а через 10 дней после приготовления.
Хранить раствор Na2S2O3 нужно в бутылях, защищенных от двуокиси углерода трубкой с натронной известью или аскаритом, как растворы NaOH.
В дальнейшем титр раствора Na2S2O3 начинает медленно уменьшаться, поэтому его необходимо периодически проверять.
Уменьшение титра происходит вследствие: а) окисления Na2S2O3 кислородом воздуха; б) разложения его микроорганизмами (тиобактериями), являющегося наиболее важной причиной нестойкости растворов тиосульфата. Для предупреждения этого разложения рекомендуют в качестве антисептика прибавлять на 1 л раствора около 10 мг иодида ртути HgI2. Следует также хорошо защищать раствор от света, благоприятствующего размножению в нем тиобактерий.
При приготовлении раствора тиосульфата исходят из величины его грамм-эквивалента, равной 248,2 г, и нормальности раствора (около 0,02) и учитывают все сделанные выше указания.
Установка титра тиосульфата описана ниже.
· Раствор йода. Титрованный раствор йода можно приготовить либо исходя из точной навески химически чистого кристаллического йода, либо пользуясь йодом, имеющимся в продаже. В последнем случае титр раствора устанавливают обычно по титрованному раствору тиосульфата.
Рассмотрим оба указанных способа.
1. Приготовление раствора йода по точной навеске химически чистого йода. Йод обычно содержит примеси хлора, различных соединений йода с другими галогенами, например IC1, IBr, IC13, а также гигроскопическую воду. Для очистки его пользуются тем, что давление паров твердого йода, равное атмосферному давлению, достигается при температуре более низкой, чем температура плавления йода. Поэтому, если нагревать твердый йод, он, не плавясь, обращается в пар, который конденсируется, образуя кристаллы на более холодных частях сосуда. Этот процесс испарения твердого тела, происходящего без образования жидкой фазы, называется возгонкой или сублимацией.
Для того чтобы путем сублимации очистить йод от примесей, нужно предварительно превратить их в нелетучие вещества. Для этого йод растирают в яшмовой или агатовой ступке с KI и СаО. Окись кальция поглощает воду, образуя Са(ОН)2, тогда как KI образует с примесями галогенидов свободный йод и нелетучие соли.
Смесь йода с KI и СаО помещают в совершенно сухой стакан, накрывают его круглодонной колбой, наполненной холодной водой, и осторожно нагревают на плитке. Время от времени оседающие на холодной поверхности колбы кристаллы йода переносят стеклянной палочкой на предварительно тарированное часовое стекло и взвешивают на технических весах. Процесс сублимации продолжают до тех пор, пока не будет получено столько йода, сколько необходимо для приготовления раствора его. В данном случае достаточно приготовить 250 мл 0,02 н. раствора йода. Грамм-эквивалент его равен грамм-атому, т. е. 126,9 г, поэтому потребуется навеска йода:
![]() г
г
Приступая к приготовлению раствора, нужно помнить, что йод летуч и что пары его отравляют воздух лаборатории и вызывают коррозию металлических частей приборов. Поэтому пересыпание йода, возгонку и другие операции необходимо проводить под тягой. Особенно следует защищать от воздействия паров йода аналитические весы.
Как уже указывалось, йод очень плохо растворим в воде, поэтому его растворяют в концентрированном растворе KI, с которым он образует растворимый комплексный ион красно-бурого цвета [I3]-.
Чтобы растворение произошло достаточно легко и быстро, нужно брать по крайней мере тройное (в сравнении с массой йода) количество KI. Кроме того, при взвешивании нужно учитывать летучесть йода. Поэтому лучше взвешивать йод, предварительно растворив его, так как йод в растворе KI менее летуч вследствие уменьшения давления паров I2.
Обычным способом вычисляют титр и нормальность приготовленного раствора йода.
2. Приготовление рабочего раствора йода. Раствор готовят так же, с той только разницей, что взвешивают ~ 0,6 - 0,7 г йода на технических весах. Одновременно ~2—3 г KI растворяют в возможно меньшем объеме воды. В полученный раствор вносят навеску йода и после его растворения разбавляют водой до 250 мл. Титр устанавливают по тиосульфату, как описано ниже. Можно установить титр и по As2O3.
· Раствор крахмала. Для приготовления раствора крахмала взвешивают 0,5 г так называемого «растворимого крахмала» и тщательно растирают его с несколькими миллилитрами холодной воды. Полученную пасту вливают в 100 мл кипящей воды, кипятят еще около 2 мин (пока раствор не станет прозрачным) и фильтруют горячим. Вместо фильтрования можно дать крахмалу осесть на дно сосуда и при титровании пользоваться только верхним слоем совершенно отстоявшейся жидкости.
Нужно иметь в виду, что растворы крахмала являются хорошим питательным субстратом для микроорганизмов и потому скоро портятся. Более устойчивый раствор крахмала можно получить, прибавляя к нему (в момент приготовления) несколько миллиграммов HgI2.
С каплей 0,02 н. раствора йода, прибавленной к 50 мл воды, 2—3 мл раствора крахмала должны давать синюю окраску. Если она получается не синей, а фиолетовой или буроватой, это указывает на непригодность крахмала в качестве индикатора.
Установка титра рабочего раствора Na2S2O3.
Для установки титра раствора Na2S2O3 предложено много различных стандартных веществ, например твердый химически чистый йод, йодат калия КIO3, бромат калия КВrО3, бихромат калия К2Сr2О7 и др. На практике чаще всего пользуются бихроматом калия К2Сr2О7.
Хотя система Cr2O72-/Cr3+ соответственно более высокому стандартному потенциалу (E0 = +1,33 в) и способна непосредственно окислять Na2S2O3 (Е° = +0,08 в), но реакция протекает сложно, нестехиометрично и не может быть выражена одним уравнением. Поэтому титр Na2S2O3 устанавливают на основании общего принципа qодометрического определения окислителей, т. е. сначала действуют на смесь KI и H2SO4 точно измеренным объемом титрованного раствора К2Сr2О7. При этом бихромат замещается эквивалентным количеством qода, который далее оттитровывают исследуемым раствором тиосульфата.
Приготовление титрованного раствора К2Сr2О7. Пользуясь обычной методикой, берут на аналитических весах точную навеску К2Сr2О7, количественно переносят ее в мерную колбу емкостью 250 мл, растворяют в воде, разбавляют раствор до метки и тщательно перемешивают, затем вычисляют нормальность полученного раствора (должно быть около 0,02 н.).
Титрование. Приступая к титрованию, наполняют бюретку раствором Na2S2O3 и устанавливают уровень жидкости в ней на нуле.
В большую коническую колбу берут мензуркой 5—7 мл 20%-ного раствора KI и 10—15 мл 2 н. раствора H2SO4. К полученной смеси прибавляют пипеткой аликвотную часть (25,00 мл) раствора К2Сr2О7 и, накрыв колбу часовым стеклом, чтобы предупредить потери от улетучивания йода, для завершения реакции оставляют смесь на 5 мин в темноте. Затем снимают часовое стекло и ополаскивают его над колбой дистиллированной водой. Прибавляют в колбу еще около 200 мл воды и приступают к титрованию раствора тиосульфатом. Сначала титруют без индикатора. Когда же окраска раствора из темно-бурой превратится в бледно-желтую (цвет соломы), прибавляют около 5 мл раствора крахмала и продолжают титровать до перехода синей окраски в бледно-зеленую от одной капли раствора Na2S2O3. Последние капли прибавляют медленно, каждый раз хорошо перемешивая раствор. Сделав отсчет, проверяют точность титрования, прибавив к оттитрованному раствору одну каплю титрованного раствора К2Сr2О7. Если раствор не перетитрован, должна появиться устойчивая синяя окраска.
Точное титрование повторяют еще 2—3 раза. Из сходящихся результатов (разность не больше 0,1 мл) берут среднее.
Вычисление. Хотя Na2S2O3 и К2Сr2О7 при данном определении непосредственно друг с другом не реагируют, количества их тем не менее эквивалентны.
Пользуясь
формулой ![]() , по
известной нормальности раствора бихромата и по израсходованным объемам
растворов вычисляют искомую нормальность раствора тиосульфата.
, по
известной нормальности раствора бихромата и по израсходованным объемам
растворов вычисляют искомую нормальность раствора тиосульфата.
Если в лаборатории имеется титрованный раствор йода, приготовленный по точной навеске химически чистого йода, полезно проверить правильность титра раствора тиосульфата натрия. Для этого измеренный объем раствора йода титруют раствором тиосульфата. Можно было бы, конечно, устанавливать титр Na2S2O3, исходя из стандартизированного раствора I2, но это менее удобно, так как ошибки при установке обоих титров будут суммироваться.
Задача № 49
При растворении 5,4550 г анализируемого образца, содержащего железо, получено 250 мл раствора, на титрование 25,00 мл которого затрачено 25,00 мл 0,0186 н. раствора КМnО4. Рассчитайте T(KMnO4 / Fe), массу и массовую долю железа в образце.
Решение:
Метод перманганатометрии основан на реакциях окисления восстановителей ионом перманганата. В нашем случае Fe2+ перейдет в Fe3+ соответственно уравнению:
Fe2+ + MnO4- + H+ → Fe3+ + Mn2+ + H2O
|
Природа атома |
Процессы |
Элект-роны |
Наименьшее общее кратное |
Коэффици-енты |
|
Окислитель Восстановитель |
Mn+7 + 5ē → Mn+2 (вос-ние) Fe+2 - 1ē → Fe+3 (ок-ние) |
1 5 |
5 |
1 5 |
5 Fe2+ + MnO4- + 8 H+ = 5 Fe3+ + Mn2+ + 4 H2O
1. Определим молярную массу эквивалентов железа:
![]() г/моль.
г/моль.
2. Вычислим титр раствора КМnО4 по определяемому веществу Fe:
![]() г/мл.
г/мл.
3. Определим молярную концентрацию эквивалентов железа:
![]() моль/л.
моль/л.
4. Вычислим массу железа в растворе:
![]() г.
г.
5. Определим массовую долю железа в образце:
![]() или 4,77 %
или 4,77 %
Ответ: T(KMnO4 / Fe) = 0,00104 г/мл; m (Fe) = 0,2604 г; ω (Fe) = 4,77%.
Задача № 54
Определите массу и массовую долю SO2 во фруктовом пюре, если из его пробы массой 20,00 г приготовили раствор, на титрование которого израсходовали 25,50 мл 0,0252 н. раствора J2.
Решение:
SO32- + I2 + H2O → SO42- + I- + H+
|
Природа атома |
Процессы |
Элект-роны |
Наименьшее общее кратное |
Коэффи-циенты |
|
Окислитель Восстановитель |
I2 + 2ē → 2I- (восстановление) SO32- + H2O - 2ē → SO42- + H+ (окисление) |
2 2 |
2 |
1 1 |
SO32- + I2 + H2O → SO42- + 2 I- + 2 H+
1. Определим молярные массы эквивалентов окислителя и восстановителя:
![]() г/моль;
г/моль;
![]() г/моль.
г/моль.
2. Вычислим массу йода в растворе:
![]() г.
г.
3. Определим массу SO2:
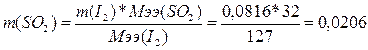 г.
г.
4. Вычислим массовую долю SO2 во фруктовом пюре:
![]() или 0,103%
или 0,103%
Ответ: m (SO2) = 0,0206 г; ω (SO2) = 0,103%.
Задача № 61
Рефрактометрия. Преломление света, показатель преломления, параметры, влияющие на его величину. Проведение количественного анализа методом градуировочного графика.
Рефрактометрия - (от лат. refractus - преломленный и ...метрия), совокупность методов и средств измерения показателей преломления n среды: измерение угла преломления света; измерение угла полного внутреннего отражения; интерференционный метод; фотометрический метод (зависимость коэффициента отражения света на границе двух сред от отношения n); другие методы, в т. ч. иммерсионный и теневой (измерение перепада n в неоднородных средах).
Рефракцией или преломлением света называют изменение направления луча при прохождении им границы раздела двух прозрачных сред I и II (рис.1). Угол 90°–a , образованный направлением падающего луча с нормалью, называют углом падения, угол b , образованный направлением преломленного луча с продолжением этой нормали, – углом преломления. Падающий и преломленный лучи лежат в одной плоскости.
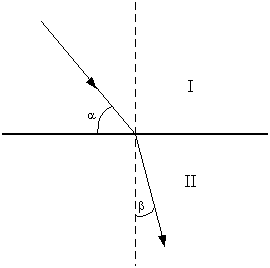
Рис.1. Преломление светового луча на границе раздела двух сред
Способность различных веществ преломлять луч света характеризуется показателем преломления. Показатель преломления обусловлен природой вещества, его химическим строением. Показатель преломления растворов зависит от их концентрации. Это свойство широко используется в контроле производства. По показателю преломления, например, водного сахарного или спиртового растворов легко определяют их концентрацию, или по показателю преломления жира в специальном растворителе определяют содержание жира в объектах кондитерского производства.
Для измерения показателя преломления используют специальные приборы, которые называют рефрактометрами.
Показателем преломления (коэффициентом преломления) называют отношение синуса угла падения луча света к синусу угла его преломления:
sin a/sin b = n
Если луч света переходит из вакуума или из воздуха в другую среду, то угол падения всегда больше угла преломления. При увеличении угла падения, изменяется соотношение между долями световой энергии проходящей в другую среду и отраженной от нее. При угле падения 400 и выше, луч света полностью отражается от поверхности раздела и называется углом полного внутреннего отражения. Зная угол полного внутреннего отражения, можно определить показатель преломления
n = 1/sin a'
где a'-угол полного внутреннего отражения.
В связи с тем, что показатель преломления зависит от длины волны, существуют несколько показателей преломления для одних и тех же веществ, имеющие следующие обозначения:
· nD- показатель преломления желтой линии натрия (линия D)
· nC-показатель преломления красной линии водорода (линия C)
· nF-показатель преломления синей линии водорода (линия F)
· nG -показатель преломления фиолетовой линии водорода (линия G).
Так как показатель преломления зависит от внутреннего состояния вещества, он также зависит от температуры, давления, концентрации, природы растворителя. Поэтому для систематизации полученных результатов, принимается показатель преломления (принятых стандартными), снятый при температуре 20±0,3 0С, в спектре натрия (598,3 нм). Полученный в данных условиях показатель преломления имеет обозначение nD20 , который и используется в справочных данных основных физико-химических свойств веществ. Обычно измерение показателя преломления проводят при температуре 20 0С. Однако, при измерениях в условиях другой температуры, вводят поправку на температуру по формуле:
n' = n20 + (20-t)*0,0002
где n'-показатель преломления при измеряемой температуре, n - стандартный показатель преломления, t - температура, при которой проводилось измерение.
Очень часто количественный анализ проводят методом градуировочного графика. При построение градуировочного графика необходимо использовать миллиметровую бумагу. Значения концентраций откладывать на оси абсцисс, а соответствующие им показания приборов (значения физических величин) - на оси ординат (обязательно пишутся единицы измерения). Масштаб по осям координат выбрать таким образом, чтобы угол наклона графика был приблизительно равен 45°. Зависимость между физической величиной, измеряемой в методе, и концентрацией раствора чаще всего изображается прямой линией. Но вследствие некоторого разброса значений экспериментальных данных, прямую линию следует провести усредненно, т.е. между точками (примерно на одинаковом расстоянии от каждой из них). Градуировочный график всегда следует подписывать.
Далее, используя построенный график, определяют содержание вещества в анализируемом растворе или образце.
Задача № 77
Для определения концентрации олова в сплаве приготовлены стандартные растворы, при анализе которых методом полярографии получены следующие данные:
|
С, мг/мл |
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
|
h волны, мм |
4,0 |
8,0 |
12,0 |
16,0 |
20,0 |
Определить массовую долю олова в 2,5 г пробы, если при анализе 50 мл его раствора высота полярографической волны равна 6 мм.
Решение:
1. По результатам анализа стандартных растворов строим градуировочный график в координатах h – С и по нему определяем концентрацию олова в сплаве.
2. По графику определяем, какой концентрации раствора соответствует высота полярографической волны равная 6 мм: С = 0,75 мг/мл.
3. Вычислим массу олова в 50 мл раствора:
![]() мг или 0,0375 г.
мг или 0,0375 г.
4. Определим муссовую долю олова в 2,5 г пробы:
![]() или 1,5 %.
или 1,5 %.
Ответ: ω (олова) = 1,5 %.
Список литературы
1. Алексеев В.Н. Количественный анализ. – М.: «Химия», 1972.
2. Алексеев В.Н. Теоретические основы физико-химических методов анализа. – М.: Высшая школа, 1979.
3. Здешнева А.М. Сборник задач и упражнений по аналитической химии. – М.: Высшая школа, 1979.
4. Крешков А.П. Основы аналитической химии. Т. 2. – М.: «Химия», 1976.
5. Крешков А.П., Ярославцев А.А. Курс аналитической химии. Качественный анализ, книга первая. – М.: «Химия», 1975.