Задача № 35
В чем сходство и различие электронной структуры атомов,
входящих в состав одной группы и одной подгруппы. Составить электронные формулы
атомов Na и К.
Решение:
В соответствии с максимальным числом электронов на внешнем
квантовом слое невозбужденных атомов элементы периодической системы
подразделяются на восемь групп. Положение в группах s- и р-элементов определяется общим
числом электронов внешнего квантового слоя. Например, фосфор (3s2 Зр3),
имеющий на внешнем слое пять электронов, относится к V группе, аргон (3s2 Зр6) — к VIII, кальций (4s2) — ко II группе и т. д.
Положение в группах d-элементов обусловливается общим числом s-электронов внешнего и d-электронов предвнешнего
слоев. По этому признаку первые шесть элементов каждого семейства d-элементов располагаются в
одной из соответствующих групп: скандий (3d1 4s2)
в III, марганец (3d5 4s2) в VII, железо (3d6 4s2) в VIII и т. д. Цинк (3d10 4s2), у которого
предвнешний слой завершен и внешними являются 452-электроны,
относится ко II группе.
По наличию на внешнем слое лишь одного электрона (за счет
«провала» одного из 45-электронов в Sd-подслой) медь (3d10 4 s1),
а также серебро (4d10
5s1) и
золото (5d10
6 s1)
относят к I группе.
Кобальт (3d7
4s2) и
никель (3d8
4s2), родий
(4d8 5s1) и палладий (4d10), иридий (5d7 6s2) и платину (5d9 6s1) вместе с Fe, Ru и Os обычно помещают в VIII группу.
Элементы групп подразделяются на подгруппы, s- и р- Элементы составляют
так называемую главную подгруппу или подгруппу А, d-элементы — побочную или
подгруппу В.
11Na 1s22s22p63s1
|
|
|
|
|
3s
|
↑
|
|
|
|
2p
|
↑↓
|
↑↓
|
↑↓
|
|
|
2s
|
↑↓
|
|
|
|
|
|
1s
|
↑↓
|
|
|
|
|
|
19K 1s22s22p63s23p64s1
|
|
|
|
|
|
|
|
|
4s
|
↑
|
|
|
|
|
|
|
3p
|
↑↓
|
↑↓
|
↑↓
|
|
|
|
|
|
|
3s
|
↑↓
|
|
|
|
|
|
|
2p
|
↑↓
|
↑↓
|
↑↓
|
|
|
|
|
|
|
2s
|
↑↓
|
|
|
|
|
|
|
|
|
|
1s
|
↑↓
|
|
|
|
|
|
|
|
|
|
Задача № 45
Укажите типы химической связи в молекулах F2, KCl, H2O,
AlCl3, N2, NH3. Ответ
поясните.
Решение:
В
зависимости от характера распределения электронной плотности в веществе
различают три основных типа химической связи: ковалентную, ионную,
металлическую.
1.
Ковалентная связь – связь между атомами в молекуле, которая осуществляется за
счет общих электронных пар. Выделяют ковалентную полярную и неполярную связи:
·
ковалентная неполярная связь – связь, в которой нет смещения
электронной плотности к одному из атомов;
·
ковалентная полярная связь – связь, в которой общие
электронные пары смещены к более электроотрицательному атому.
2. Ионная связь – связь, которая осуществляется за
счет электростатического притяжения разноименно заряженных частиц – ионов.
3. Металлическая связь - связь, которая осуществляется
за счет электростатического притяжения между ионами металлов и свободными
электронами. Характерна для металлов в твердом и жидком состоянии.
F2 – ковалентная неполярная
связь;
KCl – ионная связь;
H2O – ковалентная полярная связь;
AlCl3 – ковалентная полярная
связь;
N2 – ковалентная неполярная
связь;
NH3 – ковалентная полярная
связь;
Задача № 65
Написать математическое выражение для скоростей следующих
реакций:
3H2
+ N2 = 2NH3;
4NH3
+ 5O2 = 4NO + 6H2O;
2NO2 + O2 = 2NO2.
Решение:
Скорость химической реакции – это
изменение концентрации веществ во времени. Для химической реакции:
аА
+ bB ↔ cC + dD
она выражается в виде:
υ = к * [A]a[B]b
где:
υ –
скорость реакции;
к – константа скорости реакции;
[A] и [B] – концентрации веществ А и В, соответственно, моль/л;
a и b –
коэффициенты в уравнениях реакций.
Таким образом, для данных реакций
математическое выражение скоростей будет выглядеть следующим образом:
а) 3H2
+ N2 = 2NH3;
υ = к * [H2]3[ N2]
б) 4NH3
+ 5O2 = 4NO + 6H2O;
υ = к * [NH3]4[O2]5
в) 5NO2 + O2 = 2NO2.
υ = к * [NO2]2[O2]
Задача № 105
Какие из следующих солей будут
подвергаться гидролизу. Составить молекулярные и ионные уравнения гидролиза. K2CO3, NaNO2,
NH4HCOO, CuCl2, NaCl.
Решение:
Из перечисленных солей гидролизу
подвергаются: K2CO3, NaNO2, NH4HCOO, CuCl2.
K2CO3:
K2CO3
↔ 2К+ + СО32-
1 стадия:
СО32- + Н2О ↔ НСО3-
+ ОН -
K2CO3 + Н2О
↔ КНСО3 + КОН
2 стадия:

 НСО3-
+ Н2О ↔ Н2СО3 + ОН –
НСО3-
+ Н2О ↔ Н2СО3 + ОН –
Н2О СО2
КНСО3 + Н2О ↔ КОН + Н2О
+ СО2 ↑
NaNO2:
NaNO2
↔ Na+ + NO2-
NO2- + + Н2О ↔ HNO2 + ОН –
NaNO2
+ Н2О ↔ HNO2 + KОН
NH4HCOO:
NH4HCOO ↔ NH4+ + HCOO-
 NH4+ + HCOO- + Н2О
↔ NH4ОН
+ HCOOН
NH4+ + HCOO- + Н2О
↔ NH4ОН
+ HCOOН
NH3 ∙ Н2О
NH4HCOO + Н2О ↔
NH3 ∙
Н2О + HCOOН
CuCl2:
CuCl2
↔ Cu2+
+ 2Cl
1 стадия:
Cu2+ + Н2О ↔ CuОН+ + Н+
CuCl2 + Н2О ↔ CuОНCl + НCl
2 стадия:
CuОН+
+ Н2О ↔ Cu(ОН)2+
Н+
CuОНCl + Н2О ↔ Cu(ОН)2 + НCl
Задача № 125
Написать формулы сульфатов металлов 2-й группы периодической
системы и указать наиболее труднорастворимые.
Решение:
BeSO4
– сульфат бериллия;
MgSO4
– сульфат магния;
CaSO4
– сульфат кальция;
SrSO4
– сульфат стронция (наиболее труднорастворимый);
BaSO4
– сульфат бария (наиболее труднорастворимый);
RaSO4
– сульфат радия (наиболее труднорастворимый).
Задача № 135
Назвать следующие комплексные
соединения, определить степень окисления комплексообразователя и
координационное число. Написать выражение для константы их нестойкости.
Na2 [PbI4];
[Cr (NH3)4]PO4.
Решение:
а) Na2+ [Pb+I4-] –
тетрайодоплюмбонат натрия.
координационное
число = 4.
комплексообразователь
- Pb+
Na2 [PbI4]
↔ 2Na+ + [Pb+I4-]2-
PbI42- ↔
Pb2+ + 4I-

б) [Cr (NH3)]4PO4
– фосфат тетрааминхрома.
координационное
число = 4.
комплексообразователь
– Cr.
[Cr (NH3)4]PO4
↔ [Cr (NH3)4]3+ + PO43-
Cr (NH3)43+
↔ Cr3+ + 4NH3
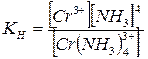
Задача № 225
Определить рН растворов, в которых
концентрация ионов водорода равна: 10-2, 10-9, 10-5.
Решение:
pH = -lg[H+]
[H+] = 10-2, pH = -lg10-2 = 2;
[H+] = 10-9, pH = -lg10-9 = 9;
[H+] = 10-5, pH = -lg10-5
= 5.
Список используемой литературы
1.
Ахметов Н.С. Общая и неорганическая химия: Учебник для вузов.
– М.: Высшая школа, 1981.
2.
Вовченко Г.Д. Третьяков Ю.Д. Общая химия, 1980
3.
Глинка Н.Л. Общая химия, 2000
4.
Зайцев О.С. Задачи, упражнения и вопросы по химии - М.:
Химия, 1996
5.
Зубович И.А. Неорганическая химия: Учебник для технол. спец.
вузов. – М.: Высшая школа, 1989.