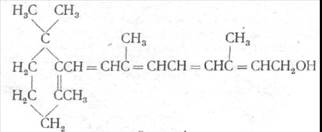Задача № 1
Стероидные гормоны (гормоны коркового вещества надпочечников, половые гормоны).
К группе стероидных гормонов принадлежат гормоны, являющиеся производными стеролов. Они синтезируются в надпочечниках, семенниках, яичниках и некоторых других органах и тканях.
· Кортикостероиды.
Общее число всех стероидов, которые синтезируются в надпочечниках многих животных, приближается к 100. Однако биологической активностью обладают не все выделенные из коры надпочечников кортикостероиды.
В зависимости от характера оказываемого биологического эффекта гормоны коры надпочечников условно делят на глюкокортикоиды (кортикостероиды, оказывающие влияние на обмен углеводов, белков, жиров и нуклеиновых кислот) и минералокортикоиды (кортикостероиды, оказывающие влияние на обмен солей и воды).
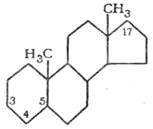
Все стероидные гормоны обладают общей для них химической особенностью: в структуре их имеется циклический компонент в виде пергидрофенантренциклопентана.
В настоящее время установлено, что у человека и большинства животных предшественником кортикостероидов является холестерин и что процесс стероидогенеза, как и нормальное гистологическое строение и масса надпочечников, регулируется и зависит от АКТГ гипофиза.
Глюкокортикоиды оказывают разностороннее влияние на обмен веществ в разных тканях. В частности, в мышечной, лимфатической, соединительной и жировой тканях глюкокортикоиды, оказывая катаболический эффект, вызывают снижение проницаемости клеточных мембран и соответственно торможение поглощения глюкозы и аминокислот; в то же время в печени они дают противоположный эффект. Конечным итогом действия глюкокортикоидов является развитие гипергликемии, обусловленной главным образом глюконеогенезом (образование глюкозы из безазотистых остатков аминокислот).
В ткани печени доказано индуцирующее действие кортизона и гидрокортизона на синтез некоторых белков-ферментов, свидетельствующее о том, что гормоны действуют на первую стадию передачи генетической информации — стадию транскрипции, способствуя синтезу мРНК.
Минералокортикоиды (дезоксикортикостерон и альдостерон) регулируют главным образом обмен натрия, калия, хлора и воды; они способствуют удержанию ионов натрия и хлора в организме и выведению с мочой ионов калия. Альдостерон является наиболее активным минералокортикоидом среди других кортикостероидов, в частности он в 50—100 раз активнее дезоксикортикостерона по влиянию на минеральный обмен.
· Половые гормоны
Половые гормоны синтезируются в основном в половых железах женщин (яичники) и мужчин (семенники); некоторое количество половых гормонов образуется, кроме того, в плаценте и коре надпочечников.
Мужские половые гормоны
Мужские половые гормоны носят название андрогенных гормонов (греч. andros - мужчина).
|
Андростан |
Биосинтез андрогенов осуществляется главным образом в семенниках и частично в яичниках и надпочечниках. Прообразом их может служить полициклический углеводород андростан. Основными источниками и предшественниками андрогенов, в частности тестостерона, являются уксусная кислота и холестерин. Регуляция биосинтеза андрогенов в семенниках осуществляется гонадотропными гормонами гипофиза (ЛГ и ФСГ); в свою очередь андрогены регулируют секрецию гонадотропинов по механизму отрицательной обратной связи, блокируя соответствующие центры в гипоталамусе.
Биологическая роль андрогенов в мужском организме в основном связана с дифференцировкой и функционированием репродуктивной системы, причем в отличие от эстрогенов андрогенные гормоны уже в эмбриональном периоде оказывают существенное влияние на дифференцировку мужских акцессорных половых желез, а также на дифференцировку других тканей, определяя характер секреции гонадотропных гормонов во взрослом состоянии. Во взрослом организме андрогены регулируют развитие мужских вторичных половых признаков, сперматогенез в семенниках и т.д. Имеются данные, свидетельствующие об участии андрогенов в регуляции биосинтеза макромолекул в женских репродуктивных органах, в частности синтеза мРНК в матке.
Женские половые гормоны
В настоящее время открыты две группы женских половых гормонов, отличающихся как по своей химической структуре, так и по биологической функции: эстрогены (главный представитель — эстрадиол) и прогестины (главный представитель — прогестерон).
|
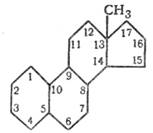
Эстран |
Наиболее активный эстроген — эстрадиол, преимущественно синтезируемый в фолликулах; два остальных являются производными эстрадиола и синтезируются также в надпочечниках и плаценте. Секреция эстрогенов и прогестерона яичником носит циклический характер, зависящий от фазы полового цикла; так, в первой фазе цикла в основном синтезируются эстрогены, а во второй — преимущественно прогестерон. Предшественником этих гормонов в организме является, как и в случае кортикостероидов, холестерин. Все они имеют в своих молекулах циклический компонент в виде дегидрофенантренциклопентана и прототипом их может являться циклический углеводород эстран.
Ведущую роль в регуляции синтеза эстрогенов и прогестерона играют гонадотропные гормоны гипофиза (ФСГ и ЛГ).
Основная биологическая роль эстрогенов и прогестерона, синтез которых начинается после наступления половой зрелости, заключается в обеспечении репродуктивной функции организма женщины. В этот период они вызывают развитие вторичных половых признаков и создают оптимальные условия, обеспечивающие возможность оплодотворения яйцеклетки после овуляции. Прогестерон выполняет в организме ряд специфических функций: подготавливает слизистую оболочку матки к успешной имплантации яйцеклетки в случае ее оплодотворения; при наступлении беременности основная роль сводится к сохранению беременности; прогестерон оказывает тормозящее влияние на овуляцию и стимулирует развитие ткани молочной железы. Эстрогены оказывают анаболическое действие на организм, стимулируя синтез белка.
Задача № 20
Химическая природа, биологическое значение витамина А (ретинола) и потребность в нем организмов.
Для того чтобы разобраться в химической структуре витамина А, необходимо прежде всего остановиться на химическом строении каротинов.
Каротины впервые были выделены из столовой моркови, а затем и из иных растений. Различают три вида каротинов: α-, β- и γ-каротины, несколько отличающиеся друг от друга по химической структуре. Все они — циклические углеводороды, но число колец и их структура у различных каротинов не одинаковы.
Все три вида каротинов являются провитаминами А и все они имеют в своем составе кольца β-ионона. Структура β-каротина симметрична, его молекулу можно расщепить на две равные половины. Подобное окислительное расщепление молекулы β-каротина происходит в печени под влиянием содержащегося в ней фермента каротиназы. Структура образующихся при расщеплении β-каротина двух молекул одинакова и идентична со структурой витамина А.
Следовательно, из каждой молекулы β-каротина в печени (и в слизистой оболочке тонких кишок ряда млекопитающих животных) образуются две молекулы витамина А.
|
Витамин А1 |
Витамин А2 |
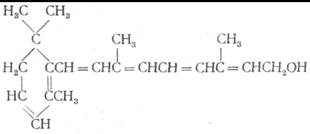
Из всех трех каротинов наиболее активен как предшественник витамина β-каротин. Некоторые другие каротины, например, криптоксантин, имеющие в своей структуре по одному β-иононовому кольцу, также являются провитаминами А. Из каждого из них под влиянием каротиназы в печени образуется витамин А, причем из каждой молекулы этих каротиноидов возникает по одной молекуле витамина А.
В печени пресноводных рыб имеется витамин А, несколько отличающийся по своей структуре от витамина А, образующегося из каротина. Этот витамин получил название витамина А2 и он в β-иононовом кольце имеет не одну, а две двойные связи.
Витамин А осуществляет свою функцию, входя в состав важного в физиологическом отношении вещества — зрительного пурпура.
Зрительный пурпур, или как его еще называют, родопсин, представляет собою соединение белка опсина с альдегидным производным витамина А. Родопсин содержится в воспринимающих концевых аппаратах зрительного нерва, в его палочках, занимающих периферическую часть сетчатки глаза. Родопсин очень чувствителен к действию света и играет роль фотохимического сенсибилизатора. От концентрации родопсина в палочках зрительного нерва зависит восприимчивость глаза к свету. Под влиянием освещения родопсин распадается с образованием через ряд промежуточных продуктов пигмента ретинена (альдегида витамина А) и опсина. При длительном воздействии света ретинен восстанавливается с образованием витамина А. В темноте, а также при ослаблении освещения, распавшийся родопсин регенерирует за счет продуктов своего распада. Чем ярче освещение, тем больше распадается родопсина и чувствительность сетчатки глаза к восприятию света понижается. Наоборот, в темноте в результате регенерации родопсина, чувствительность сетчатки глаза повышается к восприятию слабого освещения.
При недостатке витамина А в организме количество родопсина в сетчатке уменьшается, так как ощущается недостаток в материале для образования ретинена. Синтез распавшегося на свету родопсина в темноте замедляется, световые раздражения в темноте и при слабом освещении воспринимаются сетчаткой плохо. Этим и объясняется причина возникновения куриной слепоты при недостатке витамина А в организме.
Роль витамина А в организме человека и животных не исчерпывается тем, что он, вернее его альдегид, являясь составной частью родопсина, участвует в акте восприятия сетчаткой глаза света. Он также предохраняет эпителий слизистых оболочек органов от засыхания.
Потребность организма человека в витамине А обеспечивается как за счет каротинов, так и за счет витамина А пищевых продуктов. Подсчеты показывают, что примерно 2/3 общей потребности организма в витамине А обеспечивается каротинами растительной пищи и 1/3 — витамином А из пищи животного происхождения. Если оставить рыбий жир, не являющийся пищевым продуктом (его потребляют как медицинский препарат), то витамин А в небольших количествах доставляется в организм с коровьим маслом, цельным молоком, сливками, сметаной и яичным желтком и с печенью крупного рогатого скота и свиней.
У детей чувствительность к недостатку витамина А значительно выше, чем у взрослых. Объясняется это сравнительно большим запасом витамина А в печени взрослых.
При обеспечении организма витамином А приходится учитывать, что каротины всасываются в кишечнике значительно хуже, чем витамин А. Для всасывания каротинов в кишечнике исключительно большое значение имеют желчные кислоты.
Суточная потребность организма в витамине А составляет 1—2 мг. Такое количество витамина А может образоваться в печени из 2—4 мг β-каротина. Введение больших количеств витамина А (а не каротинов) в организм приводит к ряду отрицательных явлений — гипервитаминозу А.
Задача № 29
Под влиянием каких ферментов идет последовательный распад белков до аминокислот?
Гидролиз белков и продуктов их распада — полипептидов ускоряют ферменты, относящиеся к протеазам. В обоих случаях протеазы катализируют гидролиз пептидной связи (—СО—NH—). Протеазы часто разделяют на протеиназы — ферменты, катализирующие гидролиз белков, и на пептидазы, катализирующие гидролиз полипептидов. Однако это разделение следует считать условным, так как установлено, что такая типичная протеиназа, как, например, пепсин, катализирует гидролиз пептидных связей не только в белках, но и в полипептидах, в тех случаях, когда в составе их молекул имеются пептидные связи, в образовании которых участвуют аминные группы тирозина или фенилаланина. К протеазам относятся такие ферменты, как пепсин, химозин, трипсин, химотрипсин, катепсин, папаин.
Пепсин в виде профермента (пепсиногена) образуется в клетках предпилорической и пилорической частей слизистой оболочки желудка (в главных клетках) млекопитающих животных. Пепсиноген активируется (превращается в пепсин) под влиянием соляной кислоты, образующейся в обкладочных клетках пилорической части слизистой оболочки желудка, а также при воздействии на него пепсина.
Пепсин катализирует гидролиз большинства известных белков. Исключением являются протамины, кератины волос и шерсти, белок губок — спонгин. Под влиянием действия пепсина начинается переваривание белков в желудке. При продолжительном действии пепсина расщепляется до 30% всех имеющихся в белках пептидных связей. В результате действия на белки пепсина образуются различные по своей сложности полипептиды и небольшое количество аминокислот.
Химозин, или сычужный фермент, вырабатывается в слизистой желудка молодых млекопитающих (телят) и вызывает свертывание молока. Действие его заключается в том, что он превращает растворимый в воде (молоке) казеиноген в нерастворимый казеин. Значение химозина заключается в том, что образующийся при его действии на казеиноген нерастворимый казеин дольше задерживается в желудке и подвергается вследствие этого более длительному воздействию пепсина.
Трипсин образуется в поджелудочной железе как профермент трипсиноген и в таком виде выделяется с соком этой железы. Трипсиноген активируется энтерокиназой — ферментом, вырабатываемым в слизистой тонких кишок. Трипсиноген активируется также ничтожно малыми количествами трипсина. Под влиянием трипсина белки расщепляются на полипептиды и аминокислоты. Трипсин катализирует гидролиз в белках и в полипептидах пептидных связей, в образовании которых участвует карбоксильная группа аргинина или лизина.
Химотрипсин образуется в виде химотрипсиногена (профермента) в поджелудочной железе и выделяется с ее соком. Химотрипсиноген превращается в химотрипсин под влиянием ничтожно малых количеств трипсина. Химотрипсин энергично действует на казеиноген молока, превращая его в казеин. Химотрипсин также катализирует гидролиз различных белков и полипептидов. Установлено, что трипсин и химотрипсин катализируют не только гидролиз пептидных связей, но и гидролиз сложно-эфирных связей. Они также катализируют реакции перенесения аминокислотных остатков от одних полипептидов на другие.
Катепсин является протеиназой тканей животных. В значительных количествах он содержится в печени, почках и селезенке. Катепсин катализирует гидролиз белков с образованием полипептидов.
Папаин содержится в млечном соке и в семенах некоторых растений. Активируется восстановителями (цистеином и др.). Полагают, что папаин встречается в окисленной и восстановленной формах, причем активной является восстановленная форма.
В зависимости от характера белка, подвергающегося гидролизу, папаин оптимально действует при слабокислой, нейтральной или слабощелочной реакции (рН 5—7,5).
Пептидазы катализируют гидролиз продуктов распада белков — полипептидов, но не оказывают влияния на белки. Под действием пептидаз полипептиды гидролизуются с образованием аминокислот. Пептидазы образуются в слизистой оболочке тонких кишок и выделяются с кишечным соком. Раньше считалось, что в кишечном соке имеется один фермент, катализирующий гидролиз различных полипептидов,— эрепсин. В дальнейшем же оказалось, что кишечный сок, а также сок поджелудочной железы, содержат смесь различных пептидаз — карбоксипептидазу, аминопептидазу, пролиназу и дипептидазу.
Пептидазы обладают большой специфичностью действия, которая зависит от расположения в полипептиде определенных химических группировок: наличия в них групп — NH2,—СООН и др.
Карбоксипептидаза содержится в кишечном соке и в соке поджелудочной железы. Она катализирует расщепление полипептидов, имеющих свободную карбоксильную группу.
Аминопептидаза образуется в слизистой оболочке кишечника. Она катализирует гидролиз полипептидов, которые имеют свободную аминогруппу по месту пептидной связи, находящейся у конца пептида, где содержится свободная аминогруппа.
Пролиназа обнаружена в почках, легких, в слизистой оболочке кишечника и в дрожжах. Она катализирует гидролиз пептидов, у которых в образовании пептидной связи участвует карбоксильная группа пролина и у которых отсутствует свободная аминогруппа.
Пролидаза образуется в слизистой оболочке кишок. Она катализирует Гидролиз синтетических полипептидов, у которых пролин своей иминогруппой создает пептидную связь.
Дипептидаза широко распространена в тканях растений, животных и в микроорганизмах. Содержится в слизистой кишечника, почках, лейкоцитах. Она катализирует гидролиз дипептидов с образованием двух аминокислот.
В результате последовательного действия протеиназ и пептидаз сложные по своему строению молекулы белка распадаются до аминокислот.
Задача № 31
Понятие о буферной системе организма и регуляции рН.
Измерение рН в крови и в тканях показало, что он изменяется в очень незначительных пределах и что реакция крови и тканей слабощелочная (рН равно 7,3—7,4). Между тем, изучение процессов обмена веществ позволяет сделать вывод, что в организме беспрестанно возникают кислоты. При распаде углеводов образуется ряд промежуточных продуктов — кислот (фосфоглицериновые кислоты, фосфопировиноградная и молочная кислоты ди- и трикарбоновые кислоты). Распад жиров начинается с процесса их омыления, который завершается появлением, наряду с глицерином, жирных кислот. И т.д.
Все это говорит о том, что в организме образуется больше кислых продуктов обмена веществ, чем щелочных. Чем же объяснить, что реакция среды в тканях и жидкостях организма сохраняется без явных изменений? Объяснение следует искать в регуляторных механизмах, удерживающих слабо щелочную реакцию в крови и в тканях. Эти механизмы основаны на действии буферных систем организма и на функции выделительных систем.
В тканях и в жидкостях организма содержатся слабые кислоты и их соли, образующие буферные системы. Буферами принято называть вещества, способные обратимо связывать ионы водорода и тем самым устранять их из раствора с высокой кислотностью и освобождать их в растворе с низкой кислотностью. В организмах имеются следующие три главные буфера: 1) фосфатный, 2) бикарбонатный и 3) белковый.
Фосфатный буфер состоит из вторичного фосфата (Na2HPO4), диссоциирующего с образованием двух ионов натрия (Na+) и иона вторичного фосфата (НРО42-). Вторичные ионы фосфата связывают ионы водорода и дают первичные фосфатные ионы (Н2РО4-): НРО42- + Н+ ↔ Н2РО4-.
Ион Н2РО4-, подобно кислоте, диссоциирует на ион водорода и анион НРО42-. Первичные фосфатные ионы можно рассматривать как слабую кислоту, вторичные фосфатные ионы — как слабую щелочь.
Концентрация фосфатных ионов в тканях, и особенно в крови, незначительна и поэтому буферная емкость их невелика. Следует, однако, учесть, что из организма с мочою выделяется довольно значительное количество фосфатов (первичных и вторичных) и они составляют главный буфер мочи; рН мочи варьирует в больших пределах и в норме колеблется между 5 и 7. При образовании избыточного количества кислот в организме с мочою выделяются преимущественно первичные фосфаты. Наоборот, при избытке в организме щелочи с мочой выводятся вторичные и даже третичные фосфаты.
Бикарбонатный буфер имеет важное значение в жидкостях организма и в первую очередь в крови. Карбонатный ион связывается с ионом водорода согласно уравнению
НСО3- + Н+ ↔ СО2 + Н2О(Н2СО3).
В крови основная часть углекислого газа находится в виде бикарбонатных ионов и только незначительное количество СО2 содержится в растворенном состоянии. Бикарбонатный буфер предохраняет организм человека и животных от сдвига реакции в кислую сторону образующимися в тканях органическими кислотами. В результате связывания водородных ионов из бикарбонатных ионов получается СО2 и Н2О. Однако СО2 не накопляется в плазме крови. Едва уловимое изменение в концентрации водородных ионов, вызываемое образованием угольной кислоты из бикарбонатных ионов, действует на дыхательный центр в головном мозгу, следствием чего является усиление дыхания и выделение избытка углекислого газа из организма.
Буферные свойства белков играют очень важную роль в поддержании постоянства рН крови и тканей организма. Белковые молекулы имеют известное количество не связанных между собою карбоксильных и аминных групп и являются поэтому амфотерными электролитами. Они способны связывать как водородные, так и гидроксильные ионы. В кислых растворах белки связывают водородные ионы, в щелочных растворах — гидроксильные ионы.
Большое значение для сохранения постоянства рН крови и тканей организма имеют выделительные системы организма, функция которых регулируется центральной нервной системой. Выше уже указывалось на значение удаления углекислого газа при дыхании. Следовательно, выделительная функция легких играет роль в удалении излишка углекислого газа из плазмы крови, а отсюда — в сохранении емкости бикарбонатного буфера. Еще более важная роль принадлежит выделительной функции почек. Почки выделяют с мочой различные вещества. При избыточном образовании и накоплении в организме органических кислот, последние выделяются из организма частично в свободном состоянии, но главным образом в виде аммонийных солей. В случае введения в организм щелочи (например, питьевой соды) избыток щелочи быстро выделяется из организма с мочой.
Задача № 50
Опишите превращения дисахаридов в процессе жизнедеятельности организма животных и человека.
Расщепление дисахаридов — сахарозы, лактозы, мальтозы — происходит в тонких кишках. Из перечисленных трех дисахаридов первые два (сахароза и лактоза) поступают в организм с пищей. Что же касается мальтозы, то она появляется в ротовой полости и в тонких кишках как продукт переваривания крахмала, гидролизуется под влиянием мальтазы.
Сахароза, или, как обычно ее называют, сахар, наряду с энергетическим значением, общим для всех углеводов, важна также как вещество, обладающее сладким вкусом. Расщепление сахарозы с образованием глюкозы и фруктозы происходит в тонких кишках под влиянием сахаразы кишечного сока. Сахароза расщепляется в кишечнике быстрее, чем крахмал, и поэтому быстрее усваивается.
Молочный сахар, или лактоза, поступает в организм с молоком. Переваривание лактозы происходит под влиянием лактазы кишечного сока с образованием глюкозы и галактозы. Переваривание лактозы имеет особое значение у детей и у молодых млекопитающих в период, когда лактоза является единственным углеводом пищи.
Задача № 51
Постройте полипептид, в состав, которого входят аспарагиновая, глютаминовая кислоты, цистеин, треонин. Отметьте активные группы.
HOOC—CH2—CHNH2—COOH – аспарагиновая кислота;
HOOC—CH2—CH2—CHNH2—COOH – глютаминовая кислота;
CH2SH—CHNH2—COOH – цистеин;
CH3—CHOH—CHNH2—COOH – треонин.
![]()
![]()
![]()
![]() HOOC—CH2—CH—CO―NH―CH―CO―NH―CH―CO―NH―CH―COOH
HOOC—CH2—CH—CO―NH―CH―CO―NH―CH―CO―NH―CH―COOH
![]()
![]() NH2 CH2 CH2SH CHOH
NH2 CH2 CH2SH CHOH
![]() CH2 CH3
CH2 CH3
COOH
Задача № 69
Роль фосфатидов в обменных процессах организма.
Обмен фосфатидов в организме тесным образом связан с обменом жиров. Фосфатиды участвуют в процессах всасывания жиров, в транспорте их в организме.
Фосфаты ускоряют процесс всасывания жиров.
Об участии фосфатидов в транспорте жиров говорят следующие факты. Обогащение жирами и жирными кислотами плазмы крови при всасывании жиров сопровождается увеличением содержания в ней фосфатидов (фосфатидемией). Фосфатидемия наблюдается также при усиленной мобилизации жиров из мест их отложения в организме, что происходит в первый период голодания и при заболеваниях, ведущих к истощению организма.
Велико значение фосфатидов и в процессе использования жиров в организме. При недостатке фосфатидов в организме (оно может быть вызвано недостатком холина или же метионина, необходимого для его синтеза) замедляются процессы превращения жиров в печени. Доставляемые в печень с кровью жиры накапливаются, причем содержание их в печени может дойти до 50%.
Участие холинсодержащих фосфатидов (лецитинов) в обмене жиров наглядно видно из результатов исследований над животными, у которых вызывали ожирение печени («жировую печень») кормлением их пищей, богатой жирами и бедной белками. По мере накопления жира в печени в ней уменьшается содержание фосфатидов. Установлено, что введение в организм животных лецитина или холина предохраняет их от накопления жира в печени.
Фосфатиды играют важную роль в органах размножения (репродукции) — семенниках, яичниках, желтом теле — и при развитии зародыша. В этих органах содержится много фосфатидов. С наступлением беременности содержание фосфатидов в яичниках увеличивается и достигает максимума к концу первого периода беременности (у кролика к 16—18-му дню). Затем начинается понижение содержания фосфатидов, которое происходит постепенно до конца беременности.
Наибольшее содержание фосфатидов в желтом теле совпадает с фазой его наивысшей активности.
Список литературы
1. Анисимов А.А. Основы биохимии. – М.: Высшая школа, 1986.
2. Березов Т.Т., Коровкин Б.Ф. Биологическая химия: Учебник. – М.: Медицина, 1982.
3. Ленинджер А. Биохимия. – М.: Высшая школа, 1989.
4. Фердман Д.Л. Основы биохимии. – М.: Высшая школа, 1972.
5. Филлипович Ю.Б. Основы биохимии: Учебник. – М.: Высшая школа, 1985.