Задача № 17
При взаимодействии 3,24 г трехвалентного металла с кислотой
выделяется 4,03 л водорода (н. у.). Вычислите молярную масса эквивалента,
молярную и относительную атомную массы металла.
Решение:
1. Определим молярную
массу эквивалента металла по закону эквивалентов:
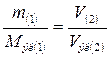 ,
,
где: m1 – масса вещества 1, г;
Мэк (1) – молярная
масса эквивалента вещества 1, г/моль;
V2 – объем вещества 2, л;
Vэк (2) – эквивалентный объем
вещества 2, л/моль, в нашем случае Vэк (Н2) = 11,2 л/моль.
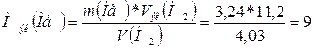 г/моль.
г/моль.
2. Определим молярную
массу металла:
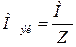 ,
,
где: М – молярная масса вещества,
г/моль;
Z – эквивалентное
число, в нашем случае это валентность металла.
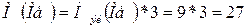 г/моль.
г/моль.
3. Молярная масса металла равна относительной атомной массе
металла, т.е. Аr (Ме) =
27.
Ответ: Мэк (Ме)
= 9 г/моль; М (Ме) = 27 г/моль; Аr (Ме) = 27.
Задача № 34
Сколько и какие значения может принимать магнитное квантовое
число m при орбитальном
числе l = 0, 1, 2 и 3?
Какие элементы в периодической системе называются s-, p-, d- и f-элементами? Приведите
примеры.
Решение:
m –
магнитное квантовое число; задает ориентацию орбиталей в пространстве, которая
определяет количество возможных орбиталей данной симметрии. Принимает значения –
вся гамма значений от –l через 0 до +l.
|
l = 0
|
l = 1
|
l = 2
|
l = 3
|
|
m = 0
|
m = -1
m = 0
m = +1
|
m = -2
m = -1
m = 0
m = +1
m = +2
|
m = -3
m = -2
m = -1
m = 0
m = +1
m = +2
m = +3
|
|
одна s-орбиталь
|
три p-орбитали
|
пять d-орбиталей
|
семь f-орбиталей
|
В зависимости от того, какой
подуровень последним заполняется электронами, все элементы делятся на четыре
типа (семейства).
1. s-Элементы: заполняется электронами s-подуровень внешнего уровня.
К ним относятся первые два элемента каждого периода, например, натрий, магний.
2. p-Элементы: заполняется электронами
р-подуровень внешнего уровня. Это последние 6 элементов каждого периода (кроме
первого и седьмого). Например, алюминий, селен.
3. d-Элементы: заполняется электронами d-подуровень второго снаружи
уровня, а на внешнем уровне остается один или два электрона. К ним относятся
элементы вставных декад больших периодов, расположенных между s- и p- элементами. Например, титан, железо.
4. f-Элементы: заполняется электронами f-подуровень третьего снаружи
уровня, а на внешнем уровне остается два электрона. Это лантаноиды и актиноиды.
Задача № 59
Какую низшую и высшую степени окисления проявляют углерод,
фосфор, сера и йод? Почему? Составьте формулы соединений данных элементов, отвечающих
этим степеням окисления.
Решение:
Высшая положительная степень окисления проявляется
тогда, когда в образовании связи принимаю участие все валентные электроны
атома. Численно она равна номеру группы периодической системы (за редким
исключением). Наименьшее значение степени окисления элемента, которое
встречается в его соединениях (водородные соединения), принято называть низшей
степенью окисления. Численно она равна 8 минус количество электронов на внешнем
уровне (отличается от высшей степени окисления на 8 единиц).
Углерод - элемент IV группы, следовательно,
высшая степень окисления: +4, например, в соединении СO2.
6С 1s22s22p2 – четыре электрона на
внешнем уровне, следовательно, низшая степень окисления углерода: -4, например,
в соединении Al4C3.
Фосфор
– элемент V группы, следовательно, высшая степень окисления: +5, например, в соединении P2O5.
15P 1s22s22p63s23p3 - 5ē на внешнем уровне, следовательно, низшая
степень окисления фосфора: -3, например, в соединении PH3.
Сера – элемент VI
группы, следовательно, высшая степень окисления: +6, например, в соединении SO3.
16S 1s22s22p63s23p4 - 6ē на внешнем
уровне, следовательно, низшая степень окисления серы: -2, например, в
соединении H2S.
Йод – элемент VII группы,
следовательно, высшая степень окисления: +7, например, в соединении HIO4.
53I 1s22s22p63s23p63d104s24p64d105s25p5 - 7ē на внешнем
уровне, следовательно, низшая степень окисления йода: -1, например, в соединении
HI.
Задача № 76
Нарисуйте энергетическую схему образования
молекулярного иона Н2- и молекулы Н2 по методу
молекулярных орбиталей. Где энергия связи больше? Почему?
Решение:
|
Н2-
|
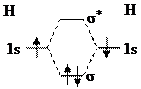 Н2 Н2
|
Для того чтобы определить, где энергия связи больше,
необходимо рассчитать порядок связи (n).
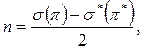
где: σ(π) –
количество электронов на связывающих орбиталях;
σ*(π*)
– количество электронов на разрыхляющих орбиталях.
Для иона Н2-: 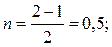 для молекулы Н2:
для молекулы Н2:
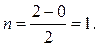
По правилу, чем больше n, тем меньше длина связи и тем
больше ее энергия, следовательно, в нашем случае в молекуле Н2
энергия связи больше, чем в ионе Н2-.
Задача № 154
На нейтрализацию 1 л раствора, содержащего 1,4 г
КОН, требуется 50 см3 раствора кислоты. Вычислите молярную
концентрацию эквивалента раствора кислоты.
Решение:
1. Вычислим молярную массу эквивалентов КОН по формуле:
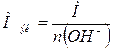 ,
,
где: Мэк –
молярная масса эквивалентов вещества, г/моль;
М – молярная масса вещества,
г/моль;
n (ОН-) – число ионов ОН-
в основании.
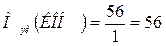 г/моль.
г/моль.
2. Определим молярную концентрацию эквивалентов КОН
по формуле:
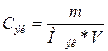 ,
,
где: Сэк -
молярная концентрация эквивалентов вещества, моль/л;
m – масса растворенного вещества, г;
V – объем раствора, л.
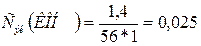 моль/л.
моль/л.
3. Определим молярную концентрацию эквивалентов
раствора кислоты по закону эквивалентов:
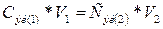 ,
,
где: Сэк (1) и Сэк
(2) - молярные концентрации эквивалентов веществ 1 и 2, моль/л;
V(1) и
V(2) –
объемы растворов веществ 1 и 2, мл.
1 л = 1000 мл, 50 см3
= 50 мл.
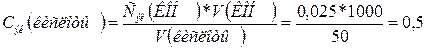 моль/л.
моль/л.
Ответ: Сэк
(кислоты) = 0,5 моль/л или 0,5 н.
Задача № 196
Составьте молекулярные и ионно-молекулярные
уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Zn2+
+ H2S = ZnS + 2H+
б) HCO3-
+ H+ = H2O + CO2
в) Ag+
+ Cl- = AgCl
Решение:
К ионам в левой части исходного уравнения допишем
ионы с противоположными значениями заряда с таким коэффициентом, чтобы можно
было составить формулы веществ. При этом учитываем, что исходные вещества
должны быть достаточно хорошо растворимы в воде. Затем те же ионы с теми же
коэффициентами пишем в правой части уравнения, получая при этом полное
ионно-молекулярное уравнение. Объединяя ионы в молекулы, получим уравнение
реакции в молекулярной форме.
а) Zn2+ +
H2S = ZnS + 2H+
Zn2+ + 2Cl- + H2S =
ZnS + 2H+ + 2Cl-
ZnCl2 + H2S = ZnS↓ +
2HCl
б) HCO3- + H+ =
H2O + CO2
HCO3- + К+ + H+ + Сl- = H2O + CO2 + K+
+ Cl-
KHCO3 + HCl = KCl + H2O + CO2↑
в) Ag+
+ Cl- = AgCl
Ag+ + NO3- + Cl-
+ K+ = AgCl + NO3- + K+
AgNO3 + KCl = AgCl↓ + KNO3
Задача № 217
Составьте ионно-молекулярное и молекулярное уравнения
гидролиза соли, раствор которого имеет: а) щелочную реакцию; б) кислую реакцию.
Решение:
Гидролиз соли – взаимодействие ионов соли с водой,
приводящее к образованию слабого электролита.
Любую соль можно представить как продукт взаимодействия
кислоты и основания. Все соли, образованные слабой кислотой и сильным
основанием, подвергаются гидролизу, сообщая раствору щелочную реакцию (рН >
7). Например, ацетат натрия СН3СООNa. Соли, образованные сильной кислотой и слабым основанием,
подвергаются гидролизу, сообщая раствору кислую реакцию (рН < 7). Например,
хлорид аммония NH4Cl.
а) гидролиз ацетата натрия СН3СООNa
СН3СОО- + Н2О
↔ СН3СООН + ОН- - ионно-молекулярное уравнение
СН3СООNa + Н2О ↔
СН3СООН + NaОН
– молекулярное уравнение
б) гидролиз хлорида аммония NH4Cl
NH4+ + Н2О
↔ NH4ОН
+ Н+
точнее:
NH4+ + Н2О
↔ NH3·Н2О
+ Н+ - ионно-молекулярное уравнение
NH4Cl + Н2О ↔ NH3·Н2О
+ Н+ - молекулярное уравнение
Задача № 222
Реакции выражаются схемами:
P + HIO3 + H2O → H3PO4
+ HI
H2S + Cl2 + H2O → H2SO4 + HCl
Составьте электронные уравнения. Расставьте коэффициенты в
уравнениях реакций. Для каждой реакции укажите, какое вещество является
окислителем, какое – восстановителем; Какое вещество окисляется, какое –
восстанавливается.
Решение:
0
+5 +5
-1
P + HIO3 + H2O → H3PO4 + HI
 Р0
- 5ē = Р5+ 6 процесс окисления, восстановитель
Р0
- 5ē = Р5+ 6 процесс окисления, восстановитель
I5+
+ 6ē = I- 5 процесс восстановления, окислитель
6P + 5HIO3
+ 9H2O → 6H3PO4 + 5HI
-2 0 +6 -1
H2S
+ Cl2 + H2O → H2SO4 + HCl
 S2- - 8ē = S6+ 1 процесс окисления, восстановитель
S2- - 8ē = S6+ 1 процесс окисления, восстановитель
Cl20
+ 2ē = 2Сl- 4 процесс
восстановления, окислитель
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Задача № 236
См. условие задачи 222.
HCl + CrO3 → Cl2 + CrCl3
+ H2O
Cd + KMnO4 + H2SO4
→ CdSO4 + MnSO4 + K2SO4 + H2O
Решение:
-1 +6 0 +3
HCl
+ CrO3
→ Cl2
+ CrCl3 + H2O
 2Сl- - 2ē = Cl20 3
процесс окисления, восстановитель
2Сl- - 2ē = Cl20 3
процесс окисления, восстановитель
Cr6+
+ 3ē = Cr3+ 2 процесс
восстановления, окислитель
12HCl + 2CrO3
→ 3Cl2 + 2CrCl3 + 6H2O
0 +7 +2
+2
Cd + KMnO4
+ H2SO4 → CdSO4 + MnSO4 + K2SO4
+ H2O
 Cd0 - 2ē = Cd2+ 5 процесс окисления, восстановитель
Cd0 - 2ē = Cd2+ 5 процесс окисления, восстановитель
Mn7+ + 5ē = Mn2+ 2
процесс восстановления, окислитель
5Cd + 2KMnO4 + 8H2SO4 → 5CdSO4
+ 2MnSO4 + K2SO4 + 8H2O
Задача № 284
Если пластинку из чистого цинка опустить в разбавленную
кислоту, то начавшееся выделение водорода вскоре почти прекращается. Однако при
прикосновении к цинку медной палочки на последней начинается бурное выделение
водорода. Дайте этому объяснение, составив электронные уравнения анодного и
катодного процессов. Напишите уравнения протекающей химической реакции.
Решение:
При опускании пластинки из чистого цинка в разбавленную
кислоту на его поверхности может образовываться нерастворимое соединение – Zn(OH)2, что ведет к торможению
процесса. Когда к цинку прикасается медная палочка, возникает гальваническая
пара, но электроны от цинка идут не на медь (которая в данном случае должна
восстанавливаться), а на протон:
на аноде Zn0 - 2ē = Zn2+
на катоде 2Н+ + 2ē = Н2
Zn + 2H+ = Zn2+ + H2
Задача № 308
Определите, чему равен заряд следующих комплексных ионов: [Cr(H2O)4Cl2], [HgBr4], [Fe(CN)6], если комплексообразователями являются Cr3+, Hg2+, Fe3+. Напишите
формулы соединений, содержащих эти комплексные ионы.
Решение:
Для того чтобы определить заряд комплексных ионов необходимо
знать заряд входящих в них лиганд: H2O
– нейтральный лиганд; Cl,
Br, CN – анионные лиганды с зарядом -1.
Z ([Cr(H2O)4Cl2])
= +3 + 4*0 + 2*(-1) = +1;
Z ([HgBr4]) = +2 +
4*(-1) = -2;
Z ([Fe(CN)6]) = +3 + 6*(-1) = -3.
Примеры соединений, содержащих эти комплексные ионы:
[Cr(H2O)4Cl2]Br,
[Cr(H2O)4Cl2]NO3, [Cr(H2O)4Cl2]OH
K2[HgBr4], Na2[HgBr4], H2[HgBr4]
K3[Fe(CN)6],
Fe3[Fe(CN)6]2, K2Na[Fe(CN)6]
Задача № 321
Какую степень окисления может проявлять водород в своих
соединениях? Приведите примеры реакций, в которых газообразный водород
окислитель и в которых – восстановитель.
Решение:
В соединениях водород может иметь степень окисления -1 и +1.
Водород проявляет и восстановительные и окислительные свойства. Его
восстановительная способность используется для получения некоторых простых
веществ из оксидов и галидов:
+2
0 0 +1
CuO + H2
= Cu + H2O
 Cu2+ + 2ē = Cu0 1
окислитель
Cu2+ + 2ē = Cu0 1
окислитель
H20
- 2ē = 2H+ 1
восстановитель
В качестве окислителя
водород взаимодействует с активными металлами:
0 0
+1 -1
2Na + H2
= 2NaH
 Na0 - 1ē = Na+ 2
восстановитель
Na0 - 1ē = Na+ 2
восстановитель
H20
+ 2ē = 2H-
1 окислитель
Задача № 341
Какую массу Na3PO4 надо прибавить
к 500 л воды, чтобы устранить ее карбонатную жесткость, равную 5 ммоль/л.
Решение:
Карбонатной называется жесткость, вызванная присутствием той
части катионов Са2+ и Mg2+, которая эквивалентна содержащимся в воде
гидрокарбонатным ионам НСО3-. Иными словами, карбонатная
жесткость вызвана присутствием гидрокарбонатов кальция и магния.
1. Определим содержание гидрокарбонатов в 500 л воды:
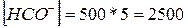 ммоль или 2,5 моль.
ммоль или 2,5 моль.
2. Определим количество вещества Na3PO4:
3Me(HCO3)2 + 2Na3PO4
= 6NaHCO3 + Me3(PO4)2
где: Ме – кальций или магний.
По уравнению реакции на 2Na3PO4
приходится 6 НСО3-, т.е.:
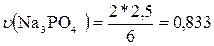 моль
моль
3. Определим массу Na3PO4:
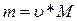 ,
,
где: m – масса вещества, г;
М – молярная масса вещества,
г/моль; М(Na3PO4) = 164 г/моль
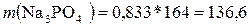 г
г
Ответ: m(Na3PO4) = 136,6 г.
Список литературы
1.
Зубович И.А. Неорганическая химия: Учебник для технол. спец.
вузов. – М.: Высшая школа, 1989.
2.
Ахметов Н.С. Общая и неорганическая химия: Учебник для вузов.
– М.: Высшая школа, 1981.
3.
Зайцев О.С. Задачи, упражнения и вопросы по химии - М.:
Химия, 1996
4.
Вовченко Г.Д. Третьяков Ю.Д. Общая химия, 1980
5.
Глинка Н.Л. Общая химия, 2000