1. Предмет познания и важнейшие особенности химический науки………….3
1. 1. Специфика химии как науки………………………………………………..3
1. 2. Важнейшие особенности современной химии………………………….....3
2. Концептуальные системы химии.......................................................................5
2. 1. Понятие о химическом элементе...................................................................5
2. 2. Магическая матрица периодической системы химических
элементов.....7
2. 3. Современная
картина химических знаний.................................................13
2. 3. 1. Первый уровень химического знания. Учение о составе
вещества.....15
2. 3. 2. Второй уровень химического знания......................................................18
2. 3. 3. Третий уровень химического знания. Учение о
химических процессах................................................................................................................21
2. 3. 4. Четвертый уровень химического знания. Эволюционная
химия.........25
3. Список использованной
литературы...............................................................31
1. ПРЕДМЕТ ПОЗНАНИЯ И ВАЖНЕЙШИЕ ОСОБЕННОСТИ ХИМИЧЕСКОЙ НАУКИ
Для человека одной из
важнейших естественных наук является химия - наука о составе, внутреннем
строении и превращении вещества, а также о механизмах этих превращений.
«Химия - наука, изучающая
свойства и превращения веществ, сопровождающиеся изменением их состава и
строения». Она изучает природу и свойства различных химических связей,
энергетику химических реакций, реакционную способность веществ, свойства
катализаторов и т.д.
Химия всегда была нужна
человечеству для того, чтобы получать из природных веществ материалы со
свойствами, необходимыми для повседневной жизни и производства. Получение таких
веществ - производственная задача, и, чтобы ее реализовать, надо уметь
осуществлять качественные превращения вещества, т. е. из одних веществ получать
другие. Чтобы этого добиться, химия должна справиться с теоретической проблемой
генезиса (происхождения) свойств вещества.
Таким образом, основанием
химии выступает двуединая проблема - получение веществ с заданными свойствами
(на достижение ее направлена производственная деятельность человека) и
выявление способов управления свойствами вещества (на реализацию этой задачи
направлена научно-исследовательская работа ученых). Эта же проблема является
одновременно и системообразующим началом химии.
1.В химии, прежде всего в
физической химии, появляются многочисленные самостоятельные научные дисциплины
(химическая термодинамика, химическая кинетика, электрохимия, термохимия, радиационная
химия, фотохимия, плазмохимия, лазерная химия).
2.
Химия активно интегрируется с остальными науками, результатом чего было
появление биохимии, молекулярной биологии, космохимии, геохимии, биогеохимии.
Первые изучают химические процессы в живых организмах, геохимия -
закономерности поведения химических элементов в земной коре.
Биогеохимия - это наука о процессах
перемещения, распределения, рассеяния и концентрации химических элементов в
биосфере при участии организмов. Основоположником биогеохимии является В. И.
Вернадский.
Космохимия изучает химический состав
вещества во Вселенной, его распространенность и распределение по отдельным
космическим телам.
3. В химии появляются
принципиально новые методы исследования (рентгеновский структурный анализ,
масс-спектроскопия, радиоспектроскопия и др.)?
Химия способствовала интенсивному
развитию некоторых направлений человеческой деятельности. Например, хирургии
химия дала три главных средства, благодаря которым современные операции стали
безболезненными и вообще возможными:
1) введение в практику эфирного наркоза, а
затем и других наркотических веществ;
2) использование антисептических средств для
предупреждения инфекции;
3) получение новых, не имеющихся в природе
аллопластических материалов-полимеров.
В химии весьма отчетливо
проявляется неравноценность отдельных химических элементов. Подавляющее
большинство химических соединений (96% из более 8,5 тыс. известных в настоящее
время) - это органические соединения. В их основе лежат 18 элементов
(наибольшее распространение имеют всего 6 из них).
Это происходит в силу
того, что, во-первых, химические связи прочны (энергоемки) и, во-вторых, они
еще и лабильны. Углерод как никакой другой элемент отвечает всем этим
требованиям энергоемкости и лабильности связей. Он совмещает в себе химические
противоположности, реализуя их единство.
Однако подчеркнем, что
материальная основа жизни не сводится ни к каким, даже самым сложным,
химическим образованиям. Она не просто агрегат определенного химического
состава, но одновременно и структура, имеющая функции и осуществляющая
процессы. Поэтому невозможно дать жизни только функциональное определение.
В последнее время химия
все чаще предпринимает штурм соседних с нею уровней структурной организации
природы. Например, химия все более и более вторгается в биологию, пытаясь
объяснить основы жизни.
В развитии химии происходит не смена,
а строго закономерное, последовательное появление концептуальных систем. При
этом вновь появляющаяся система опирается на предыдущую и включает ее в себя в
преобразованном виде. Таким образом, появляется система химии - единая
целостность всех химических знаний, которые появляются и существуют не отдельно
друг от друга, а в тесной взаимосвязи, дополняют друг друга и объединяются в
концептуальные системы знаний, которые находятся между собой в отношениях
иерархии.
Концепция химического
элемента появилась в химии в результате стремления человека обнаружить
первоэлемент природы. Р. Бойль положил начало современному представлению о
химическом элементе как о простом теле, пределе химического разложения
вещества, переходящем без изменения из состава одного сложного тела в другое.
Но еще целый век после этого химики делали ошибки в выделении химических
элементов: сформулировав понятие химического элемента, ученые еще не знали ни
одного из них.
Химические знания до
определенного времени накапливались эмпирически, пока не назрела необходимость
в их классификации и систематизации, т.е. в теоретическом обобщении. Основоположником системного освоения
химических знаний явился Д. И. Менделеев. Попытки объединения химических
элементов в группы предпринимались и ранее, однако не были найдены определяющие
причины изменений свойств химических веществ. Д. И. Менделеев исходил из
принципа, что любое точное знание представляет систему. Такой подход позволил
ему в 1869 г. открыть периодический закон и разработать Периодическую систему
химических элементов. В его системе основной характеристикой элементов являются
атомные веса. Периодический закон Д. И. Менделеева сформулирован в следующем
виде:
«Свойства простых тел, а
также формы и свойства соединений элементов находятся в периодической
зависимости от величины атомных весов элементов».
Это обобщение давало новые
представления об элементах, но в силу того, что еще не было известно строение
атома, физический смысл его был недоступен. В современном представлении этот
периодический закон выглядит следующим образом:
«Свойства простых
веществ, а также формы и свойства соединений элементов находятся в
периодической зависимости от величины заряда ядра атома (порядкового номера)».
Простейшим химическим
элементом является водород (1H), состоящий из одного протона (ядра атома,
имеющего положительный заряд) и одного электрона, имеющего отрицательный заряд.
Баланс взаимоотношений в атоме
водорода, между протоном и электроном, можно описать тождеством
то мы получим первое представление
о балансе взаимоотношений между протонами
и электронами в химических элементах.
Приводится следующая
структура Периодической таблицы Д.И.Менделеева. Приводимая ниже информация
приводится только для ознакомления и последующего осознания, что современные
представления о тайнах Периодической системы химических элементов еще далеки от
Истины.
рис. 1-1
Этот рисунок дает четкие
представления о строго эволюционном формировании Периодической таблицы, в
полном соответствии с законами сохранения
симметрии. Все оболочки, подоболочки оказываются здесь строго
взаимосвязаны и взаимообусловлены. Каждый химический элемент занимает в этом
многомерном и многоуровневом "кубе" строго определенную эволюционную
нишу.
рис. 1-2
В монографиях
"Основы миологии", "Миология" были рассмотрены свойства магической матрицы, отражающей свойства подоболочек и оболочек Периодической системы
химических элементов.
рис. 1-3
1. Количественный состав подоболочек и по
горизонтали, и по вертикали матрицы одинаковы.
2.Группировки чисел, отражающие состав
подоболочек Периодической системы
характеризуют группировки этих подоболочек, разные по структуре. Но это
так и должно быть, т.к. матрица является "отпечатком"
пространственной структуры (монадного кристалла) на плоскость.
3. Главная диагональ матрицы является суммой
всех чисел по горизонтали и по вертикали.
Эта магическая матрица
химических элементов заслуживает самого пристального изучения.
рис. 1-4
Разве здесь не видно
двойной спирали, в которой каждое число есть матрица строго определенной
размерности?
рис. 1-5
Из этой матрицы,
используя многомерные весы, можно
непосредственно увидеть баланс взаимоотношений между подоболочками.
рис. 1-6
В этих матричных весах
неукоснительно соблюдаются правила матричного умножения вектора-столбца на
вектор-строку. Данные весы отражают баланс взаимоотношений между оболочками и
подоболочками на восходящем участке эволюции химических элементов.
Здесь философским
категориям восходящей и нисходящей спиралям нет места, ибо эти категории здесь
имеют не философский, а чисто "химический" смысл.
Теперь мы можем записать
Периодическую систему в форме матричных тождеств, отражающих баланс взаимоотношений ее подоболочек и
оболочек.
рис. 1-7
Нижеприведенный рисунок
дает более полное представление о Периодической системе химических элементов.
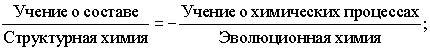
В левой части тождества
отношение отражает структурный аспект эволюции химии, правая часть тождества,
напротив, отражает уже функциональный (процессы) аспект эволюции химии.
2. 3. 1. ПЕРВЫЙ УРОВЕНЬ ХИМИЧЕСКОГО ЗНАНИЯ. УЧЕНИЕ О СОСТАВЕ ВЕЩЕСТВА
Учение о составе веществ
является первым уровнем химических знаний. До 20-30-х гг. XIX в. вся химия не
выходила за пределы этого подхода. Но постепенно рамки состава (свойств) -
стали тесны химии, и во второй половине XIX в. главенствующую роль в химии
постепенно приобрело понятие «структура», ориентированное, что и отражено
непосредственно в самом понятии, на структуру молекулы реагента.
Первый действенный способ
решения проблемы происхождения свойств вещества появился в XVII в. в работах
английского ученого Р. Бойля. Его исследования показали, что качества и
свойства тел не имеют абсолютного характера и зависят от того, из каких
химических элементов эти тела составлены. У Бойля наименьшими частичками
вещества оказывались неосязаемые органами чувств мельчайшие частички (атомы),
которые могли связываться друг с другом, образуя более крупные соединения -
кластеры (по терминологии Бойля). В зависимости от объема и формы кластеров, от
того, находились они в движении или покоились, зависели и свойства природных
тел. Сегодня мы вместо термина «кластер» используем понятие «молекула».
В период с середины XVII
в. до первой половины XIX в. учение о составе вещества представляло собой всю
химию того времени. Оно существует и сегодня, представляя собой первую
концептуальную систему химии. На этом уровне химического знания Ученые решали и
решают три важнейшие проблемы: химического элемента, химического соединения и
задачу создания новых материалов с вновь открытыми химическими элементами.
Химическим элементом
называют все атомы, имеющие одинаковый заряд ядра. Особой разновидностью
химических элементов являются изотопы, у которых ядра атомов отличаются числом
нейтронов (поэтому у них разная атомная масса), но содержат одинаковое число
протонов и поэтому занимают одно и тоже место в периодической системе
элементов. Термин «изотоп» был введен в 1910 г. английским радиохимиком Ф.
Содди. Различают стабильные (устойчивые) и нестабильные (радиоактивные)
изотопы.
С момента открытия изотопов
наибольший интерес вызвали радиоактивные изотопы, которые стали широко
использоваться в атомной энергетике, приборостроении, медицине и т. д.
Первое научное
определение химического элемента, когда еще не было открыто ни одного из них,
сформулировал английский химик и физик Р. Бойль. Первым был открыт химический
элемент фосфор в 1669 г., потом кобальт, никель и другие. Открытие французским химиком А. Л. Лавуазье
кислорода и установление его роли в образовании различных химических соединений
позволило отказаться от прежних представлений об «огненной материи»
(флогистоне).
В Периодической системе
Д.И. Менделеева насчитывалось 62 элемента, в 1930-е гг. она заканчивалась
ураном. В 1999 г. было сообщено, что путем физического синтеза атомных ядер
открыт 114-й элемент.
Концепция химических
соединений. Долгое время химики эмпирическим путем определяли, что относится к
химическим соединениям, а что - к простым телам или смесям. В начале XIX в. Ж.
Пруст сформулировал закон постоянства состава, в соответствии с которым любое
индивидуальное химическое соединение обладает строго определенным, неизменным
составом и тем самым отличается от смесей.
Теоретическое обоснование
закона Пруста было дано Дж. Дальтоном в законе кратных отношений. Согласно этому
закону состав любого вещества можно было представить как простую формулу, а
эквивалентные составные части молекулы - атомы, обозначавшиеся соответствующими
символами, - могли замещаться на другие атомы.
Химическое соединение - понятие более
широкое, чем «сложное вещество», которое должно состоять из двух и более разных
химических элементов. Химическое соединение может состоять и из одного
элемента. Это О2, графит, алмаз и другие кристаллы без посторонних включений в
их решетку в идеальном случае».
Дальнейшее развитие химии
и изучение все большего числа соединений приводили химиков к мысли, что наряду
с веществами, имеющими определенный состав, существуют еще и соединения
переменного состава - бертоллиды. В результате были переосмыслены представления
о молекуле в целом. Молекулой, как и прежде, продолжали называть наименьшую
частичку вещества, способную определять его свойства и существовать
самостоятельно. Но в XX в. была понята сущность химической связи, которая стала
пониматься как вид взаимодействия между атомами и атомно-молекулярными
частицами, обусловленный совместным использованием их электронов.
На этой концептуальной
основе была разработана стройная атомно-молекулярная теория того времени,
которая впоследствии оказалась не в состоянии объяснить многие
экспериментальные факты конца XIX - начала XX вв. Картина прояснилась с
открытием сложного строения атома, когда стали ясны причины связи атомов,
взаимодействующих друг с другом. В частности, химические связи указывают на
взаимодействие атомных электрических зарядов, носителями которых оказываются
электроны и ядра атомов.
Существуют ковалентные,
полярные, ионные и ионно-ковалентные химические связи, отличающиеся характером
физического взаимодействия частиц между собой. Поэтому теперь под химическим соединением
понимают определенное вещество, состоящее из одного или нескольких химических
элементов, атомы которых за счет взаимодействия друг с другом объединены в
частицу, обладающую устойчивой структурой: молекулу, комплекс, монокристалл или
иной агрегат.
Осуществляют химические
связи между атомами электроны, расположенные на внешней оболочке и связанные с
ядром наименее прочно. Их назвали валентными электронами. В зависимости от
характера взаимодействия между этими электронами различают ковалентную, ионную
и металлическую химические связи.
Ковалентная связь
осуществляется за счет образования электронных пар, в одинаковой мере
принадлежащих обоим атомам.
Ионная связь представляет
собой электростатическое притяжение между ионами, образованное за счет полного
смещения электрической пары к одному из атомов.
Металлическая связь - это
связь между положительными ионами в кристаллах атомов металлов, образующаяся за
счет притяжения электронов, но перемещающаяся по кристаллу в свободном виде.
Химическая связь является
таким взаимодействием, которое связывает отдельные атомы в более сложные
образования, в молекулы, ионы, кристаллы, т.е. в те структурные уровни
организации материи, которые изучает химическая наука. Химическую связь
объясняют взаимодействием электрических полей, образующихся между электронами и
ядрами атомов в процессе химических преобразований. Прочность химической связи
зависит от энергии связи.
Основываясь на законах
термодинамики, химия определяет возможность того или иного процесса, условия
его осуществления, внутреннюю энергию. «Внутренняя энергия - это общий запас
энергии системы, который складывается из энергии движения и взаимодействия
молекул, энергии движения и взаимодействия ядер и электронов в атомах, в
молекулах и т.п.».
2. 3. 2. ВТОРОЙ УРОВЕНЬ ХИМИЧЕСКОГО ЗНАНИЯ. СТРУКТУРНАЯ ХИМИЯ
Многочисленные
эксперименты по изучению свойств химических элементов в первой половине XIX в.
привели ученых к убеждению, что свойства веществ и их качественное разнообразие
обусловлены не только составом элементов, но и структурой их молекул. К этому
времени в химическом производстве стала преобладать переработка огромных масс
вещества растительного и животного происхождения. Их качественное разнообразие
потрясающе велико - сотни тысяч химических соединений, состав которых крайне
однообразен, так как они состоят из нескольких элементов-органогенов (углерода,
водорода, кислорода, серы, азота, фосфора).
Наука считает, что только эти шесть элементов составляют основу живых систем, из-за чего
они получили название органогенов. Весовая доля этих элементов в живом
организме составляет 97,4%. Кроме того, в состав биологически важных
компонентов живых систем входят еще 12 элементов: натрий, калий, кальций,
магний, железо, цинк, кремний, алюминий, хлор, медь, кобальт, бор.
Особая роль отведена
природой углероду. Этот элемент способен организовать связи с элементами,
противостоящими друг другу, и удерживать их внутри себя. Атомы углерода
образуют почти все типы химических связей. На основе шести органогенов и еще
около 20 других элементов природа создала около 8 млн. различных химических
соединений, обнаруженных к настоящему времени. 96% из них приходится на органические
соединения.
Объяснение необычайно
широкому разнообразию органических соединений при столь бедном элементном
составе было найдено в явлениях изомерии и полимерии. Так было положено начало
второму уровню развития химических знаний, который получил название структурной
химии.
Структура - это
устойчивая упорядоченность качественно неизменной системы (молекулы). Под
данное определение подпадают все структуры, которые исследуются в химии:
квантово-механические, основанные на понятиях валентности и химического
сродства, и др.
Она стала более высоким
уровнем по отношению к учению о составе вещества, включив его в себя. При этом
химия из преимущественно аналитической науки превратилась в синтетическую.
Главным достижением этого этапа развития химии стало установление связи между
структурой молекул и реакционной способностью веществ.
Термин «структурная
химия» условен. В нем подразумевается такой уровень химических знаний, при
котором, комбинируя атомы различных химических элементов, можно создать структурные
формулы любого химического соединения. Возникновение структурной химии
означало, что появилась возможность для целенаправленного качественного
преобразования веществ, для создания схемы синтеза любых химических соединений,
в том числе и ранее неизвестных.
Основы структурной химии
были заложены Дж. Дальтоном, который показал, что любое химическое вещество
представляет собой совокупность молекул, состоящих из определенного количества
атомов одного, двух или трех химических элементов. Затем И.-Я. Берцелиус выдвинул
идею, что молекула представляет собой не простое нагромождение атомов, а
определенную упорядоченную структуру атомов, связанных между собой
электростатическими силами.
Важнейшим шагом в
развитии структурной химии стало появление теории химического строения
органических соединений русского химика A.M. Бутлерова, который считал, что
образование молекул из атомов происходит за счет замыкания свободных единиц
сродства, но при этом он указывал на то, с какой энергией (большей или меньшей)
это сродство связывает вещества между собой. Иными словами, Бутлеров впервые в
истории химии обратил внимание на энергетическую неравноценность разных
химических связей. Эта теория позволила строить структурные формулы любого
химического соединения, так как показывала взаимное влияние атомов в структуре
молекулы, а через это объясняла химическую активность одних веществ и
пассивность других.
В XX в. структурная химия
получила дальнейшее развитие. В частности, было уточнено понятие структуры, под
которой стали понимать устойчивую упорядоченность качественно неизменной
системы. Также было введено понятие атомной структуры - устойчивой совокупности
ядра и окружающих его электронов, находящихся в электромагнитном взаимодействии
друг с другом, - и молекулярной структуры - сочетания ограниченного числа
атомов, имеющих закономерное расположение в пространстве и связанных друг с
другом химической связью с помощью валентных электронов.
Однако дальнейшее
развитие химической науки и основанного на ее достижениях производства показали
более точно возможности и пределы структурной химии.
Например, многие реакции
органического синтеза на основе структурной химии давали очень низкие выходы
необходимого продукта и большие отходы в виде побочных продуктов. Вследствие этого их нельзя было использовать
в промышленном масштабе.
Структурная химия
неорганических соединений ищет пути получения кристаллов для производства
высокопрочных материалов с заданными свойствами, обладающих термостойкостью,
сопротивлением агрессивной среде и другими качествами, предъявляемыми
сегодняшним уровнем развития науки и техники. Решение этих вопросов наталкивается на различные
препятствия. Выращивание, например, некоторых кристаллов требует исключения
условий гравитации. Поэтому такие кристаллы выращивают в космосе, на
орбитальных станциях.
2. 3. 3. ТРЕТИЙ УРОВЕНЬ ХИМИЧЕСКОГО ЗНАНИЯ. УЧЕНИЕ О ХИМИЧЕСКИХ ПРОЦЕССАХ
Учение о химических
процессах - область науки, в которой осуществлена наиболее глубокая интеграция
физики, химии и биологии. В основе этого учения находятся химическая
термодинамика и кинетика, поэтому оно в равной степени принадлежит физике и
химии. Одним из основоположников этого научного направления стал русский химик
Н.Н. Семенов, основатель химической физики.
Учение о химических
процессах базируется на идее, что способность к взаимодействию различных
химических реагентов определяется кроме всего прочего и условиями протекания
химических реакций, которые могут оказывать воздействие на характер и
результаты этих реакций.
Важнейшей задачей химиков
становится умение управлять химическими процессами, добиваясь нужных
результатов. В самом общем виде методы управления химическими процессами можно
подразделить на термодинамические (влияют на смещение химического равновесия
реакции) и кинетические (влияют на скорость протекания химической реакции).
Для управления
химическими процессами разработаны термодинамический и кинетический методы.
Французский химик А. Лее
Шателье в конце XIX в. сформулировал принцип подвижного равновесия, обеспечив
химиков методами смещения равновесия в сторону образования целевых продуктов.
Эти методы управления и получили название термодинамических. Каждая химическая реакция в принципе
обратима, но на практике равновесие смещается в ту или иную сторону. Это
зависит как от природы реагентов, так и от условий процесса.
Термодинамические методы
преимущественно влияют на направление химических процессов, а не на их
скорость.
Скоростью химических
процессов управляет химическая кинетика, в которой изучается зависимость
протекания химических процессов от строения исходных реагентов, их
концентрации, наличия в реакторе катализаторов и других добавок, способов
смешения реагентов, материала и конструкции реактора и т. п.
Химическая кинетика.
Объясняет качественные и количественные изменения в химических процессах и
выявляет механизм реакции. Реакции проходят, как правило, ряд последовательных
стадий, которые составляют полную реакцию. Скорость реакции зависит от условий
протекания и природы веществ, вступивших в нее. К ним относятся концентрация, температура
и присутствие катализаторов. Описывая химическую реакцию, ученые скрупулезно
отмечают все условия ее протекания, поскольку в других условиях и при иных
физических состояниях веществ эффект будет разный.
Задача исследования
химических реакций является очень сложной. Ведь практически все химические
реакции представляют собой отнюдь не простое взаимодействие исходных
реагентов, а сложные цепи последовательных стадий, где реагенты
взаимодействуют не только друг с другом, но и со стенками реактора, могущими
как катализировать (ускорять), так и ингибировать (замедлять) процесс.
Катализ - ускорение
химической реакции в присутствии особых веществ - катализаторов, которые
взаимодействуют с реагентами, но в реакции не расходуются и не входят в
конечный состав продуктов. Он был открыт в 1812 г. российским химиком К. Г. С.
Кирхгофом.
Сущность катализа
сводится к следующему:
1) активная молекула реагента достигается за
счет их неполновалентного взаимодействия с веществом катализатора и состоит в
расслаблении химических связей реагента;
2) в общем случае любую каталитическую
реакцию можно представить проходящей через промежуточный комплекс, в котором
происходит перераспределение расслабленных (неполновалентных) химических
связей.
Каталитические процессы различаются
по своей физической и химической природе на следующие типы:
гетерогенный катализ - химическая
реакция взаимодействия жидких или газообразных реагентов на поверхности
твердого катализатора;
гомогенный катализ - химическая
реакция в газовой смеси или в жидкости, где растворены катализатор и реагенты;
электрокатализ - реакция на
поверхности электрода в контакте с раствором и под действием электрического
тока;
фотокатализ - реакция на поверхности
твердого тела или в жидком растворе, стимулируется энергией поглощенного
излучения.
Применение катализаторов
изменило всю химическую промышленность. Катализ необходим при производстве
маргарина, многих пищевых продуктов, а также средств защиты растений. Почти вся
промышленность основной химии (60-80 %) основаны на каталитических процессах.
Химики не без основания говорят, что некаталитических процессов вообще не
существует, поскольку все они протекают в реакторах, материал стенок которых
служит своеобразным катализатором.
С участием катализаторов
скорость некоторых реакций возрастает в 10 млрд раз. Есть катализаторы,
позволяющие не просто контролировать состав конечного продукта, но и
способствующие образованию молекул определенной формы, что сильно влияет на
физические свойства продукта (твердость, пластичность).
В современных условиях
одно из важнейших направлений развития учения о химических процессах - создание
методов управления этими процессами. Поэтому сегодня химическая наука
занимается разработкой таких проблем, как химия плазмы, радиационная химия, химия
высоких давлений и температур.
Химия плазмы изучает
химические процессы в низкотемпературной плазме при 1000-10 000 °С. Такие
процессы характеризуются возбужденным состоянием частиц, столкновением молекул
с заряженными частицами и очень высокими скоростями химических реакций. В
плазмохимических процессах скорость перераспределения химических связей очень
высока, поэтому они очень производительны.
Одним из самых молодых
направлений в исследовании химических процессов является радиационная химия,
которая зародилась во второй половине XX в. Предметом ее разработок - стали
превращения самых разнообразных веществ под воздействием ионизирующих
излучений. Источниками ионизирующего излучения служат рентгеновские установки,
ускорители заряженных частиц, ядерные реакторы, радиоактивные изотопы. В
результате радиационно-химических реакций вещества получают повышенную
термостойкость и твердость.
Еще одна область развития
учения о химических процессах - химия высоких и сверхвысоких давлений.
Химические превращения веществ при давлениях выше 100 атм относятся к химии
высоких давлений, а при давлениях выше 1000 атм - к химии сверхвысоких
давлений.
При высоком давлении
сближаются и деформируются электронные оболочки атомов, что ведет к повышению
реакционной способности веществ. При давлении 102-103 атм исчезает различие
между жидкой и газовой фазами, а при 103-105 атм - междутвердой и жидкой
фазами. При высоком давлении сильно меняются физические и химические свойства
вещества. Например, при давлении 20 000 атм. металл становится эластичным, как
каучук.
Химические процессы
представляют собой сложнейшее явление как в неживой, так и в живой природе. Эти
процессы изучают химия, физика и биология. Перед химической наукой стоит
принципиальная задача - научиться управлять химическими процессами. Дело в том,
что некоторые процессы не удается осуществить, хотя в принципе они осуществимы,
другие трудно остановить - реакции горения, взрывы, а часть из них
трудноуправляема, поскольку они самопроизвольно создают массу побочных продуктов.
2. 3. 4. ЧЕТВЕРТЫЙ УРОВЕНЬ ХИМИЧЕСКОГО ЗНАНИЯ. ЭВОЛЮЦИОННАЯ ХИМИЯ
Эволюционная химия
зародилась в 1950 - 1960 гг. В основе
эволюционной химии лежат процессы биокатализа, ферментологии; ориентирована она
главным образом на исследование молекулярного уровня живого, что основой живого
является биокатализ, т.е. присутствие различных природных веществ в химической
реакции, способных управлять ею, замедляя или ускоряя ее протекание. Эти
катализаторы в живых системах определены самой природой, что и служит идеалом
для многих химиков.
Идея концептуального
представления о ведущей роли ферментов, биорегуляторов в процессе
жизнедеятельности, предложенная французским естествоиспытателем Луи Пастером в
ХIX веке, остается основополагающей и сегодня. Чрезвычайно плодотворным с этой точки
зрения является исследование ферментов и раскрытие тонких механизмов их
действия.
Ферменты- это белковые
молекулы, синтезируемые живыми клетками. В каждой клетке имеются сотни
различных ферментов. С их помощью осуществляются многочисленные химические
реакции, которые благодаря каталитическому действию ферментов могут идти с
большой скоростью при температурах, подходящих для данного организма, т.е. в
пределах примерно от 5 до 40 градусов. Можно сказать, что ферменты - это
биологические катализаторы.
В основе
эволюционной химии принцип использования таких условий, которые
приводят к самосовершенствованию катализаторов химических реакций, т. е. к
самоорганизации химических систем.
В эволюционной химии
существенное место отводится проблеме «самоорганизации» систем. Теория
самоорганизации «отражает законы такого существования динамических систем,
которое сопровождается их восхождением на все более высокие уровни сложности в
системной упорядоченности, или материальной организации». В сущности, речь идет об использовании
химического опыта живой природы. Это своеобразная биологизация химии.
Химический реактор предстает как некое подобие живой системы, для которой
характерны саморазвитие и определенные черты поведения. Так появилась эволюционная
химия как высший уровень развития химического знания.
Под эволюционными
проблемами понимают проблемы
самопроизвольного синтеза новых химических соединений (без участия человека).
Эти соединения являются более сложными и более высокоорганизованными продуктами
по сравнению с исходными веществами.
Поэтому эволюционную химию заслуженно считают предбиологией, наукой о
самоорганизации и саморазвитии химических систем.
До последней трети XX в.
об эволюционной химии ничего не было известно. В отличие от биологов, которые
вынуждены были использовать эволюционную теорию Дарвина для объяснения
происхождения многочисленных видов растений и животных, химики не
интересовались вопросом происхождения вещества, потому что получение любого
нового химического соединения всегда было делом рук и разума человека.
Постепенное развитие
науки XIX в., приведшее к раскрытию
структуры атома и детальному познанию строения и состава клетки, открыло
перед химиками и биологами практические возможности совместной работы над
химическими проблемами учения о клетке. Для освоения опыта живой природы и
реализации полученных знания в промышленности химики наметили ряд перспективных
путей.
Во-первых ведутся
исследования в области металлокомплексного катализа, который обогащается
приемами, используемыми живыми организмами в реакциях с участием ферментов
(биокатализаторов).
Во-вторых, ученые
пытаются моделировать биокатализаторы. Уже удалось создать модели многих
ферментов, которые извлекаются из живой клетки и используются в химических
реакциях. Но проблема осложняется тем, что ферменты, устойчивые внутри клетки,
вне нее быстро разрушаются.
В-третьих, развивается
химия иммобилизованных систем, благодаря которой биокатализаторы стали
стабильными, устойчивыми в химических реакциях, появилась возможность их
многократного использования.
В-четвертых, химики
пытаются освоить и использовать весь опыт живой природы. Это позволит ученым
создать полные аналоги живых систем, в которых будут синтезироваться самые
разнообразные вещества. Таким образом, будут созданы принципиально новые
химические технологии.
Изучение процессов самоорганизации в
химии привело к формированию двух подходов к анализу предбиологических систем:
субстратного и функционального.
Результатом субстратного
подхода стала информация об отборе химических элементов и структур.
Химикам важно понять, каким образом
из минимума химических элементов (основу жизнедеятельности живых организмов
составляют 38 химических элементов) и химических соединений (большинство
образовано на основе 6—18 элементов) образовались сложнейшие биосистемы.
Функциональный подход в
эволюционной химии. В рамках этого подхода также изучается роль катализа и
выявляются законы, которым подчиняются процессы самоорганизации химических
систем.
Роль каталитических
процессов усиливалась по мере усложнения состава и структуры химических систем.
Именно на этом основании некоторые ученые стали связывать химическую эволюцию с
самоорганизацией и саморазвитием каталитических систем.
На основе этих наблюдений
профессор МГУ А.П. Руденко выдвинул теорию саморазвития открытых каталитических
систем. Очень скоро она была преобразована в общую теорию химической эволюции и
биогенеза. В ней решены вопросы о движущих силах и механизмах эволюционного
процесса, т. е. о законах химической эволюции, об отборе элементов и структур и
их причинной обусловленности, о высоте химической организации и иерархии
химических систем как следствии эволюции.
Сущность этой теории
состоит в том, что эволюционирующим веществом являются катализаторы, а не
молекулы. При катализе идет реакция химического взаимодействия катализатора с
реагентами с образованием при этом промежуточных комплексов со свойствами
переходного состояния. Именно такой комплекс Руденко назвал элементарной
каталитической системой. Если в ходе реакции идет постоянный приток извне новых
реактивов, отвод готовой продукции, а также выполняются некоторые
дополнительные условия, реакция может идти неограниченно долго, находясь на
одном и том же стационарном уровне. Такие многократно возобновляемые комплексы
являются элементарными открытыми каталитическими системами.
Саморазвитие,
самоорганизация и самоусложнение каталитических систем происходят за счет
постоянного притока трансформируемой энергии. А так как основным источником
энергии является базисная реакция, то максимальное эволюционное преимущество
получают каталитические системы, развивающиеся на базе экзотермических реакций.
Таким образом, реакция является не только источником энергии, но и орудием
отбора наиболее прогрессивных эволюционных изменений катализаторов.
Тем самым Руденко
сформулировал основной закон химической эволюции, согласно которому с
наибольшей скоростью и вероятностью реализуются те пути эволюционных изменений
катализаторов, которые связаны с ростом их абсолютной каталитической активности.
При этом по параметру абсолютной каталитической активности складываются
механизмы конкуренции и естественного отбора.
Теория саморазвития
каталитических систем дает следующие возможности: выявлять этапы химической
эволюции и на этой основе классифицировать катализаторы по уровню их
организации; использовать принципиально новый метод изучения катализа; дать
конкретную характеристику пределов в химической эволюции и перехода от химогенеза (химического становления) к биогенезу,
связанного с преодолением второго кинетического предела саморазвития
каталитических систем.
Набирает теоретический и
практический потенциал новейшее направление, расширяющее представление об
эволюции химических систем, - нестационарная кинетика.
Развитие химических знаний позволяет
надеяться на разрешение многих проблем, которые встали перед человечеством в
результате его наукоемкой и энергоемкой практической деятельности.
Химическая наука на ее
высшем эволюционном уровне углубляет представления о мире. Концепции
эволюционной химии, в том числе о химической эволюции на Земле, о
самоорганизации и самосовершенствовании химических процессов, о переходе от
химической эволюции к биогенезу, являются убедительным аргументом,
подтверждающим научное понимание происхождения жизни во Вселенной.
Химическая эволюция на
Земле создала все предпосылки для появления живого из неживой природы.
Жизнь во всем ее многообразии
возникла на Земле самопроизвольно из неживой материи, она сохранилась и
функционирует уже миллиарды лет.
Жизнь полностью зависит от
сохранения соответствующих условий ее функционирования. А это во многом зависит
от самого человека.
3. Список
использованной литературы
1. Краткая химическая энциклопедия, гл. ред. И. Л. Кнунянц, т. 1—5, М., 1961—67;
2. Краткий справочник по химии, под
ред. О. Д. Куриленко, 4 изд.. К., 1974;
3. Общая химия, Полинг
Л., пер. с англ., М., 1974;
4. Современная общая химия, Кемпбел Дж., пер. с
англ., [т.] 1—3, М., 1975.