Задача № 1
Укажите положение элементов в периодической системе, составьте электронную формулу железа и калия. Укажите степень окисления. Определите химическую природу (металл, неметалл, амфотерность), приведите примеры оксидов, гидроксидов.
Решение.
Железо - элемент четвертого периода побочной подгруппы VIII группы периодической системы элементов. Электронная формула железа выглядит следующим образом: 1s22s22p63s23p63d64s2.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4s |
↑↓ |
|
|
|
|
|
|
|
|
|
|
3d |
↑↓ |
↑ |
↑ |
↑ |
↑ |
|
|
|
|
|
|
|
|
3p |
↑↓ |
↑↓ |
↑↓ |
|
|
|
|
|
|
|
|
|
|
|
|
3s |
↑↓ |
|
|
|
|
|
|
|
|
|
|
|
|
2p |
↑↓ |
↑↓ |
↑↓ |
|
|
|
|
|
|||||
|
|
2s |
↑↓ |
|
|
|
|
|
|
|
||||||
|
1s |
↑↓ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
26Fe
Железо, отдавая два внешних электрона, проявляет степень окисления +2; отдавая три электрона (два внешних и один с предпоследнего энергетического уровня), проявляет степень окисления +3. Известны также производные железа, в которых его степень окисления равна -2, 0, +4 и +6.
Железо – металл средней химической активности, обладает слабовыраженной амфотерностью: легко взаимодействует с разбавленными кислотами, в обычных условиях не растворяется в щелочах.
Для железа наиболее характерны два ряда соединений: соединение железа (II) и железа (III): оксид железа (II) – FeO, оксид железа (III) – Fe2O3, оксид железа (II, III) – Fe3O4, гидроксид железа (II) – Fe(OH)2, гидроксид железа (III) – Fe(OH)3.
Калий – элемент четвертого периода главной подгруппы I группы периодической системы Д.И. Менделеева. Электронная формула калия выглядит следующим образом: 1s22s22p63s23p64s1
|
|
|
|
|
|
|
|
|
|
4s |
↑ |
|
|
|
|
|
|
|
3p |
↑↓ |
↑↓ |
↑↓ |
|
|
|
|
|
|
|
3s |
↑↓ |
|
|
|
|
|
|
|
2p |
↑↓ |
↑↓ |
↑↓ |
|
|
|
|
|
|
|
2s |
↑↓ |
|
|
|
|
|
|
|
|
|
1s |
↑↓ |
|
|
|
|
|
|
|
|
|
19К
Атомы калия при химическом взаимодействии легко отдают валентные электроны, переходя в положительно заряженные ионы – К+ и проявляя степень окисления +1.
Калий – исключительно реакционноспособный металл. Образует с кислородом следующие соединения: оксид калия – К2О, пероксид калия – К2О2, надпероксид калия – КО2. Гидроксид калия – КОН является сильным основанием.
Задача № 2
Укажите тип химической связи в следующих соединениях: H2S, BaCl2, Cl2. Ответ поясните. Составьте схему образования связи, укажите, к какому элементу смещена электронная пара.
Решение.
В зависимости от характера распределения электронной плотности в веществе различают три основных типа химической связи: ковалентную, ионную и металлическую.
Ковалентная связь – связь между атомами в молекуле, которая осуществляется за счет общих электронных пар. Выделяют:
· ковалентная неполярная связь – связь, в которой нет смещения электронной плотности к одному из атомов;
· ковалентная полярная связь – связь, в которой общие электронные пары смещены к более электроотрицательному атому.
Ионная связь – связь, которая осуществляется за счет электростатического притяжения разноименно заряженных частиц – ионов.
Металлическая связь – связь, характерная для металлов.
Исходя из этого:
H2S – соединение с ковалентной полярной связью, общие электронные пары смещены в сторону серы.
|
16S 3s23p4 |
S + 2H → H S |
BaCl2 – соединение с ионной связью, общие электронные пары полностью смещены к хлору.
|
17Сl 3s23p5 |
2 Сl + Ba → Cl Ba Cl |
Cl2 – соединение с ковалентной неполярной связью.
|
17Сl 3s23p5 |
Сl + Сl → Cl Cl |
Задача № 3
Составьте окислительно-восстановительный баланс в следующем уравнении:
Na2SO3 + KMnO4 + NaOH → Na2SO4 + K2MnO4 + Na2MnO4 + H2O
Решение.
+4 +7 +6 +6
Na2SO3 + KMnO4 + NaOH → Na2SO4 + K2MnO4 + Na2MnO4 + H2O
Коэффициенты в уравнении определим методом электронного баланса с помощью электронных уравнений. Вычислим, как изменяют свою степень окисления восстановитель и окислитель, и отразим это в электронных уравнениях:
![]() восстановитель 1
S4+ - 2ē = S6+ процесс окисления
восстановитель 1
S4+ - 2ē = S6+ процесс окисления
окислитель 2 Mn7+ + 1ē = Mn6+ процесс восстановления
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которое присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов двум. Разделив это число на 2, получаем коэффициент 1 для восстановителя и продукта его окисления, а при делении 2 на 1 получаем коэффициент 2 для окислителя и продукта его восстановления. Коэффициенты перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид
Na2SO3 + 2KMnO4 + 2NaOH → Na2SO4 + K2MnO4 + Na2MnO4 + H2O
Задача № 4
Составьте молекулярное, ионное и сокращенное ионное уравнение между: хлоридом кальция и кремниевой кислотой; карбонатом натрия и соляной кислотой.
Решение.
а) CaCl2 + H2SiO3 = CaSiO3 + 2HCl молекулярное уравнение
Ca2+ + 2Cl- + H2SiO3 = CaSiO3 + 2H+ + 2Cl- полное ионное уравнение
Ca2+ + H2SiO3 = CaSiO3 + 2H+ сокращенное ионное уравнение
б) Na2CO3 + 2HCl = 2NaCl + CO2 + H2O молекулярное уравнение
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ + 2Cl- + CO2 + H2O полное ионное ура-ие
2H+ + CO32- = CO2 + H2O сокращенное ионное уравнение
Задача № 5
Напишите уравнения реакций гидролиза солей в ионном, молекулярном и сокращенном уравнении. Определите среду раствора и значения рН для солей: SnCl2 и Al2S3.
а) хлорид олова SnCl2 – соль слабого многоосновного основания Sn(ОН)2 и сильной кислоты НCl. При растворении в воде молекулы SnCl2 полностью диссоциируют на катионы Sn2+ и анионы Cl-. Катионы Cl- не могут связывать ионы Н+ воды, так как HCl – сильный электролит. В этом случае катионы Sn2+ связывают гидроксильные ионы воды, образуя катионы основной соли SnОН+. Образование молекул Sn(ОН)2 не происходит, так как ионы SnОН+ диссоциируют гораздо труднее, чем молекулы Sn(ОН)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Sn2+ + H2O ↔ SnOH+ + H+
или в молекулярной форме
SnCl2 + H2O ↔ SnOHCl + НCl
В растворе появляется избыток ионов водорода, поэтому раствор SnCl2 имеет кислую реакцию (рН < 7).
б) сульфид алюминия Al2S3 – соль слабой многоосновной кислоты H2S и слабого многоосновного основания Al(OH)3. Анионы S2- связывают ионы Н+ воды, образуя молекулы H2S, а не анионы кислой соли HS-, а катионы Al3+ связывают гидроксильные ионы воды, образуя молекул Al(ОН)3,а не катионы основной соли AlОН2+. Это происходит из-за того, что идет взаимное усиление гидролиза, ибо ионы Н+ и ОН- образуют молекулу слабого электролита Н2О. Ионно-молекулярное уравнение:
2Al3+ + 3S2- + 3Н2О = 2Al(ОН)3 + 3Н2S
или в молекулярной форме
Al2S3 + 3Н2О = 2Al(ОН)3 + 3Н2S
Задача № 6
Какими свойствами обладает водород? Напишите химические свойства водорода, укажите применение.
Решение.
Водород (Н) – элемент первого периода, расположен в главной подгруппе первой группы. Положение водорода в периодической системе химических элементов двоякое: подобно щелочным металлам он находится в I группе, т.е. способен отдавать электроны, проявляя свойства восстановителя. И, кроме того, водород пишут в VII группу, главную подгруппу галогенов, так как подобно им он может принимать электроны, проявляя свойства окислителя (при этом завершается двухэлектронная оболочка).
Водород – это самый легкий газ, не имеет цвета, вкуса и запаха. Мало растворим в воде.
Водород существует в молекулярном виде и молекула двухатомна.
Химические свойства водорода:
1. Взаимодействует с кислородом
2Н2 + О2 = 2Н2О
2. Взаимодействует с неметаллами
N2 + 3H2 = 2NH3 – используется для получения аммиака.
3. Взаимодействует с металлами (щелочными и щелочноземельными)
2Na + H2 = 2NaH
4. Взаимодействует с оксидами – используется для получения некоторых металлов
WO3 + 3H2 = W + 3H2O.
5. Взаимодействует с органическими соединениями – используется для синтеза различных органических веществ.
а) с непредельными – гидрирование
С2Н2 + Н2 = С2Н4 + Н2 = С2Н6
б) восстановление альдегидов
Н3С2ОН + Н2 = С2Н5ОН
Задача № 7
Какими свойствами обладают щелочноземельные металлы, ответ поясните уравнениями реакций. Что такое жесткость воды.
Решение.
1. Взаимодействуют с водородом с образование гидридов
Са + Н2 = СаН2
2. Взаимодействуют с кислородом с образование оксидов
2Са + О2 = 2СаО
3. Взаимодействуют с другими неметаллами
Са + S = CaS
4. Взаимодействуют с кислотами с образованием солей
Са + 2HCl = CaCl2 + H2
5. Взаимодействуют с водой с образованием гидроксидов
Са + 2Н2О = Са(ОН)2 + Н2.
Жесткость воды – это совокупность свойств воды, обусловленная наличием в ней ионов Са2+ и Mg2+.
Существует два вида жесткости:
1. Временная или карбонатная жесткость - жесткость, вызванная присутствием той части катионов Са2+ и Mg2+, которая эквивалентна содержащимся в воде гидрокарбонатным ионам НСО3-. Иными словами, карбонатная жесткость вызвана присутствием гидрокарбонатов кальция и магния. Ее устраняют кипячением или действием известкового молока или соды.
2. Постоянная жесткость – жесткость, обусловленная наличием других растворимых солей кальция и магния. Ее устраняют действием соды.
Задача № 8
Какой объем водорода требуется для получения 15 м3 фтороводорода.
Решение.
Уравнение данной реакции выглядит следующим образом
Н2 + F2 = 2HF
1. Определим количество вещества (υ) фтороводорода по формуле:
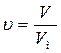 ,
,
где: V – объем вещества, л, в нашем случае он равен 15000 л (1 м3 = 1000 л); Vм – молярный объем равный 22,4 л/моль.
![]() моль
моль
По уравнению реакции υ (HF) относится к υ (H2) как 2 к 1, т.е. υ (H2) равно 334,82 моль.
2. Определим объем водорода:
![]() л или 7,5 м3
л или 7,5 м3
Ответ: V (H2) = 7,5 м3
Список литературы
1. Ахметов Н.С. Общая и неорганическая химия: Учебник для вузов. – М.: Высшая школа, 1981.
2. Глинка Н.Л. Общая химия, 2000
3. Зайцев О.С. Задачи, упражнения и вопросы по химии - М.: Химия, 1996
4. Зубович И.А. Неорганическая химия: Учебник для технол. спец. вузов. – М.: Высшая школа, 1989.
5. Хомченко Г.П. Пособие для поступающих в ВУЗы. – М.: «Новая Волна», 1996.