Задача № 3
Из 1,35 г оксида металла получается 3,15 г его нитрата.
Вычислите эквивалентную массу этого металла.
Решение. По закону
эквивалентов:
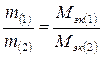 ,
,
где: m1 и m2 – масса веществ 1 и 2, г;
Мэк (1) и Мэк (2)
– молярная масса эквивалентов веществ 1 и 2, г/моль.
Эквивалентную массу оксида металла можно представить в виде:
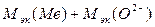 , а эквивалентную массу нитрата -
, а эквивалентную массу нитрата - 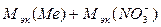 . Эквивалентная масса О2- равна 16 / 2 = 8 г/моль;
эквивалентная масса NO3-
равна 62 г/моль. Подставляя данные значения в формулу, имеем
. Эквивалентная масса О2- равна 16 / 2 = 8 г/моль;
эквивалентная масса NO3-
равна 62 г/моль. Подставляя данные значения в формулу, имеем
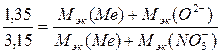 ;
; 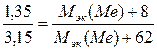 ;
;
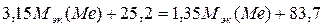 ;
; 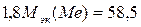 ;
;
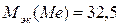 г/моль
г/моль
Задача № 25
Какие орбитали атома заполняются электронами раньше: 4s или 3d; 5s или 4p?
Почему? Напишите электронную формулу атома элемента с порядковым номером 21.
Решение. Электронные
формулы изображают распределение электронов в атоме по энергетическим уровням и
подуровням (атомным орбиталям). Электронная конфигурация обозначается группами
символов nlх,
где n -
главное квантовое число, l -
орбитальное квантовое число (вместо него указывают соответствующее буквенное
обозначение - s, p, d, f), x - число электронов в данном
подуровне (орбитали). При этом следует учитывать, что электрон занимает тот
энергетический подуровень, на котором он будет обладать наименьшей энергией -
меньшая сумма n+l.
Заполнение энергетических уровней и подуровней идет
в такой последовательности: 1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→ (5d1)→4f→(5d2-10)→6р→7s→(6d1)→5f→(6d2-10)→7р
Отсюда видно, что сначала заполняются орбитали: 4s, а потом 3d; 4p, а затем 5s.
Так как число электронов в атоме того или иного
элемента равно его порядковому номеру в таблице Д.И.Менделеева, то для элемента
№ 21 (скандий) электронная формула имеет вид:
21Sc 1s22s22p63s23p63d14s2
Задача № 43
Что такое электроотрицательность? Как изменяется
электроотрицательность р-элементов в периоде, в группе периодической системы с
увеличением порядкового номера? Почему?
Решение. Электроотрицательность
– это способность атомов притягивать к себе электроны от других атомов. Она
зависит от многих факторов, в частности, от валентного состояния элемента, типа
соединения, в которое он входит, и пр. Тем не менее это понятие полезно для
качественного объяснения свойств химической связи и соединений.
Чем меньше радиус атома и больше число электронов на внешнем
энергетическом уровне, тем больше электроотрицательность. Отсюда видно, что в
периоде с увеличением порядкового номера электроотрицательность р-элементов
увеличивается (возрастает число электронов на внешнем энергетическом уровне,
уменьшается радиус атома); а в группе соответственно уменьшается (увеличивается
радиус атома).
Задача № 90
Тепловой эффект реакции сгорания жидкого бензола с образованием
паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое
уравнение этой реакции и вычислите теплоту образования С6Н6
(ж).
Решение. Составим термохимическое
уравнение данной реакции:
С6Н6
(ж) + 7½О2 (г) = 6СО2 (г) + 3Н2О
(г); ΔНх.р. = -3135,58
кДж.
Для
решения задачи применим вывод из закона Гесса:
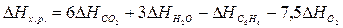
Используя
табличные данные, определим теплоты образования СО2 (г), Н2О
(г):
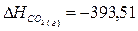 кДж;
кДж;
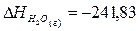 кДж;
кДж;
Учитывая,
что теплоты образования простых веществ условно приняты равными нулю
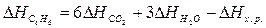
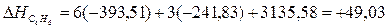 ;
;
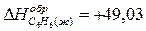 кДж/моль.
кДж/моль.
Задача № 131
Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O = 2N2 + О2, равна 5 *
10-4. Начальная концентрация N2O
= 6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, когда
разложится 50% N2O.
Решение. Согласно
закону действия масс скорость данной реакции равна
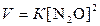
Подставляя известные значения, получим
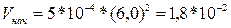
После того как разложилось 50% N2O, его
концентрация стала 6,0 * 0,5 = 3,0 моль/л. Отсюда скорость реакции равна
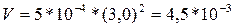
Задача № 148
Какой объем 20,01%-ного раствора HCl (пл. 1,100 г/см3)
требуется для приготовления 1 л 10,17%-ного раствора (пл. 1,050 г/см3).
Решение. Для
приготовления 1000 см3 (1 л = 1000 см3) 10,17%-ного
раствора требуется 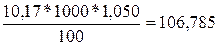 г HCl.
г HCl.
Масса 1 см3 20,01%-ной кислоты 1,100 г. В этом
растворе содержится 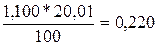 г HCl.
г HCl.
Следовательно, для приготовления 1 л 10,17%-ного раствора
нужно взять 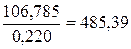 см3 этой
кислоты.
см3 этой
кислоты.
Задача № 191
Составьте молекулярные уравнения реакций, которые выражаются
ионно-молекулярными уравнениями:
а) CaCO3
+ 2H+ = Ca2+ + H2O + CO2
б) Al(OH)3
+ OH- = AlO2- + 2H2O
в) Pb2+
+ 2I- = PbI2
Решение. В данных
ионно-молекулярных уранений указаны свободные ионы, которые образуются при
диссоциации растворимых сильных электролитов, следовательно, при составлении
молекулярных уравнений следует исходить из соответствующих растворимых сильных
электролитов. Например:
а) CaCO3
+ 2HCl = CaCl2 + H2O + CO2
б) Al(OH)3
+ KOH = KAlO2 + 2H2O
в) Pb(NO3)2
+ 2KI = PbI2 + 2KNO3
Задача № 201
Составьте
ионно-молекулярное и молекулярное уравнения совместного гидролиза,
происходящего при смешивании растворов K2S и CrCl3.
Каждая из взятых солей гидролизуется необратимо до конца с образованием
соответствующих основания и кислоты.
Решение. Соль K2S гидролизуется по аниону, а CrCl3 – по
катиону:
S2-
+ Н2О = НS-
+ ОН-
Cr3+
+ Н2О = CrОН2+
+ Н+
Если растворы этих солей находятся в одном сосуде, то идет
взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН-
образуют молекулу слабого электролита Н2О. При этом гидролитическое
равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с
образованием Н2S и Cr(ОН)3.
Ионно-молекулярное уравнение:
2Cr3+
+ 3S2- + 3Н2О
= 2Cr(ОН)3 +
3Н2S
молекулярное уравнение:
2CrCl3
+ 3K2S + 3Н2О = 2Cr(ОН)3 + 3Н2S + 6KCl
Задача № 221
Исходя из степени окисления хлора в соединениях HCl, HClO3, HClO4, определите, какое из
них является только окислителем, только восстановителем и какое может проявлять
как окислительные, так и восстановительные свойства. Почему? На основании
электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по
схеме
KBr + KBrO3
+ H2SO4 → Br2 + K2SO4
+ H2O
Решение. Атом того или иного элемента
в своей высшей степени окисления не может ее повысить (отдать электроны) и
проявляет только окислительные свойства, а в своей низшей степени окисления не
может ее понизить (принять электроны) и проявляет только восстановительные
свойства. Атом же элемента, имеющий промежуточную степень окисления, может
проявлять как окислительные, так и восстановительные свойства.
Степень
окисления n (Cl) в указанных соединениях соответственно равна: -1
(низшая), +5 (промежуточная), +7 (высшая). Отсюда: HCl – только восстановитель; HClO4 – только окислитель; HClO3 – окислитель и восстановитель.
-
+5 0
KBr + KBrO3
+ H2SO4 → Br2 + K2SO4
+ H2O
Коэффициенты
в уравнении определим методом электронного баланса с помощью электронных
уравнений. Вычислим, как изменяют свою степень окисления восстановитель и
окислитель, и отразим это в электронных уравнениях:
 восстановитель 5
Вr- - 1ē = Br0 процесс окисления
восстановитель 5
Вr- - 1ē = Br0 процесс окисления
окислитель 1 Br5+ + 5ē = Br0 процесс восстановления
Общее
число электронов, отданных восстановителем, должно быть равно числу электронов,
которое присоединяет окислитель. Общее наименьшее кратное для отданных и
принятых электронов пять. Разделив это число на 1, получаем коэффициент 5 для
восстановителя и продукта его окисления, а при делении 5 на 5 получаем
коэффициент 1 для окислителя и продукта его восстановления. Коэффициенты перед
веществами, атомы которых не меняют свою степень окисления, находят подбором.
Уравнение реакции будет иметь вид
5KBr + KBrO3
+ 3H2SO4 → 3Br2 + 3K2SO4
+ 3H2O
Задача № 250
Какой гальванический элемент называется концентрационным? Составьте
схему, напишите электронные уравнения электродных процессов и вычислите ЭДС
гальванического элемента, состоящего из серебряных электродов, опущенных:
первый в 0,01 н., а второй в 0,1 н. растворы AgNO3.
Решение. Устройство,
в котором химическая энергия самопроизвольно превращается в электрическую,
называется химическим источником тока (ХИТ) или гальваническим элементом. Гальванический
элемент состоит из двух или нескольких соприкасающихся друг с другом растворов
электролитов, в которые погружены металлические пластинки — электроды,
соединенные между собой внешним проводником. Электрод, на котором протекает реакция восстановления, называется
катодом, а электрод, на
котором протекает реакция окисления, — анодом.
Гальванические элементы бывают химическими и
концентрационными. В концентрационных цепях электроды и раствор имеют одинаковый
качественный химический состав и отличаются тем, что активности окисленной или
восстановленной формы одного и того же вещества (или той и другой формы) на
электродах неодинаковы. На обоих электродах протекает одна и та же реакция, но
в различных направлениях:
катодная реакция
 Ох + zē Red
Ох + zē Red
анодная
реакция
Протекающий
процесс заключается в переносе вещества с одного электрода на другой. Движущей
силой процесса является выравнивание концентраций вещества в системе, которое
осуществляется не диффузией, а электрохимическим путем.
Схема
данного гальванического элемента
Ag│AgNO3
││AgNO3 │Ag
0,01 н. 0,1 н.
При
их работе концентрации электролитов выравниваются. На электроде справа
притекает анодная реакция, а слева – катодная.
Электродный
потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта
зависимость выражается уравнением Нернста:
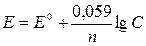 ,
,
где: Е0 – стандартный электродный
потенциал; n – число электронов, принимающих участие в процессе; С –
концентрация гидратированных ионов металла в растворе. Е0 для
серебра составляет +0,80 В. Определим электродные потенциалы металла при данных
в условии концентрациях:
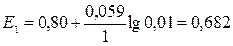 В
В
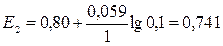 В
В
Для определения ЭДС гальванического элемента из потенциала
катода следует вычесть потенциал анода. В нашем случае ЭДС равна
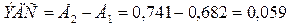 В
В
Задача № 275
Составьте электронные уравнения процессов, происходящих на
угольных электродах при электролизе раствора CuCl2. Вычислите массу меди, выделившейся на катоде,
если на аноде выделилось 560 мл газа (н.у.).
Решение. В растворе CuCl2 находятся гидратированные
ионы Cu2+ и Cl-, а также молекулы воды. Если в этот раствор погрузить
инертные (угольные) электроды и пропустить постоянный электрический ток, то
ионы будут двигаться к электродам: катионы Cu2+ - к катоду, анионы Cl- - к аноду. На катоде будут
восстанавливаться катионы меди:
Cu2+ + 2ē = Cu0
а на аноде окисляются хлорид-ионы:
2Cl - - 2ē = Cl2
Общее
уравнение электролиза водного раствора CuCl2 в ионной форме имеет вид
электролиз
 Cu2+ + 2Cl - Cu + Cl 2
Cu2+ + 2Cl - Cu + Cl 2
или в молекулярной форме:
электролиз
 CuCl2 Cu + Cl2
CuCl2 Cu + Cl2
Количество
вещества выделившегося на аноде газа  моль (0,560 л = 560 мл). По уравнению реакции количество
вещества меди равно также 0,025 моль. Следовательно, масса выделившейся на
катоде меди равно
моль (0,560 л = 560 мл). По уравнению реакции количество
вещества меди равно также 0,025 моль. Следовательно, масса выделившейся на
катоде меди равно 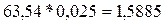 г (63,54 г/моль – мольная масса меди).
г (63,54 г/моль – мольная масса меди).
Задача № 301
Определите, чему равны заряд комплексного иона, степень
окисления и координационное число комплексообразователя в соединениях [Cu(NH3)4]SO4, K2[PtCl6], K[Ag(CN)2]. Напишите уравнения диссоциации этих соединений
в водных растворах.
Решение. Заряд
комплексного иона равен заряду внешней сферы, но противоположен ему по знаку.
Координационное число комплексообразователя равно числу лигандов,
координированных вокруг него. Степень окисления комплексообразователя
определяется так же, как степень окисления атома в любом соединении, исходя из
того, что сумма степеней окисления всех атомов в молекуле равна нулю.
|
Заряд
иона
|
к.ч.
|
Степень
окисления
|
|
[Cu(NH3)4]SO4
|
+2
|
4
|
+2
|
|
K2[PtCl6]
|
-2
|
6
|
+4
|
|
K[Ag(CN)2]
|
-1
|
2
|
+1
|
Данные
комплексные соли являются сильными электролитами, в водном растворе они
необратимо диссоциируют на ионы внешней и внутренней сфер
[Cu(NH3)4]SO4
= [Cu(NH3)4]2+ + SO42-;
K2[PtCl6] = 2K+ + [PtCl6]2-;
K[Ag(CN)2] = K+ + [Ag(CN)2]-,
комплексные же ионы диссоциируют обратимо и в
незначительной степени на составляющие их частицы:
[Cu(NH3)4]2+ ↔ Cu2+ + 4 NH3;
[PtCl6]2- ↔ Pt4+ + 6Cl-;
[Ag(CN)2]- ↔ Ag+ + 2CN-
Задача № 341
Какую
массу Na3PO4 надо прибавить к 500 л
воды, чтобы устранить ее карбонатную жесткость, равную 5 ммоль/л.
Решение. В 500 л
воды содержится 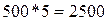 мэкв солей, обусловливающих жесткость воды. Для устранения
жесткости следует прибавить
мэкв солей, обусловливающих жесткость воды. Для устранения
жесткости следует прибавить 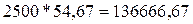 мг = 136,67 г Na3PO4 (54,67 г/моль –
эквивалентная масса Na3PO4).
мг = 136,67 г Na3PO4 (54,67 г/моль –
эквивалентная масса Na3PO4).
Задача № 392
Составьте уравнения реакций, которые надо провести для
осуществления следующих превращений:
Cu →
Cu(NO3)2 → Cu(OH)2 → CuCl2
→ [Cu(NH3)4]Cl2
Решение.
3Cu
+ 8HNO3 = 3Cu(NO3)2 +2NO + 4H2O
 восстановитель 3
Cu0 - 2ē = Cu2+ процесс окисления
восстановитель 3
Cu0 - 2ē = Cu2+ процесс окисления
окислитель
2 N5+ + 3ē = N2+ процесс восстановления
Cu(NO3)2
+ Ba(OH)2 = Cu(OH)2 + Ba(NO3)2
Cu(OH)2
+ 2HCl = CuCl2
+ 2H2O
CuCl2 + 4NH3 =
[Cu(NH3)6]Cl2
Задача № 421
Почему оксид марганца (IV) может проявлять и окислительные и восстановительные свойства?
Исходя из электронных уравнений, составьте уравнения реакций:
а) MnO2
+ KI + H2SO4 = ;
б) MnO2
+ KNO3 + KOH =
Решение. Атом того или иного элемента
в своей высшей степени окисления не может ее повысить (отдать электроны) и
проявляет только окислительные свойства, а в своей низшей степени окисления не
может ее понизить (принять электроны) и проявляет только восстановительные
свойства. Атом же элемента, имеющий промежуточную степень окисления, может
проявлять как окислительные, так и восстановительные свойства.
Степень
окисления n (Мn) в указанном соединении равна +4 (промежуточная), следовательно MnO2 - окислитель и восстановитель.
а) MnO2 + KI + H2SO4
=
 восстановитель 1
2I- - 2ē = I20 процесс окисления
восстановитель 1
2I- - 2ē = I20 процесс окисления
окислитель 1 Mn4+ + 2ē = Mn2+ процесс восстановления
Уравнение
реакции будет иметь вид
MnO2
+ 2KI + 2H2SO4 = MnSO4 + I2 + K2SO4
+ 2H2O
б) MnO2 + KNO3 + KOH =
 восстановитель 2
Mn4+ - 3ē = Mn7+ процесс окисления
восстановитель 2
Mn4+ - 3ē = Mn7+ процесс окисления
окислитель 3 N5+ + 2ē = N3+ процесс восстановления
Уравнение
реакции будет иметь вид
2MnO2
+ 3KNO3 + 2KOH = 2KMnO4 + 3KNO2 + H2O
Список литературы
1.
Глинка Н.Л. Общая химия, 2000
2.
Зубович И.А. Неорганическая химия: Учебник для технол. спец.
вузов. – М.: Высшая школа, 1989.
3.
Степин Б.Д. и др. Неорганическая химия. – М.: Высшая школа,
1994.
4.
Суворов А.В. и др. Общая химия. – СПб: Химия, 1995.
5.
Угай Я.А. Общая химия. – М.: Высшая школа, 1984.