Задача № 1
Определите эквивалент и эквивалентную массу фосфора,
кислорода и брома в соединениях PH3,
H2O, HBr.
Решение. Эквивалент
– количество вещества, которое присоединяет, отдает или замещает в химических
реакциях 1 моль атомов водорода. Отсюда эквивалент фосфора равен 3 моль,
кислорода – 2 моль, брома – 1 моль. Следовательно эквивалентная масса указанных
веществ равна: для фосфора 
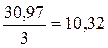 г/моль; для кислорода
г/моль; для кислорода 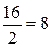 г/моль; для брома
г/моль; для брома 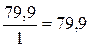 г/моль.
г/моль.
Задача № 24
Напишите электронные формулы атомов элементов с порядковыми
номерами 9 и 28. Покажите распределение электронов этих атомов по квантовым
ячейкам. К какому электронному семейству относится каждый из этих элементов?
Решение. Электронные формулы изображают распределение
электронов в атоме по энергетическим уровням и подуровням (атомным орбиталям).
Электронная конфигурация обозначается группами символов nlх,
где n -
главное квантовое число, l -
орбитальное квантовое число (вместо него указывают соответствующее буквенное
обозначение - s, p, d, f), x - число электронов в данном
подуровне (орбитали). При этом следует учитывать, что электрон занимает тот
энергетический подуровень, на котором он будет обладать наименьшей энергией -
меньшая сумма n+l.
Заполнение энергетических
уровней и подуровней идет в такой последовательности: 1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→ (5d1)→4f→(5d2-10)→6р→7s→(6d1)→5f→(6d2-10)→7р
Так как число электронов в
атоме того или иного элемента равно его порядковому номеру в таблице
Д.И.Менделеева, то для элементов № 9 (фтор)
и № 28 (никель) электронные формулы имеют вид:
9F 1s22s22p5
28Ni 1s22s22p63s23p63d84s2
Электронная структура атома
может быть изображена также в виде схем размещения электронов в квантовых (энергетических)
ячейках, которые являются схематическим изображением атомных орбиталей (АО):
|
s
|
|
|
|
|
n
= 1
|
↑↓
|
|
p
|
|
|
n
= 2
|
↑↓
|
↑↓
|
↑↓
|
↑
|
9F
|
s
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n
= 1
|
↑↓
|
|
p
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n
= 2
|
↑↓
|
↑↓
|
↑↓
|
↑↓
|
|
|
d
|
|
|
|
|
|
|
|
|
|
|
n
= 3
|
↑↓
|
↑↓
|
↑↓
|
↑↓
|
↑↓
|
↑↓
|
↑↓
|
↑
|
↑
|
|
|
|
f
|
|
|
|
|
n
= 4
|
↑↓
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28Ni
Задача № 42
Что такое энергия ионизации? В каких единицах она
выражается? Как изменяется восстановительная активность s- и p-элементов в группах периодической системы с увеличением
порядкового номера? Почему?
Решение. Энергией ионизации
I называется
количество энергии, необходимое для отрыва электрона от невозбужденного атома:
Э0 + I =Э+ + ē
Энергия ионизации выражается в кдж/г-ат или эв/атом.
Значения энергии ионизации в эв/атом численно равны потенциалам
ионизации в в.
Наименьшей энергией ионизации (3 - 5 эв) обладают s-элементы I группы, наибольшей — s- и р-элементы VIII
группы. Возрастание энергии ионизации (соответственно возрастание
восстановительной активности) при переходе от s-элементов I группы к р-элементам VIII группы обусловливается возрастанием
эффективного заряда ядра.
Задача № 89
Тепловой эффект какой реакции равен теплоте образования
гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из
следующих термохимических уравнений:
Са (к) + ½О2 (г) = СаО (к); ΔН = -635,60 кДж
Н2 (г) + ½О2 (г) = Н2О
(ж); ΔН = -285,84 кДж
СаО (к) + Н2О (ж) = Са(ОН)2 (к); ΔН = -65,06 кДж
Решение. Теплотой
образования (энтальпией) данного соединения называют тепловой эффект реакции образования 1 моль
этого соединения из простых веществ, взятых в их устойчивом состоянии при
данных условиях. Следовательно нужно вычислить тепловой эффект реакции,
термохимическое уравнение которой имеет вид
Са (к) + О2 (г) + Н2 (г) = Са(ОН)2
(к); ΔН =?
На основании закона Гесса с термохимическими уравнениями
можно оперировать так же, как и с алгебраическими. Для получения искомого
результата следует сложить эти уравнения
Са (к) +
½О2 (г) + Н2 (г) + ½О2 (г) + СаО
(к) + Н2О (ж) = СаО (к) + Н2О (ж) + Са(ОН)2
(к)
ΔН = -635,60 + (-285,84) + (-65,06) = -986,50 кДж;
Са (к) + О2 (г) + Н2 (г) = Са(ОН)2
(к); ΔН = -986,50 кДж.
Задача № 105
Уменьшается или
увеличивается энтропия при переходах: а) воды в пар; б) графита в алмаз?
Почему? Вычислите ΔS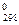 для каждого
превращения. Сделайте вывод о количественном изменении энтропии при фазовых и
аллотропических превращениях.
для каждого
превращения. Сделайте вывод о количественном изменении энтропии при фазовых и
аллотропических превращениях.
Решение. Энтропия
отражает движение частиц веществ и является мерой неупорядоченности системы.
Она возрастает с увеличением движения частиц.
В
первой системе энтропия возрастает, так как хотя в жидком состоянии молекулы могут
свободно двигаться, для газа возможность
хаотического движения больше. Во второй системе энтропия уменьшается, так как
уменьшается возможность хаотического движения: в соответствии с sp2-гибридизацией графита атомы
углерода в нем объединяются в макромолекулы С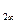 , углеродные слои объединяются в кристаллическую решетку в
основном за счет межмолекулярных сил – поэтому графит довольно мягок и легко
расслаивается, а в алмазе, вследствие sp3-гибридизации каждый атом
образует равноценные прочные σ-связи с четырьмя соседними – это
обуславливает его исключительную твердость.
, углеродные слои объединяются в кристаллическую решетку в
основном за счет межмолекулярных сил – поэтому графит довольно мягок и легко
расслаивается, а в алмазе, вследствие sp3-гибридизации каждый атом
образует равноценные прочные σ-связи с четырьмя соседними – это
обуславливает его исключительную твердость.
Для первого превращения ΔS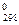 = ΔS
= ΔS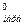 - ΔS
- ΔS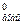 ; для
второго - ΔS
; для
второго - ΔS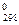 = = ΔS
= = ΔS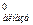 - ΔS
- ΔS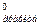 . Используя табличные данные, определим стандартные энтропии Н2О
(г), Н2О(ж), С (графит), С (алмаз):
. Используя табличные данные, определим стандартные энтропии Н2О
(г), Н2О(ж), С (графит), С (алмаз):
Н2О (г) = 188,72 Дж/(моль*К);
Н2О(ж) = 69,94 Дж/(моль*К);
С (графит) = 5,69 Дж/(моль*К);
С (алмаз) = 2,44 Дж/(моль*К).
а) ΔS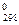 = 188,72 –
69,94 = 118,78 Дж/(моль*К);
= 188,72 –
69,94 = 118,78 Дж/(моль*К);
б) ΔS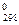 = 2,44 – 5,69 =
-3,25 Дж/(моль*К).
= 2,44 – 5,69 =
-3,25 Дж/(моль*К).
Вывод. При фазовых
превращениях изменение энтропии происходит в большем диапазоне, чем при
аллотропических превращениях.
Задача № 130
В гомогенной газовой системе А + В ↔ С + D равновесие установилось при
концентрациях: [В] = 0,05 моль/л, [С] = 0,02 моль/л. Константа равновесия
системы равна 0,04. Вычислите исходные концентрации веществ А и В.
Решение. Константа
равновесия данной системы
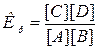
В
выражение Кр входят только равновесные концентрации всех веществ
системы.
По уравнению реакции моли всех веществ равны, следовательно,
[С]р = [D]р
= [В]прор. = [А]прор. =0,02 моль. Отсюда определим
равновесную концентрацию вещества А:
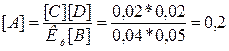 моль/л
моль/л
Следовательно исходные
концентрации веществ А и В равны: [А]исх.= = 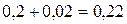 моль/л; [В]исх.=
=
моль/л; [В]исх.=
= 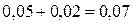 моль/л.
моль/л.
Задача № 147
Для осаждения в виде AgCl всего серебра, содержащегося в 100 см3 раствора AgNO3,
потребовалось 50 см3 0,2 н. раствора HCl. Какова нормальность раствора AgNO3? Какая масса
AgCl выпала в осадок?
Решение. Так как
вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы
равной нормальности реагируют в равных объемах. При разных нормальностях объемы
растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.
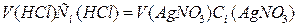 , откуда
, откуда
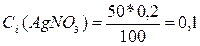 н.
н.
Эквивалент
AgNO3
равен 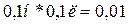 моль (100 см3 = 0,1 л), следовательно, эквивалент AgCl также равен 0,01 моль.
Эквивалентная масса AgCl
равна его мольной массе, т.е. 143,37 г/моль. Отсюда масса AgCl равна
моль (100 см3 = 0,1 л), следовательно, эквивалент AgCl также равен 0,01 моль.
Эквивалентная масса AgCl
равна его мольной массе, т.е. 143,37 г/моль. Отсюда масса AgCl равна 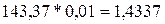 г.
г.
Задача № 220
При
смешивании растворов Al2(SO4)3 и Na2S каждая
из взятых солей гидролизуется необратимо до конца с образованием
соответствующих основания и кислоты. Выразите этот гидролиз ионно-молекулярным
и молекулярным уравнениями.
Решение. Соль Al2(SO4)3 гидролизуется
по катиону, а Na2S - по аниону:
Al3+ + Н2О = AlОН2+ + Н+
S2- + Н2О = НS- + ОН-
Если
растворы этих солей находятся в одном сосуде, то идет взаимное усиление
гидролиза каждой из них, ибо ионы Н+ и ОН- образуют
молекулу слабого электролита Н2О. При этом гидролитическое
равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с
образованием Al(ОН)3 и Н2S.
Ионно-молекулярное уравнение:
2Al3+ + 3S2- + 3Н2О = 2Al(ОН)3
+ 3Н2S
молекулярное
уравнение:
2Al2(SO4)3
+ 3Na2S + 3Н2О = 2Al(ОН)3
+ 3Н2S + 3Na2SO4
Задача № 222
Реакции
выражаются схемами:
P + HIO3 + H2O
→ H3PO4 + HI
H2S + Cl2 + H2O
→ H2SO4 + HCl
Составьте
электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой
реакции укажите, какое вещество является окислителем, какое – восстановителем;
Какое вещество окисляется, какое – восстанавливается.
Решение.
0
+5
+5 -1
P + HIO3 + H2O
→ H3PO4 + HI
Коэффициенты
в уравнении определим методом электронного баланса с помощью электронных
уравнений. Вычислим, как изменяют свою степень окисления восстановитель и
окислитель, и отразим это в электронных уравнениях:
 восстановитель 6
Р0 - 5ē = Р5+ процесс окисления
восстановитель 6
Р0 - 5ē = Р5+ процесс окисления
окислитель 5 I5+ + 6ē = I- процесс восстановления
Общее
число электронов, отданных восстановителем, должно быть равно числу электронов,
которое присоединяет окислитель. Общее наименьшее кратное для отданных и
принятых электронов тридцати. Разделив это число на 5, получаем коэффициент 6
для восстановителя и продукта его окисления, а при делении 30 на 6 получаем
коэффициент 5 для окислителя и продукта его восстановления. Коэффициенты перед
веществами, атомы которых не меняют свою степень окисления, находят подбором.
Уравнение реакции будет иметь вид
6P + 5HIO3 + 9H2O
→ 6H3PO4 + 5HI
-2 0 +6 -1
H2S + Cl2 + H2O
→ H2SO4 + HCl
Коэффициенты
в уравнении определим методом электронного баланса с помощью электронных
уравнений. Вычислим, как изменяют свою степень окисления восстановитель и
окислитель, и отразим это в электронных уравнениях:
 восстановитель 1
S2- - 8ē = S6+ процесс окисления
восстановитель 1
S2- - 8ē = S6+ процесс окисления
окислитель 4 Cl20 + 2ē = 2Сl- процесс восстановления
Общее
число электронов, отданных восстановителем, должно быть равно числу электронов,
которое присоединяет окислитель. Общее наименьшее кратное для отданных и
принятых электронов восьми. Разделив это число на 8, получаем коэффициент 1 для
восстановителя и продукта его окисления, а при делении 8 на 2 получаем
коэффициент 4 для окислителя и продукта его восстановления. Коэффициенты перед
веществами, атомы которых не меняют свою степень окисления, находят подбором.
Уравнение реакции будет иметь вид
H2S + 4Cl2 + 4H2O
→ H2SO4 + 8HCl
Задача № 274
Составьте
электронные уравнения процессов, происходящих на графитовых электродах при электролизе
раствора КBr. Какая масса вещества выделяется на катоде и аноде, если
электролиз проводить в течение 1 ч 35 мин при силе тока 15 А.
Решение. В растворе KBr
находятся гидратированные ионы K+ и Br-, а также молекулы воды.
Если в этот раствор погрузить инертные (графитовые) электроды и пропустить
постоянный электрический ток, то ионы будут двигаться к электродам: катионы K+ - к катоду, анионы Br- - к аноду. Однако вместо
ионов натрия восстанавливаются молекулы воды (т.к. калия имеет малый
стандартный электродный потенциал):
2H2O +
2ē = H2 + 2OH-
а на аноде окисляются бромид-ионы:
2Br- - 2ē = Br2
В
итоге на катоде выделяется водород, на аноде – йод, а в растворе (вблизи
катода) накапливается гидроксид натрия КОН. Общее уравнение электролиза водного
раствора КBr в ионной форме имеет вид
электролиз
 2H2O + 2Br- H2 + I2 + 2OH-
2H2O + 2Br- H2 + I2 + 2OH-
или в молекулярной форме:
электролиз
 2H2O + 2 KBr H2 + I2 + 2KOH
2H2O + 2 KBr H2 + I2 + 2KOH
Согласно
законам Фарадея
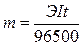 ,
,
где: m – масса вещества,
окисленного или восстановленного на электродах; Э – эквивалентная масса
вещества; I – сила тока, А; t – продолжительность
электролиза, с. Эквивалентная масса водорода равна 2 / 2 = 1 г/моль, брома
– 160 / 2 = 80 г/моль; t = 5700 (1 ч 35 мин = 5700 с), подставляя данные
значения в формулу, получим:
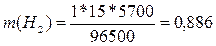 г;
г;
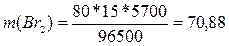 г.
г.
Задача № 300
Как протекает атмосферная коррозия железа, покрытого слоем
никеля, если покрытие нарушено? Составьте электронные уравнения анодного и
катодного процессов. Каков состав продуктов коррозии.
Решение. Никель
имеет более отрицательный потенциал (-0,25 В), чем железо (-0,037), поэтому он
является анодом, а железо катодом.
Анодный процесс:
Ni0
- 2ē = Ni2+
Катодный процесс:
½ О2 + Н2О + 2ē = 2ОН-
Так как ионы Ni2+
с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии
будет Ni(OH)2.
Список используемой литературы
1.
Ахметов Н.С. Общая и неорганическая химия: Учебник для вузов.
– М.: Высшая школа, 1981.
2.
Глинка Н.Л. Общая химия, 2000
3.
Степин Б.Д. и др. Неорганическая химия. – М.: Высшая школа,
1994.
4.
Суворов А.В. и др. Общая химия. – СПб: Химия, 1995.
5.
Угай Я.А. Общая химия. – М.: Высшая школа, 1984.