Задача № 7
Выразите в молях: а) 6,02 * 1022 молекул С2Н2;
б) 1,80 * 1024 атомов азота; в) 3,01 * 1023 молекул NH3. Какова
молярная масса указанных веществ?
Решение. Моль
любого вещества содержит постоянную Авогадро NА структурных единиц.
а)  моль;
моль;
б) 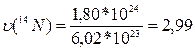 моль;
моль;
в) 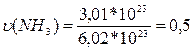 моль.
моль.
Молярная масса указанных веществ равна:
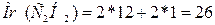 ;
;
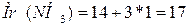 ;
;
Атомная масса азота равна 14, если рассматривать молекулу
азота (N2),
то ее молярная масса равна: 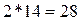 .
.
Задача № 29
Изотоп кремния-30 образуется при бомбардировке
α-частицами ядер атомов алюминия-27. Составьте уравнение этой реакции и
напишите его в сокращенной форме.
Решение. Превращения
атомных ядер записываются в виде уравнений ядерных реакций. При этом следует
помнить, что суммы массовых чисел (цифры, стоящие у символа элемента вверху
слева) и алгебраические суммы зарядов (цифры, стоящие у символа элемента внизу
слева) частиц в левой и правой частях равенства должны быть равны. Данную
реакцию выражают уравнением
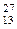 Al +
Al + 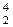 He =
He = 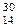 Si +
Si + 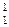 H
H
Часто применяют сокращенную форму записи. Для приведенной
реакции она имеет вид: 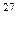 Al(α, p)
Al(α, p)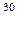 Si.
Si.
Задача № 51
У какого из р-элементов пятой группы периодической системы –
фосфора или сурьмы – сильнее выражены неметаллические свойства? Какое из
водородных соединений данных элементов более сильный восстановитель? Ответ
мотивируйте строением атома этих элементов.
Решение. Электронные
формулы данных элементов
15Р 1s22s22p63s23p3
51Sb 1s22s22p63s23p63d104s24p64d105s25p3
У атомов этих элементов на внешнем энергетическом уровне по
пять электронов. Элементы, атомы которых на внешнем энергетическом уровне
содержат более трех электронов, обладают определенным сродством к электрону, а,
следовательно, приобретают отрицательную степень окисления – выражены
неметаллические свойства. Однако, как видно из электронных формул, атомы сурьмы
содержат больше количество энергетических уровней, что приводит к увеличению
размера атома, уменьшению энергии сродства к электрону. Этим обусловлено
ослабление признаков неметаллических элементов и усиление признаком
металлических элементов. Следовательно, неметаллические свойства у фосфора
выражены сильнее, чем у сурьмы.
Водородные соединения данных элементов
Н3Р – фосфин
Н3Sb
– стибин
Оба эти соединения сильные восстановители. Однако, исходя из
строения атомов фосфора и сурьмы, можно сделать вывод, что стибин более сильный
восстановитель, чем фосфин.
Задача № 94
При сгорании 11,5 г жидкого этилового спирта выделилось
308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате
которого образуются пары воды и диоксид углерода. Вычислите теплоту образования
С2Н5ОН (ж).
Решение. При
сгорании 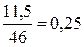 моль жидкого этилового спирта выделяется 308,71 кДж тепла,
определим, сколько теплоты выделится при сгорании 1 моль спирта:
моль жидкого этилового спирта выделяется 308,71 кДж тепла,
определим, сколько теплоты выделится при сгорании 1 моль спирта:
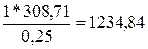 кДж
кДж
Если в результате реакции выделяется теплота, то ΔН
< 0. Учитывая сказанное, составим термохимическое уравнение данной реакции:
С2Н5ОН (ж) + 3О2 (г) = 2СО2
(г) + 3Н2О (г); ΔНх.р.
= -1234,84 кДж.
Для решения задачи применим вывод из закона Гесса:
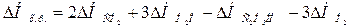
Используя табличные данные, определим теплоты образования СО2
(г), Н2О (г):
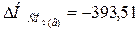 кДж;
кДж;
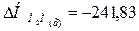 кДж;
кДж;
Учитывая, что теплоты образования простых веществ условно
приняты равными нулю
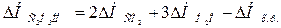
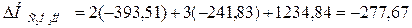 ;
;
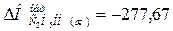 кДж/моль.
кДж/моль.
Задача № 136
Константа равновесия гомогенной системы
СО (г) + Н2О (г) ↔ СО2 (г) + Н2
(г)
при некоторой температуре равна 1.
Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации:
[СО]исх = 0,10 моль/л; [Н2О]исх = 0,40 моль/л.
Решение. Константа
равновесия данной системы
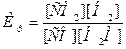
В условии задачи даны исходные концентрации, тогда как в
выражении Кр входят только равновесные концентрации всех веществ
системы. Предположим, что к моменту равновесия концентрация [СО2]р
= х моль/л. Согласно уравнению системы число молей образовавшегося водорода при
этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О
расходуется для образования по х молей СО2 и Н2.
Следовательно, равновесные концентрации всех четырех веществ
[СО2]р = [Н2]р =
х моль/л;
[СО]р = (0,10 – х) моль/л;
[Н2О]р = (0,40 – х) моль/л.
Зная константу равновесия, находим значение х, а затем
искомые концентрации всех веществ
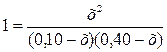 ;
;
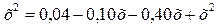 ;
; 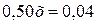 ;
; 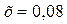 моль/л.
моль/л.
Таким образом, искомые равновесные концентрации:
[СО2]р = 0,08 моль/л;
[Н2]р = 0,08 моль/л;
[СО]р = 0,10 – 0,08 = 0,02 моль/л;
[Н2О]р = 0,40 – 0,08 = 0,32 моль/л.
Задача № 153
Какой объем 0,3 н. раствора кислоты требуется для
нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3?
Решение. Определим
нормальность раствора NaОН.
Так как эквивалентная масса NaOH
= М/1 = 40 г/моль и 40 см3 = 0,04 л, то
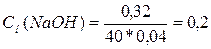 н.
н.
При разных нормальностях объемы растворов реагирующих
веществ обратно пропорциональны их нормальностям, т.е.
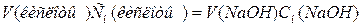 , откуда
, откуда
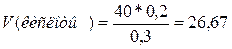 см3
см3
Задача № 195
Составьте молекулярные и ионно-молекулярные уравнения
реакций взаимодействия в растворах между: а) CdS и HCl; б) Cr(OH)3 и NaOH; в) Ba(OH)2 и CoCl2.
Решение. Запишем
уравнения взаимодействия указанных веществ в молекулярном виде:
а) CdS + 2HCl
= CdCl2 + H2S
б) Cr(OH)3
+ 3NaOH = Na3[Cr(OH)6]
в) Ba(OH)2
+ CoCl2 = BaCl2 + Co(OH)2
Исключив одинаковые ионы из обеих частей равенства а) Cl-; б) Na+; в) Ba2+ и Cl-, получим
ионно-молекулярные уравнения соответствующих реакций:
а) CdS + 2H+
= Cd2+ + H2S
б) Cr(OH)3
+ 3OH- = [Cr(OH)6]3-
в) 2OH-
+ Co2+ = Co(OH)2
Задача № 206
Какое значение рН (> 7 <) имеют растворы солей Na2S, AlCl3, NiSO4? Составьте
ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
Решение. а)
сульфид натрия Na2S – соль слабой многоосновной
кислоты H2S и сильного основания NaOH. При растворении в воде
молекулы Na2S полностью диссоциируют на
катионы Na+
и анионы S2-.
Катионы Na+
не могут связывать ионы ОН- воды, так как NaOH – сильный электролит. Анионы S2- связывают ионы
Н+ воды, образуя анионы кислой соли HS-, а не молекулы H2S, так как ионы HS- диссоциируют
гораздо труднее, чем молекулы H2S. В обычных условиях
гидролиз идет по первой ступени. Соль гидролизуется по аниону.
Ионно-молекулярное уравнение гидролиза
S2-
+ H2O ↔ HS- + OH-
или в молекулярной форме
Na2S + H2O ↔ NaHS + NaOH
В растворе появляется избыток ионов OH-, поэтому раствор Na2S имеет щелочную реакцию (рН
> 7).
б) хлорид алюминия AlCl3 – соль слабого многоосновного основания Al(ОН)3 и сильной
кислоты НCl. В этом
случае катионы Al3+
связывают гидроксильные ионы воды, образуя катионы основной соли AlОН2+.
Образование молекул Al(ОН)3
не происходит, так как ионы AlОН2+
диссоциируют гораздо труднее, чем молекулы Al(ОН)3. В обычных условиях гидролиз идет по первой
ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Al3+
+ H2O ↔ AlOH2+ + H+
или в молекулярной форме
AlCl3
+ H2O ↔ AlOHCl2 + HCl
В растворе появляется избыток ионов водорода, поэтому
раствор AlCl3
имеет кислую реакцию (рН < 7).
в) сульфат никеля NiSO4 – соль слабого многоосновного основания Ni(ОН)2 и сильной
кислоты Н2SO4.
В этом случае катионы Ni2+
связывают гидроксильные ионы воды, образуя катионы основной соли NiОН+. Образование
молекул Ni(ОН)2
не происходит, так как ионы NiОН+
диссоциируют гораздо труднее, чем молекулы Ni(ОН)2. В обычных условиях гидролиз идет по первой
ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Ni2+
+ H2O ↔ NiOH+ + H+
или в молекулярной форме
2NiSO4
+ 2H2O ↔ (NiOH)2SO4 + Н2SO4
В растворе появляется избыток ионов водорода, поэтому
раствор NiSO4
имеет кислую реакцию (рН < 7).
Задача № 228
Исходя из степени окисления хрома, йода и серы в соединениях
K2Cr2O7, KI и H2SO3, определите,
какое из них является только окислителем, только восстановителем и какое может
проявлять как окислительные, так и восстановительные свойства. Почему? На
основании электронных уравнений расставьте коэффициенты в уравнении реакции,
идущей по схеме
NaCrO2
+ PbO2 + NaOH → Na2CrO4 + Na2PbO2
+ H2O
Решение. Атом того
или иного элемента в своей высшей степени окисления не может ее повысить
(отдать электроны) и проявляет только окислительные свойства, а в своей низшей
степени окисления не может ее понизить (принять электроны) и проявляет только
восстановительные свойства. Атом же элемента, имеющий промежуточную степень
окисления, может проявлять как окислительные, так и восстановительные свойства.
Степень окисления n (Cr) в
указанном соединении равна +6 (высшая); n (I)
соответственно равна -1 (низшая); n (S)
соответственно равна +4 (промежуточная). Отсюда: KI – только
восстановитель; K2Cr2O7 – только
окислитель; H2SO3 – окислитель и
восстановитель.
+3
+4 +6 +2
NaCrO2
+ PbO2 + NaOH → Na2CrO4 + Na2PbO2
+ H2O
Коэффициенты в уравнении определим методом электронного
баланса с помощью электронных уравнений. Вычислим, как изменяют свою степень
окисления восстановитель и окислитель, и отразим это в электронных уравнениях:
 восстановитель 2
Cr3+
- 3ē = Cr6+
процесс окисления
восстановитель 2
Cr3+
- 3ē = Cr6+
процесс окисления
окислитель 3
Pb4+
+ 2ē = Pb2+ процесс восстановления
Общее число электронов, отданных восстановителем, должно
быть равно числу электронов, которое присоединяет окислитель. Общее наименьшее
кратное для отданных и принятых электронов шесть. Разделив это число на 3,
получаем коэффициент 2 для восстановителя и продукта его окисления, а при
делении 6 на 2 получаем коэффициент 3 для окислителя и продукта его
восстановления. Коэффициенты перед веществами, атомы которых не меняют свою
степень окисления, находят подбором. Уравнение реакции будет иметь вид
2NaCrO2 + 3PbO2 + 8NaOH =
2Na2CrO4 + 3Na2PbO2 + 4H2O
Задача № 246
Потенциал серебряного электрода в растворе AgNO3 составил 95 % от
значения его стандартного электронного потенциала. Чему равна концентрация
ионов Ag+ (в
моль/л)?
Решение. Электродный
потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта
зависимость выражается уравнением Нернста:
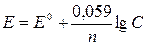 ,
,
где: Е0 – стандартный
электродный потенциал; n
– число электронов, принимающих участие в процессе; С – концентрация
гидратированных ионов металла в растворе. Е0 для серебра составляет
+0,80 В. 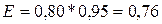 В.
В.
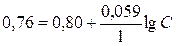 ,
,
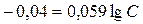 ,
,
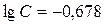 ,
,
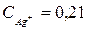 моль/л.
моль/л.
Задача № 270
Электролиз раствора NaI проводили при силе тока 6 А в течение 2,5 ч. Составьте
электронные уравнения процессов, происходящих на угольных электродах, и
вычислите массу вещества, выделившегося на катоде и аноде.
Решение. В растворе
NaI находятся
гидратированные ионы Na+
и I-, а
также молекулы воды. Если в этот раствор погрузить инертные (угольные)
электроды и пропустить постоянный электрический ток, то ионы будут двигаться к
электродам: катионы Na+
- к катоду, анионы I-
- к аноду. Однако вместо ионов натрия восстанавливаются молекулы воды (т.к. натрий
имеет малый стандартный электродный потенциал):
2H2O + 2ē = H2 + 2OH-
а на аноде окисляются йодид-ионы:
2I- - 2ē = I2
В итоге на катоде выделяется водород, на аноде – йод, а в
растворе (вблизи катода) накапливается гидроксид натрия NaОН. Общее уравнение электролиза
водного раствора NaI в
ионной форме имеет вид
электролиз
 2H2O + 2I- H2 + I2 + 2OH-
2H2O + 2I- H2 + I2 + 2OH-
или в молекулярной форме:
электролиз
 2H2O + 2NaI H2 + I2 + 2NaOH
2H2O + 2NaI H2 + I2 + 2NaOH
Согласно законам Фарадея
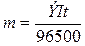 ,
,
где: m – масса вещества, окисленного или
восстановленного на электродах; Э – эквивалентная масса вещества; I – сила тока, А; t – продолжительность
электролиза, с. Эквивалентная масса водорода равна 2 / 2 = 1 г/моль, йода – 256
/ 2 = 127 г/моль; t = 9000
(2,5 ч = 9000 с), подставляя данные значения в формулу, получим:
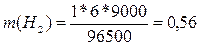 г;
г;
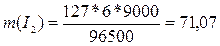 г.
г.
Задача № 311
Составьте координационные формулы следующих комплексных
соединений кобальта: 3NaNO2·Co(NO2)3, CoCl3·3NH3·2H2O, 2KNO2·NH3·Co(NO2)3. Координационное число кобальта (III) равно шести. Напишите
уравнения диссоциации этих соединений в водных растворах.
Решение. 3NaNO2·Co(NO2)3:
Na3[Co(NO2)6];
CoCl3·3NH3·2H2O:
[Co(H2O)2(NH3)3Cl]Cl2;
2KNO2·NH3·Co(NO2)3:
K2[CoNH3(NO2)5].
Данные комплексные соли являются сильными электролитами, в
водном растворе они необратимо диссоциируют на ионы внешней и внутренней сфер
Na3[Co(NO2)6]
= 3Na+ + [Co(NO2)6]3-;
[Co(H2O)2(NH3)3Cl]Cl2
= [Co(H2O)2(NH3)3Cl]2+ +
2Cl-;
K2[CoNH3(NO2)5] = 2K+ + [CoNH3(NO2)5]2-,
комплексные же ионы диссоциируют
обратимо и в незначительной степени на составляющие их частицы:
[Co(NO2)6]3-
↔ Co3+ + 6NO2-;
[Co(H2O)2(NH3)3Cl]2+
↔ Co3+ + 2H2O + 3NH3 + Cl-;
[CoNH3(NO2)5]2-
= Co3+ + NH3 + 5NO2-.
Задача № 346
Вода, содержащая только сульфат магния, имеет жесткость 7
мэкв. Какая масса сульфата магния содержится в 300 л. этой воды?
Решение. Жесткость
воды определяется по формуле:
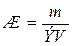 ,
,
где: m – масса вещества обуславливающего
жесткость воды или применяемого для устранения жесткости воды, мг; Э –
эквивалентная масса этого вещества; V – объем воды, л.
Отсюда
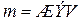
Эквивалентная масса сульфата магния MgSO4 120,37 / 2 = 60,185
г/моль, подставляя ее в формулу, находим
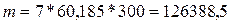 мг = 126,4 г.
мг = 126,4 г.
Задача № 396
Составьте уравнения реакций, которые надо провести для
осуществления следующих превращений:
Cd →
Cd(NO3)2 → Cd(OH)2 → [Cd(NH3)6](OH)2
→ CdSO4
Решение.
4Cd + 10HNO3
= 4Cd(NO3)2 + NH4NO3 + 3H2O
 восстановитель 4
Cd0 -
2ē = Cd2+
процесс окисления
восстановитель 4
Cd0 -
2ē = Cd2+
процесс окисления
окислитель
1 N5+ + 8ē = N3- процесс восстановления
Cd(NO3)2
+ Ba(OH)2 = Cd(OH)2 + Ba(NO3)2
Cd(OH)2
+ 6NH3 = [Cd(NH3)6](OH)2
[Cd(NH3)6](OH)2
+ MgSO4 = CdSO4 + Mg(OH)2 + 6NH3
Задача № 416
Составьте уравнения реакций, которые надо провести для
осуществления превращений:
Na2Cr2O7 → Na2CrO4 → Na2Cr2O7 → CrCl3 → Cr(OH)3
Уравнение окислительно-восстановительной реакции напишите на
основании электронных уравнений.
Решение.
Na2Cr2O7 + 2NaOH = 2Na2CrO4 + H2O
2Na2CrO4
+ H2SO4 = Na2Cr2O7 + Na2SO4
+ H2O
Na2Cr2O7
+ 14HCl = 3Cl2 + 2CrCl3 + 2NaCl + 7H2O
 восстановитель 3
2Cl- - 2ē = Cl20 процесс
окисления
восстановитель 3
2Cl- - 2ē = Cl20 процесс
окисления
окислитель
1 2Cr6+ + 6ē = 2Cr3+ процесс
восстановления
CrCl3
+ 3KOH = Cr(OH)3 + 3KCl
Список литературы
1.
Ахметов Н.С. Общая и неорганическая химия: Учебник для вузов.
– М.: Высшая школа, 1981.
2.
Вовченко Г.Д. Третьяков Ю.Д. Общая химия, 1980.
3.
Глинка Н.Л. Общая химия, 2000
4.
Зайцев О.С. Задачи, упражнения и вопросы по химии - М.:
Химия, 1996
5.
Зубович И.А. Неорганическая химия: Учебник для технол. спец.
вузов. – М.: Высшая школа, 1989.