Задача № 13
Избытком гидроксида калия подействовали на растворы: а)
дигидрофосфота калия; б) нитрата дигидроксовисмута (III). Напишите уравнения реакций этих
веществ с КОН и определите их эквиваленты и эквивалентные массы.
Решение.
а) 2КОН + КН2РО4 = К3РО4
+ 2Н2О
Эквивалентная масса КН2РО4 равна
½ его мольной массе, т.е. 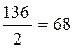 г/моль. Следовательно,
эквивалент КН2РО4 равен 2 моль.
г/моль. Следовательно,
эквивалент КН2РО4 равен 2 моль.
б) КОН + Bi(OН)2NО3 = Bi(OH)3 + KNO3
Эквивалентная масса Bi(OН)2NО3 равна его
мольной массе, т.е. 305 г/моль. Следовательно, эквивалент Bi(OН)2NО3
равен 1 моль.
Задача № 35
Какие значения могут принимать квантовые числа n, l, ml, ms,
характеризующие состояние электронов в атоме? Какие значения они принимают для
внешних электронов атомов магния.
Решение.
Движение электрона в атоме носит вероятностный характер.
Околоядерное пространство, в котором с наибольшей вероятностью (0,9—0,95) может
находиться электрон, называется атомной орбиталью (АО). Атомная орбиталь, как
любая геометрическая фигура, характеризуется тремя параметрами (координатами),
получившими название квантовых чисел (n, l, ml). Квантовые
числа принимают не любые, а определенные, дискретные (прерывные) значения. Соседние
значения квантовых чисел различаются на единицу. Квантовые числа определяют размер
(n), форму (l) и, ориентаццию (ml) атомной
орбитали в пространстве. Занимая ту или иную атомную орбиталь, электрон
образует электронное облако, которое у электронов одного и тогоже атома может
иметь различную форму. Формы электронных облаков. аналогичны АО. Их также
называют электронными или атомными орбиталями. Электронное облако
характеризуется четырьмя квантовыми числами (n, l, ml, ms). Эти квантовые
числа связаны с физическими свойствами электрона, и число n (главное
квантовое число) характеризует энергетический (квантовый) уровень электрона,
принимает значения от 1 и выше; число l (орбитальное) — момент количества
движения (энергетический подуровень), для s-подуровня l
= 0, для р-подуровня l
=1, для d-подуровня l = 2, для f-подуровня l = 3; число ml (магнитное)
— магнитный момент, принимает значение от –l через 0 до +l; ms — спин. Спин электрона возникает за счет вращения
его вокруг собственной оси. Электроны в атоме должны отличаться хотя бы одним квантовым
числом (принцип Паули), поэтому в АО могут находиться не более двух электронов, отличающихся своими спинами (ms = ±½).
Для магния (12) электронная формула имеет вид:
12Mg 1s22s22p63s2
На
внешнем энергетическом уровне магния находится два электрона, для которых
квантовые числа принимают значения: n = 3, l
= 0, ml = 0,
ms =
±½.
Задача № 53
Исходя из степени окисления атомов соответствующих
элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов
является более сильным основанием: CuOH или Cu(OH)2; Fe(OH)2 или Fe(OH)3; Sn(OH)2 или Sn(OH)4?
Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II).
Решение.
Если данный элемент проявляет переменную степень окисления и
образует несколько оксидов и гидроксидов, го с увеличением степени окисления
свойства последних меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической
диссоциации гидроксидов ЭОН, которая в зависимости от сравнительной прочности и
полярности связей Э-О и О-Н Может протекать по двум типам:
ЭОН ↔ Э+ + ОН-
ЭОН ↔ ЭО- + Н+
Полярность связей, в свою очередь, определяется разностью электроотрицательностей
компонентов, размерами и эффективными зарядами атомов. Диссоциация по кислотному
типу (П) протекает, если ЕО-Н > ЕЭ-О (высокая степень
окисления), а по основному типу, если ЕО-Н < ЕЭ-О (низкая
степень окисления). Если прочности связей О-Н и Э-О близки или равны,
диссоциация гидроксида может одновременно протекать и по (I), и по (II) типам. В атом случае речь идет амфотерных
электролитах (амфолитах).
Следовательно, более сильными основаниями будут, CuOH, а не Cu(OH)2; Fe(OH)2, а не Fe(OH)3; Sn(OH)2, а не Sn(OH)4.
Гидроксид олова (II) – амфотерный Гидроксид, так как реагирует с кислотами и
щелочами:
Sn(OH)2
+ 2HCl = SnCl2 + 2H2O;
Sn(OH)2
+ 2KOH = K2SnO3 + 2H2O.
Задача № 75
Какие силы молекулярного взаимодействия называют
ориентационными, индукционными и дисперсионными? Когда возникают эти силы и
какова их природа?
Решение.
Между молекулами может осуществляться как
электростатическое, так и донорно-акцепторное взаимодействие.
Электростатическое взаимодействие молекул
подразделяют на ориентационное, индукционное и дисперсионное. Наиболее
универсально (т. е. проявляется в любых случаях) дисперсионное, так как оно
обусловлено взаимодействием молекул друг с другом за счет их мгновенных
микродиполей. При сближении молекул ориентация микродиполей перестает быть
независимой, и их появление и исчезновение в разных молекулах происходит в такт
друг другу. Синхронное появление и исчезновение микродиполей разных молекул
сопровождается их притяжением. При отсутствии синхронности в появлении и
исчезновении микродиполей происходит отталкивание.
Ориентационное (диполь-дипольное) взаимодействие проявляется
между полярными молекулами. В результате беспорядочного теплового движения
молекул при их сближении друг с другом одноименно заряженные концы диполей
взаимно отталкиваются, а противоположно заряженные притягиваются. Чем более
полярны молекулы, тем сильнее они притягиваются и тем самым больше
ориентационное взаимодействие. Нагревание усиливает тепловое движение молекул
и тем самым уменьшает возможность ориентации, поэтому, чем выше температура,
тем слабее ориентационное взаимодействие.
Индукционное взаимодействие молекул осуществляется за fin их индуцированных
диполей. Допустим, что встречаются полярная и неполярная молекулы. Под
действием полярной молекулы неполярная молекула деформируется, и в ней
возникает (индуцируется) диполь. Индуцированный диполь притягивается к
постоянному диполю полярной молекулы. Индуцированный диполь в свою очередь
усиливает дипольный момент полярной молекулы.
Индукционное взаимодействие молекул практически не зависит
от температуры. Оно
тем больше, чем больше дипольный момент и поляризуемость молекулы и чем меньше
межмолекулярное расстояние.
Относительный вклад каждого из рассмотренных видов межмолекулярных
сил зависит в основном от двух свойств взаимодействующих молекул: полярности и
поляризуемости (деформируемости). Чем выше полярность, тем значительнее роль ориентационных
сил; чем больше деформируемость, тем значительнее роль сил дисперсионных.
Индукционные силы зависят от обоих факторов, но сами обычно играют
второстепенную роль.
Задача № 100
При получении эквивалентной массы гидроксида кальция
из CaO (к) и Н2О (ж) выделяется 32,53 кДж теплоты. Напишите
термохимическое уравнение этой реакции и вычислите теплоту образования оксида
кальция.
Решение.
Эквивалентная масса Са(ОН)2 равна ½
его мольной массы, т.е. 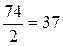 г/моль. При получении 37 г/моль гидроксида кальция выделяется
32,53 кДж тепла, определим, сколько теплоты выделится при получении 74 г/моль
(1 моль) гидроксида кальция:
г/моль. При получении 37 г/моль гидроксида кальция выделяется
32,53 кДж тепла, определим, сколько теплоты выделится при получении 74 г/моль
(1 моль) гидроксида кальция:
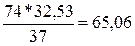 кДж
кДж
Если в результате реакции выделяется теплота, то
ΔН < 0. Учитывая сказанное, составим термохимическое уравнение данной
реакции:
СаО (к) + Н2О (ж)
= Са(ОН)2 (к); ΔНх.р.
= -65,06 кДж.
Для решения задачи применим вывод из закона Гесса:
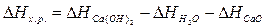
Используя табличные данные, определим теплоты
образования Са(ОН)2 (к), Н2О (ж):
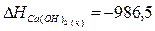 кДж;
кДж;
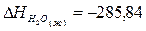 кДж;
кДж;
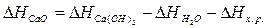
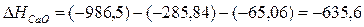 кДж.
кДж.
Ответ: 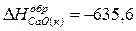 кДж/моль.
кДж/моль.
Задача № 116
Вычислите ∆Н0, ∆S0 и ∆G0Т реакции, протекающей по
уравнению:
TiO2 (к) + 2С (к) = Ti (к) +
2СО (г)
Возможна ли реакция восстановления TiO2 углеродом при температурах
1000 и 3000 К?
Решение.
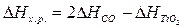
Используя табличные данные, определим теплоты
образования СО (г), TiO2 (к):
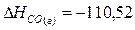 кДж;
кДж;
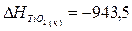 кДж;
кДж;
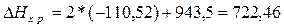 кДж.
кДж.
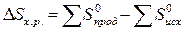
Используя
табличные данные, определим стандартные энтропии TiO2 (к), С (к), Ti (к),
СО (г):
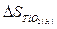 = 50,2 Дж/К;
= 50,2 Дж/К;
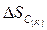 = 5,69 Дж/К
= 5,69 Дж/К
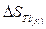 = 30,7 Дж/К;
= 30,7 Дж/К;
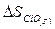 = 197,7 Дж/К;
= 197,7 Дж/К;
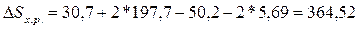 Дж/К или 0,36452 кДж/К.
Дж/К или 0,36452 кДж/К.
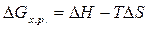
При Т = 1000, 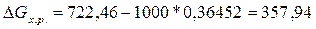 кДж, ∆G
> 0, следовательно, реакция
восстановления TiO2 углеродом при температуре 1000 К не возможна.
кДж, ∆G
> 0, следовательно, реакция
восстановления TiO2 углеродом при температуре 1000 К не возможна.
При Т = 3000, 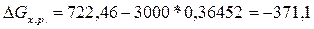 кДж, ∆G
< 0, следовательно, реакция
восстановления TiO2 углеродом при температуре 3000 К возможна.
кДж, ∆G
< 0, следовательно, реакция
восстановления TiO2 углеродом при температуре 3000 К возможна.
Задача № 121
Окисление серы и ее диоксида протекает по
уравнениям: а) S (к) + О2 = = SO2 (г); б) 2SO2 (г) + О2 = 2SO3 (г). Как изменятся
скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза?
Решение.
а) Согласно закону действия масс скорость реакции
равна
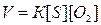
После уменьшения объема системы в четыре раза концентрация
кислорода увеличится в четыре раза, а концентрация серы останется неизменной.
При новых концентрациях скорость  реакции:
реакции:
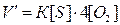
Отсюда
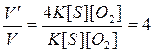 , т.е. скорость реакции увеличится в 4 раза.
, т.е. скорость реакции увеличится в 4 раза.
б) Согласно закону действия масс скорость реакции равна
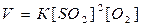
После уменьшения объема системы в четыре раза концентрация каждого
из реагирующих веществ увеличится в четыре раза. При новых концентрациях
скорость  реакции:
реакции:
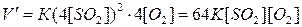
Отсюда
 , т.е. скорость реакции увеличится в 64 раза.
, т.е. скорость реакции увеличится в 64 раза.
Задача № 211
Какие из солей RbCl, Cr2(SO4)3, Ni(NO3)2, Na2SO3 подвергаются
гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза
соответствующих солей. Какое значение рН (>7<) имеют растворы этих солей?
Решение.
Гидролизу подвергаются: Cr2(SO4)3,
Ni(NO3)2, Na2SO3.
а)
сульфат хрома Cr2(SO4)3 – соль слабого
многоосновного основания Cr(ОН)3 и сильной
кислоты H2SO4. В этом случае катионы Cr3+ связывают гидроксильные
ионы воды, образуя катионы основной соли CrОН2+. Образование
молекул Cr(ОН)3 не происходит, так как ионы CrОН2+
диссоциируют гораздо труднее, чем молекулы Cr(ОН)3. В обычных
условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону.
Ионно-молекулярное уравнение гидролиза
Cr3+ + H2O ↔ CrOH2+ + H+
или
в молекулярной форме
Cr2(SO4)3 + 2H2O
↔ 2CrOHSO4 + H2SO4
В
растворе появляется избыток ионов водорода, поэтому раствор Cr2(SO4)3 имеет кислую реакцию (рН
< 7).
б) нитрат
никеля Ni(NO3)2 – соль слабого
многоосновного основания Ni(ОН)2 и сильной
кислоты НNO3. В этом случае катионы Ni2+ связывают гидроксильные
ионы воды, образуя катионы основной соли NiОН+. Образование
молекул Ni(ОН)2 не происходит, так как ионы NiОН+
диссоциируют гораздо труднее, чем молекулы Ni(ОН)2. В обычных
условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону.
Ионно-молекулярное уравнение гидролиза
Ni2+ + H2O ↔ NiOH+ + H+
или
в молекулярной форме
Ni(NO3)2 + H2O
↔ NiOHNO3 + НNO3
В
растворе появляется избыток ионов водорода, поэтому раствор Ni(NO3)2 имеет кислую реакцию (рН
< 7).
в) сульфит
натрия Na2SO3 – соль слабой многоосновной
кислоты H2SО3 и сильного
основания NaOH. В этом случае анионы SО32-
связывают ионы Н+ воды, образуя анионы кислой соли HSО3-,
а не молекулы H2SО3, так как ионы HSО3-
диссоциируют гораздо труднее, чем молекулы H2SО3.
В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по
аниону. Ионно-молекулярное уравнение гидролиза
SО32- + H2O
↔ HSО3- + OH-
или
в молекулярной форме
Na2SO3 + H2O
↔ NaHSО3 + NaOH
В
растворе появляется избыток ионов OH-, поэтому раствор Na2SO3 имеет щелочную реакцию (рН
> 7).
Задача № 231
Реакции
выражаются схемами:
P + HСlO3 + H2O
→ H3PO4 + HCl
H3AsO3 + KMnO4
+ H2SO4 → H3AsO4 + MnSO4
+ K2SO4 + H2O
Составьте
электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой
реакции укажите, какое вещество является окислителем, какое – восстановителем;
Какое вещество окисляется, какое – восстанавливается.
Решение.
0
+5 +5 -1
P + HСlO3 + H2O
→ H3PO4 + HCl
Коэффициенты
в уравнении определим методом электронного баланса с помощью электронных
уравнений. Вычислим, как изменяют свою степень окисления восстановитель и
окислитель, и отразим это в электронных уравнениях:
 восстановитель 6
Р0 - 5ē = Р5+ процесс окисления
восстановитель 6
Р0 - 5ē = Р5+ процесс окисления
окислитель 5 Cl5+ + 6ē = Cl- процесс восстановления
Общее
число электронов, отданных восстановителем, должно быть равно числу электронов,
которое присоединяет окислитель. Общее наименьшее кратное для отданных и
принятых электронов тридцати. Разделив это число на 5, получаем коэффициент 6
для восстановителя и продукта его окисления, а при делении 30 на 6 получаем
коэффициент 5 для окислителя и продукта его восстановления. Коэффициенты перед
веществами, атомы которых не меняют свою степень окисления, находят подбором.
Уравнение реакции будет иметь вид
6P + 5HClO3 + 9H2O
→ 6H3PO4 + 5HCl
+3 +7 +5 +2
H3AsO3 + KMnO4
+ H2SO4 → H3AsO4 + MnSO4
+ K2SO4 + H2O
Коэффициенты
в уравнении определим методом электронного баланса с помощью электронных
уравнений. Вычислим, как изменяют свою степень окисления восстановитель и
окислитель, и отразим это в электронных уравнениях:
 восстановитель 5
As3+ - 2ē = As5+ процесс окисления
восстановитель 5
As3+ - 2ē = As5+ процесс окисления
окислитель 2 Mn7+ + 5ē = Mn2+ процесс восстановления
Общее
число электронов, отданных восстановителем, должно быть равно числу электронов,
которое присоединяет окислитель. Общее наименьшее кратное для отданных и
принятых электронов десяти. Разделив это число на 2, получаем коэффициент 5 для
восстановителя и продукта его окисления, а при делении 10 на 5 получаем
коэффициент 2 для окислителя и продукта его восстановления. Коэффициенты перед
веществами, атомы которых не меняют свою степень окисления, находят подбором.
Уравнение реакции будет иметь вид
5H3AsO3 + 2KMnO4
+ 3H2SO4 → 5H3AsO4 + 2MnSO4
+ K2SO4 + 3H2O
Задача № 260
Какие химические процессы протекают на электродах при зарядке и разрядке
железо-никелевого аккумулятора?
Решение.
Пластинки: Fe и NiOOH
Электролит: КОН с добавкой LiOH
Железо имеет меньший потенциал (-0,44 в) и является
анодом, на котором протекает окислительный процесс:
Fe0 – 2 ē = Fe2+
Никель, потенциал которого +0,49 в, - катод, т.е.
электрод на котором протекает восстановительный процесс:
NiOOH
+ 1ē + H2O = Ni(OH)2 + OH-
Уравнение окислительно-восстановительной реакции,
характеризующее работу данного аккумулятора:
разряд
2NiOOH + Fe
+ 2H2O ↔ 2Ni(OH)2
+ Fe(OH)2
заряд
Задача № 291
Железное изделие покрыли кадмием. Какое это покрытие –
анодное или катодное? Почему? Составьте электронные уравнения анодного и
катодного процесса коррозии этого изделия при нарушении покрытия во влажном
воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии
образуются в первом и во втором случаях?
Решение.
Железо имеет больший потенциал (-0,037 в), чем кадмий (-0,403 в), поэтому
оно является катодом, а кадмий анодом, следовательно, это покрытие анодное.
Анодный
процесс:
Cd0 – 2ē = Cd2+
Катодный
процесс:
-
во влажном воздухе ½О2
+ Н2О + 2ē = 2ОН-
- в кислой среде 2Н+
+ 2ē = 2ОН-
Так как ионы Cd2+
с гидроксильной группой образуют нерастворимый Гидроксид, то продуктом коррозии
будет Cd(OH)2.
Список литературы
1.
Ахметов Н.С. Общая и неорганическая химия: Учебник для вузов.
– М.: Высшая школа, 1981.
2.
Глинка Н.Л. Общая химия, 2000.
3.
Зубович И.А. Неорганическая химия: Учебник для технол. спец.
вузов. – М.: Высшая школа, 1989.
4.
Степин Б.Д. и др. Неорганическая химия. – М.: Высшая школа,
1994.
5.
Суворов А.В. и др. Общая химия. – СПб: Химия, 1995.