Острый Инфаркт Миокарда
Ведение на догоспитальном и госпитальном этапах
РУКОВОДСТВО ЕВРОПЕЙСКОГО ОБЩЕСТВА КАРДИОЛОГОВ
Под редакцией И.Н.Бокарева, Лауреата Государственной
премии, профессора
Acute
myocardial infarction: pre-hospital and in-hospital management.
Острый
инфаркт миокарда; ведение на догоспитальном и госпитальном этапах.
The Task Force on the Management of Acute Myocardial
Infarction of the European Society of Cardiology. (European
Heart Journal, 1996; 17: 43-63)
ПРЕДИСЛОВИЕ К РЕКОМЕНДАЦИЯМ ЕВРОПЕЙСКОГО ОБЩЕСТВА
КАРДИОЛОГОВ
И.Н.БОКАРЕВ профессор, Лауреат
Государственной премии России
Омертвление части сердечной мышцы, вызванное
нарушением доступа крови к ней по коронарным артериям, получило название
инфаркта миокарда. Этот феномен, сопровождаемый разнообразными клиническими
проявлениями, развивающийся в подавляющем большинстве случаев вследствие
тромбозирования коронарных артерий сердца, был доложен в 1909 году на 1-м
съезде российских врачей отечественными клиницистами В.П.Образцовым и
Н.Д.Стражеско, которые ясно представили клинические проявления данного заболевания,
а затем опубликовали свои соображения в немецком журнале клинической медицины
"Zeitschrift fur Klinische medizinae" 71:116,1910. Много времени
потребовалось человечеству для распознавания этого синдрома. Ведь еще в 1768
году сначала француз Руньо (Rougnon) и вслед за ним англичанин Хеберден
(Heberden) дали описание внезапной смерти людей, последовавшей вслед за болями
в грудной области. Хеберден назвал данные проявления грудной жабой. О
возможности ее развития из-за окклюзии коронарных артерий говорили довольно
много, но лишь В.П.Образцов и Н.Д.Стражеско подвели итог всем этим дискуссиям,
сообщив о симптоматологии и диагностике тромбоза венечных артерий сердца, как
причины инфаркта миокарда. Последующие работы J.Herrick, описавшего клиническую
картину внезапной обструкции коронарных артерий сердца, H.Pardee, обнаружившего
в 1920 году изменения электрокардиограммы при обструкции коронарной артерии, а
также широкое внедрение в клиническую практику метода электрокардиографии
привели к тому, что инфаркт миокарда стал часто распознаваться практикующими
врачами. На сегодня инфаркт миокарда является главной причиной смерти в
экономически развитых странах. Только в 1990 году, по данным ВОЗ, из 10 912 000
погибших 2 695 000 людей унесла ишемическая болезнь сердца, что составило почти
25 процентов. В развивающихся странах значимость этой патологии также
непрерывно нарастает. В том же году в этих странах от инфаркта миокарда погибли
3 565 000 человек, что составило 9,2%. Все это заставляет общество искать новые
и эффективные методы лечения данной патологии. И эти поиски дают себя знать.
Так, создание палат интенсивного наблюдения, в которые с середины 60-х годов
стали помещать всех больных, у которых подозревалось наличие инфаркта миокарда,
позволило снизить смертность сразу на тридцать процентов. Внедрение тромболитической
терапии в 80-е годы снизило смертность от инфаркта миокарда еще на 25%. Сегодня
в ведущих клиниках мира смертность от инфаркта миокарда составляет 5-7%.
Естественно, что достижение лучших врачей мира не должно оставаться неизвестным
широкой массе практических врачей. Европейское общество кардиологов установило
хорошее правило, согласно которому все достижения современной медицины в области
диагностики, профилактики и лечения наиболее частых заболеваний публикуются в
виде руководств, авторами которых являются специальные группы
наикомпетентнейших специалистов Европы. Можно выразить надежду на то, что
отечественные врачи, ознакомившись с данным руководством, смогут еще более
эффективно бороться с данным заболеванием.
Введение
Тактика
лечения острого инфаркта миокарда (ОИМ) за последние несколько лет претерпела
множество изменений. Хорошая практика должна основываться на проверенных данных,
полученных в ходе больших, хорошо организованных клинических исследований. В
связи с этим Европейское общество кардиологов решило, что наступил подходящий
момент для написания руководства, и сформировало группу ученых для того, чтобы
его подготовить. Следует иметь в виду, что многие аспекты терапии, такие как
лечение остановки сердца и кардиогенного шока (КШ), в большей степени зависят
от опыта, а не от результатов рандомизированных контролированных исследований.
Кроме того, даже если клинические исследования проведены блестяще, их
результаты могут быть подвергнуты различной интерпретации. Наконец, выбор
метода лечения может быть ограничен финансовыми возможностями; сопоставление
стоимости и эффективности очень важно при выборе лечебной стратегии.
При написании
этого руководства группа авторов попыталась также выделить способы лечения,
которые основываются на неоспоримых доказательствах. Представлены и те, которые
могут обсуждаться. Руководство не является предписывающим. Пациенты настолько
отличаются один от другого, что принцип индивидуального выбора лечения должен
быть главенствующим, и здесь важное значение имеют клиническое мышление, опыт и
здравый смысл.
Естественное течение острого инфаркта миокарда
Истинное
начало ОИМ бывает трудно установить, поскольку часто развивается безболевой ИМ.
Нередко острая коронарная смерть наступает вне госпиталя, кроме того,
наблюдается большая вариабельность в методах диагностики ИМ. Большие
многоцентровые исследования убедительно показали, что общая смертность при острых
сердечных приступах в первый месяц составляет около 50% и половина из этих
смертей происходит в первые 2 ч. Эти высокие показатели за последние 30 лет
изменились незначительно. В то же время значительно уменьшилась доля общей
смертности, приходящаяся на госпитальную летальность. До создания блоков
интенсивного наблюдения в 1960-х годах внутрибольничная летальность доходила в
среднем до 25 - 30%. По результатам систематического обзора исследований, посвященных
изучению смертности при ОИМ в дотромболитическую эру (середина 1980-х годов),
частота фатального исхода составила 18%. С тех пор смертность в первый месяц
уменьшилась, но еще осталась высокой, несмотря на широкое применение
тромболитиков и аспирина. Так, в недавно проведенном исследовании MONICA (мониторирование
тенденций и детерминант при сердечно-сосудистых заболеваниях) в пяти городах
смертность за 28 дней составила 13 - 27%. В других исследованиях смертность за
1 мес. составила 10 - 20%.
Много лет
назад было выявлено, что есть несколько несомненных факторов, предопределяющих
смерть пациентов, поступивших в стационар по поводу ОИМ. Основными из них
являются возраст, отягощенный анамнез (сахарный диабет, перенесенный ОИМ),
большие размеры ИМ, локализация ИМ (передняя или нижняя), низкое исходное артериальное
давление (АД), наличие легочной гипертензии и степень ишемии, которая
выражается подъемом и/или депрессией сегмента ST на электрокардиограмме (ЭКГ).
Влияние этих факторов сохраняется и сегодня.
Таблица 1. Введение
тромболитических препаратов при ОИМ
|
Препарат
|
Начальная доза
|
Гепаринотерапия
|
Специфические противопоказания
|
|
СК
|
1,5 млн. ЕД, 100 мл 5% глюкозы или 0,9% физиологического раствора за
30-60 мин
|
Не нужна или п/к 12 500 ЕД 2 раза в день
|
Предшествующее (до 5 дней) введение СК или анистреплазы
|
|
Анистреплаза
|
30 ЕД за 3-5 мин
|
|
Предшествующее (до 5 дней) введение СК или анистреплазы. Аллергия к
СК/ анистреплазе
|
|
Альтеплаза
(ТАП)
|
15 мг в/в болюсом (0,75 мг/кг за 30 мин, далее 0,5 мг/кг за 60 мин
в/в). Общая доза не должна превысить 100 мг.
|
В/в в течение 48 ч*
|
|
|
Урокиназа**
|
2 млн. ЕД в/в болюсом или 1,5 млн. ЕД болюсом + 1,5 млн. ЕД за 1 ч
|
в/в в течение 48 ч*
|
|
|
Примечание. Аспирин следует назначать всем больным без
противопоказаний. Одна звездочка - доза определяется по ТАП, две - не зарегистрирован
в некоторых странах для применения при ОИМ.
|
|
|
|
|
|
|
|
Цели лечения
Поскольку
основной задачей врачей является предотвращение смерти больного, те из них,
которые лечат пациентов с ОИМ, стараются снизить до минимума дискомфорт и
стресс, имеющиеся у пациента, и ограничить степень повреждения миокарда. Можно
выделить три фазы лечения:
•
немедленная помощь, основной целью которой является облегчение боли и
предотвращение угрозы остановки сердца;
• ранняя
помощь, основной целью которой является начало реперфузионной
терапии для ограничения размера ИМ и предотвращения расширения и растяжения
зоны ИМ, а также неотложное лечение таких осложнений, как недостаточность
сократительной функции, шок, угрожающие жизни аритмии;
•
последующее лечение, направленное на купирование поздних осложнений. Основная
цель при этом одна - предотвращение смерти и повторного ИМ.
Эти фазы
могут соответствовать терапии на догоспитальном этапе, лечению в блоке
интенсивной терапии (БИТ) и ведению в постблоковой
палате. Часто эти задачи переплетаются, и любое разделение такого рода является
искусственным.
Неотложная помощь
Постановка диагноза
В первую
очередь должен быть установлен рабочий диагноз ОИМ. Этот диагноз основывается
на данных анамнеза (тяжелая загрудинная боль длительностью более 15 мин, не купирующаяся нитроглицерином). Но боль может быть
неинтенсивной, и часто наблюдаются одышка, слабость, потеря сознания, особенно
у пожилых пациентов. При этом важное значение для постановки диагноза имеют
наличие в анамнезе ишемической болезни сердца (ИБС), иррадиация боли в шею,
нижнюю челюсть или левую руку. Не существует индивидуальных физикальных
признаков, имеющих диагностическое значение при ОИМ, но у большинства пациентов
имеют место признаки активации вегетативной нервной системы (бледность,
холодный пот), а также гипотония или низкое пульсовое давление. Могут
выявляться неравномерность пульса, брадикардия, тахикардия, III тон сердца,
хрипы в базальных отделах. Необходимо как можно скорее снять ЭКГ. Даже в ранней
стадии ИМ параметры ЭКГ редко остаются в норме. Однако в первые часы ЭКГ часто
не поддается однозначной интерпретации, и даже при несомненном ИМ на ЭКГ может
не быть классических признаков подъема сегмента ST и появления нового зубца Q.
Поэтому необходимо повторное снятие ЭКГ и, если возможно, сравнение полученных
данных с предыдущими записями ЭКГ. Для выявления угрожающих жизни аритмий
необходимо как можно раньше начинать мониторирование ЭКГ у всех больных. Если
диагноз ИМ остается сомнительным, то важное значение приобретает быстрое
определение сывороточных маркеров. В трудных случаях диагностике могут помочь
эхокардиография (ЭхоКГ) и коронароангиография.
Таблица 2. Спектр
гемодинамических состояний при ИМ
|
Нормальное состояние
|
Нормальные АД, частота сердечных сокращений (ЧСС), частота дыхания
(ЧД), хороший периферический кровоток
|
|
Гипердинамическое состояние
|
Тахикардия, громкие тоны сердца, хорошее периферическое
кровообращение, терапия b-блокаторами
|
|
Брадикардия - гипотензия
|
"Теплая гипотензия", брадикардия, венодилатация,
нормальное центральное венозное давление, снижение тканевой перфузии. Обычно
возникает при нижнем ИМ, но может быть спровоцировано опиатами.
Эффективны применение атропина и электрокардиостимуляция
|
|
Гиповолемия
|
Веноконстрикция, низкое центральное венозное
давление, недостаточная перфузия тканей. Эффективна
инфузия жидкости
|
|
Инфаркт правого желудочка
|
Высокое венозное югулярное давление,
недостаточная перфузия тканей или шок желудочка,
брадикардия, гипотония. См. в тексте
|
|
Насосная недостаточность
|
Тахикардия, тахипноэ, низкое пульсовое давление, недостаточная перфузия тканей, гипоксемия, отек легких. См. в тексте
|
|
Кардиогенный шок
|
Очень низкая перфузия тканей, олигурия,
тяжелая гипотензия, низкое пульсовое давление, тахикардия, отек легких. См. в
тексте
|
Купирование боли, одышки и возбуждения
Купирование
боли имеет первостепенное значение не только из гуманных соображений , а еще и
потому, что боль сопровождается активацией симпатической нервной системы,
приводит к вазоконстрикции и увеличивает работу сердца. Чаще всего для этого
применяются внутривенные опиоиды - морфин или диаморфин (внутримышечных инъекций следует избегать). Может
понадобиться повторное их применение. Среди побочных реакций наблюдаются
тошнота, рвота, гипотония с брадикардией, угнетение дыхания. Для их
предотвращения одновременно с введением опиоидов возможно
применение противорвотных средств. Гипотония и брадикардия успешно разрешаются
с помощью атропина, а угнетение дыхания - с помощью налоксона,
который всегда надо иметь под рукой. Если применение опиоидов
не позволяет облегчить боль даже после их повторных инъекций, часто бывает
эффективным внутривенное введение b-блокаторов и нитратов. У
средних медицинских работников имеется ограниченный выбор ненаркотических опиоидов, применение которых отличается в разных странах.
Пациентам следует давать кислород. Особенно он показан больным с одышкой или
признаками сердечной недостаточности (СН) и шока.
Возбуждение
- это естественная реакция организма на боль и обстоятельства, сопровождающие
сердечный приступ. Важно успокоить больного и людей, его окружающих. Если
возбуждение становится чрезмерным, возможно применение транквилизаторов, но
обычно опиоидов бывает достаточно.
Схема 1. Руководство Европейского совета реаниматологов по лечению ФЖ
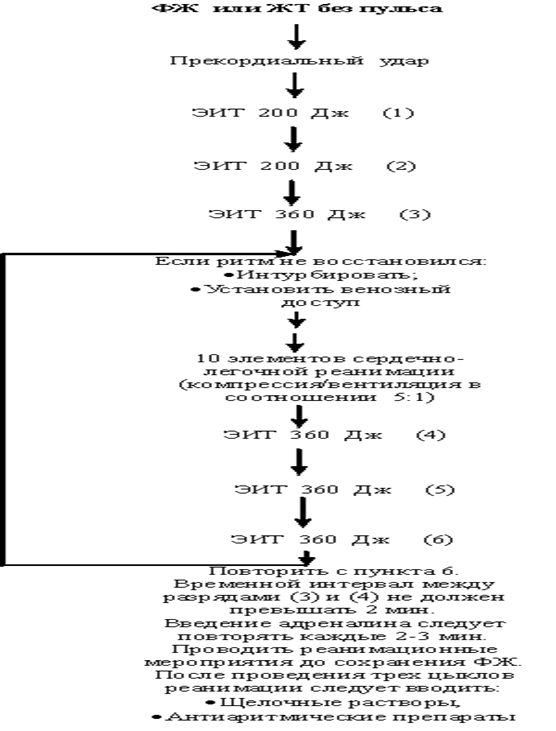
Остановка сердца
Основные способы поддержания жизни
Лицам, не
имеющим достаточного опыта или оснащения, основные мероприятия по поддержанию
жизни следует проводить согласно рекомендациям Европейского совета реаниматологов.
Расширенные способы поддержания жизни
Обученным и
тренированным лицам, имеющим неврачебное медицинское
образование, следует осуществлять расширенные меры реанимации, как описано в
руководствах Европейского совета реаниматологов.
Ранняя помощь
Восстановление
и поддержание проходимости артерии, окклюзия которой привела к инфаркту
миокарда.
Больным с
клиническими признаками ИМ и подъемом сегмента ST или блокадой ножки пучка Гиса
следует проводить мероприятия, имеющие целью восстановить кровоток в коронарных
артериях, как можно раньше.
Тромболитическая терапия (ТЛТ)
Доказательства
эффективности. В рандомизированных исследованиях, посвященных сравнению ТЛТ с контролем или одного метода данной терапии с другим,
участвовало более 100 000 больных. Несомненный эффект этого лечения показан для
больных, получавших лечение в первые 12 ч после появления симптомов ИМ.
При
проведении ТЛТ у пациентов в первые 6 ч после
появления симптомов при наличии подъема сегмента ST или блокады ножки пучка
Гиса можно предотвратить 30 смертей на 1000 леченых больных. Если лечение
начато в период от 7 до 12 ч, то можно предотвратить 20 смертей на 1000
больных. При начале лечения позже, чем через 12 ч, убедительных данных о его
пользе пока не получено.
Исследование
ISIS-2 продемонстрировало существенный дополнительный эффект от применения
аспирина: смертность при его комбинации с тромболитиками
уменьшилась на 50 смертей на 1000 леченых пациентов. Эффективность отмечалась
как при предварительном анализе результатов всей группы, так и при анализе
данных, полученных в различных подгруппах. Кроме этого, самая большая
абсолютная польза наблюдалась у больных группы наибольшего риска. Так, большее
количество жизней на 1000 леченых можно сохранить у больных с высоким риском -
пациентов старше 65 лет, больных, имеющих систолическое АД ниже 100 мм рт. ст.,
а также у пациентов с передним ИМ или признаками продолжающейся ишемии.
Время до
начала лечения. Чем быстрее начато лечение от момента появления симптомов, тем
больше пользы. При анализе результатов исследований, в которых больные были рандомизированы по введению тромболитика
на догоспитальном или госпитальном этапе, выявлено, что начало лечения лишь на
1 ч раньше может существенно уменьшить смертность. Но относительно малый объем
этих исследований не позволяет дать точную количественную оценку эффективности.
В обзоре по фибринолизу сообщается о прогрессирующем уменьшении выживаемости на
1,6 смертей за каждый час промедления на 1000 леченых пациентов. Этот расчет,
основанный на исследованиях, проведенных без рандомизации по времени до начала
лечения, следует интерпретировать с осторожностью, поскольку время до начала
лечения рандомизировать практически невозможно.
Риск
тромболизиса. ТЛТ имеет небольшой, но существенный
недостаток - развитие 3,9 инсультов на 1000 леченых больных, причем в первые
сутки от начала лечения. В большинстве своем эти инсульты связаны с внутричерепными
кровоизлияниями; более поздние инсульты чаще имеют тромботический или
эмболический генез. В более поздний период отмечена незначительная тенденция к
менее частому возникновению тромбоэмболических инсультов у леченных тромболитическими средствами. Часть этих инсультов (1,9 на
1000) развивается у тех больных, которые впоследствии умирают, и учитывается
при оценке общего снижения смертности. Таким образом, на 1000 леченых больных
развивается 2 случая нефатальных инсультов. Половина
из этих больных умеренно или тяжело инвалидизируется.
Риск инсульта варьирует с возрастом. Он значительно увеличивается у больных
старше 75 лет, а также у страдающих артериальной гипертонией (АГ). Другие
большие внечерепные кровотечения, требующие переливания крови или угрожающие
жизни, возникают у 7 из 1000 леченых пациентов. Не выявлено каких-либо
особенностей у подгруппы больных с избыточной кровоточивостью, но небольшие
исследования свидетельствуют о четкой связи между развитием больших гематом и
пункцией артерии или вены. Риск увеличивается, если пункция артерии проводится
при введении тромболитического препарата.
Введение
стрептокиназы (СК) или анистреплазы может сопровождаться гипотензией,
но тяжелые аллергические реакции возникают редко. Рутинное применение
гидрокортизона не показано. При возникновении гипотензии следует временно
приостановить инфузию, опустить изголовье кровати или поднять ножной конец.
Изредка может понадобиться введение атропина или внутрисосудистая инфузия плазмозаменителей.
Сравнение
тромболитических средств. Ни Международная исследовательская группа, ни Третье
международное исследование по выживанию при ИМ (ISIS-3) не выявили различий в
смертности между группами больных, получавших СК, тканевой активатор плазминогена (ТАП) или анистреплазу.
Кроме того, добавление подкожного введения гепарина не приводило к
дополнительному уменьшению смертности по сравнению с контролем. Однако в
исследовании GUSTO ( Глобальное использование
стрептокиназы и ТАП при окклюзии коронарной артерии) был применен ускоренный
метод введения ТАП за 90 мин (по сравнению с ранее принятым способом введения
за 3 ч). Сообщалось, что ускоренное введение ТАП и одновременное регулирование
активированного частичного тромбопластинового времени
(АЧТВ) с помощью внутривенного введения гепарина
позволяет сохранить 10 жизней на 1000 леченых больных. Риск возникновения
инсульта при применении ТАП или анистреплазы выше, чем при использовании СК. В
наблюдениях GUSTO зафиксированно
на 3 инсульта больше на 1000 леченых больных при ускоренном введении ТАП и
гепарина , чем при использовании СК и подкожном введении гепарина, и только
один из этих больных выживал с остаточным дефектом. При оценке общей
клинической пользы эти факты следует принимать в расчет наряду с уменьшением
смертности в группе ТАП. Выбор стратегии реперфузионной
терапии может зависеть от индивидуальной оценки риска, а также наличия
препарата и стоимости лечения.
В табл. 1 описаны часто применяемые способы введения
тромболитиков. Альтернативные способы и новые препараты могут оказаться лучше
этих методов, но их потенциальные преимущества еще не были изучены в больших
исследованиях.
Клинические показания. К настоящему времени
получены бесспорные доказательства несомненной пользы (снижение смертности и
заболеваемости) при быстром лечении ОИМ с помощью тромболитического
средства и аспирина, препаратов, дополняющих эффект друг друга. При наличии
соответствующего оборудования и тренированного медицинского и вспомогательного
персонала возможно догоспитальное введение тромболитика, если у больного имеются клинические признаки
ИМ, а на ЭКГ отмечается подъем сегмента ST или блокада ножки пучка Гиса.
При
отсутствии противопоказаний больных с ИМ, диагностированныом
на основании клинических проявлений и подъема сегмента ST или блокады ножки
пучка Гиса, следует немедленно начинать лечить аспирином и тромболитическим
средством с минимальной отсрочкой по времени. Если на первой ЭКГ нет четких
диагностических признаков, следует проводить частое или постоянное ЭКГ
мониторирование. Могут помочь быстрое определение ферментов крови, ЭхоКГ и иногда коронароангиография.
Реальной целью является начало проведения ТЛТ в
пределах 90 мин от момента обращения пациента за медицинской помощью (время
"от вызова до укола"). У больных с медленно развивающимся ИМ следует
оценивать серию ЭКГ и клинические данные, чтобы зарегистрировать возникающий ИМ
(быстрое определение кардиальных ферментов, если это возможно).
ТЛТ не следует проводить в следующих случаях:
• Если
потенциальная польза невелика - при нормальной ЭКГ, при наличии изменений
только зубца Т. У этих пациентов риск плохого прогноза ниже, чем риск
осложнений ТЛТ. В исследованиях не было доказано
пользы ТЛТ у больных, имеющих только одну депрессию
сегмента ST, даже при высоком риске. Однако возможность некоторой пользы от
применения тромболитиков у них не исключается.
• Если ИМ
произошел более 12 ч назад, даже при наличии признаков продолжающейся ишемии и
ЭКГ - критериев для тромболизиса.
Противопоказания для ТЛТ
Абсолютные:
• инсульт;
• недавняя
большая травма или хирургическая операция, а также травма головы в
предшествующие 3 нед;
•
желудочно-кишечное кровотечение в течение последнего месяца;
• известное
нарушение гемокоагуляции;
•
расслаивающаяся аневризма аорты.
Относительные:
• транзиторные ишемические атаки в предшествующие 6 мес;
• терапия
оральными антикоагулянтами - антивитаминами К (кумадином или варфарином);
• беременность;
• пункция
сосудов, не поддающихся внешней компрессии;
•
травматическая реанимация;
• рефрактерная гипертония (систолическое АД выше 180 мм рт. ст);
• недавняя
терапия сетчатки с помощью лазера.
Повторное введение тромболитика. При наличии доказательств реокклюзии или рецидива ИМ с повторным повышением сегмента
ST или развитием блокады левой ножки пучка Гиса следует вновь ввести тромболитик или провести ангиопластику.
СК или анистреплазу не следует вводить повторно в
период от 5 дней до, по крайней мере, 2 лет после первого введения любого из
этих лекарств. Антитела к СК сохраняются в организме по крайней мере в течение
2 лет в концентрациях, которые могут значительно снижать ее активность.
Введение альтеплазы (ТАП) и урокиназы
не приводит к образованию антител.
Дополнительная антитромботическая
и антитромбоцитарная терапия. Независимая и дополнительная
польза от приема аспирина описывалась выше. Механизм его действия остается
неясным. Непонятно, усиливает ли он действие тромболитика,
предотвращая реокклюзию, или ограничивает эффект
активации тромбоцитов на уровне микроциркуляции. В исследованиях по изучению
поздней реокклюзии показано, что аспирин был более
эффективным в плане предотвращения рецидива клинических эпизодов, чем в
отношении поддержания проходимости сосудов. При приеме первой дозы 150 - 160 мг
таблетку следует разжевать, в дальнейшем эту же дозу следует сразу проглатывать.
Применение
гепарина после тромболизиса, особенно после введения ТАП, широко изучалось.
Показано, что гепарин не улучшает немедленный лизис тромба, но проходимость
коронарных артерий после его внутривенного введения оказывается лучше. Не
выявлено разницы в степени проходимости коронарных артерий при подкожном и
внутривенном применении гепарина на фоне лечения СК. Было показано, что
длительное внутривенное введение одного гепарина, так же, как и подобное
введение гепарина с последующим назначением оральных антикоагулянтов, не смогли
предотвратить реокклюзию после ангиографически
подтвержденного успешного коронарного тромболизиса. Инфузия
гепарина после введения ТАП может быть прекращена через 24 - 48 ч. Обязательно
тщательное мониторирование гепаринотерапии: увеличение АЧТВ
свыше 90 с коррелирует с нежелательным риском
кровоизлияния в мозг. В исследовании ISIS-3 подкожное введение гепарина (12 500
ЕД 2 раза в день) не влияло на смертность при комбинации с аспирином и СК, дьютеплазой, или анистреплазой.
Таблица 3. Способы применения
ИАКФ в различных исследованиях
|
Исследование, препарат
|
Начальная доза
|
Максимальная суточная доза,
мг
|
|
CONSENSUS II, эналаприл
|
Эналаприлат 1 мг в/в в течение 2 ч,
далее 2,5 мг 2 раза в день, увеличивая дозу до 20 мг при переносимости
|
До 20
|
|
GISSI-3 лизиноприл
|
5 мг
|
До 10
|
|
ISIS-4, каптоприл
|
6,25 мг первоначально, далее 12,5 мг за 2 ч, 25 мг за 10 - 12 ч
|
До 50
|
|
CCS-1, каптоприл
|
6,25 мг первоначально, далее 12,5 мг за 2 ч при переносимости
|
до 12,5 3 раза
|
|
SMILE зофеноприл
|
7,5 мг первоначально, повторно через 12 ч, при переносимости доза
удваивалась
|
До 30 2 раза
|
|
AIRE, рамиприл
|
2,5 мг 2 раза в день, при переносимости дозу увеличивали до 5 мг 2
раза в день
|
До 5 2 раза
|
|
SAVE, каптоприл
|
6,25 мг первоначально, при переносимости дозу увеличивали до 25 мг 3
раза в день
|
До 50 3 раза
|
|
TRACE, трандолаприл
|
0,5 мг первоначально
|
До 4
|
<!DOCTYPE HTML
PUBLIC "-//IETF//DTD HTML//EN">
Чрескожная транслюминальная коронарная ангиопластика
(ЧТКА)
ЧТКА
в ранние часы ИМ может быть первичной, комбинированной с ТЛТ,
или "спасительной" после неудавшегося тромболизиса.
Первичная ангиопластика. Этот вид ЧТКА,
проводимой без предшествуюшего и сопутствующего
тромболизиса, возможен только при быстрой подготовке (в течение 1 ч)
лаборатории для катетеризации. Для этого необходима бригада, включающая не
только опытных кардиологов-интервенционистов, но и обученный вспомогательный
персонал. Это означает, что применение ЧТКА как
рутинного способа лечения больных, поступающих с клиническими симптомами и
признаками ОИМ, возможно лишь в больницах с оборудованием, отвечающим
требованиям интервенционной кардиологии. Если больной доставлен в стационар, не
имеющий соответствующей лаборатории, следует тщательно оценить возможную пользу
от ЧТКА по сравнению с риском, учитывая и риск,
связанный с отсрочкой начала лечения, вызванной транспортировкой пациента в
ближайшую лабораторию интервенционной кардиологии. ЧТКА
следует резервировать для больных, у которых польза от реперфузионной
терапии может быть большой, но и риск осложнений ТЛТ
высокий.
Первичная ЧТКА эффективна с точки зрения обеспечения и поддержания
проходимости коронарной артерии и позволяет избежать риска кровотечения при тромболизисе. Рандомизированные клинические исследования по
сравнению первичной ЧТКА и ТЛТ
свидетельствуют о более эффективном восстановлении проходимости, лучшей функции
левого желудочка (ЛЖ) и тенденции к лучшему
клиническому исходу при применении ангиопластики. ЧТКА
может играть особую роль в лечении шока.
У больных,
имевших противопоказания к ТЛТ, наблюдаются более
высокие заболеваемость и смертность по сравнению с пациентами, леченными тромболитиками. Первичная ЧТКА
может быть с успехом применена у большинства этих больных, но опыт ее
применения еще невелик, а эффективность и безопасность вне основных центров
может быть значительно ниже, чем в больших исследованиях. Необходимы большие
многоцентровые исследования.
Ангиопластика в сочетании с тромболизисом. Результаты выполнения ЧТКА немедленно после ТЛТ для
улучшения реперфузии и уменьшения риска реокклюзии не
оправдали ожиданий в ряде исследований, в которых была продемонстрирована
тенденция к увеличению риска осложнений и смерти. Поэтому рутинная ЧТКА после тромболизиса не может быть рекомендована.
"Спасительная" ангиопластика. В настоящее время есть
только одно исключение из этого общего правила - это "спасительная" ЧТКА, которая определяется как ЧТКА,
выполненная на коронарной артерии, просвет которой остается закрытым несмотря
на проведенную ТЛТ. Ограниченный опыт двух
рандомизированных исследований свидетельствует о тенденции в направлении
клинической эффективности в тех случаях, когда удается восстановить
проходимость окклюзированного сосуда с помощью ЧТКА. Хотя возможность успешной ЧТКА
высока, нерешенной проблемой остается оценка проходимости сосуда, которая может
быть только инвазивной.
Операция аортокоронарного шунтирования (АКШ)
Операция АКШ занимает очень ограниченное место в лечении острой
стадии ИМ. Однако она может быть показана в том случае, если ЧТКА не удалась, если произошла внезапная окклюзия
коронарной артерии во время катетеризации или ЧТКА
неосуществима. Ее можно выполнять в сочетании с оперативным вмешательством по
поводу дефекта межжелудочковой перегородки (МЖП) или
митральной регургитации вследствие дисфункции или разрыва папиллярной мышцы.
Насосная недостаточность миокарда и шок
Различные
гемодинамические ситуации, возникающие при ИМ, представлены в табл 2.
Сердечная недостаточность (СН)
Недостаточность
ЛЖ в остром периоде ИМ связана с плохим краткосрочным
и долгосрочным прогнозом. Клиническими признаками СН являются одышка, III тон
сердца и хрипы в легких, которые сначала отмечаются в базальных отделах, но
затем могут распространиться на оба легочных поля. Необходимо иметь в виду, что
значительный легочный застой может иметь место и без аускультативных признаков.
Поэтому у всех больных в остром периоде ИМ следует повторно проводить аускультацию сердца и легких наряду с исследованием других
жизненных функций.
Общие меры
включают мониторирование аритмий, выявление электролитных нарушений, а также
диагностику сопутствующих заболеваний, таких как клапанные дисфункции и болезни
легких. Легочный застой можно выявить с помощью переносного рентгеновского
аппарата. ЭхоКГ имеет важное значение в оценке
функции ЛЖ и определении ее механизмов, таких как
митральная регургитация, дефект МЖП, которые могут
приводить к развитию СН. В некоторых случаях дополнительную информацию для
лечения может дать коронароангиография.
Степень СН
может быть определена по классификации, предложенной Killip.
Класс 1: отсутствие
хрипов или III тона сердца.
Класс 2:
хрипы в легких распространяются на 50% легочных полей или выслушивается III тон
сердца.
Класс 3:
хрипы распространяются больше чем на 50% легочных полей.
Класс 4:
шок.
СН легкой и умеренной степени тяжести
Необходимо
наладить ингаляцию кислорода через маску или интраназально.
При этом требуется осторожность при наличии хронического заболевания легких.
При СН
легкой и умеренной степени часто эффективны диуретики, такие как фуросемид (10
- 40 мг внутривенно медленно, при необходимости инъекцию следует повторять
через 1 - 4 ч). При отсутствии должного эффекта показаны внутривенное введение
нитроглицерина и/или оральные нитраты. Дозу следует титровать под контролем АД,
чтобы избежать гипотензии. Назначение ингибиторов ангиотензин-конвертирующего
фермента (ИАКФ) возможно в последующие 24 - 48 ч при
отсутствии гипотензии или почечной недостаточности.
Тяжелая СН
Кислород и
петлевые диуретики назначают так, как описано выше. Если нет гипотензии,
следует приступить к внутривенному введению нитроглицерина, начиная с дозы 0,25
мкг/кг в минуту и увеличивая скорость каждые 5 мин до снижения АД на 15 мм рт.
ст. или до 90 мм рт. ст. Следует также рассмотреть возможность измерения
давления легочной артерии, давления заклинивания легочной артерии и сердечного
выброса с помощью плавающего мониторирующего катетера,
добиваясь снижения давления заклинивания ниже 20 мм рт. ст. и повышения
сердечного индекса выше 2 л/мин х м2.
Инотропную
терапию следует начинать при наличии гипотензии. Если преобладают признаки
почечной гипоперфузии, рекомендуется внутривенное
введение допамина в дозе 2,5 - 5,0 мкг/кг в 1 мин. При преобладании легочного
застоя следует вводить добутамин в начальной дозе 2,5 мкг/кг в 1 мин. Дозу
можно увеличивать каждые 5 - 10 мин до 10 мкг/кг в 1 мин или до достижения
клинического улучшения. Возможно также применение ИАКФ
и ингибиторов фосфодиэстеразы.
Следует
контролировать газовый состав крови. Может быть показано длительное
положительное давление на вдохе, если напряжение кислорода не удается
поддержать на уровне выше 60 мм рт. ст. несмотря на ингаляцию 100 % кислорода с
помощью маски со скоростью 8-10 л/мин и адекватное применение
бронходилататоров.
Кардиогенный
шок (КШ). КШ - это снижение систолического АД ниже 90 мм рт.ст. в сочетании с
признаками нарушения кровообращения, проявляющимися периферической
вазоконстрикцией, снижением образования мочи (менее 20 мл/ч) и спутанностью или
помутнением сознания.
Диагноз КШ
ставится при исключении других возможных причин гипотензии, таких как
гиповолемия, вазовагальные реакции, электролитные
нарушения, побочное действие лекарств или аритмия. КШ обычно развивается при
обширном повреждении ЛЖ, но может возникнуть и при ИМ
правого желудочка (обширном нижнем). Функцию ЛЖ
следует оценить с помощью ЭхоКГ, а гемодинамику - с
помощью плавающего мониторирующего катетера. Следует
добиваться снижения давления заклинивания по крайней мере до 15 мм рт.ст. и
повышения сердечного индекса до уровня более 2 л/мин х
м2. Для улучшения функции почек возможно назначение небольших доз
допамина - 2,5 - 5 мкг/кг в 1 мин - и дополнительное введение добутамина в дозе
5-10 мкг/кг в 1 мин.
Можно
предположить, что у больных при КШ развивается ацидоз, коррекция которого имеет
важное значение, так как в условиях ацидоза активность катехоламинов невелика.
Неотложная ЧТКА или хирургическое вмешательство могут спасти жизнь
больному, и их следует предпринимать как можно раньше. Поддерживающая терапия с
помощью баллонного насоса может быть важным лечебным мероприятием,
предшествующим этим вмешательствам.
Разрыв сердца и митральная регургитация
Разрыв свободной стенки левого желудочка
Это
осложнение развивается у 1 - 3% больных, госпитализированных по поводу ОИМ
(42). В 30 - 50% случаев разрыв происходит в первые сутки ОИМ и в 80 - 90% - в
первые 2 нед.
Острый
разрыв свободной стенки желудочка характеризуется сердечно-сосудистым коллапсом
с электромеханической диссоциацией, т.е. продолжающейся электрической
активностью при отсутствии сердечного выброса и пульса. Фатальный исход
наступает в течение нескольких минут и его не удается обратить посредством
стандартной сердечно-легочной реанимации. Лишь очень редко удается выполнить
хирургическое вмешательство.
Подострый
разрыв свободной стенки желудочка. Примерно в 25% случаев небольшие количества
крови достигают полости перикарда и вызывают прогрессирующее нарушение
гемодинамики. Клиническая картина может симулировать развитие повторного ИМ,
так как возникают боль, новый подъем сегмента ST, однако чаще развивается
внезапное нарушение гемодинамики с транзиторной или стойкой гипотензией.
Появляются классические признаки тампонады сердца, наличие которой можно
подтвердить с помощью ЭхоКГ. Необходимо немедленное
хирургическое вмешательство независимо от клинического состояния больного,
поскольку в большинстве случаев клиническая ситуация резко ухудшается.
Оперативное вмешательство выполняют с помощью бесшовной техники, описанной J.Padro и соавт., без подключения больного к аппарату
искусственного кровообращения.
Дефект межжелудочковой перегородки
Дефект МЖП развивается в остром периоде у 1 - 2% всех ИМ. Без
хирургического вмешательства смертность составляет 54% в первую неделю и 92% в
первый год. Диагноз, впервые заподозренный по появлению громкого систолического
шума в сочетании с тяжелым клиническим ухудшением, лучше всего подтверждается с
помощью ЭхоКГ и/или посредством определения
концентрации кислорода в правом желудочке (повышена). Шум может быть мягким или
отсутствовать. Некоторое улучшение при отсутствии КШ возможно при внутривенной
инфузии нитроглицерина, но наиболее эффективной является внутриаортальная
баллонная контрпульсация, служащая для поддержания кровообращения при
подготовке к операции. Единственный шанс выжить при дефекте МЖП
на фоне большого постинфарктного кардиосклероза и КШ больному дает оперативное
вмешательство. Основной целью раннего хирургического вмешательства является
надежное ушивание дефекта с помощью заплаты. Перед операцией желательно
провести коронарографию, при условии, что она не
ухудшит гемодинамику и не вызовет значительную отсрочку операции. При
необходимости устанавливают обходные шунты. Предвестниками плохого исхода
являются КШ, задняя локализация ИМ, дисфункция правого желудочка, пожилой
возраст и длительная отсрочка оперативного лечения. Госпитальная смертность
после операции составляет 25 - 60%, и у 95% выживших наблюдается СН I - II
класса по NYHA.
Митральная регургитация
В
большинстве случаев митральная регургитация после ИМ мягкая и носит транзиторный характер. Однако у небольшого числа больных
значительная острая регургитация является катастрофическим осложнением, которое
требует быстрой диагностики и хирургического лечения. Встречаемость умеренно
тяжелой или тяжелой митральной регургитации составляет 4%, а смертность без
хирургического лечения достигает 24%. Развитие митральной регургитации обычно
связано со значительным сужением как правой, так и левой огибающих коронарных
артерий с повреждением заднемедиальной папиллярной мышцы.
Неотложное
хирургическое лечение необходимо при развитии КШ или отека легких. При
подготовке к операции возможно установление внутриаортальной баллонной
контрпульсации. Если позволяет состояние больного, возможно выполнение коронароангиографии. При застойной СН можно попробовать
провести первичную катетеризацию и реперфузию окклюзированной артерии с помощью тромболизиса или ЧТКА.
Замена
клапана является процедурой выбора при дисфункции папиллярной мыщцы или ее разрыве, хотя у отдельных больных возможно
"поремонтировать" старый клапан. При
обструкции крупного сосуда показана реваскуляризация.
Аритмии и нарушения проводимости
Аритмии и
нарушения проводимости в ранние часы ИМ встречаются чрезвычайно часто. В
некоторых случаях, таких как желудочковая тахикардия (ЖТ) или фибрилляция
желудочков (ФЖ), они угрожают жизни и требуют немедленной
коррекции. Часто аритмии сами по себе не являются угрожающими для жизни, но
свидетельствуют о серьезных нарушениях, таких как продолжающаяся ишемия, гиперактивность вагуса или электролитные нарушения,
требующих коррекции. Необходимость лечения аритмий и его неотложность зависят в
основном от гемодинамических последствий нарушений ритма.
Желудочковые аритмии
Желудочковые
эктопические ритмы. Желудочковые эктопические сокращения встречаются почти у
всех больных в первый день ОИМ, наиболее часты сложные аритмии (политопные комплексы, короткие пробежки или феномен R-on-T). Их значение как предвестников ФЖ
спорно. ФЖ может развиваться настолько быстро, что
невозможно предпринять какие-либо профилактические меры, но нередко при наличии
этих предвестников серьезные аритмии не возникают.
Желудочковая
тахикардия. Короткие пробежки ЖТ могут хорошо переноситься и не требуют
лечения. Более продолжительные эпизоды могут вызвать гипотонию и СН. Средством
выбора является лигнокаин, но могут быть эффективны и
другие антиаритмические препараты. В качестве первичной дозы внутривенно вводят
1 мг лигнокаина на 1 кг массы тела больного, далее
половину этой дозы вводят повторно каждые 8 - 10 мин , максимальная доза
составляет до 4 мг/кг. Можно проводить внутривенную инфузию для предотвращения
рецидива. Электроимпульсная терапия (ЭИТ) показана, если ЖТ сопровождается нарушениями
гемодинамики.
Важно
отличать истинную ЖТ от ускоренного идиовентрикулярного ритма, обычно
безопасного последствия реперфузии, когда частота желудочковых сокращений не
превышает 120 в 1 мин.
Фибрилляция желудочков. Необходима немедленная
дефибрилляция. Если дефибриллятор не подготовлен, необходимо нанести удар
кулаком на область сердца. Рекомендации Европейского совета по реанимации
представлены на схеме 1.
Наджелудочковые аритмии
Трепетание предсердий развивается в 15 - 20%
случаев ИМ, часто на фоне тяжелого повреждения ЛЖ и
СН. Обычно оно купируется самостоятельно. Эпизоды могут длиться минуты - часы и
часто рецидивируют. Во многих случаях частота желудочковых сокращений невелика,
а аритмия хорошо переносится и не требует лечения. В других случаях, когда
частый ритм способствует возникновению или прогрессированию СН, необходима
быстрая коррекция. Применение дигоксина во многих случаях позволяет снизить ЧСС
, но для купирования аритмии более эффективен амиодарон. Можно применять ЭИТ,
но только в крайних случаях, так как возможны частые рецидивы.
Другие наджелудочковые аритмии возникают редко и обычно купируются самостоятельно. Они могут отвечать на массаж
каротидного синуса. При отсутствии противопоказаний эффективны
блокаторы, но применение верапамила противопоказано. ЭИТ
следует применять при плохой переносимости аритмии.
Синусовая брадикардия и блокада сердца
Синусовая
брадикардия (СБ) часто встречается в первый час ИМ,
особенно при его нижней локализации. В некоторых случаях развитие СБ связано с применением опиоидов.
Она может сопровождаться развитием тяжелой гипотензии. В этих случаях следует
назначать в вену атропин, начиная с дозы 0,3 - 0,5 мг и повторяя введение до
общей дозы 1,5 - 2,0 мг. Далее в ходе течения ИМ СБ
обычно является благоприятным признаком течения болезни и не требует специального
лечения. В редких случаях она может сопровождаться гипотензией.
При отсутствии реакции на атропин может потребоваться временная электрокардиостимуляция
(ЭКС).
Атриовентрикулярная
блокада (АV-блокада) I степени не требует лечения.
АV-блокада II степени 1-го типа (Wenkebach) обычно
развивается при нижнем ИМ и редко вызывает серьезные гемодинамические
нарушения. При их возникновении сначала следует назначить атропин, при
отсутствии эффекта показана ЭКС.
AV-блокада
II степени 2-го типа (Mobitz) и полная AV-блокада
являются показаниями для постановки электрода для ЭКС.
Стимуляцию следует проводить в тех случаях, когда медленный ритм сердца
является причиной гипотонии или СН. При тяжелом нарушении гемодинамики
необходимо предпочесть последовательную стимуляцию предсердий и желудочков.
Асистолия
может развиться после AV-блокады, би - или трифасцикулярной блокады или ЭИТ. Если внутрикардиальный
электрод к этому моменту установлен, необходимо попытаться произвести ЭКС. В противном случае следует начинать непрямой массаж
сердца, прибегнуть к искусственной вентиляции легких и наружной стимуляции.
Трансвенозный электрод для ЭКС следует устанавливать, как
уже обсуждалось ранее, при наличии прогрессирующей AV-блокады, при развитии би- или трифасцикулярной блокады.
Многие кардиологи предпочитают подключичный доступ, но его следует избегать при
проведении тромболизиса или применении антикоагулянтов. В этих случаях следует
использовать альтернативные способы постановки электрода.
Профилактическая терапия в остром периоде ИМ
Аспирин. Убедительные данные об эффективности аспирина были
получены в исследовании ISIS-2, в котором было показано, что полезные эффекты
аспирина и СК дополняют друг друга. В этом исследовании, в которое было
включено более 17 000 больных, первая доза аспирина составляла 160 мг и
таблетку пациенты разжевывали и далее ежедневно аспирин в этой же дозе
проглатывали. Смертность в группе больных, леченных аспирином, составила 9,4%
против 11,8% в группе больных, получавших плацебо.
Аспирин был эффективен как в группе с ТЛТ, так и без
нее. При обзоре всех исследований, посвященных изучению влияния аспирина,
отмечено дополнительное уменьшение смертности на 29% при 11,7% сосудистой
смертности в группе плацебо и 9,3% в группе
получавших аспирин, что составляет 24 спасенных жизни на 1000 леченых. В группе
леченых наблюдалось несколько большее число нефатальных
инсультов и нефатальных повторных ИМ.
Есть
несколько противопоказаний к назначению аспирина. Его не следует применять при
наличии гиперчувствительности, кровоточащей язве желудка, заболеваниях крови
или тяжелом заболевании печени. Аспирин может случайно спровоцировать
бронхоспазм у больных астмой. В отличие от ТЛТ нет
четких доказательств зависимости между эффективностью и временем от появления
симптомов до начала лечения. Тем не менее, аспирин следует назначать всем
больным с острой коронарной патологией как можно скорее после постановки
диагноза. Эти больные составляют 85 - 95% всех больных с ОИМ.
Антиаритмические препараты. Было показано, что лигнокаин может уменьшить частоту возникновения ФЖ в остром периоде ИМ, однако этот препарат значительно
увеличивает риск асистолии . Метаанализ 14
исследований показал недостоверное увеличение смертности среди больных,
леченных лигнокаином, по сравнению с таковой в контрольной
группе. В связи с этим профилактическое применение данного препарата не
рекомендуется.
-Блокаторы. Было предпринято много
исследований по изучению внутривенного применения блокаторов в
остром периоде ИМ. Блокаторы способны ограничить размер ИМ,
уменьшить количество фатальных аритмий и облегчить боль. Исследование ISIS-1, в
котором атенолол вводили внутривенно 16 000 больных, выявило значительное
уменьшение смертности за 7 дней (на 15%, 2Р<0,05). Недельная смертность в
группе плацебо составила 4,6%.
Это
позволяет предполагать, что в исследование были включены больные с невысоким
риском. Pooling, проанализировав 28 исследований,
посвященных изучению эффекта внутривенного введения блокаторов,
выявил абсолютное уменьшение смертности за 7 дней с 4,3% до 3,7%, что
соответствовало 6 спасенным жизням на 1000 больных, леченных в этой группе. Неясно,
сохраняется ли этот эффект у больных с более высоким риском.
Эти
исследования проводились в дотромболитическую эру. Только одно большое
исследование по внутривенному применению блокаторов было
предпринято со времени начала широкого использования тромболитических средств -
TIMI-IIB. Однако количество наблюдений в нем было
недостаточным для того, чтобы делать окончательное заключение. Как будет
обсуждаться позднее, блокаторы в остром периоде ИМ во многих
странах применяют нечасто. Целесообразно шире применять внутривенные
блокаторы при тахикардии (в отсутствие СН), относительной гипертонии
или боли, не отвечающей на введение опиоидов. Было бы
разумно проверять реакцию пациента на это лечение, применяя в первый раз
короткодействующие препараты.
Нитраты. Метаанализ 10
исследований по раннему внутривенному введению нитратов , общее число участников
которых составляло 2041, показал уменьшение смертности на одну треть. Каждое
исследование было небольшим, всего в них зарегистрировано 329 летальных исходов.
Хотя результаты были достоверными и значимыми, они имели широкий интервал
достоверности. В исследовании GISSI-3 также изучалось и внутривенное введение
нитратов с последующим чрескожным их применением у 19
394 больных. Значительного уменьшения смертности не наблюдалось. Эти данные
следует оценивать осторожно, поскольку 44% больных из контрольной группы также
получали нитраты внутривенно. Исследование ISIS-4, в котором мононитрат назначали перорально в
острую фазу и далее в течение месяца, также не показало его эффективности. Не
было показано эффекта в исследовании ESPRIM, в
котором использовали молсидомин, донатор окиси азота.
Однако как в ISIS-4, так и в ESPRIM частое раннее
применение внутривенных нитратов в контрольной группе создает проблемы при оценке
их эффективности. Все изложенное позволяет говорить о том, что убедительных
данных о пользе рутинного применения нитратов в остром периоде ИМ не имеется.
Антагонисты кальция. Метаанализ
исследований по применению антагонистов кальция в раннем периоде ОИМ выявил
незначительную отрицательную тенденцию. В остром периоде ИМ нет необходимости
применять антагонисты кальция с профилактической целью.
Ингибиторы ангиотензин-конвертирующего
фермента (ИАКФ). Сейчас хорошо известно, что их следует
применять на более позднем госпитальном этапе у больных со сниженной фракцией
выброса (ФВ) или у больных с СН в раннюю фазу (см. ниже). Исследования GISSI-3,
ISIS-4, а также китайское исследование CCS-1 показали, что ИАКФ
при назначении в первые сутки ОИМ уменьшают смертность в последующие 4 - 6 нед в небольшой, но значимой степени. Однако в исследовании
CONSENSUS-2 такого эффекта не наблюдалось. Это могло быть следствием
случайности или того обстоятельства, что лечение начинали с внутривенного
введения препарата. Систематический анализ исследований по применению ИАКФ в ранние сроки ИМ свидетельствует о том, что лечение
этими препаратами приводит к сохранению 4,6 жизней на 1000 леченых больных.
Хотя считается, что анализ в подгруппах ненадежен, есть основания полагать, что
эта терапия особенно важна для больных группы высокого риска, т.е. поступающих
с клинической картиной СН или с повторным ИМ. Вероятно, польза от применения ИАКФ зависит от класса препарата. Способы назначения ИАКФ, применявшиеся в исследованиях, представлены в табл. 3.
Существуют различные мнения о том, назначать
ли ИАКФ всем больным (у которых нет противопоказаний)
в первый день, или начинать лечение лишь в определенных группах больных и
несколько позже. По мнению авторов этого руководства, у обеих сторон есть
серьезные аргументы. Конечно, применять эти препараты следует, если клинические
проявления СН не исчезают при проведении обычной терапии.
Магнезия. Метаанализ исследований
по применению магнезии при ОИМ свидетельствует об определенной пользе ее,
однако более позднее исследование ISIS-4 не подтвердило этих данных. По общему
мнению исследователей, режим применения магнезии в ISIS-4 не был оптимальным, и
все же в настоящее время нет достаточных оснований рекомендовать этот препарат
для рутинного применения.
Лечение специфических типов ИМ
Подозрение на ИМ без подъема ST или блокады ножки
пучка Гиса
Многие
пациенты поступают с симптомами, подозрительными на ОИМ, но без наличия ЭКГ-признаков: подъема сегмента ST или блокады ножки пучка
Гиса, служащих показанием для ТЛТ. У некоторых из
этих больных развивается в дальнейшем ИМ с зубцом Q (Q - ИМ), у других - ИМ без
зубца Q (не - Q - ИМ). Многим больным ставят диагноз нестабильной стенокардиии. Существенной части этих больных в дальнейшем
ставят диагноз стабильной стенокардии, а у части больных последующий диагноз не
содержит указаний о поражении сердца. Лечение будет зависеть от обоснованности
предположения на наличие ИМ. Если у больного раньше был ИМ, если имеют место
четкие изменения сегмента ST и зубца T, но не подъем ST или появление нового
зубца Q, если симптомы и клиническая картина свидетельствуют об остром
коронарном синдроме, пациента следует внимательно наблюдать, снимать повторно
ЭКГ, контролировать активность ферментов крови. При отсутствии противопоказаний
этим больным следует назначить аспирин и рассмотреть вопрос о назначении
гепарина и блокаторов. При рецидивировании
боли в грудной клетке следует применять нитраты, а при тяжелых болях - опиоиды. Если боль продолжается или повторяется несмотря на
это лечение, следует подумать о коронароангиографии с
дальнейшей ангиопластикой или оперативным вмешательством.
Схема 2. Стратегии оценки риска
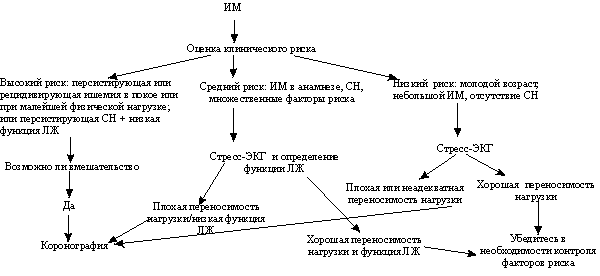
Не - Q - ИМ
Не - Q - ИМ
- это ИМ с характерной клинической картиной и изменениями ферментов, но без
зубца Q на ЭКГ. Частота не - Q - ИМ составляет 20-40% всех ИМ и может
увеличиваться по отношению к Q - ИМ. Эта вариабельность может быть связана с
применением реперфузионной терапии и/или более
чувствительной техникой определения ферментов.
Госпитальная летальность в этих случаях
значительно ниже, чем при Q - ИМ. В то же время долгосрочная летальность и
частота острых коронарных приступов после выписки из стационара при не - Q - ИМ
выше, так что показатели смертности через 3 - 5 лет выравниваются. Часто
выявляют резидуальную ишемию (на 50-90% больше, чем
при Q - ИМ).
Маркеры риска. Исходная и персистирующая депрессия сегмента
ST, осложнения в остром периоде ИМ, постинфарктная стенокардия с изменениями на
ЭКГ, рецидив ИМ и невозможность провести стресс-тест (тест с дозированной
физической нагрузкой) связаны с более высокой смертностью. Ограниченный стресс
- тест следует выполнять, как при Q - ИМ, но более чувствительными и
специфичными могут быть сцинтиграфия с таллием и
стресс - ЭхоКГ, позволяющие обнаружить, высчитать и
локализовать ишемизированный миокард при бессимптомном не - Q - ИМ.
Лечение. Приведет ли возникшая ишемия миокарда к развитию Q
- ИМ или завершится как не - Q - ИМ, станет ясно лишь через несколько дней
наблюдения. Таким образом, при поступлении в БИТ не следует делать различий
между этими двумя группами больных. ТЛТ особенно
показана больным с подъемом сегмента ST вследствие обширной ишемии, являющейся
результатом окклюзии коронарной артерии. Исследования ISIS-2 и GISSI показали отсутствие снижения смертности при ТЛТ у больных с ИМ и депрессией сегмента ST при
поступлении; у этих больных, видимо, не происходит полной окклюзии коронарной
артерии. Последнее исследование TIMI IIIB
подтверждает отсутствие значимого положительного влияния применения ТАП на
смертность или возникновение повторного ИМ при не - Q - ИМ.
Антитромботическая терапия аспирином перорально
и гепарином внутривенно уменьшает частоту возникновения повторного ИМ и число
летальных исходов. ТЛТ может предотвратить развитие Q
- ИМ только у больных с подъемом сегмента ST.
Два
небольших исследования дали основание предположить, что дилтиазем
уменьшает частоту только ранних, но не всех повторных ИМ. Однако необходимо
дальнейшее изучение данного вопроса, прежде чем этот препарат будет
рекомендован к применению при не - Q - ИМ. Специальных исследований по
применению блокаторов при не-Q-ИМ не
проводилось. Ретроспективный анализ группы больных с не-Q-ИМ
в больших исследованиях не позволяет сделать какое-либо определенное заключение.
Раннее инвазивное вмешательство - системная коронароангиография
и реваскуляризация в первые 48 часов - изучалось в
исследовании TIMI IIIB. Никаких различий в уровне
смертности, частоте повторных ИМ или положительного стресс-теста
в первые 6 нед по сравнению с таковыми в группе
больных, получавших консеративную терапию, отмечено
не было.
О реваскуляризации следует думать уже тогда, когда
зафиксирована спонтанная или провоцируемая ишемия, в этом случае показана коронароангиография. В настоящее время нет данных больших
контролированных исследований, в которых изучался бы долгосрочный эффект
медикаментозного лечения, ЧТКА или хирургического
вмешательства у больных с не-Q-ИМ и остаточной
ишемией. ЧТКА пораженного сосуда безопасна и
эффективна в плане облегчения стенокардии и рецидивирующей ишемиии,
но у многих больных после не-Q-ИМ обнаруживают
многочисленные или тяжелые стенозы коронарных артерий, при которых предподчительно хирургическое лечение.
Инфаркт правого желудочка
Распознавание
ИМ правого желудочка очень важно, так как он также может проявляться КШ. Однако
стратегия лечения при этом отлична от лечения шока, возникающего из-за тяжелой
дисфункции ЛЖ.
ИМ правого
желудочка можно заподозрить при наличии специфичной клинической триады -
гипотензии, чистых легочных полей и повышенного центрального венозного давления
у больных с нижним ИМ. Подъем сегмента ST в V4R с большой
вероятностью подтверждает диагноз. Это отведение следует снимать во всех
случаях шока, если это не делается рутинно. Наличие зубца Q и подъема сегмента
ST в V1-3 также подтверждает диагноз.
Если ИМ
правого желудочка проявляется гипотензией и шоком,
важно поддержать давление правого желудочка. Желательно избегать применения
вазодилататоров - опиоидов, нитратов, диуретиков и ИАКФ. Во многих случаях эффективно внутривенное введение
жидкостей . При этом сначала раствор следует вводить быстро, например, со скоростью
200 мл за 10 мин. Может потребоваться 1 - 2 л физиологического раствора в
первые несколько часов, в дальнейшем его обычно вводят со скоростью 200 мл/ч.
Во время инфузии следует проводить тщательный гемодинамический мониторинг. Если
сердечный выброс не увеличивается при этом методе лечения, следует вводить добутамин.
ИМ правого
желудочка часто осложняется трепетанием предсердий. Это нарушение ритма следует
быстро устранять, так как вклад предсердия в наполнение правого желудочка имеет
важное значение. Аналогично следует действовать, если развивается полная
поперечная блокада. Необходимо стимулирование из обеих камер. Существуют сомнения
относительно эффективности ТЛТ при ИМ правого
желудочка, но ее несомненно стоит проводить при наличии гипотензии.
Альтернативой является прямая ангиопластика, которая также может привести к
быстрому гемодинамическому улучшению.
ИМ у больных сахарным диабетом
Среди
больных диабетом, у которых развивается ИМ, наблюдается высокая смертность.
Контроль уровня гликемии с помощью инсулина призван уменьшить долгосрочную
летальность. Диабет не является противопоказанием к ТЛТ
даже в присутствии ретинопатии.
Дальнейшее ведение больного на госпитальном этапе
Общие правила
Большинство
больных должны соблюдать постельный режим в течение 12 - 24 ч в тех случаях,
когда выявляются осложнения ИМ. При неосложненном
течении болезни пациент может сидеть в постели к концу первых суток,
пользоваться стульчаком, самостоятельно есть и умываться. Встать с постели
можно уже на следующий день. Больные могут ходить по квартире до 200 м и через
несколько дней вверх по лестнице. При наличии СН, КШ или серьезных аритмий
больные должны соблюдать постельный режим дольше, а их физическая активность
должна увеличиваться постепенно, в зависимости от симптоматики и степени
повреждения миокарда.
Тромбоз глубоких вен и эмболия легких
Эти
осложнения после ИМ встречаются относительно редко, исключение составляют
больные с СН, долго находящиеся на постельном режиме. Осложнения можно
предотвратить с помощью гепарина. Если они все-таки развиваются, следует
назначать гепарин и затем оральные антикоагулянты в течение 3 - 6 мес .
Внутрижелудочковые тромбы и системная эмболия
ЭхоКГ позволяет во многих случаях выявить внутрижелудочковые
тромбы, особенно при больших передних ИМ. Если тромбы подвижны или
увеличиваются, на них следует воздействовать с помощью гепарина с последующим
назначением оральных антикоагулянтов в течение 3 - 6 мес
.
Перикардиты
Острый перикардит может осложнять течение ИМ,
проявляясь болью в грудной клетке, которую можно ошибочно принять за рецидив ИМ
или стенокардию. Боль, однако, отличается острым характером и связью с
положением тела и дыханием. Диагноз может быть подтвержден выслушиванием шума
трения перикарда. Если боль причиняет беспокойство, следует назначать большие
дозы аспирина перорально или внутривенно,
нестероидные противовоспалительные средства или стероиды.
Геморрагический выпот с тампонадой нехарактерен для ИМ и обычно связан с
антикоагулянтной терапией. Его можно распознать с помощью ЭхоКГ.
При геморрагическом выпоте проводится перикардиоцентез.
Поздние желудочковые аритмии
ЖТ и ФЖ, возникающие в первый день болезни, лишь в небольшой
степени ухудшают прогноз. Если эти аритмии развиваются позже, они склонны к рецидивированию и связаны с высоким риском смерти. Частично
это обусловлено исходным тяжелым повреждением миокарда. В связи с этим
необходимо тщательно оценивать анатомию коронарных сосудов и функцию ЛЖ. Если это сделать трудно, то возможны различные
терапевтические подходы, которые пока мало изучены. Сюда относятся применение
блокаторов, амиодарона и антиаритмическая терапия под контролем
электрофизиологического исследования. В некоторых случаях возможна имплантация кардиовертера - дефибриллятора.
Постинфарктная стенокардия и ишемия
Мягкая
стенокардия, возникающая у больных, перенесших ИМ, может хорошо поддаваться
обычному медикаментозному лечению. Вновь возникшая стенокардия, особенно
стенокардия покоя, в раннем постинфарктном периоде требует дальнейшего
обследования.
Эффект
рутинного применения избирательной ЧТКА после ТЛТ сравнивали с результатами консервативного подхода в
нескольких рандомизированных исследованиях. Можно заключить, что рутинная ЧТКА в отсутствие спонтанной или провоцируемой ишемии не
улучшает ни функцию ЛЖ, ни выживаемость. ЧТКА играет определенную роль в лечении стенокардии или
рецидивирующей ишемии, возникшей вследствие реокклюзии
или резидуального стеноза. Она может иметь значение в
лечении аритмий, связанных с персистирующей ишемией. Хотя анализ нескольких
исследований показал, что проходимость сосуда, кровоснабжающего
зону ИМ, является маркером хорошего долгосрочного исхода, не показано, что
поздняя ЧТКА, произведенная с целью восстановления
проходимости артерии, влияет на поздний прогноз.
АКШ
может быть показано при невозможности контролировать симптомы другими
способами. Оно требуется и тогда, когда при коронарографии
выявлен стеноз левой главной коронарной артерии или стеноз трех сосудов с
низкой функцией ЛЖ. Оперативное вмешательство в этих
случаях улучшает прогноз.
Оценка степени риска, реабилитация и вторичная
профилактика
Оценка риска
Перед
выпиской необходимо определить прогноз, решить вопрос о дальнейших
исследованиях и помочь в выборе наилучшей терапевтической стратегии. У больных,
переживших острые события, степень риска зависит от клинических данных,
возраста, наличия исходных факторов риска, предшествующего ИМ, сахарного
диабета, гемодинамического статуса и аритмий в остром периоде ИМ и, частично,
от результатов функциональных проб.
Определение степени клинического риска
Клинический
риск подразделяют на высокий, промежуточный или низкий. Это важно, так как
количество необходимых исследований зависит от оценки возможности
положительного результата перед проведением теста.
Группа высокого риска. К больным наивысшего риска
относятся пациенты с персистирующей СН, выраженным нарушением функции ЛЖ, рано появившейся стенокардией покоя или стенокардией
при минимальных физических нагрузках, рецидивирующей аритмией, а также
пациенты, неспособные выполнить тест с нагрузкой перед выпиской. Эти больные
чаще всего относятся к старшей возрастной группе, у них много факторов риска, в
анамнезе обычно имеется ИМ. Функцию ЛЖ следует
оценивать с помощью ЭхоКГ и/или сцинтиграфии. Коронароангиография позволяет обеспечить независимую
прогностическую информацию и помогает выбрать дальнейшее лечение, в том числе и
реваскуляризацию.
Группа среднего риска. Больные группы среднего
риска часто старше 55 лет, имеют преходящую СН, перенесли раньше ИМ или имеют
такие факторы риска, как АГ или диабет. У этих больных следует оценивать
дисфункцию ЛЖ и резидуальную
ишемию. Последнюю можно оценить с помощью стресс - ЭКГ, радиоизотопной
вентрикулографии на фоне нагрузки, или стресс - ЭхоКГ
в зависимости от разрешающей способности аппарата. Больным с нарушением функции
ЛЖ и/или индуцируемой ишемией желательно провести
ангиографию. Этот подход к оценке среднего риска представлен на схеме 2.
Группа низкого риска. Эти больные моложе 55 лет, у
них нет ИМ в анамнезе, клиническое течение ИМ без осложнений. Наиболее полезным
исследованием у этих больных является стресс - ЭКГ. Она может быть проведена в
виде пробы с субмаксимальной физической нагрузкой
перед выпиской или как тест на тредмиле или на велоэргометре через 3 - 8 нед после ИМ. Изменения в виде резидуальной
ишемии миокарда, вызываемой нагрузкой, не влияют на смертность.
Больных,
которые не смогли выполнить необходимую нагрузку при стресс - тесте, у которых
развился приступ стенокардии или тяжелая одышка или на ЭКГ имеются признаки
ишемии, следует расширенно обследовать. Для больных, выполнивших третью стадию
стандартного протокола Bruce или его эквивалента без
возникновения боли в грудной клетке или ишемических изменений на ЭКГ, прогноз
оптимистичен. Кроме того, эти исследования оказывают положительное влияние на
психологическое состояние больного и полученная информация полезна в
планировании реабилитации. Нет необходимости прекращать лечение перед
выполнением теста.
Оценка ишемии
Больных,
которые не смогли достичь адекватной нагрузки при стресс-тесте,
у которых развилась стенокардия или появились ЭКГ- признаки ишемии при средней
нагрузке, следует расширенно обследовать с целью оценки локализации места и
объема миокарда в зоне риска, а также размеров потенциально жизнеспособного
миокарда. Выбор между стресс-ЭхоКГ и радиоизотопной вентрикулографией зависит от опыта и возможностей
конкретного центра. В опытных руках оба этих метода более чувствительны и
специфичны, чем стресс- ЭКГ.
Оценка насосной функции миокарда
Оценка
поражения сердца с помощью ЭхоКГ или радиоизотопной
вентрикулографии помогает выделить больных без признаков СН, особенно если
исследования проводятся в условиях стресс-теста.
Однако известно, что функция ЛЖ у больных группы
низкого риска хорошо сохраняется.
Оценка риска аритмий
При
обследовании больных с высоким риском аритмий имеют значение холтеровское мониторирование ЭКГ и электрофизиологическое
исследование. Было обнаружено, что после ИМ колебания ЧСС, дисперсия QT,
чувствительность барорефлексов и поздние потенциалы имеют прогностическое
значение . Чтобы выяснить, смогут ли эти показатели существенно повлиять на
обычные прогностические тесты, необходимы дальнейшие наблюдения.
Оценка метаболических маркеров риска
Важно
оценить такие метаболические маркеры, как уровень общего холестерина,
холестерина липопротеидов низкой и высокой плотности, триглицеридов и глюкозы
плазмы.
Показания для коронароангиографии
В раннем
постинфарктном периоде коронароангиографию следует
проводить при наличии:
•
стенокардии, не поддающейся медикаментозному лечению;
•
стенокардии или ишемии миокарда в покое;
•
стенокардии или ишемии миокарда при выполнении низкой нагрузки во время стресс-теста или при холтеровском мониторировании
ЭКГ на фоне нормальной ЧСС или ее небольшого увеличения.
Целесообразность
коронароангиографии следует оценить при наличии:
• стенокардии или провоцируемой ишемии миокрада;
•
постинфарктной стенокардии, поддающейся медикаметозному
лечению;
• тяжелой
дисфункции ЛЖ;
• сложной
желудочковой аритмии, возникшей позже, чем через 48 ч после начала
ИМ.
В отдельных
случаях, особенно у молодых пациентов, о коронароангиографии
следует подумать при неосложненном течении ИМ для
оценки успеха реперфузии, выявления больных с тяжелым поражением коронарных
артерий и ускорения выписки из больницы и возвращения к работе.
Реабилитация
Целью
реабилитации является максимально возможное возвращение пациента к полноценной
жизни. Она включает в себя физические, психологические и
социально-экономические факторы. Процесс реабилитации должен начинаться как
можно раньше после поступления в стационар и продолжаться в последующие недели
и месяцы. Детали реабилитации в нашем руководстве обсуждаться не будут,
поскольку полностью ее принципы и методы рассмотрены в докладе рабочей группы
по реабилитации Европейского общества кардиологов.
Психологические
и социально-экономические аспекты. Как пациенты, так и их родственники
обеспокоены, и это неизбежно. Важное значение имеют убеждение и объяснение
природы заболевания, требующие от врача большого такта. Необходимо также
предупреждать возникновение депрессии и раздражительности, что чаще всего имеет
место по возвращении домой. Следует признать, что больные часто отрицают
наличие болезни. Если в острую фазу это может играть защитную роль, то в
дальнейшем может затруднить осознание больным своего диагноза.
Вопрос о
возвращении к работе и другим видам активности следует обсуждать с больным
перед выпиской из стационара.
Советы
относительно образа жизни. С больными и их родственниками следует обсуждать
возможные причины ИБС и давать индивидуальные советы, касающиеся здорового
питания , контроля массы тела, отказа от курения и оптимизации физической
нагрузки.
Физическая активность. Всем пациентам следует
давать рекомендации относительно возможной физической активности с учетом
степени восстановления после ангинозного приступа, возраста больного, уровня
его физической активности до ИМ и наличия физических ограничений. При этом
большую помощь может оказать стресс-тест перед выпиской, который не только дает
важную клиническую информацию, но может успокоить взволнованного больного. Метаанализ эффективности реабилитационных программ,
включающих физические упражнения, свидетельствует о снижении смертности при их
реализации.
Вторичная профилактика
Курение. Несмотря на отсутствие рандомизированных
исследований, данные обзорных исследований несомненно свидетельствуют о том,
что смертность среди больных, прекративших курить, составляет в последующие
годы меньше половины смертности тех, кто курить продолжал. Вероятно,
прекращение курения является наиболее эффективной из всех мер вторичной
профилактики, и на это должны быть направлены наибольшие усилия. Большинство
пациентов в остром периоде ИМ не курят, поэтому период реконвалесценции
является идеальным для того, чтобы помочь курильщикам отказаться от этой
вредной привычки. Возобновление курения обычно происходит по возвращении
пациента домой, поэтому в период реабилитации ему необходимы поддержка и совет.
Рандомизированное исследование продемонстрировало
эффективность программы примера медиков; протокол отказа от курения должен быть
принят каждым госпиталем.
Диета и пищевые добавки. Имеется мало доказательств
эффективности диетического лечения постинфарктных больных. Больным с избыточной
массой следует рекомендовать диету для ее снижения. Всем пациентам следует рекомендовать
диету с низким содержанием насыщенных жирных кислот, включающую много фруктов и
овощей. В одном исследовании было показано, что употребление жирной рыбы по
крайней мере 2 раза в неделю уменьшает риск смерти и повторного ИМ. Роль
антиоксидантов в предотвращении ИБС до сих пор не установлена.
Антитромботическая и антикоагулянтная терапия. Метаанализ,
проведенный Antiplatelet Trialists
Collaboration, показал уменьшение повторного ИМ и
смертности у постинфарктных больных, получавших аспирин, примерно на 25%. В
проанализированных исследованиях доза аспирина составляла от 75 до 325 мг в
день с учетом того, что меньшие дозы аспирина дают меньше побочных эффектов.
Клинические
исследования, проведенные до начала широкого применения аспирина, показали, что
оральные антикоагулянты эффективны в плане предотвращения повторного ИМ и
смерти у выживших после ИМ. Больные в этих исследованиях были рандомизированы через 2 нед после
перенесенного ИМ. Роль раннего рутинного назначения оральных антикоагулянтов
после ИМ менее ясна, и она оценивалась у больных, получавших ТЛТ. Не было получено четких доказательств преимущества оральных
антикоагулянтов перед антиагрегантной терапией. Возможно, что отдельные группы
больных (имеющие аневризму ЛЖ, мерцание предсердий,
доказанный эхокардиографически тромб ЛЖ) могут выиграть от раннего применения антикоагулянтов,
но большие рандомизированные исследования в этом направлении не проводились.
Этим пациентам также может помочь амбулаторное применение подкожного гепарина,
но это еще требует подтверждения в дальнейших исследованиях.
Комбинированная
антикоагулянтная и антиагрегантная
терапия после ИМ в настоящее время изучается; первые полученные результаты
обнадеживают/
b-Блокаторы. Несколько исследований и метаанализ
показали, что b-блокаторы
снижают смертность и частоту повторных ИМ у перенесших ОИМ на 20 - 25%.
Положительные данные были получены при применении пропранолола,
метопролола, тимолола, ацебутолола. Небольшие по объему исследования с применением
других b-блокаторов
дают сходные результаты. Примерно 25% больных b-блокаторы
противопоказаны вследствие неконтролируемой СН, болезней органов дыхания или по
другим причинам. Более половины оставшихся - больные группы низкого риска,
которым b-блокаторы
дают минимальную пользу при возможности возникновения неприятных побочных
эффектов. Вопрос о том, следует ли назначать b-блокаторы
всем, кому они не противопоказаны, или их следует давать лишь больным с умеренным
риском, которые в наибольшей степени выиграют от их применения, все еще обсуждается.
Антагонисты кальция. Исследования с верапамилом и
дилтиаземом свидетельствуют о том, что эти препараты могут предотвратить
повторный ИМ и смерть. Их следует назначать с осторожностью при сниженной
функции ЛЖ. Они могут применяться в тех случаях, если
b-блокаторы противопоказаны
(особенно при обструктивных заболеваниях легких).
Исследования
с дигидропиридинами не продемонстрировали их
положительного эффекта в плане улучшения прогноза после ИМ; они должны
назначаться по четким клиническим показаниям, с учетом их потенциального отрицательного
эффекта у больных со сниженной функцией ЛЖ.
Нитраты. Нет четких доказательств того, что пероральное или чрезкожное применение нитратов улучшает прогноз после ИМ.
Исследования GISSI-3 и ISIS-4 не показали пользы от их применения через 4 - 6 нед после ИМ. Бесспорно, нитраты остаются основными
препаратами для лечения стенокардии.
ИАКФ. В
нескольких исследованиях показано, что ИАКФ уменьшают
смертность после ОИМ. В исследование SAVE больных
включали через 11 дней после ангинозного приступа, если фракция выброса (ФВ) у
них была меньше 40% по данным изотоиного исследования
и если у них не было ишемии при стресс-тесте. В
первый год влияния данной терапии на смертность отмечено не было. В последующие
3 - 5 лет наблюдалось снижение смертности на 19% (с 24,6 до 20,4%). Уже в
первый год было отмечено уменьшение количества повторных ИМ и СН.
В
исследовании AIRE больные были рандомизированы
по применению рамиприла, который назначали через 5 дней после начала ИМ при
наличии клинических или рентгенологических признаков СН. Через 15 мес смертность уменьшилась с 22,6% до 16,9% (на 27%). В
исследовании TRACE больные были рандомизированы
по получению трандолаприла или плацебо
через 4 дня после ИМ при наличии у них дисфункции ЛЖ,
о которой свидетельствовал индекс движения стенки, равной 1,2 или меньше. Через
108 нед наблюдения смертность составила 34,7% в
основной группе и 42,3% в группе плацебо. На
основании этих трех исследований можно говорить о том, что есть существенные
основания назначать ИАКФ больным, пережившим в остром
периоде ИМ СН, даже если на момент назначения препарата ее симптомы
отсутствуют. Их следует назначать при ФВ ЛЖ менее
40%, а также в тех случаях, когда индекс движения стенки составляет 1,2 или
меньше, при отсутствии противопоказаний.
Как уже
обсуждалось, назначать ИАКФ можно всем больным с ОИМ
с момента поступления при отсутствии противопоказаний. Против этого можно
выдвинуть следующие аргументы: увеличение случаев гипотонии и почечной
недостаточности у пациентов, получивших ИАКФ в остром
периоде, а также небольшая их эффективность у больных с относительно низким
риском, например, при наличии небольшого нижнего ИМ. При очень раннем
назначении ИАКФ их прием следует прекращать через 4 -
6 нед в тех случаях, когда ИМ протекает без
осложнений и ФВ превышает 40%.
Гиполипидемические средства. Скандинавское исследование
4S (Scandinavian Simvastatin Survival
Study - влияние симвастатина
на выживаемость) четко продемонстрировало положительный эффект снижения уровня
липидов у 4444 больных со стенокардией и/или постинфарктным кардиосклерозом при
уровне холестерина в пределах 5,5 - 8,0 ммоль/л (212
- 308 мг/дл). Этому предшествовали попытки нормализации уровня холестерина с
помощью диеты. Больных включали в исследование через 6 мес
после перенесенного ИМ. Все они относились к группе низкого риска. Через 5,4
года общая смертность среди леченых снизилась в среднем на 30% (с 12 % до 8%),
что составляет 33 спасенных жизни на 1000 леченых больных за этот период.
Наблюдались значительное снижение коронарной смертности, а также уменьшение
необходимости в АКШ. Оказалось, что больные старше 60
лет выиграли в такой же степени, как и более молодые. Женщинам лечение также
принесло пользу, поскольку большинство коронарных событий у них удалось предотвратить,
однако статистически значимого уменьшения смертности в этой группе выявлено не
было. Возможно, это обусловлено относительно малым числом леченых женщин.
Можно
говорить о том, что гиполипидемические средства следует назначать больным,
которые соответствуют критериям включения в исследование 4S. До сих пор неясно,
как быстро следует начинать лечение после ИМ и следует ли расширить критерии
лечения за счет больных с более низким уровнем липидов.
Организация лечения
Лечение на догоспитальном этапе
Отсрочка
начала лечения. Наиболее опасной при ОИМ является самая ранняя фаза, когда
больной испытывает боль и высок риск остановки сердца. Чем раньше начато
лечение, в частности ТЛТ, тем больше пользы от него
можно ожидать. Однако очень часто проходит час или больше после появления
симптомов, прежде чем больной обратится за помощью. Иногда это объясняется тем,
что симптомы нетяжелы или нетипичны, или внезапно прервались, но очень часто
даже при их наличии больной не обращается за помощью. Должно стать правилом
информирование больных с диагностированной ИБС и их родственников о симптомах
ИМ и правильном реагировании на них. Менее очевидна роль образования всего
населения. Конечно, все должны знать о том, как вызвать неотложную службу,
однако остается неясным, какое влияние оказывает кампания по обучению населения
на исход заболевания.
Обучение
населения приемам сердечно-легочной реанимации. Обучение приемам поддержания
основных жизненных функций должно стать частью школьной программы. При этом
должна моделироваться непредвиденная ситуация остановки сердца у постороннего
человека, возникающая во время работы, как это бывает у полицейских и пожарных,
которые обязаны грамотно проводить сердечно-легочную реанимацию.
Служба
скорой помощи. Служба скорой помощи играет ключевую роль в лечении ОИМ и
остановки сердца. Качество оказываемой помощи зависит от тренированности персонала.
Весь персонал скорой помощи должен быть обучен распознавать симптомы ИМ, давать
кислород, облегчать боль и проводить основные мероприятия по поддержанию жизни.
Все бригады неотложной помощи должны быть укомплектованы дефибрилляторами и по
крайней мере один член бригады должен уметь оказывать неотложную помощь.
Врачебные бригады, имеющиеся лишь в некоторых странах, могут обеспечить более
точную диагностику и терапевтические мероприятия, имеют право назначать
наркотики и тромболитические средства. В некоторых
странах эти функции выполняет специально обученный средний медицинский персонал.
Желательно,
чтобы бригада скорой помощи регистрировала ЭКГ с диагностической целью и
интерпретировала ее или передавала таким образом, чтобы это мог сделать опытный
сотрудник в отделении неотложной кардиологии (ОНК).
Регистрация ЭКГ перед поступлением может существенно ускорить лечение на
госпитальном этапе.
Врачи общей практики. В некоторых странах врачи
общей практики играют важную роль в лечении ИМ на раннем этапе. В этих странах
пациенты в первую очередь вызывают именно врачей общей практики. Если они
смогут быстро откликнуться и хорошо подготовлены, их помощь может быть
высокоэффективной, поскольку они хорошо знают пациента, могут регистрировать и
интерпретировать ЭКГ, ввести опиоиды и тромболитические средства и произвести дефибрилляцию. В
большинстве стран врачи общей практики не столь подготовлены. Безотлагательное
посещение ими больного желательно, но они должны незамедлительно вызвать
бригаду скорой помощи.
Мероприятия при поступлении больного в госпиталь. Действия по отношению к
пациенту по приезде в больницу должны быть быстрыми, особенно при постановке
диагноза ОИМ и введении тромболитических средств. В некоторых больницах
пациенты поступают непосредственно в ОНК, что
является наилучшим вариантом, но в большинстве случаев пациенты поступают в
отделение общей реанимации. Отсрочка начала лечения в этом случае может быть
существенной. Необходимо, чтобы персонал был подготовлен, способен оценить
обстановку и лечить больных с подозрением на ИМ в этих условиях. Больные с
явными клиническими признаками ИМ, имеющие на ЭКТ
подъем ST или блокаду левой ножки пучка Гиса, должны включаться в "систему
быстрого реагирования", т.е. ТЛТ им следует проводить
в отделении реанимации. При этом время от момента поступления больного до
введения ему препарата не должно превышать 20 мин. Остальные больные нуждаются
в более детальном наблюдении, которое лучше всего проводить в ОНК.
Отделение неотложной кардиологии
Все больные
с подозрением на ОИМ должны сразу поступать для наблюдения в соответствующее
отделение, где специально обученный персонал постоянно готов оказать помощь и
где всегда "под рукой" есть необходимое оборудование для
мониторирования и немедленного лечения. В условиях ОНК
часто происходит сортировка пациентов. При этом очень важно, чтобы здесь
имелись все условия для быстрой транспортировки в другие палаты тех больных,
которые не нуждаются в такой высокоспециализированной помощи.
Неинвазивное мониторирование. ЭКГ - мониторирование
аритмий следует начинать немедленно у каждого больного с подозрением на ОИМ.
Оно должно проводиться по крайней мере 24 ч или до постановки иного диагноза.
Дальнейшее ЭКГ - мониторирование зависит от конкретного риска для больного и от
имеющегося оборудования. Когда пациент покидает ОНК,
мониторирование ритма можно продолжать при необходимости с помощью телеметрии.
Более продолжительное мониторирование необходимо у тех больных, у которых
имеются клинические проявления СН, КШ или серьезные аритмии в остром периоде
ИМ, поскольку риск аритмий остается высоким.
Инвазивное мониторирование. Во всех ОНК
должны иметься персонал и оборудование для инвазивного
мониторирования АД и легочного давления. Мониторирование АД следует проводить у
больных с КШ. Плавающие баллонные катетеры типа Swan
- Gans важны для наблюдения и лечения больных с
низким сердечным выбросом. Введение таких катетеров показано при КШ,
прогрессирующей СН и подозрении на дефект МЖП или
дисфункцию сосочковых мышц.
Современное использование методов лечения,
проверенных в клинических исследованиях
Результаты
клинических исследований часто не используются на практике, а методы лечения,
которые дают незначительную пользу или вовсе бесполезны, продолжают широко
применяться. Получить достоверные данные о применении различных методов лечения
при ИМ легче всего в ходе клинических исследований, которые не могут быть точным
отражением клинической практики. Европейская группа по вторичной профилактике
ИБС недавно сообщила о применении препаратов у 200 - 520 больных с ОИМ из 11
стран. ТЛТ проводилась примерно у 35% больных (от 13
до 52%). Частота применения внутривенных блокаторов варьирует
от 0,5 до 54% (в среднем 13%), оральных блокаторов - от 33 до
81% (в среденем 52%). Эти данные свидетельствуют о необходимости
продолжения образования врачей и осуществления постоянного контроля за
внедрением передовых методов лечения. Центры, участвующие в многоцентровых
исследованиях, наиболее часто способствуют внедрению в клиническую практику
новейших данных.
Рекомендации
Больные. Больные с подозрением на сердечный приступ имеют
право на быструю постановку диагноза, облегчение боли, реанимацию и, если
потребуется, реперфузионную терапию.
Больных с
возможным или достоверным ИМ должен лечить опытный и тренированный персонал в
современном ОНК. Им следует проводить диагностику и
лечение современными методами как в месте первоначального поступления, так и
при переводе в специализированное отделение.
Больных
следует наблюдать после выписки, проводить реабилитацию и вторичную
профилактику.
Пациентов и
их родственников следует информировать о способах распознавания и адекватной
реакции на последующие сердечные приступы.
Кардиологи. Кардиологи совместно с реаниматологами
и администрацией органов здравоохранения должны делать все необходимое для
того, чтобы в их районе действовала оптимальная система помощи больным с
ангинозным приступом. Эта система включает соответствующую тренировку персонала
скорой помощи и врачей первой помощи, оборудование, необходимое для диагностики
и лечения при подозрении на ОИМ в отделении реанимации и четкие инструкции для
быстрого проведения ТЛТ.
Кардиологи
совместно с анестезиологами и другими специалистами должны обеспечить обучение
врачей и среднего медицинского персонала технике проведения реанимационных
мероприятий.
Следует
регистрировать время от обращения за помощью до введения тромболитика
(время "от вызова до укола") и от поступления в стационар до
проведения ТЛТ (время"от
двери до укола"). Первое время не должно превышать 90 мин, а для больных,
имеющих четкие показания для ТЛТ и включенных в
"систему неотложного реагирования", время "от двери до
укола" не должно превышать 20 мин.
Следует
регистрировать больных с четкими признаками ИМ, поступивших в первые 12 ч после
появления симптомов с подъемом сегмента ST или блокадой ножки пучка Гиса,
получивших ТЛТ. Их количество должно составлять около
90% от всех поступивших с ИМ.
ЧТКА
должна быть доступной и экономически сопоставимой альтернативной ТЛТ при наличии соответствующих возможностей и умения.
Результаты ЧТКА следует фиксировать в национальном
регистре.
Программа
реабилитации должна быть доступна для всех больных с учетом их индивидуальных
потребностей.
Должна
проводиться пропаганда отказа от курения, подкрепляемая поведением медицинского
персонала. Последнее может усилить стремление больного к сокращению курения и
даже к отказу от него.
Следует
регистрировать препараты, предназначенные для вторичной профилактики у выживших
после ИМ. Предлагаемый минимум препаратов к моменту выписки должен быть следующим:
аспирин у 85% и более, блокаторы у 35% и более, ИАК более чем у 20%.
У всех
пациентов следует определять уровень липидов в крови, желательно на день
поступления. Больным с повышенным уровнем липидов первоначально следует
рекомендовать соблюдение диеты. Если этого недостаточно для существенного
снижения уровня липидов, следует назначить гиполипидемические средства в
соответствии с критериями исследования 4S.
Врачи общей практики. Если врачи общей практики
первыми контактируют с пациентом, у которого возможен ИМ, они должны или
немедленно приступить к лечению, или вызвать скорую помощь, а лучше - и то, и
другое.
Если врачи
общей практики могут быстро реагировать и хорошо тренированы и оснащены, они
могут эффективно провести дефибрилляцию и ТЛТ.
Врачи
должны быть вовлечены в местную координационную программу по неотложной
кардиологии.
Они должны
видеть пациентов как можно раньше после выписки из стационара, убедиться, что
их реабилитация хорошо организована, и наблюдать за реализацией мер вторичной профилактики.
Администрация органов здравоохранения должна
обеспечить:
• обучение
населения основным приемам сердечно-легочной реанимации, а персонала скорой
помощи - основным и специальным методам поддержания жизни;
•
функционирование оптимальной системы помощи больному с подозрением на ОИМ путем
координации действий бригад скорой помощи, врачей общей практики и врачей
больниц;
• наличие в
отделениях реанимации рекомендаций (протокола) по лечению больных с возможным
ИМ. Это будет способствовать тому, чтобы тренированный персонал мог оказать
помощь в любое время;
•
достаточное количество коек в ОНК для больных с ИМ и
подготовку врачей по кардиологии;
•
реабилитацию больных, выписанных из больницы после ИМ;
•
благоприятные условия для проведения передовых исследований и лечения больных с
осложнениями ИМ в их больнице или районе или, если это неосуществимо на месте,
возможность доставки больных в другие территориальные центры.
Перевод с
английского К.М.Н., С.А. Довголис
под редакцией Лауреата Государственной Премии профессора И.Н. Бокарева