Полиакриламидный гель (ПААГ)
Реферат на
тему:
Полиакриламидный
гель (ПААГ)
2009
1. Полиакриламидный
гель (ПААГ)
Это
— продукт
полимеризации
акриламида.
В результате
разрывов двойных
связей и конденсации
по ним получаются
длинные бесцветные
нити линейного
полимера
полиакриламида.
Эти нити могут
быть ковалентно
связаны («сшиты»)
между собой.
Конечно,
в реальных
полимерах нити
полиакриламида
вовсе не параллельны,
а расположены
хаотически,
но в отдельных
точках своего
сближения они
сшиты мостиками
«Биса». Получаются
неправильной
формы поры
пространственной
решетки, средний
размер которых,
тем не менее,
определяется
частотой расположения
сшивок и концентрацией
основных нитей
полимеров.
Оба
мономера: акриламид
и «Бис» представляют
собой хорошо
растворимые
в водной среде
порошки. Образование
пространственной
сетки геля
происходит
прямо в растворе
выбранного
буфера, который
благодаря этому
заполняет все
поры геля.
Полимеризацию
стимулируют
добавки в малых
количествах
еще двух веществ.
Одно из них
служит инициатором
процесса
полимеризации,
второе — ускоряет
этот процесс.
Содержание
водной фазы
в геле очень
велико — от 70
до 97%.
Пористость
и механические
характеристики
ПААГ задают
путем выбора
процентного
отношения
суммарной массы
обоих полимеров
к объему геля.
Эту величину
принято обозначать
буквой Т. Практически
она варьирует
от 3 до 30%. Вес сшивки
(«Биса») составляет
обычно от 1 до
5% суммарного
веса мономе-ров.
Эту величину
обозначают
буквой С. При
малых значениях
сшивки (С<2%) ПААГ
нельзя считать
жесткой регулярной
пространственной
решеткой. Скорее
это — длинные
нити, лишь в
отдельных
точках, случайным
образом связанные
между собой.
Расстояние
между этими
точками вдоль
нити в среднем
составляет
50—100 мономерных
единиц. Мигрирующие
в геле молекулы
белка могут
раздвигать
длинные, гибкие
участки линейных
полимеров
акриламида.
На это расходуется
энергия, что
также сказывается
замедлением
миграции.
ПААГ
хорошо прилипает
к чисто вымытому
стеклу.
В
свободной
жидкости скорость
миграции большинства
кислых белков
при рН8,5 составляет
0,1-0,5 см/час при
напряженности
поля 1 В/см. Для
эффективного
разделения
белков в ПААГ,
как показывает
опыт, средняя
скорость их
миграции (благодаря
сопротивлению
геля) должна
быть в 5-10 раз
меньше. При
нормальной
напряженности
электрического
поля в 10-20 В/см
этому соответствует
средняя скорость
миграции белков
в геле порядка
0,1-2 см/час. Таким
образом, при
рабочей длине
геля в 20 см за
10 часов электрофореза
наиболее быстрые
белки могут
достигнуть
нижнего конца
геля в то время,
как наиболее
медленные
продвинутся
лишь на 1 см.
Напряжение,
которое при
этом должно
подаваться
на трубочку
геля, составит
200—400 В. Цифры эти,
конечно, сугубо
ориентированные.
Выбор
значения Т
зависит от
характера
электрофоретических
подвижностей
белков в геле.
Если сильно
различаются
размеры белковых
молекул, а отношение
заряда к массе
у них более или
менее одинаковое,
то имеет смысл
выбрать Т
максимальным.
Разделение
в этом случае
будет происходить
в основном за
счет трения
о гель. Причем
тем эффективнее,
чем больше Т,
хотя при этом
в связи с увеличением
продолжительности
электрофореза
усилится диффузия
белков в полосах.
Если же компоненты
анализируемой
смеси имеют
заведомо различные
отношения
заряда к массе,
то может оказаться
выгодным вести
разделение
в крупнопористом
геле (при малых
значениях Т),
то есть как бы
в свободной
жидкости.
В
качестве сугубо
ориентировочной
можно рекомендовать
следующую,
полученную
на практике,
таблицу соответствия
молекулярных
масс разделяемых
белков (М) и
концентраций
ПААГ (Т):
М
(тыс. дальтон)
Т (%) 10-40 15-20 40-100 10-15 100-300 5-10 >300 5
2.
Электрофорез
белков в вертикальных
пластинах
Первые
опыты с электрофорезом
белков ставились
в вертикально
стоящих трубочках.
Для простоты
изложения я
в этой системе
рассматривал
и основные
особенности
электрофореза,
не зависящие
от формы геля.
Однако в ходе
эксплуатации
довольно скоро
выяснилось,
что система
трубочек неудобна
в двух отношениях.
Во-первых, в
трубочке трудно
добиться одинакового
охлаждения
геля по всему
ее сечению.
Во-вторых, для
сравнения
результатов
электрофореза
нескольких
сопоставляемых
препаратов
белков нужно
было приготовить
столько же
отдельных
трубочек в
совершенно
одинаковых
условиях состава
и полимеризации
ПААГ, что затруднительно.
Поэтому с середины
70-х годов электрофорез
белков ведут
исключительно
в вертикально
расположенных
пластинах (рис.
1).
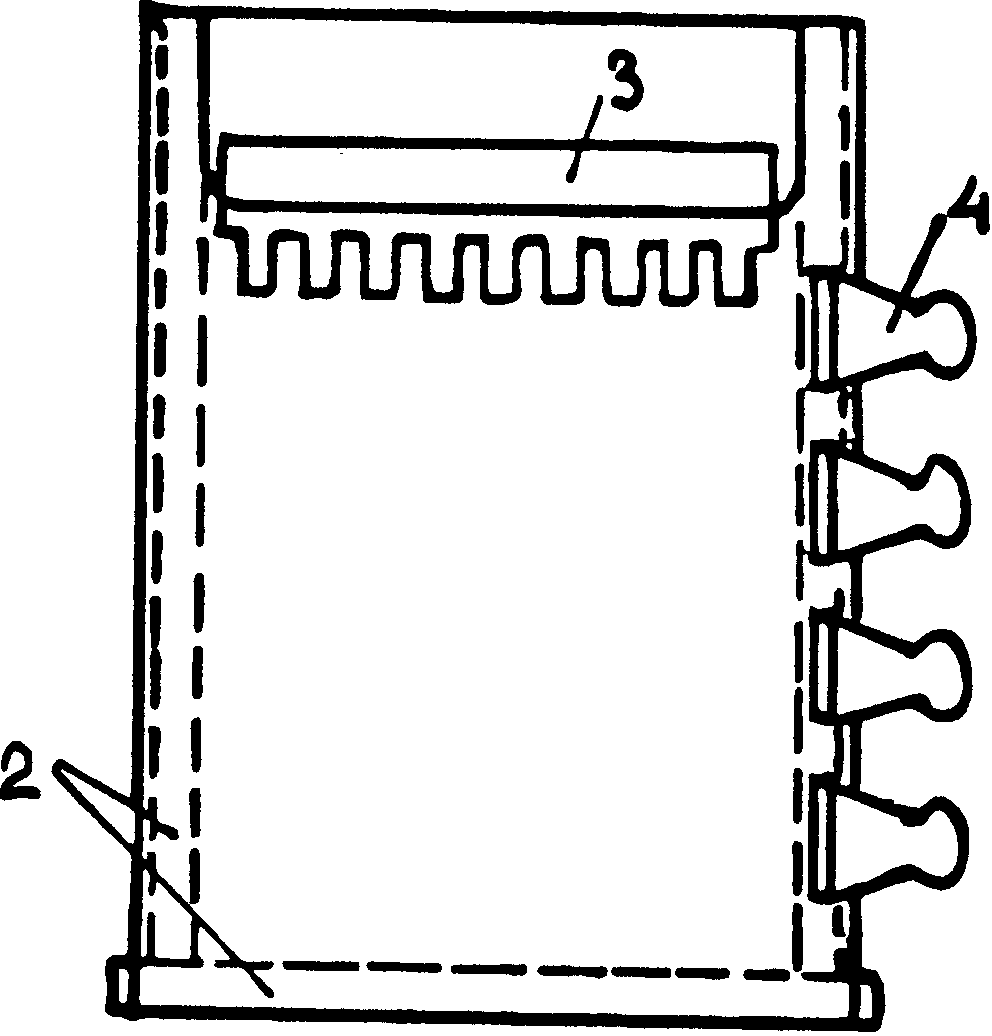
2-ПРОКЛАДКИ;
3-ПЛЕНКА; 4-ЗАЖИМ
Рис.
1
Обычно
используют
пластины шириной
8-14 см и длиной
до 30 см. Полимеризацию
акриламида,
а затем и сам
электрофорез
ведут в форме,
образованной
двумя пластинами
зеркального
стекла толщиной
5 мм. Переднее
стекло (на рис.
37) имеет вырез,
назначение
которого будет
ясно из дальнейшего.
Расстояние
между пластинами,
— а значит и
толщина геля,
— задается
толщиной прокладок
из тефлона
(0,4-1,5 мм) при ширине
10-15 мм (на рисунке
они показаны
пунктиром). Эти
прокладки
устанавливают
по бокам и внизу
формы, при условии
плотного прилегания
нижней прокладки
к торцам боковых.
Нижняя прокладка
— немного выступает
за пределы
формы, поскольку
после затвердевания
геля ее надлежит
удалить. Тефлон
хорошо прилегает
к зеркальному
стеклу, а нижние
торцы боковых
прокладок можно
слегка смазать
силиконовым
маслом. Прокладки
между стеклами
надежно зажимают
по всей периферии
пружинными
зажимами для
бумаг. (На рисунке
показаны только
4 зажима с одной
стороны пластины.)
Вся камера
таким образом
должна быть
надежно герметизирована,
кроме верхнего
ее края, на то
время, пока в
ней будет проходить
полимеризация
жидкой смеси
предшественников
ПААГ.
По
окончании этого
процесса (о чем
можно судить
по образованию
резкой границы
между гелем
и тонким слоем
воды, которым
защищают
полимеризацию
от контакта
с кислородом
воздуха) зажимы
можно снять.
Полимеризация
занимает обычно
30-40 минут.
В
аналитических
опытах на каждой
пластине в
параллельных
«треках» ведут
электрофорез
нескольких
препаратов,
состав которых
затем можно
сопоставлять
при строго
одинаковых
условиях разделения
(рис.2 ).

Рис2.
Для
фиксации этих
треков в ходе
полимеризации
на верхнем крае
геля формируют
ряд одинаковых
углублений
прямоугольной
формы «карманов»,
куда затем и
вносят различные
препараты.
Для
этого в еще не
заполимеризовавшийся
гель вставляют
«гребенку»
из тефлона,
такой же толщины,
как прокладки
между стеклами.
Как видно на
разрезе, верхняя
часть гребенки
делается немного
толще, чем нижняя
(с зубцами). Это
удобно так как
позволяет
устанавливать
гребенку каждый
раз одинаково
и ровно — до
упора в торец
стеклянной
пластины. Жидкий
гель заливают
между пластинами
с таким расчетом,
чтобы при опускании
гребенки до
упора он заполнял
бы промежутки
между ее зубцами.
Торцы зубцов
гребенки перед
установкой
смачивают,
потерев их об
стекло с налитым
на него жидким
гелем. Кроме
того начинают
вставлять ее
с некоторым
перекосом,
следя за тем,
чтобы под зубцами
не задержались
пузырьки воздуха.
После
завершения
полимеризации
геля снимают
зажимы, удаляют
нижнюю прокладку
и вынимают
гребенку. Весь
«сэндвич»
сохраняет свою
целостность
благодаря
прилипанию
ПААГ к стеклу.
Его устанавливают
в простой прибор,
склеенный из
оргстекла —
его нетрудно
изготовить
в лабораторных
условиях (рис.
3). Так, чтобы то
стекло формы
геля, которое
имеет вырез,
прилегало к
верхнему резервуару
прибора. Вырезы
в стекле и резервуаре
совпадают, а
второе, не вырезанное
стекло формы
геля, замыкает
собой объем
резервуара.
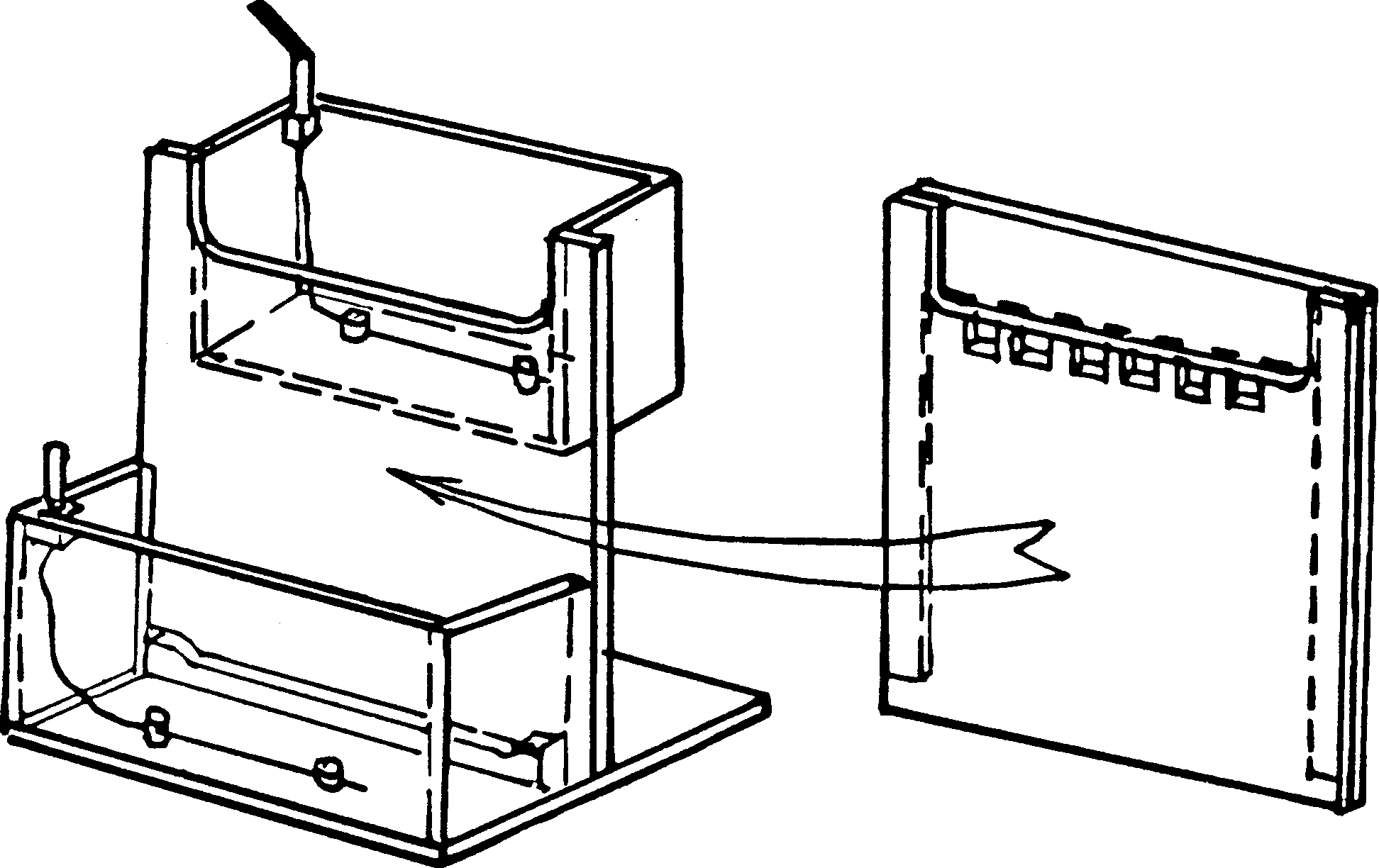
Рис.
3
Его
можно заполнять
буфером, который
таким образом
попадает и в
карманы геля.
Естественно,
что всю форму
с гелем надо
хорошо прижать
к стенке прибора
(лучше через
резиновую
прокладку),
чтобы предотвратить
вытекание
буфера из верхнего
резервуара.
На дне коробки
нижнего резервуара
видна опора,
на которую
ставят пластины
с гелем. Выемка
на этой опоре
обеспечивает
контакт нижнего
буфера с нижним
торцом геля.
Необходимо
проверять, что
на этом торце
тоже нет пузырьков
воздуха.
Препараты
белков с добавленной
в них сахарозой
или глицерином
вносят в карманы
геля после
окончания
сборки прибора,
осторожно
подслаивая
их, как было
описано выше,
под буфер. Препараты
должны быть
заведомо освобождены
от пыли, нерастворившихся
белков и других
посторонних
частиц фильтрованием
или центрифугированием.
В верхнем
и нижнем резервуарах
для буфера
видны проволочки
электродов.
Через штырьковые
разъемы их
присоединяют
к клеммам источника
питания.
В приборе
описанного
типа можно
обойтись и без
вырезов в стеклянной
пластине и
верхнем резервуаре,
если электрическую
цепь между
верхним буфером
и гелем замкнуть
через смоченный
тем же буфером
широкий фитиль
из толстой
фильтровальной
бумаги. Конструкция
прибора упрощается,
но при этом
следует иметь
в виду возможность
обсыхания
фитиля, что
приведет к
увеличению
его электрического
сопротивления,
а следовательно
к уменьшению
напряжения,
подающегося
на гель.
По
окончании
электрофореза
пластины разнимают,
отслаивая одну
из них от геля
с помощью шпателя.
Его всовывают
между пластинами
со стороны
карманов и
слегка поворачивают.
Эту операцию
не следует
форсировать.
Лучше сначала
пройтись шпателем
с легким нажимом
вдоль всего
верхнего края
пластины, наблюдая
за тем как между
стеклом и гелем
постепенно
проникает
воздух, а потом
уже приподнять
пластину. Со
второй пластины
гель снимают
руками и переносят
в ванночку для
фиксации белков
и их окраски.
Эту простую
операцию следует
производить
в перчатках.
Случайное
прикосновение
руки к рабочей
поверхности
геля при современных
высокочувствительных
методах окрашивания
может оставить
на геле артефактное
белковое пятно.
Я намеренно
столь подробно
описал операцию
проведения
электрофореза
в этом простом
устройстве,
чтобы дать
учащемуся или
читателю
представление
о необходимости
исключительной
предусмотрительности
и тщательности
в постановке
соответствующих
экспериментов.
3. Загрузка
геля. Ширина
белковых полос
Очевидно,
что распределение
близко идущих
зон белков
будет тем успешнее,
чем тоньше сами
эти зоны. Поэтому
при электрофорезе
следует заботиться
об уменьшении
толщины белковых
зон. Это накладывает
ограничение
на допустимую
загрузку каждого
трека пластины
геля. В качестве
ориентировочного
максимума можно
принять загрузку
в 50 мкг белка
в карман шириной
в 5 мм для пластины
толщиной в 1
мм. Идентификацию
полос белка
по их окраске
можно проводить
и при загрузках
в 10 раз меньших.
При перегрузке
белковые полосы
бывают резкими
в передней
своей части
и размытыми
сзади. В этом
случае всегда
следует считаться
с возможностью
выпадения белка
в осадок в момент
вступления
его в гель, когда
все макромолекулы
стягиваются
в тонкую полоску
и локальная
их концентрация
сильно увеличивается.
В простом
варианте
электрофореза
желательно
наносить белковую
смесь на гель
в минимальном
объеме, чтобы
высота исходного
слоя в кармане
была не более,
чем 2-3 мм. Исходя
из цифры загрузки
в 50 мкг можно
подсчитать
цифру исходной
концентрации
белкового
препарата в
3-5 мг/мл.
Улучшения
разрешения
зон можно добиться
путем принудительного
концентрирования
исходного
препарата белка
в тонкую полоску
в момент его
вхождения в
гель. Основной
прием заключается
в том, чтобы
создать перед
гелем область
с повышенной
напряженностью
электрического
поля, где белки
мигрируют
намного быстрее,
чем в рабочем
геле. На границе
перехода из
этой области
в гель они будут
стягиваться
в тонкую полоску,
так как находившиеся
первоначально
далеко позади
молекулы белка
догонят впереди
идущих, замедливших
свое движение
при вступлении
в рабочий гель.
Повышения
напряженности
поля в области
кармана, где
находится
исходный препарат
очень просто
достигнуть
путем растворения
этого препарата
в рабочем буфере,
но в 5—10 раз менее
концентрированном
(меньшей молярности),
чем в геле и
верхнем резервуаре.
Благодаря
уменьшению
числа носителей
заряда (например
ионов С1) резко
увеличивается
локальное
сопротивление
слоя, содержащего
препарат, а
значит и напряжение
на нем по сравнению
с участком
такой же длины
в геле. Смешиванию
с буфером верхнего
резервуара
в кармане помешает
присутствие
сахарозы в
препарате.
Другим
очень эффективным,
но более сложным
способом сужения
полос уже в
ходе их миграции
является
использование
градиента
пористости
геля в направлении
уменьшения
среднего размера
пор при продвижении
к нижнему краю
пластинки.
Предположим,
что еще при
формировании
рабочего геля
нам удалось
создать такой
градиент пористости.
Сделать это
можно с помощью
относительно
простого устройства,
изображенного
на рис. 4.
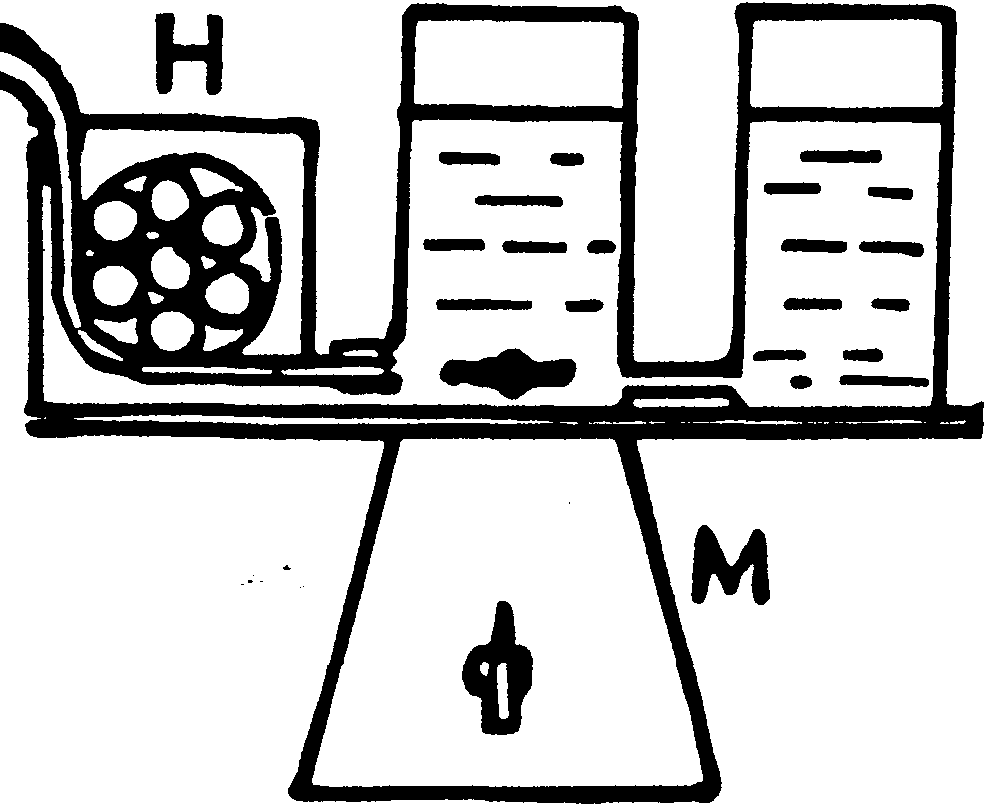
Рис.4
В
левом из двух
сообщающихся
между собой
(у самого дна)
стаканов находится
смесь жидких
компонентов
будущего геля
низкой концентрации
(например. Т=5%),
а в правом—
высокой концентрации
(Т==20%). В первом из
стаканов вращается
магнитик мешалки
(М). Из левого
стакана жидкость
поступает в
перистальтический
насос (Н), который
медленно через
трубочку (Тр)
подает ее на
дно формы для
геля (Ф).
Если
стаканы одинакового
диаметра были
залиты первоначально
до одинакового
уровня, а суммарный
объем жидкости
в них равен
объему формы,
то на дно ее
будет поступать
постепенно
все более плотная
жидкость, которая,
растекаясь
по дну, станет
оттеснять вверх
все более легкие
слои. В итоге,
после полимеризации
у дна окажется
мелкопористый
20%-ный гель, а
наверху —
крупнопористый,
5%-ный. Изменение
это будет линейным
по высоте пластины.
При
миграции белковых
зон в таком
«градиентном»
геле передний
край каждой
полосы будет
постоянно
оказываться
в области чуть-чуть
более концентрированного
геля, чем ее
задний край.
Молекулы белка,
расположенные
ближе к переднему
краю полосы
будут тормозиться
трением о гель
сильнее, чем
идущие сзади,
что и приведет
к непрерывному
сужению полос
в ходе их продвижения
вниз по гелю.
Существует
множество
фирменных
приборов для
проведения
электрофореза
белков в вертикальных
пластинках.
В некоторых
из них предусмотрено
охлаждение
поверхностей
стеклянной
формы геля,
например, током
буфера, прокачиваемого
между резервуарами.
Проблемы теплоотвода
от геля мы коснулись,
говоря о недостатках
гелей в трубочках.
Для пластин
с толщиной геля
в 1 мм естественное
воздушное
охлаждение
является вполне
достаточным.
Для более толстых
гелей охлаждение
циркулирующей
водной средой
оправдано.
Некоторые
фирмы выпускают
приборы для
электрофореза
в горизонтально
расположенных
пластинах. В
этом есть свои
преимущества.
К примеру, пластину
с гелем можно
положить на
охлаждаемый
столик. Но есть
и недостатки.
Хотя бы уже
упомянутое
обсыхание
фитилей, без
которых в этих
системах нельзя
обойтись. А
также необходимость
защиты от обсыхания
и самого геля,
который в этих
вариантах
открыт сверху
для наложения
фитилей (гель
лежит на одной
пластинке).
Препараты в
этих моделях
вносят в «колодцы»,
расположенные
с одного края
геля перпендикулярно
его плоскости.
Можно их расположить
и на середине
геля для того,
чтобы в одном
опыте разделять
и основные, и
кислые белки
— они будут
мигрировать
в разные стороны.
С проблемой
обсыхания
стараются
справиться
закрывая весь
прибор (резервуары,
фитили и гель)
герметической
крышкой из
плексигласа.
4.
Фиксация и
окрашивание
белков в геле
Как
только прекращается
действие
электрического
поля, разделившиеся
белковые зоны
склонны «расплываться»
в силу тепловой
диффузии. Поэтому
сразу после
окончания
разделения
белки необходимо
фиксировать
в тех местах
геля, куда они
успели дойти.
Проще всего
это сделать
осаждением
из раствора
прямо в геле.
Пористость
полиакриламидного
геля позволяет
легко изменять
жидкую среду,
окружающую
белки, путем
простого вымачивания
извлеченной
из формы пластинки
геля в соответствующем
водном растворе.
Для фиксации
осаждением
пригодны крепкие
растворы уксусной
кислоты (СНзСООН)
или ТХУ — трихлоруксусной
кислоты. Последнюю
используют
в виде 10% -ного
или 50% -ного раствора.
Часто
фиксацию белков
совмещают с
их окрашиванием.
Для этого краситель
растворяют
в ТХУ или в смеси
уксусной кислоты
с метанолом.
Исторически
для окрашивания
белков в геле
были прежде
всего использованы
давно апробированные
красители для
шерсти. Это —
сложные молекулы
с несколькими
ароматическими
кольцами и
заряженными
группами. Механизм
их взаимодействия
с белками еще
далеко не ясен.
По-видимому,
первоначальное
связывание
идет за счет
кулоновского
взаимодействия
отрицательно
заряженных
сульфогрупп
с положительно
заряженными
боковыми группами
основных аминокислот
белка. Буфер
в момент окрашивания
заменяется
на сильно кислую
среду. В ней
преимущественный
заряд любого
белка становится
положительным.
В то же время
краситель,
несущий «сильную»
SОз-группу
сохраняет
отрицательный
заряд даже при
малых значениях
рН. Далее связь
белка с красителем
закрепляется
водородными
и гидрофобными
связями. Для
кислых белков
широко используют
красители
класса «Кумасси
яркоголубой»
(Coomassie brilliant
blue). Его выпускают
в двух модификациях
СВВ R-250 и СВВ
G-250. Обилие
ароматических
колец в красителях
этого типа
делает их плохо
растворимыми
не только в
воде и разбавленной
уксусной кислоте,
но даже и в 10% -ной
ТХУ. В этих случаях
для улучшения
растворимости
добавляют до
40% метанола. Если
используют
50%-ную ТХУ, то в
этом нет необходимости.
Содержание
красителя в
растворе 0,1-0,25% по
весу. Продолжительность
окрашивания
варьирует в
зависимости
от толщины геля
в пределах от
3 до 12 часов. Для
ускорения
проникновения
раствора в гель
окрашивание
можно вести
при температуре
37°.
Первоначально
после окончания
процедуры
окрашенным
кажется весь
гель. Но молекулы
красителя не
связываются
акриламидом.
После окончания
окраски сам
гель можно
отмыть до полной
прозрачности,
вымачивая его
в течение ночи
в достаточно
большом объеме
7%-ной уксусной
кислоты. Чувствительность
метода позволяет
вполне надежно
обнаружить
полоску, содержащую
10 мкг белка.
До
сих пор речь
шла о кислых
белках. Основные
белки окрашиваются
теми же красителями
еще проще, так
как они уже
несут положительный
заряд. Достаточно
позаботиться
о растворимости
красителя и
осаждении
белка.
На
порядок величины
лучшую чувствительность
дает окрашивание
белков ионами
серебра. После
осаждения
белков уксусной
кислотой и
этанолом, тщательной
промывки этанолом
и водой гель
переносят на
30 минут в 5 объемов
0,1% раствора AgNO3.
Затем
после промывки
водой в такой
же объем карбоната
натрия + 0,02% формальдегида
(НСНО). Инкубируют
при комнатной
температуре,
покачивая
кювету. Окрашенные
полосы белка
появляются
через несколько
минут. Следует
дождаться
наилучшего
контраста и
остановить
реакцию промывкой
в 1%-ной уксусной
кислоте. Механизм
окрашивания
неясен. Но,
по-видимому,
он в чем-то сходен
с восстановлением
серебра в
фотографическом
процессе. Во
всяком случае
при проявлении
окраски белков
следует точно
так же избегать
передержки
в проявителе.
Окраску
белков флюоресцентными
красителями,
такими как
«данзилхлорид»
и «флюоресцамин»
или «ортофталевый
ангидрид»,
используют
в тех случаях,
когда желательно
следить за
ходом электрофоретического
процесса разделения
белков. Этими
красителями
окрашивают
суммарный
белковый препарат
до электрофореза.
Сохраняя прочную
связь с белками,
они мало сказываются
на их электрофоретической
подвижности.
За движением
белковых полос
в геле наблюдают,
освещая его
ультрафиолетовым
светом.
Очень
высокую чувствительность
при фиксации
положения
белковых полос
после электрофреза
можно получить
для радиоактивно
меченых белков.
Пока
же заметим, что
этот метод
хорош для
исследования
белков, синтезированных
in vitro с
использованием
радиоактивно
меченых аминокислот
или для белков,
выделенных
из бактерий
ауксотрофных
по какой-либо
аминокислоте
(не способной
к ее синтезу),
когда соответствующую
радиоактивно
меченую аминокислоту
включают в
питательную
среду.
Литература
Курашвили
Л.В., Бобылева
Л.Н. Определение
триглицеридов
во фракции
липопротеидов
высокой плотности
/Лабораторное
дело. - N 7. - 1991. - С.7576.
Курашвили
Л.В., Владимирова
А.А. Содержание
триглицеридов
в ЛПВП у больных
ишемической
болезнью сердца
//Кардиология.
- 7-8. - 1992. - С.35-38.
Курашвили
Л.В., Волков А.С.
Прогностическая
значимость
определения
холестерина
в фракции
липопротеидов
высокой плотности
у доноров крови
// Гематология
и трансфузиология.
- N 5. - 1993. - С.39-41.