Получение рекомбинантного аденовируса CELO
В том случае, когда различные по специфичности действия рестриктазы присутствуют в клетках разных штаммов одного вида бактерий, в название рестриктазы вводят дополнительную букву, например рестриктазы Hinc и Hind выделены из бактериальных клеток Haemophilus influenzae, штаммы с и d. Цифры, следующие за буквенными обозначениями, отражают последовательность открытия соответствующих рестриктаз в клетках бактерий одного вида, например Hael, Haell и НаеШ из Н. aegipticus. Рестриктазы типа II - основной инструмент генной инженерии. Большинство рестриктаз типа II специфически узнают на ДНК тетра- и гексануклеотидные последовательности, а по крайней мере три из них - октануклеотиды. Чем короче олигонуклеотидная последовательность сайта рестрикции, узнаваемого рестриктазой, тем чаще он встречается в случайной последовательности нуклеотидов, в которой каждый из четырех нуклеотидов представлен с одинаковой частотой (50% А-Т-пар и 50% G-C-nap). Так, случайная тетрануклеотидная последовательность встречается в среднем через каждые 256 п.о., а гексануклеотидная - через каждые 4096 п.о. Однако в природных ДНК распределение нуклеотидов может заметно отличаться от случайного. Например, для эукариотических ДНК характерна низкая частота встречаемости динуклеотида CpG и соответственно сайтов рестрикции, содержащих эти динуклеотиды (рестриктазы Hhal, Hpall, TaqI, Thai, Aval, Haell, Hindll, Sail, Smal, Xhol, Xmal). Существенное отклонение частоты встречаемости сайтов рестрикции от ожидаемого при случайном их распределении вдоль ДНК свойственно и хромосомам термофильных бактерий, которым, напротив, свойственно (хотя и не во всех случаях) обогащение по G-C-парам. Для большинства сайтов, узнаваемых рестриктазами типа II, характерно наличие в них симметрии второго порядка, т.е. узнаваемые ими последовательности представляют собой палиндромы, например у рестриктазы EcoRI - 5'-GAATTC- 3'. Это означает, что нуклеотиды, расположенные в каждой из цепей на равном расстоянии от оси симметрии, комплементарны друг другу. Если точки расщепления противоположных цепей ДНК смещены друг относительно друга в сайте рестрикции, то образующиеся в результате рестрикции концы ДНК содержат выступающие одноцепочечные участки. Поскольку такие участки комплементарны сами себе и друг другу и могут между собой взаимодействовать, их часто называют "липкими" концами. В "липких" концах выступающим одноцепочечным участком может быть как 5'-, так и З'-конец Формальным признаком образования 5'- или 3'-выступающих "липких" концов в сайтах рестрикции является расположение точки расщепления цепей ДНК в последовательности, используемой для обозначения сайта рестрикции, слева или справа от оси симметрии соответственно. У некоторых рестриктаз точки расщепления обеих цепей ДНК расположены непосредственно друг под другом в сайте рестрикции. В этом случае после расщепления ДНК "липких" концов не образуется, а получаются так называемые "тупые" концы, в которых нет выступающих одноцепочечных участков ДНК. Имеется одно принципиальное функциональное различие между 5'- и 3'-выступающими "липкими" концами - последние невозможно пометить путем их достройки ДНК-полимеразой. Эту особенность следует иметь в виду при выборе рестриктаз для получения рестрикционных фрагментов ДНК, которые предполагается использовать в качестве зондов.Рестриктазы являются высокоспецифическими ферментами. Однако для поддержания этой специфичности in vitro необходимо соблюдать в реакционной смеси оптимальные условия для действия ферментов. При нарушении таких условий у некоторых рестриктаз начинает проявляться вторичная (так называемая штриховая) активность. Так, рестриктаза EcoRI расщепляет последовательность GAATTC при рН 7,3, 100 мМ NaCl в присутствии 5 мМ MgC12, однако при изменении значений рН, понижении концентрации NaCl или замене ионов Mg2+ на Мп2+, а также в присутствии органических растворителей у фермента появляется тенденция к расщеплению более короткой последовательности ААТТ (так называемая активность EcoRI). К рестриктазам, обладающим подобными свойствами, относятся также BamHI, BstI, Bsul, Ddel, Hhal, PstI, Sail, SstI, Xbal.
В природе существуют антагонисты рестриктаз - метилазы. Это ферменты, которые катализируют реакции метилирования А или Ц в немногих специфических сайтах в хромосомах, в результате чего метилированная ДНК оказывается нечувствительной к атакам рестриктазами. Метилазы используются для ограничения числа сайтов рестрикции и получения более крупных фрагментов ДНК с помощью рестриктаз.
Большинство штаммов Е. coli содержит два типа ферментов, метилирующих ДНК: dam- и dcm-метилазы. Первая осуществляет перенос метальных групп в N-положение аденина в последовательности GATC. В таком случае многие рестриктазы (например Bell, Mbol или Clal), в состав сайтов
рестрикции которых входит данная метилированная последовательность, перестают расщеплять ДНК по этим сайтам. Аналогичное действие на некоторые рестриктазы, например EcoRII, оказывает и dcm-метилаза, осуществляющая метилирование остатков цитозина по положению С5 в последовательностях CMeCAGG и CMeCTGG.
1.3.5.2 ДНК-лигазы
Создание фосфодиэфирных связей в одноцепочечных разрывах двухцепочечной ДНК с помощью ДНК-лигаз является, наряду с рестрикцией, одним из важнейших этапов получения рекомбинантных ДНК in vitro. Наибольшее применение в генно-инженерных исследованиях находит ДНК-лигаза бактериофага Т4. Реакция лигирования протекает в два этапа. Вначале образуется промежуточный комплекс фермент-АМР (этап 1), после чего остаток AMP переносится на 5'-фосфатную группу концевого нуклеотида в точке разрыва ДНК (этап 2). Образовавшаяся фосфодиэфирная связь гидролизуется во время нуклеофильной атаки З'-ОН группы соседнего нуклеотида, что приводит к образованию новой фосфодиэфирной связи, восстанавливающей целостность сахаро-фосфатного остова ДНК. Т4-ДНК- лигаза осуществляет соединение фрагментов двухцепочечной ДНК, обладающих комплементарными "липкими" или "тупыми" концами. Как следует из механизма реакции, необходимым условием протекания лигирования является наличие 5'-концевого фосфата и З'-концевого гидроксила в точках разрыва цепей ДНК. При этом эффективность соединения фрагментов ДНК по "тупым" концам Т4-ДНК-лигазой возрастает в присутствии Т4-РНК-лигазы, которая осуществляет ковалентное соединение 5'-фосфорилированных концов одноцепочечных ДНК или РНК с З'-ОН группами одноцепочечных нуклеиновых кислот.
1.3.6 Векторы
Ферменты, описанные в предыдущем разделе, позволяют производить тонкие манипуляции как с протяженными молекулами ДНК, так и с их фрагментами. В частности, с помощью рестриктаз можно с большой точностью разрезать молекулы ДНК, а образовавшиеся в результате фрагменты соединять в любой желаемой последовательности друг с другом, восстанавливая сахаро- фосфатный остов молекулы ДНК с помощью ДНК-лигазы. Однако с использованием только этих ферментов еще нельзя решить одну из основных методических задач молекулярной генетики - выделение любой требуемой нуклеотидной последовательности в чистом виде и в количестве, достаточном для исследования этих последовательностей биохимическими методами. Исключение составляет метод ПЦР, однако его применение ограничивается короткими последовательностями нуклеотидов.
Основная идея, позволяющая решать эту задачу, заключается в том, чтобы присоединить исследуемые фрагменты ДНК к молекуле-переносчику, которая могла бы автономно существовать внутри бактериальных или эукариотических клеток в виде одной или нескольких копий и передаваться вместе со встроенным в нее фрагментом ДНК от одной клетки к другой. Такие молекулы- переносчики фрагментов нуклеиновых кислот были созданы, их называют векторами, и они являются одним из важнейших инструментов генной инженерии.
Идеальная векторная молекула должна обладать несколькими обязательными свойствами. Во-первых, любой вектор должен длительное время существовать в популяции клеток-хозяев, т.е. реплицироваться автономно или вместе с хромосомами клеток. Во-вторых, в любом векторе должны быть биохимические или генетические маркеры, которые позволяли бы обнаруживать его присутствие в клетках. В-третьих, структура векторной молекулы должна допускать встраивание в нее чужеродной последовательности нуклеотидов без нарушения ее функциональной целостности. Для конструирования векторов в генной инженерии используют небольшие молекулы нуклеиновых кислот, способные к автономной репликации в бактериальных и эукариотических клетках - плазмиды, хромосомы вирусов, а также фрагменты хромосом эукариотических клеток /15, 16/.
Различные векторы для клонирования ДНК и их рестрикционные карты приведены на рисунке 1.4
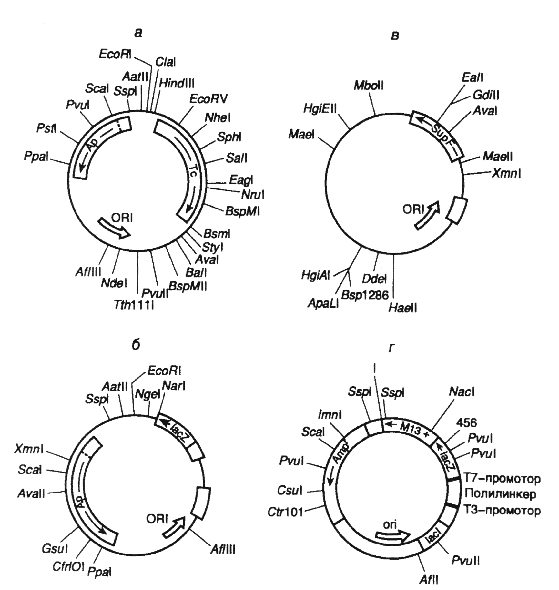
Первые эффективные векторы для клонирования фрагментов чужеродной ДНК, не утратившие своего значения и поныне, были получены с использованием бактериальных плазмид. Большая серия векторных плазмид, обозначенных символом pBR, создана на основе репликона природной плазмиды ColEI, придающей клеткам Е. coli устойчивость к колицину путем его объединения с генами устойчивости к антибиотикам. Таким образом, бактериальные клетки, несущие подобные комбинированные плазмиды, приобретали устойчивость к соответствующим антибиотикам, и их было легко отличить от бесплазмидных клеток путем простого посева на питательную среду с антибиотиками. Генетическая карта одного широко распространенного вектора этой серии - pBR322 изображена на рис. II.5,а.
Такая плазмида представляет собой кольцевую ковалентно замкнутую молекулу ДНК длиной 4363 и.о. Последовательность нуклеотидов pBR322 полностью известна. Плазмида содержит гены устойчивости к тетрациклину (Тс) и ампициллину (Ар), которые были перенесены в плазмиду pBR322 из плазмиды pSClOl и транспозона ТпЗ соответственно. Оба этих гена являются селектируемыми генетическими маркерами плазмиды, т.е. позволяют проводить отбор бактериальных клеток с плазмидой pBR322 по их способности к росту на питательных средах в присутствии тетрациклина и(или) ампициллина. Плазмида pBR322 содержит также обеспечивающий ее стабильную репликацию в клетках Е. coli участок ДНК, который включает область начала репликации (ori). Характерной чертой плазмиды pBR322, как и любого современного вектора, является наличие в ней нескольких уникальных сайтов рестрикции, обозначенных на генетической карте. Следует иметь в виду, что встраивание в плазмиду клонируемых чужеродных фрагментов ДНК по сайтам рестрикции, расположенным в генах Ар или Тс (например PstI или BamHI), будет нарушать целостность этих генов и их функциональную активность. В результате происходит утрата бактериальными клетками, содержащими рекомбинантные плазмиды, устойчивости к соответствующим антибиотикам.
1.3.7 Введение вектора в клетку
Клетка-реципиент—эта та среда, в которой может функционировать рекомбинантная ДНК в виде вектора. Такие клетки называют пермиссивными. К ним предъявляют следующие требования:
не разрушаются чужеродной ДНК или РНК собственными ферментам;
срабатывает механизм репликации вектора;
проявляется выраженная активность промотера и/или терминатора транскрипции р-ДНК;
отмечается полный сплайсиг м-РНК ;
наблюдается эффективная трансляция м-РНК;
нет выраженной активности пептидогидролаз, катализирующих реакций гидролиза экспрессируемых чужеродных белков.
Часто в качестве пермиссивных клеток используют Е. coli, Bacillus subtilis, В. stearothermophilus, В. brevis, Saccharomyces cerevisiae.
Для включения вектора в пермессивные клетки используют различные методы: трансформация, инфекция, микроинъекция.
Клетки, способные адсорбировать и поглощать вектор, называют компетентными. У таких клеток изменены свойства клеточной стенки: снижен поверхностный заряд и повышена чувствительность к осмотическому шоку.
Компетентность клеток можно повысить, используя соли кальциялибо совместно соли кальция, магния, рубидия. Кроме того, применяют глубокое замораживание и оттаивание, а также электропорацию (кратковременное воздействие электрического поля высокой напряженности, которое вызывает разрушение цитоплазматической мембраны с образованием пор).
1.3.8 Обнаружение рекомбинантного клона
Обнаружение рекомбинантных микроорганизмов проводят, используя встроенные в вектор маркеры (например, резистентности к какому-либо антибиотику).
Подробнее рассмотрим обнаружение рекомбинантного клона на примере рассмотренной выше плазмиды pBR322. В данном случае легко различить бактериальные клетки, не содержащие плазмиды (не растут в присутствии ампициллина и тетрациклина), клетки с плазмидой, не содержащей вставки клонируемой ДНК (растут в присутствии обоих антибиотиков), и клетки с рекомбинантными плазмидами (в зависимости от локализации вставки могут расти на среде только с одним из двух вышеупомянутых антибиотиков). Следовательно, наличие в векторных молекулах селектируемых маркеров резко повышает эффективность клонирования из-за возможности проведения быстрого отбора рекомбинантных плазмид на селективных питательных средах.
Помимо генов устойчивости к антибиотикам в качестве селектируемых маркеров используют и другие гены или их фрагменты. В частности, для этих целей часто применяются гены различных ферментов, присутствие которых в клетках в составе плазмиды обнаруживают по появлению соответствующей ферментативной активности.
2.Научно-исследовательская часть
2.1 Характеристика объекта исследования
Целью выполненной нами работы явилось получение Ad-вектора на основе генома аденовируса птиц CELO (chicken embryo lethal orphan или fowl adenovirus type 1) методом гомологичной рекомбинации в Escherichia coli ( E. coli, кишечной палочке).
Преимущества плазмиды, рекомбинирующей в Е. coli, перед плазмидами, рекомбинирующими в культуре клеток, следующие: легкость выращивания бактериальных клеток по сравнению с трудоемким процессом ведения культур перевиваемых или полуперевиваемых эукариотических клеток; менее жесткие условия стерильности при выращивании бактерий; дешевизна посевного бактериального материала.
В настоящее время аденовирусы (Ad) хорошо изучены в качестве этиологических агентов различных инфекционных заболеваний человека и животных как модели для многочисленных исследований в молекулярной биологии, включая изучение сплайсинга мРНК, репликации ДНК, транскрипции и клеточной трансформации. Ad широко применяют в качестве векторов для транзиентной экспрессии генов в клетках млекопитающих. Известно большое количество методов внесения изменений в геном Ad для создания векторов, способных трансдуцировать клетки млекопитающих in vivo, исследуется применение векторов на основе Ad человека в генной терапии. Векторы на основе генома Ad человека (Ad2, Ad5 и другие) имеют ряд недостатков: предсуществующий иммунный ответ организма человека на данные Ad, ограниченный спектр клеток, в которые Ad человека эффективно проникают; наращивание препаративных количеств Ad человека в культуре клеток является трудоемким и дорогостоящим процессом. В связи с этим вызывают интерес исследования, направленные на создание векторных систем на основе генома Ad животных, в первую очередь птиц, которые были бы способны проникать в различные типы клеток с большой эффективностью, на которые не было бы предсуществующего иммунного ответа в организме человека и наращивание которых в куриных эмбрионах было более технологичным и экономически выгодным.
По общей структуре вирус CELO сходен с вирусами млекопитающих, однако размер геномной ДНК у вируса CELO (44 тысячи пар оснований-т.н.п.) больше, чем у Ad5 (36 т.н.п.). Особенностью структуры капсида вириона CELO является наличие двух фиберов различной длины, отходящих от одного основания пентона, в отличие от большинства других Ad млекопитающих и птиц, имеющих один фибер. Известно, что CELO не способен к полноценному циклу репликации в клетках человека или млекопитающих и является по отношению к данным хозяевам дефектным. Была показана возможность получения Ad-вектора на основе генома CELO.
Преимуществами векторов на основе генома CELO являются отсутствие первичного иммунного ответа в организме человека и животных, большая пакующая емкость и более высокая физическая стабильность вирионов, чем Ad человека. Наращивание вируса CELO возможно в куриных эмбрионах в
больших количествах (10 вирусных частиц из одного эмбриона), что значительно снижает стоимость получения препаративных количеств вируса.
2.2 Описание эксперимента
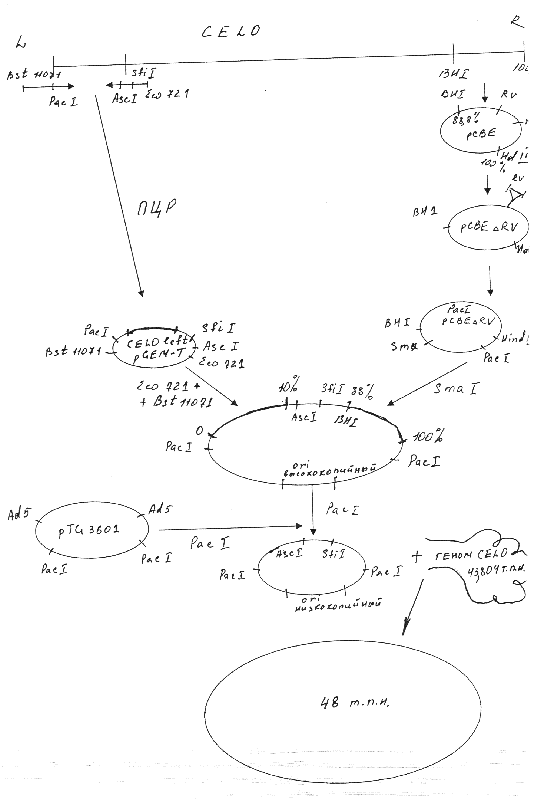
Для получения рекомбинантного аденовируса CELO методом котрансформации с ДНК вируса CELO дикого типа сконструированная плазмида должна содержать правый и левый фрагменты ДНК указанного вируса. Мы использовали плазмиду pCBEl, содержащую правый концевой фрагмент генома вируса CELO от 88.8 доЮО единиц карты (ед. к.). Участок генома от 95,3 до 99,7 ед. к., который не является существенным для репликации вируса, был делетирован из pCBEl по сайтам рестриктазы EcoRV. Указанным способом была получена плазмида pCBEARV. Полученная плазмида была подвергнута гидролизу рестриктазой Hind3 с последующим дефосфорилированием, а затем обработке олигонуклеотидом , содержащим сайт распознавания рестриктазы Рас 1.
Левый фрагмент вируса CELO был клонирован в плазмиду pGEM-T путем постановки полимеразной цепной реакции (ПЦР). В качестве праймеров были использованы олигонуклеотиды, содержащие следующие сайты рестрикции: первый - Bst и Pad, второй—Asc, Sfi и Есо721.Число циклов амплификации составило 15.
Следующий этап заключался в проведении гидролиза полученных плазмид; PacpCBEARV по сайту рестрикции Smal, CELOleftpGEM-T путем обработки рестриктазами Bstl 1071 и Есо721. Из полученных фрагментов была сконструирована плазмида, несущая правый и левый концы генома аденовируса CELO. Недостатком полученной плазмиды являлось наличие высококопийного ori ( ori—участок, в котором начинает расплетаться ДНК при помощи ДНК- полимеразы). Учитывая наличие двух сайтов рестрикции по Pad, ori было сменено при помощи рестрикции по указанным сайтам и последующим соединением липких концов образованного фрагмента с частью плазмиды pTG3601, гидролизованной также по двум сайтам Pad.
Полученная плазмида была рестриктирована по Ascl и котрансформирована с геномом вируса CELO по гомологичным участкам. Таким образом нами был получен Ad-вектор для экспрессии генов на основе генома аденовируса птиц CELO. Указанная схема представлена на рисунке 2.1.
2
2.3 Обработка экспериментальных данных
Плазмида с измененным ori была подвергнута наращиванию в Е. coli препаративных количествах. Для доказательства идентичности полученных плазмид с исходной был проведен рестрикционный анализ. В лунки 0.8% агарозного геля были внесены следующие пробы: в первую—маркер молекулярного веса (геном фага X, разрезанный рестриктазой РСТ, см. рисунок 2, б));
во вторую — плазмида, нарощенная в препаративных количествах; в третью - первоначально полученную плазмиду. По результату электрофореза, представленному на рисунке 2.2, можно судить об идентичности молекулярного состава указанных плазмид.
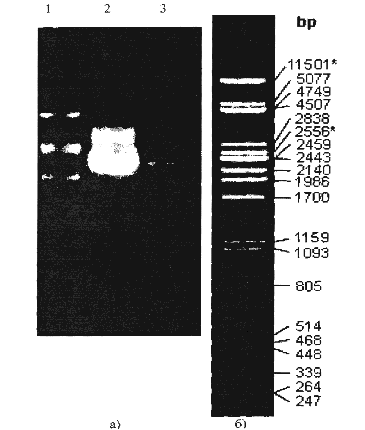
Плазмида, полученная после рекомбинации с геномом CELO и имеющая 48 тысяч пар оснований, была подвергнута обработке рестриктазой HindHI. Указанная рестриктаза активна при следующей комбинации нуклеотидов:
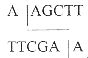
Количество сайтов рестрикции в полученной плазмиде и их местоположение указаны на рисунке:
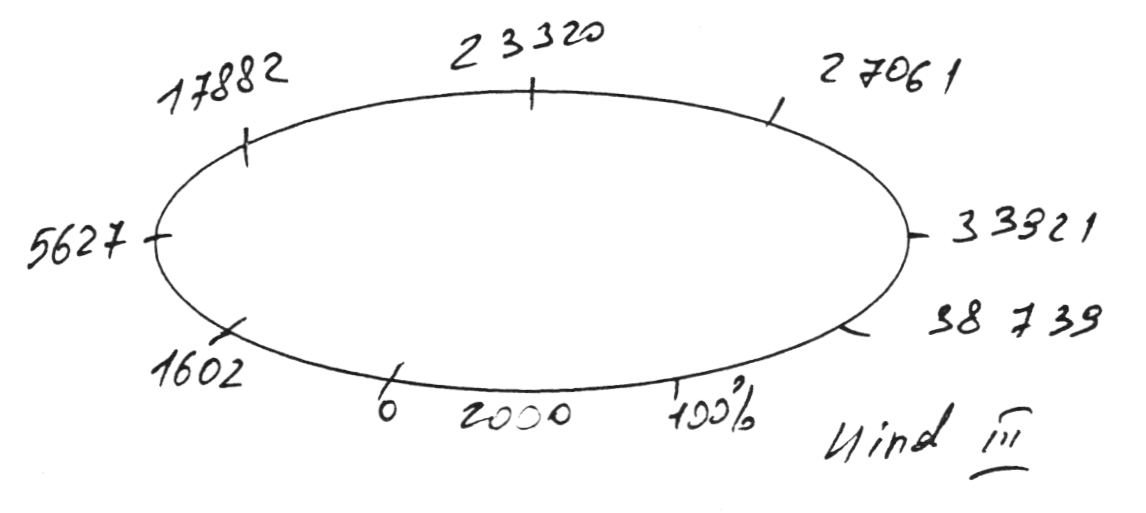
Пробы после рестрикции были подвергнуты электрофорезу. В первую, вторую и третью лунку помещены целевые плазмиды, полученные из разных клонов Е. coli. В четвертую лунку помещена плазмида, неподвергавшаяся рестрикции, в пятую — маркер молекулярного веса.
Результаты рестрикционного анализа свидетельствуют об идентичности полученных фрагментов с ожидаемыми.
Заключение
В заключении данной работы рассмотрим наиболее существенные и практически значимые достижения рекомбинантной ДНК-биотехнологии, а также перспективы её развития.
Начиная с момента открытия двойной спиральной структуры а особенно после расшифровки генома человека, научные изыскания приносят значительные практические результаты, наиболее перспективные из которых следующие: конструирование рекомбинантных организмов-продуцентов жизненно необходимых лекарственных средств, получение которых альтернативными методами невозможно или сопряжено со значительными трудностями; разработка генетических вакцин; развитие генной терапии; применение трансгенных растений и животных для интенсификации сельского хозяйства.
Сравнение структур генов секвенированных к настоящему времени геномов человека, дрозофилы нематоды, дрожжей и бактерий приводит к выводу, что все живые существа действительно произошли от общего предшественника, так как родственные гены легко идентифицируются в геномах представителей всех трех царств живых организмов. Указанный факт теоретически обосновывает возможность встраивания и успешного функционирования чужеродных генов в организме. В настоящее время широкий спектр биологически активных веществ производится рекомбинантными организмами (соматотропин, инсулин, интерфероны, интерлейкин - 2).
Одним из самых современных и перспективных направлений биотехнологии является разработка генетических вакцин. Преимуществом генетических вакцин является возможность фокусирования иммунного ответа на одном или нескольких определенных антигенах возбудителя, что принципиально невозможно при использовании традиционных вакцин и не происходит при течении инфекционного процесса, а также возможность их использования не только в превентивных, но и в терапевтических целях для лечения аутоиммунных заболеваний, аллергий и злокачественных новообразований.
К терапии нового поколения относится генная или клеточная терапия основанная на превращении стволовых клеток в любые другие необходимые для организма клетки. В настоящее время указанная выше методика находится в стадии разработки, но имеет реальную перспективу.
Литература
Альбертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки в 3-х томах. — М.: Мир, 1994. — 1558 с. — ISBN 5-03-001986-3.
Докинз Р. Эгоистичный ген. — М.: Мир.[82]
История биологии с начала XX века до наших дней. — М.: Наука, 1975. — 660 с.
Льюин Б. Гены. — М.: Мир, 1987. — 1064 с.
Пташне М. Переключение генов. Регуляция генной активности и фаг лямбда. — М.: Мир, 1989. — 160 с.[83]
Уотсон Дж. Д. Двойная спираль: воспоминания об открытии структуры ДНК. — М.: Мир, 1969. — 152 с.
Burgers P, Koonin E, Bruford E et al. (2001). «Eukaryotic DNA polymerases: proposal for a revised nomenclature». J. Biol. Chem. 276 (47): 43487-90. PMID 11579108
Авторозов Е.К. Лекции по микробиологии и биотехнологии – М.: Эксмо, 2000
Елинов М.П. Основы биотехнологии – М.: Москва, 2004
Егорова Н.С. Биотехнология. Учебное пособие для ВУЗов – М.: Просвещение, 2009.