Получение рекомбинантного аденовируса CELO
СОДЕРЖАНИЕ
Введение
1. Литературный
обзор
1.1 Генетические
механизмы
наследственности
1.1.1 Характеристика
нуклеиновых
кислот
1.1.2 Нуклеозиды
и нуклеотиды
1.1.3 Первичная
структура ДНК
1.1.4 Вторичная
структура ДНК
1.1.5 Третичная
структура
(суперспирализация)
ДНК
1.2 Эпигенетические
механизмы
наследственности
1.2.1 Контроль
активации генов
1.2.2 Роль хроматина
в жизни клетки
1.2.3 Структура
хроматина
1.2.4 Характеристика
«гистонового
кода»
1.3 Современные
методы ДНК-технологии
1.3.1 Содержание
генетической
инженерии
1.3.2 Методы
исследования
структуры и
функции гена
1.3.3 Предмет
рекомбинантной
ДНК-биотехнологии
1.3.4 Получение
чужеродной
ДНК
1.3.5 Конструирование
рекомбинантных
ДНК
1.3.5.1. ДНК-рестриктазы
и ДНК-метилазы
1.3.5.2 ДНК-лигазы
1.3.6 Векторы
1.3.7 Введение
вектора в клетку
1.3.8 Обнаружение
рекомбинантного
клона
2. Научно-исследовательская
часть
2.1 Характеристика
объекта исследования
2.2 Описание
эксперимента
2.3 Обработка
экспериментальных
данных
Заключение
Введение
Проблема
изучения структуры
и функции ДНК,
а также возможности
ее искусственного
изменения и
создания организмов
с заданными
наследственными
свойствами
- одна из центральных
задач биотехнологии.
Предлагаемая
курсовая работа
структурно
состоит из двух
частей: первая
содержит литературный
обзор наиболее
важных положений
учения о ДНК
и характеризует
современное
видение проблемы.
Вторая часть
научно- исследовательская,
выполненная
автором на базе
Государственного
НИИ эпидемиологии
и микробиологии
им. Н.Ф. Гамалеи
(г. Москва) с целью
получения
плазмиды, пригодной
для создания
рекомбинантных
аденовирусов.
Первая часть
выполнена под
руководством
профессора
Н.С. Колобелина
(Воронежская
государственная
биофабрика),
вторая часть
под руководством
канд. биологических
наук, старшего
научного сотрудника
Д.Ю. Логинова
(ГУНИИ ЭМ им.
Гамалеи, г. Москва).
25 апреля 1953 г.
в журнале «Nature»
были напечатаны
две заметки.
Авторы первой
из них, названной
«Структура
дезоксирибонуклеиновой
кислоты», -
25-тилетний
американский
биохимик Джеймс
Уотсон и 37-тилетний
английский
биофизик Фрэнсис
Крик на полутора
страницах
описали знаменитую
двойную спираль
и попытались
объяснить, как
молекуле ДНК
удаётся добиться
такой точности
самовоспроизведения.
В другой
статье ровесник,
соотечественник
и коллега Крика
Морис Уилкинс
с соавторами
опубликовал
высококачественные
рентгенограммы
молекулы ДНК,
которые подтверждали
гипотезу её
«спиральности».
Ради справедливости
следует отметить,
что к открытию
структуры ДНК
имела прямое
отношение
Розалинда
Франклин, которая
в лаборатории
М. Уилкинса
сделала прекрасные
рентгенограммы
РНК, которые
были переданы
Д. Уотсону и Ф.
Крику.
Указанное
открытие инициировало
целый ряд
исследований
в области наук
о жизни. Начиная
с момента открытия,
а особенно
после расшифровки
генома человека
научные изыскания
дают значительные
практические
результаты,
наиболее
перспективные
из которых
следующие:
создание
организмов-продуцентов
биологически
активных веществ;
разработка
генетических
вакцин; развитие
генной терапии;
применение
трансгенных
растений и
животных для
интенсификации
сельского
хозяйства.
1. Литературный
обзор
1.1 Генетические
механизмы
наследственности
1.1.1
Характеристика
нуклеиновых
кислот
Нуклеиновые
кислоты - это
природные
высокомолекулярные
органические
соединения,
обеспечивающие
хранение и
передачу
наследственной
информации
в живых организмах.
Нуклеиновые
кислоты -
высокомолекулярные
соединения
со строго
определённой
линейной
последовательностью
мономеров.
Структура ДНК
и РНК - способ
«записи информации»,
обеспечивающий
формирование
в организме
двух информационных
потоков. Один
из потоков
осуществляет
воспроизведение
информации,
заключённой
в молекулах
ДНК. Удвоение
молекул ДНК
называется
«репликацией».
В результате
этого процесса
и последующего
деления дочерние
клетки наследуют
геном родительской
клетки, в котором
содержится
полный набор
генов, или инструкции
о строении РНК
и всех белков
организма.
Второй поток
информации
реализуется
в процессе
жизнедеятельности
клетки. В этом
случае происходит
«считывание»,
или транскрипция
генов в форме
полинуклеотидных
последовательностей
гпРНК и использование
их в качестве
матриц для
синтеза соответствующих
белков. В последнем
случае осуществляется
«перевод»
(трансляция)
информации,
заключённой
в тРНК, на «язык»
аминокислот.
Этот поток
информации
от ДНК через
РНК на белок
получил название
«центральная
догма биологии».
Суть новой
молекулярной
биологии заключается
в следующем:
всё начинается
с ДНК и заканчивается
белком. Между
ДНК и белком
находится РНК,
которая является
переносчиком
генетической
информации
от ДНК к белкам.
Дальше генетическая
информация
переносится
от РНК в особые
частицы рибосомы,
где реализуется
при биосинтезе
белков. Механизм
характерен
для всех живых
организмов,
за исключением
некоторых
РНК-содержащих
вирусов.
1.1.2 Нуклеозиды
и нуклеотиды
ДНК и РНК
состоят из
мономерных
единиц - нуклеотидов,
поэтому нуклеиновые
кислоты называют
полинуклеотидами.
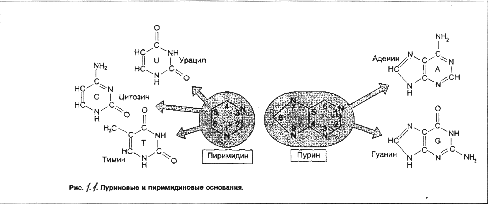
Строение
нуклеотидов.
Каждый нуклеотид
содержит 3 химически
различных
компонента:
гетероциклическое
азотистое
основание,
моносахарид
(пентозу) и остаток
фосфорной
кислоты. В состав
нуклеиновых
кислот входят
азотистые
основания двух
типов: пуриновые
- аденин (А), гуанин
(G) и пиримидиновые
- цитозин (С), тимин
(Т) и урацил (U) ~
см. рисунок
1.1.
Пентозы в
нуклеотидах
представлены
либо рибозой
(в составе РНК),
либо дезоксирибозой
(в составе ДНК).
Чтобы отличить
номера атомов
в пентозах от
нумерации
атомов в основаниях,
к цифре добавляют
штрих (') – 1’, 2', 3', 4'
и 5'. Пентозу
соединяет с
основанием
N-гликозидная
связь, образованная
Сг атомом пентозы
(рибозы или
дезоксирибозы)
и N1-атомом пиримидина
или N9- атомом
пурина.
Нуклеозиды
- соединения,
состоящие из
остатков азотистого
основания и
углевода - рибозы
или дезоксирибозы.
Нуклеотид
- это нуклеозид,
к которому
присоединены
молекулы фосфата
- см. рисунок
1.2.
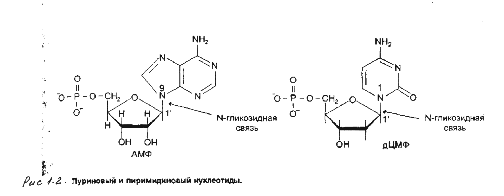
Остов нуклеиновой
кислоты имеет
одинаковое
строение по
всей длине
молекулы и
состоит из
чередующихся
групп - пентоза
- фосфат - пентоза.
Уникальность
структуры и
функциональная
индивидуальность
молекул ДНК
и РНК определяется
их первичной
структурой
- последовательностью
азотистых
оснований в
полинуклеотидной
цепи /4/.
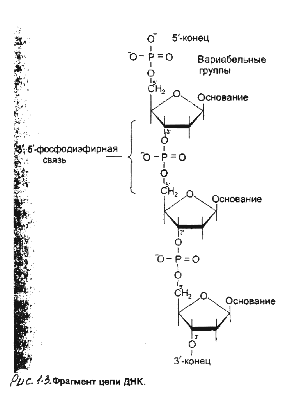
1.1.3 Первичная
структура ДНК
Первичная
структура ДНК
- порядок чередования
дезоксирибонуклеозидмонофосфатов
в полинуклеотидной
цепи. Каждая
фосфатная
группа в полинуклеотидной
цепи, за исключением
фосфорного
остатка на 5
'-конце молекулы,
участвует в
образовании
двух эфирных
связей с участием
3' и 5 '-углеводных
атомов двух
соседних
дезоксирибоз,
поэтому связь
между мономерами
обозначают
3',5' -фосфодиэфирной.
Концевые
нуклеотиды
ДНК различают
по структуре:
на 5'-конце находится
фосфатная
группа, а на
3'-конце цепи -
свободная
ОН-группа. Эти
концы называют
5' и 3'-концами —
см рисунок 1.3.
Линейная
последовательность
дезоксирибонуклеотидов
в полимерной
цепи ДНК обычно
сокращенно
записывают
с помощью
однобуквенного
кода, например
A-G-C - Т- Т- А- С- А от
5'-к З '-концу.
В
каждом мономере
нуклеиновой
кислоты присутствует
остаток фосфорной
кислоты. При
рН 7 фосфатная
группа полностью
ионизирована,
поэтому in vivo нуклеиновые
кислоты существуют
в виде полианионов
(имеют множественные
отрицательный
заряд). Остатки
пентоз тоже
проявляют
гидрофильные
свойства. Азотистые
основания почти
нерастворимы
в воде, но некоторые
атомы пуринового
и пиримидинового
циклов способны
образовывать
водородные
связи.
1.1.4 Вторичная
структура ДНК
Молекула
ДНК имеет форму
спирали, образованную
двумя полинуклеотидными
цепями, закрученными
относительно
друг друга и
вокруг общей
оси. Двойная
спираль правозакрученная,
полинуклеотидные
цепи в ней
антипараллельны,
т.е. если одна
из них ориентирована
в направлении
3' —> 5', то вторая
в направлении
5'—> 3'. Поэтому
на каждом из
концов молекулы
ДНК расположены
5' -конец одной
цепи и 3'-конец
другой цепи.
Двойная
спираль стала
символом новой,
молекулярной
биологии. Спираль
построена за
счёт комплементарных
оснований.
Именно двухцепочечностью
и комплементарностью
оснований
объясняются
биологические
функции ДНК.
В правовинтовой
спирали две
водородные
связи в паре
А - Т и три водородные
связи в паре
G - С . Естественно,
последняя пара
прочнее, а первая
слабее. Модель
Уотсона Крика
объяснила
правило Чаргаффа
- большое основание
- пуриновое
дополняется
маленьким
основанием
- одиночным
гетероциклом
пиримидина.
То же самое
вG-CивA-T. Благодаря
этому размеры
пар одинаковы
по ширине, что
и приводит к
регулярной
двойной спирали.
Спираль не
деформируется,
поскольку то,
что её скрепляет
внутри, симметрично
по отношению
друг к другу,
хотя и повёрнуто.
Плоскости
азотистых
оснований
наклонены по
отношению к
оси спирали
образуя третичную
структуру. В
местах сгиба
двойная спираль
имеет изломы,
то есть нарушается
классическая
двойная структура
ДНК.
1.2 Эпигенетические
механизмы
наследственности
1.2.1
Контроль активации
генов
Существует
мнение, что все
свойства клетки
и даже многоклеточного
организма
однозначно
определены
последовательностью
нуклеотидов
в ДНК. В настоящее
время это положение
подвергается
критике. Выдвинуты
представления
об эпигенетических
механизмах
избирательной
экспрессии
генов, ведущая
роль в которых
принадлежит
хроматину.
Именно на уровне
хроматина
работают основные
механизмы
программирования
развития живого
организма. Эти
механизмы
базируются
на структурно-функциональных
особенностях
нуклеосомы,
гистонов, формирующих
нуклеосомную
сердцевину,
межнуклеосомных
взаимодействиях,
тонко регулируемых
внешними сигналами.
На уровне нуклеосомы
реализуется
«гистоновый
код», управляющий
сложнейшим
каскадом
биохимических
реакций в клетке.
Все вышеуказанные
механизмы
обеспечивают
важнейшее
приспособление
организмов
к изменяющимся
условиям внешней
и внутренней
среды.
Геном
каждой клетки
человека составляет
около 40 тысяч
генов, но все
они одновременно
не используются.
В каждом клеточном
типе работает
около 20 тысяч
генов. Как минимум
половина всех
работающих
генов необходима
для поддержания
жизнедеятельности
любой клетки,
другая половина
определяет
специализацию
клетки, т.е. будет
ли она принадлежать
печени, почкам,
селезёнке,
другому органу
или ткани. Все
клетки содержат
одинаковую
информацию,
записанную
в молекуле ДНК,
но при развитии
организма эта
информация
в тканях или
органах считывается
избирательно,
что и приводит
к огромному
разнообразию
клеток в организме.
Существует
несколько
уровней контроля
активации
генов. Один из
них - модификация
ДНК, соответствующая
тем генам, которые
необходимо
выключить, т.е.
этот ген должен
молчать в данном
типе клеток.
При этом данный
признак сохраняется
и при удвоении
клетки. Однако
ДНК сама по
себе несёт
важнейшую
функцию кодирования
аминокислотной
последовательности
белков, и человек
не может произвольно
её модифицировать,
не затронув
этой информации
и не изменив
способность
ДНК к удвоению.
На
сегодня единственной
изученной
модификацией
ДНК, которая
не нарушает
кодирование
и копирование,
является
метилирование
цитозина, которое
выключает ген
и он становится
молчащим, и,
главное, это
свойство закрепляется
в наследственности,
т.е. в дочерней
клетке сохраняется
информация
о том, что данный
ген должен
молчать.
Как
же эта модификация
влияет на активацию
гена - на получение
РНК- копии данного
гена, служащей
в дальнейшем
матрицей для
синтеза белка?
Указанная
модификация
копируется
при удвоении
ДНК. Возможны
два механизма
контроля активации
гена. Первый
- отталкивание
белков, активирующих
ген, второй -
привлечение
к метилированной
ДНК белков,
которые селективно
узнают только
метилированную
ДНК и участвуют
в очень плотной
её упаковке
за счёт изменения
структуры
хроматина -
формы существования
генома высших
организмов.
Именно на уровне
хроматина
происходит
основной контроль
активации
генов.
Благодаря
расшифровке
генома возникли
две новые науки:
геномика, изучающая
геномы, и протеомика,
изучающая
совокупность
клеточных
белков. Почти
50 лет после открытия
ДНК господствовал
постулат: один
ген синтезирует
один белок.
После расшифровки
генома появилась
новая догма:
один ген - много
белков. Установлено,
что гены у высших
организмов
состоят из
кодирующих
и некодирующих
участков. В
результате
комбинаторики
из одного гена
путём соединения
кодирующих
участков можно
получить очень
много белков.
Если у человека
около 40 тысячи
генов (по геномике),
то по протеомике
можно получить
минимально
более 100 тысяч
белков. Это
только на уровне
первичной
структуры,
фактическая
ситуация ещё
сложнее, потому
что белки
подвергаются
модификациям,
на них «навешивается»
огромное количество
разных групп,
что приводит
к колоссальному
разнообразию.
Если геном
постоянен, то
протеом очень
вариабелен.
Уотсон очень
много сделал
для расшифровки
генома человека,
которая закончилась
в 2003 году /3/.
1.2.2 Роль
хроматина в
жизни клетки
Хроматин
- нуклеопротеид,
комплекс белков
с ДНК и РНК в
ядрах клеток,
обеспечивает
упаковку сравнительно
длинного фрагмента
ДНК в значительно
меньшее по
размерам ядро.
Хроматин -
чрезвычайно
сложный и динамичный
комплекс и в
живых клетках
высших организмов
он служит носителем
генетической
информации.
Избирательное
и комбинаторное
извлечение
информации
из ДНК, происходящее
на уровне хроматина,
приводят к
огромному
разнообразию
фенотипического
проявления
наследственного
материала.
Неудивительно
поэтому, что
при почти 80 %-ной
схожести геномов
человека и мыши
- эти два организма
весьма существенно
отличаются
друг от друга.
На
уровне хроматина,
а не ДНК наиболее
эффективно
работают многие
ферменты, участвующие
в избирательном
считывании
генетической
информации,
её удвоении
при делении
клетки и исправлении
возникающих
при этом ошибок
1.2.3
Структура
хроматина
Универсальные
компоненты
хроматина -
белки гистоны.
Гистоны
- это небольшие
по молекулярной
массе белки
с высоким содержанием
положительно
заряженных
аминокислотных
остатков - лизинов
и аргининов,
локализованных
преимущественно
в N- и С-концевых
неструктурированных
областях белка,
так называемых
«хвостах»,
которые играют
главную роль
в эпигенетических
механизмах.
В центральных,
наиболее
консервативных
участках гистонов
преобладают
гидрофобные
аминокислотные
остатки, необходимые
для белок-белкового
узнавания.
Существуют
пять типов
гистонов: HI, Н2А,
Н2В, НЗ, Н4. Последовательность
расположения
гистонов в
нуклеосоме
одинакова для
организмов-эукариотов
всех царств
живой природы:
грибов, растений,
животных.
Рассмотрим
строение нуклеосомы.
Нуклеосома
состоит из
восьми молекул
комплекса
гистонов: по
два гистона
Н2А и Н2В с высоким
содержанием
лизина, по два
богатых аргинином
гистона НЗ и
Н4. Этот гистоновый
октамер называется
«кор» (от лат.
cor - сердцевина)
На кор навивается
ДНК в виде
левозакрученной
суперспирали
с шагом 28 А, содержащей
80 пар нуклеотидов
на виток. Всего
на кор в нуклеосоме
навивается
1,75 витка или 146
пар нуклеотидов.
Описанная
нуклеосома
носит название
«минимальной»
или «кор-нуклеосомы».
Если в состав
нуклеосомы
входит гистон
HI, который связывается
с межнуклеосомной
ДНК, или линкером,
то такую нуклеосому
называют полной;
на неё навивается
2-2,5 витка ДНК
(160-200 пар нуклеотидов).
В основе
организации
нуклеосомы
лежит уровень
многоуровневого
узнавания. На
первом уровне
гистоны попарно
узнают друг
друга. Молекула
каждого гистона
состоит из
центрального
структурированного
трёхспирального
домена (одного
длинного и двух
коротких
альфа-спиральных
участков, соединённых
петельным
сегментом, так
называемая
гистонная
укладка) и двух
неструктурированных
N и С-«хвостов».
Спиральные
домены гистонов
взаимодействуют
друг с другом
(«рукопожатие»),
в результате
чего образуются
гетеродимеры
НЗ - Н4 и Н2А - Н2В.
Эти димеры
образуют тетрамер
НЗ - Н4 и два димера
Н2А - Н2В, формирующие
гистоновый
октамер, который
имеет клинообразную
форму, обеспечивающую
левое закручивание
спирали ДНК
вокруг себя.
На его поверхности,
обращённой
к ДНК, формируются
белковые структуры
{мотивы), которые
можно разделить
на три основных
типа.
Мотивы
первого типа
образованы
спаренными
петельными
сегментами
гистоновых
димеров (бета-мосты).
Мотивы
второго представляют
собой спаренные
N-концевые сегменты
первых спиральных
доменов каждого
гистона в
гетеродимерах.
К третьему типу
относят два
мотива, которые
формируются
двумя дополнительными
альфа спиральными
участками
гистона НЗ,
расположенными
по концам
суперспирали
ДНК,
где ДНК входит
и покидает
иуклеосому.
Суммарное число
всех мотивов
равно 14, что
соответствует
числу витков
двойной спирали
ДНК, накрученной
вокруг октамера.
Все
эти мотивы
содержат положительно
заряженные
аминокислоты
(в основном
аргинины), что
обеспечивает
электростатический
контакт октамера
с отрицательно
заряженными
фосфатами
сахарного
остова ДНК. При
этом 14 малых
бороздок ДНК
втягивают в
себя 14 аргинин
содержащих
мотивов гистонового
октамера,
расположенных
на поверхности
гистонового
кора и обращенных
к ДНК. Это приводит
к жёсткому
фиксированию
ДНК, которое
в малой степени
зависит от её
нуклеотидной
последовательности,
что и обеспечивает
универсальность
компактизации
ДНК на нуклеосомах.
Консервативная
глобулярная
часть гистонов
участвует в
формировании
гистонового
октамера и
фиксировании
на нём молекулы
ДНК. Так обеспечивается
первый уровень
компактизации.
При этом ДНК
оказывается
на поверхности
кора и остаётся
доступной для
взаимодействия
с другими белками.
В последние
годы изучалась
роль гистоновых
хвостов.
Согласно
рентгеноструктурному
анализу нуклеосом,
суперспираль
ДНК в нуклеосоме
закручена так,
что обеспечивается
выход «хвостов»
гистонов на
поверхность
нуклеосомы.
«Хвост» гистона
НЗ простирается
далеко от места
выхода на
поверхность
нуклеосомы
и фиксируется
межнуклеосомными
контактами.
«Хвост» гистона
Н4 имеет много
контактов с
поверхностью
димера Н2А - Н2В
соседней нуклеосомы.
«Хвосты» гистонов
выходят на
поверхность
хроматиновой
фибриллы, участвуют
в межнуклеосомном
взаимодействии,
очень подвижны
и подвергаются
многочисленным
модификациям:
ацетилированию,
фосфорилированию,
метилированию,
убиквитинилированию
и АДФ-рибозилированию.
Эти модификации
приводят к
изменению
заряда, гидрофобности
и других свойств
поверхности
белковых глобул.
В результате
формируется
сложная матрица
для узнавания
её другими
регуляторными
белками и внешними
сигналами.
Поскольку
концевые домены
гистонов участвуют
и в межнуклеосомном
взаимодействии,
вышеперечисленные
модификации
влияют и на
характер упаковки
хроматиновой
фибриллы, разрыхляя
или, наоборот,
уплотняя её,
что, в свою очередь
облегчает или
затрудняет
доступ к ДНК
многочисленным
регуляторным
факторам.
Эти
свойства «хвостов»
гистонов в
структуре
нуклеосомы
имеют большое
значение для
расшифровки
и понимания
механизмов
функционирования
хроматина, его
поведения при
активации
генов, репрессии
их и многих
других процессов,
связанных с
доступом к ДНК
/4/.
1.2.4
Характеристика
«гистонового
кода»
Наиболее
разработанной
в настоящее
время моделью
функционирования
хроматина
считается
«гистоновый
код». Это - разнообразный
набор модификаций
гистоиовых
«хвостов» на
поверхности
нуклеосом,
который можно
целенаправленно
менять и передавать
по наследству.
Он и определяет
функциональное
состояние гена.
«Гистоновый
код», по-видимому,
является основным
эпигенетическим
механизмом,
контролирующим
включение или
выключение
генов и передачу
программы этого
контроля по
наследству
от клетки к
клетке.
«Гистоновый
код» оказался
идеальным
эпигенетическим
механизмом,
с помощью которого
можно писать
программу
каскадного
включения -
выключения
генов при развитии,
не затрагивая
информацию
о белках, записанную
на самой ДНК.
Гипотеза
«гистонового
кода» предполагает,
что маркировки
на модифицированных
концевых заменах
гистонов должны
узнаваться
регуляторными
белками. Первым
был обнаружен
так называемый
бромодомен,
который специфически
узнает ацетилированные
лизины на гистоновых
«хвостах».
Бромодомен
присутствует
во многих регуляторах
транскрипции
генов (например,
белок TAFn250). (Субъединица
базального
транскипционного
фактора TFIID) узнаёт,
например, комбинацию
нескольких
ацетильных
групп и имеет
две последовательно
расположенные
копии бромодомена,
каждая их которых
узнаёт свою
ацетильную
группу.
Другой
белковый домен,
узнающий маркировки
на гистоновых
«хвостах»,
называется
хромодоменом.
Из несущих
хромодомен
белков лучше
всего изучен
НР1 (от англ.
Heterochromatin protein). Этот белок
принимает
участие в структурной
организации
гетерохроматина
- области хроматина,
находящейся
в высококонденсированном
состоянии, где
все гены репрессированы.
Таким образом,
белок НР1 - это
маркёр неактивного
состояния
хроматина. Он
имеет высокое
сродство к
метилированному
9-му лизину (Tys-9)
гистона НЗ.
Связываясь
с метилированным
Tys-9 НЗ в одной
нуклеосоме,
белок HP 1 в свою
очередь, метилирует
соседние нуклеосомы,
что вызывает
распознание
области метилирования
хроматина. Этим
достигается
эффект высококонденсированного
состояния на
протяжённых
участках хроматина.
В настоящее
время ведётся
поиск доменов,
узнающих другие
модификации
«хвостов»
гистонов
(фосфорилирование,
убиквитинилирование
и АДФ-рибозилирование).
Существуют
несколько
вариантов
реализации
«гистонового
кода».
Согласно
одному из них,
модификации
гистоновых
«хвостов»,
участвующих
в межнуклеосомных
взаимодействиях,
изменяют их
суммарный
заряд, за счёт
чего уменьшается
степень компактизации
хроматиновой
фибриллы, и ДНК
становится
доступной для
регуляторных
белков. В этом
случае роль
ферментов,
модифицирующих
«хвосты» гистонов,
заключается
только в увеличении
зоны модификаций,
и как следствие
- усиление эффекта
компактизации
либо декомпактизации.
Другой
механизм изменения
статуса гена,
маркированного
определёнными
сигналами по
«хвостам»
гистонов, связан
с факторами
перестройки
хроматина. В
1992 году на дрожжах
впервые было
показано, что
в присутствии
АТФ определенные
белковые комплексы
обладали способностью
изменять структуру
хроматина,
удаляя или
сдвигая нуклеосомы
с регуляторных
участков ДНК.
При этом активировались
молчащие гены.
В состав такого
комплекса
входят белки,
несущие бромодомены,
хромодомены,
избирательно
узнающие
модифицированные
«хвосты» гистонов.
Это позволяет
целенаправленно
доставлять
комплекс к
регуляторному
участку гена,
где и происходят
структурные
изменения в
хроматине,
облегчающие
доступ к ДНК
белкам, активирующим
транскрипцию
этого гена.
Получены
данные, свидетельствующие,
что белки, узнающие
«гистоновый
код», выполняют
транспортную
функцию: доставляют
к необходимым
генам комплекс
регуляторных
белков, порождающих
целый каскад
биохимических
реакций в области
хроматина,
который соответствует
регуляторному
участку гена.
В состав комплекса
могут входить
как модифицирующие
белки, так и
транскрипционные
факторы.
Изучение
эпигенетических
механизмов
уже перестало
быть только
проблемой
фундаментальной
науки. Известно,
что уровень
и характер
метилирования
ДНК отклоняется
от нормы при
канцерогенезе
и старении.
Понимание того,
что метилирование
ДНК определяется
эпигенетическим
молчанием
хроматина,
проливает свет
на механизмы
этих процессов.
Расшифровка
специфического
эпигенетического
«ракового кода»
и «кода старения»
на уровне
метилирования
ДНК имеет огромное
практическое
значение. Итак,
сделаем вывод:
многочисленные
модификации
гистоновых
«хвостов»,
экспонированные
на поверхности
хроматиновой
фибриллы, и их
комбинации,
огромный набор
специализированных
ферментов,
узнающих эти
комбинации,
позволяют
записать очень
сложную программу
последовательности
включения -
выключение
генов. В этом
случае генетической
информации,
записанной
на ДНК, оказывается
недостаточно
для получения
полноценного
организма. К
информации
должна прилагаться
инструкция
по её использованию.
Подтверждением
вышесказанного
могут служить
огромные сложности
при получении
клонов животных.
Если берётся
ДНК из клетки
любого органа
и переносится
в яйцеклетку,
где всё подготовлено
к тому, чтобы
дать развитие
новому организму,
то выясняется,
что эпигенетические
механизмы
развития в
исходной клетке
давно запущены,
стереть эту
информацию
невозможно
и многие гены
уже никогда
не смогут начать
работать. Несмотря
на то, что имеется
полная генетическая
копия, то есть
геном представлен
абсолютно такой
же ДНК, как запустить
программу
развития, клетка
не знает. Этой
информацией
обладают только
ДНК половых
клеток и так
называемых
эмбриональных
стволовых
клеток - первые
деления оплодотворённой
яйцеклетки.
Только на этой
стадии эпигенетические
механизмы ещё
не включены,
и клетка может
стать и клеткой
печени, и клеткой
мозга, и клеткой
кожи. На начальных
этапах исследования
ДНК казалось,
что, расшифровав
полную генетическую
информацию
геномной ДНК,
появится возможность
управлять
внутриклеточными
процессами.
Однако выясняется,
что важна и
эпигенетическая
информация,
язык которой
гораздо сложнее
и от полной
расшифровки
которой наука
ещё очень далека.
1.3. Современные
методы ДНК-технологии.
1.3.1 Содержание
генетической
инженерии
В предыдущих
разделах описывались
генетические
и эпигенетические
механизмы
наследственности.
Современные
методики позволяют
модифицировать
наследственную
информацию
и конструировать
организмы с
заданными
наследственными
свойствами.
Эти методы
составляют
предмет генетической
инженерии.
Генетическая
инженерия - это
искусство
использования
знаний, методов
и техники
физико-химической
биологии и
молекулярной
генетики для
конструирования
организмов
с заданными
наследственными
свойствами.
Конечная цель
состоит в получение
рекомбинантной
ДНК с последующим
включением
её в реципиентную
клетку или в
осуществлении
переноса целых
хромосом от
клеток-доноров
в клетки-реципиентов.
В основу генно-
инженерных
методов заложена
способность
ферментов
(рестриктаз)
расщеплять
ДНК на отдельные
нуклеотидные
последовательности,
которые могут
быть использованы
для встраивания
их в геномы
бактериальных
плазмид и фагов
с целью получения
гибридных форм,
состоящих из
собственной
ДНК и дополнительных
встроенных
фрагментов
несвойственной
им ДНК. Таким
способом добиваются
клонирования
генов, когда
выделяют нужный
отрезок ДНК
из какого-либо
биообъекта
и затем получают
любое количество
его, выращивая
колонии генетически
идентичных
клеток, содержащих
заданный участок
ДНК. Другими
словами, клонирование
ДНК—это получение
её генетически
идентичных
копий.
Генетическую
инженерию
подразделяют
на генную инженерию,
геномную инженерию,
и хромосомную
инженерию.
Сущность первой
состоит в
целенаправленном
использовании
перестроек
естественного
генома, осуществляемых
in vivo или in vitro, для
изменения
генетических
характеристик
известных
вирусов и клеток.
Примером генной
инженерии in
vitro является
создание молекулярных
химер из фрагментов
ДНК разного
происхождения,
включения их
в реципиентные
клетки Е. coli, Вас.
subtilis и др., с последующим
культивированием
этих организмов
в целях получения
необходимых
белковых продуктов
(пептидных
гормонов, ферментов
и т.д.)
Сущность
геномной инженерии
заключается
в целенаправленной
глубокой перестройке
генома прокариот
или эукариот
вплоть до создания
новых видов.
При геномной
инженерии
добиваются
внесения большого
количества
дополнительной
генетической
информации
и в результате
получают гибридный
организм,
отличающийся
от исходного
по ряду признаков.
В случае
переноса
изолированных
хромосом от
клетки-донора
одного организма
в клетку-реципиент
другого организма,
говорят о хромосомной
инженерии.
Благодаря
хромосомной
инженерии стали
возможными
получение
высокомолекулярных
БАВ, присущих
человеку, лечение
наследственных
заболеваний,
селекция пород
домашних животных
и различных
видов растений.
1.3.2 Методы
исследования
структуры и
функции гена
Образование
новых сочетаний
генов и их частей
в природных
условиях,
по-видимому,
не носит целенаправленного
характера, и
лишь жесткая
проверка естественным
отбором может
оценить жизненную
значимость
таких преобразований
геномов. Однако
сознательное
использование
в лабораторных
условиях основных
генетических
принципов,
лежащих в основе
природных
перемещений
генов, позволило
разработать
более эффективные
системы передачи
генетической
информации
между организмами
и приступить
к беспрецедентным
по информативности
исследованиям
генетических
явлений на
молекулярном
уровне.
Необходимость
манипулирования
генами диктуется
конкретными
задачами
фундаментальных
и прикладных
исследований.
Для понимания
молекулярных
механизмов
функционирования
отдельных генов
и взаимосвязанных
генетических
систем большое
значение имеет
работа с изолированными
генами. Такие
исследования
позволяют
определить
границы генов,
выделить их
в чистом виде
и идентифицировать
элементы структуры,
существенные
для функционирования.
Доказательством
функциональной
значимости
выделенного
участка генома
может быть
только его
нормальная
экспрессия
в модельной
генетической
системе. Поэтому
следующим
этапом исследования
выделейного
гена всегда
является перемещение
его в такую
генетическую
систему, где
экспрессия
гена легко
обнаруживается.
Результаты
экспрессии
оценивают либо
по появлению
белкового
продукта, кодируемого
исследуемым
геном, либо по
изменению
функций биологической
системы вследствие
появления в
ней новой
ферментативной
или другой
активности,
например по
компенсации
присутствующей
в этой системе
мутации. Таким
образом, в результате
исследования
структуры
конкретного
гена и моделирования
его экспрессии
в искусственной
генетической
системе можно
понять особенности
его функционирования
в живом организме.
Подобный подход
может быть
успешно применен
как к известным
генам, которые
выделяются
целенаправленно,
так и к неидентифицированным
ранее последовательностям
нуклеотидов,
функциональную
значимость
которых определяют
лишь после
выделения их
в чистом виде.
Последний
подход реализуется
в так называемой
обратной генетике.
В настоящее
время с помощью
методов генной
инженерии
получены данные
о структуре
и функционировании
генов разнообразных
организмов,
что дало возможность
перейти на
качественно
новый уровень
генетических
исследований.
Это, во-первых,
возможность
переноса генова
в ное для него
генетическое
окружение с
дальнейшей
его экспрессией,
что ведет к
изменению
свойств организма,
в геном которого
вводится ген
(например создание
продуцентов
биологически
активных веществ
или трансгенных
животных), а
также осуществление
генотерапии
наследственных
и приобретенных
заболеваний
путем искусственного
замещения
мутантных
аллелей. Во-вторых,
стало реальным
конструирование
новых генов
путем объединения
in vitro как известных,
так и новых,
искусственно
синтезированных
последовательностей
нуклеотидов.
Этот подход
используется
в белковой
инженерии для
исследования
функциональной
значимости
отдельных
аминокислот
и доменов в
полипептидных
цепях ферментов,
а также для
создания новых
белков. В- третьих,
в современной
биотехнологии
появилась
возможность
применять
изолированные
гены в составе
генно-инженерных
конструкций
для получения
пищевых продуктов
и биологически
активных веществ
белковой природы
1.3.3 Предмет
рекомбинантной
ДНК-биотехнологии
Практическое
использование
рекомбинантных
ДНК различного
происхождения
составляет
основу рекомбинантной
ДНК-биотехнологии,
или сокращенно
рДНК-биотехнологии.
Сущность
рДНК-биотехнологии
заключается
в том, что нуклеотидная
последовательность,
которую необходимо
выделить или
размножить,
ковалентно
встраивается
в самореплицируюшиеся
молекулы нуклеиновой
кислоты, называемые
векторами.
Далее такая
последовательность
нуклеотидов
в составе вектора
вводится в
клетки про- или
эукариотического
организма, и
эти гибридные
клетки в селективных
условиях,
обеспечивающих
сохранение
вектора внутри
клеток, выращивают
на питательной
среде. В результате
образуется
клон клеток,
теоретически
содержащих
идентичные
векторные
молекулы с
одной и той же
вставкой чужеродной
последовательности
нуклеотидов.
Поскольку
объединение
молекул клонируемой
последовательности
нуклеотидов
и вектора является
не чем иным,
как рекомбинацией
in vitro, такие гибридные
молекулы называют
рекомбинантными
молекулами.
В настоящее
время разработаны
многочисленные
методы, позволяющие
выделять определенные
последовательности
нуклеотидов
из сложной
смеси фрагментов
хромосомной
ДНК, а также
осуществлять
обмен между
строго определенными
фрагментами
генов и другими
последовательностями
нуклеиновых
кислот. Во всех
этих реакциях,
как правило,
используются
высокоочищенные
препараты
нуклеиновых
кислот и ферментов
нуклеинового
обмена /8/.
рДНК-биотехнологию
подразделяют
на следующие
этапы: получение
чужеродной
ДНК, разрезание
полученной
ДНК на фрагменты
и их очистка,
включение
фрагмента
чужеродной
ДНК в векторную
плазмиду и
получение
рекомбинантной
ДНК, или р-ДНК,
введение р-ДНК
в клетки-реципиенты
и клонирование
генов, амплификация
и экспрессия
р-ДНК.
1.3.4
Получение
чужеродной
ДНК
Чужеродную
ДНК можно получить
с помощью химического
или ферментативного
синтеза, либо
из любого организма
с последующим
определением
её первичной
структуры.
Синтетически
получают гены,
в случае известной
аминокислотной
последовательности
белка. Так
синтезированы
гены, кодирующие
образование
гормонов: про-инсулин
человека, интерферон
а и а2.
Изоляция
структурного
гена из генома
клетки возможна
только при
работе с прокариотами,
гены которых
не содержат
интронов. У
эукариот ген
состоит не
только из участков,
где записана
структура белка
(экзонов), но и
участков, которые
не кодируют
белок (интронов)
/9/.
Транскрипция
у эукариот
происходит
в ядре, при этом
образуется
матричная РНК
(м-РНК). При её
перемещении
из ядра через
ядерную мембрану
в цитоплазму
происходит
созревание
м-РНК - процессинг,
в результате
чего интроны
вырезаются
с помощью специальных
ферментов, а
экзоны сшиваются
(сплайсинг).
При работе с
эукариотами
используют
синтез структурного
гена путем
обратной
транскрипции,
то есть получение
ДНК путём копирования
м- РНК. Для получения
комплементарной
ДНК в качестве
матрицы используют
зрелую м-РНК,
не содержащую
интронов
1.3.5
Конструирование
рекомбинантных
ДНК
Основными
инструментами
для молекулярного
конструирования
являются два
типа ферментов:
а) рестриктирующие
эндонуклеазы
(рестриктазы),
необходимые
для получения
фрагментов
ДНК;
б) лигазы,
служащие для
сшивания (соединения)
участков ДНК.
1.3.5.1
ДНК-рестриктазы
и ДНК-метилазы
Это
ферменты, впервые
открытые как
часть системы
рестрикции-
модификации
ДНК у бактерий,
специфически
гидролизуют
молекулы
двухцепочечных
ДНК при наличии
в них определенных
последовательностей
нуклеотидов,
называемых
сайтами рестрикции.
По
механизму
действия и
молекулярной
структуре
различают три
типа рестриктаз.
Ферменты рестрикции
типа I представляют
собой сложные
мультимерные
комплексы,
построенные
из трех субъединиц
с молекулярной
массой до 300 кДа,
которые обладают
рестриктазной,
ДНК-метилазной
и АТРазной
активностями.
Рестриктазы
типа I для проявления
своей активности
требуют присутствия
АТР, S-аденозилметионина
и ионов Mg , они
не распознают
специфические
последовательности
нуклеотидов
и в силу этого
не находят
широкого применения
в генной инженерии.
Рестриктазы
типа II узнают
специфические
последовательности
нуклеотидов
в точке расщепления
ДНК или непосредственной
близости от
нее, требуют
для проявления
активности
наличия в реакционной
смеси АТР и
ионов Mg2" и чаще
всего используются
при молекулярном
клонировании.
Ферменты типа
III объединяют
все прочие
рестрикционные
эндонуклеазы.
Они также активны
только в присутствии
АТР и ионов Mg2
и не проявляют
абсолютной
зависимости
от S-аденозилметионина.
Названия рестриктаз
складываются
из первой буквы
родового и двух
букв видового
названия бактерий,
в которых они
обнаружены,
например Есо
- Е. coli.