Влияние алкогольной интоксикации на активность основных карбоксипептидаз в тканях самок крыс на разных стадиях эстрального цикла
гипоталамусе
активность
фермента, так
же как и у самок
на стадии эструса,
возрастала
по отношению
к контролю.
При введении
этанола в дозе
4 г/кг через 0,5 часа
после его введения
у самцов не
было выявлено
изменений в
активности
ФМСФ-КП. У самок
же на стадии
диэструса в
яичниках активность
фермента
увеличивалась,
в проэструсе
– уменьшалась
в гипофизе,
надпочечниках
и яичниках, на
стадии эструса
в яичниках
также наблюдалось
снижение активности
фермента, однако
в надпочечниках
и стриатуме
активность
ФМСФ-КП возрастала
по отношению
к контрольной
группе животных.
Через 4 часа
после инъекции
этанола (доза
4 г на кг) у самцов
активность
ФМСФ-КП не
подвергалась
изменениям
в гипофизе и
половых железах.
У самок на стадии
диэструса в
гипофизе активность
фермента
увеличивалась,
уменьшалась
в эструсе и
только в проэструсе
оставалась
на прежнем
уровне относительно
контрольных
значений. В
яичниках активность
ФМСФ-КП на стадии
эструса, как
и в семенниках,
не подвергалась
изменениям,
но увеличивалась
в диэструсе
и эструсе
относительно
контроля.
Однонаправленные
изменения в
активности
ФМСФ-КП обнаружены
через 4 часа
после введения
этилового
спирта в дозе
4 г/кг в гипоталамусе
у самцов и самок
в диэструсе
и проэструсе
по отношению
к контрольной
группе крыс.
В стриатуме
у самцов и самок
на стадии проэструса
активность
фермента также
возрастала,
однако у самок
в стадии эструса
она уменьшалась
по сравнению
с контролем.
На стадии диэструса
и проэструса
инъекция этанола
не вызывала
у самок изменений
в активности
ФМСФ-КП, но приводила
к уменьшению
активности
фермента в
эструсе, а у
самцов вызывала
увеличение
активности
ФМСФ-КП относительно
контрольной
группы животных.
Через 18 часов
после введения
этанола в дозе
4 г/кг у самок
на стадии диэструса
активность
фермента уменьшалась
в гипофизе и
гипоталамусе,
а на стадии
эструса, наоборот,
наблюдалось
увеличение
активности
фермента во
всех изученных
отделах по
сравнению с
контролем. У
самцов только
в надпочечниках
и семенниках
активность
ФМСФ-КП возрастала
и не изменялась
в других исследованных
отделах относительно
контрольной
группы животных.
Таким образом,
этанол вызывал
изменения в
активности
ФМСФ-КП у крыс
обоего пола,
однако более
существенно
активность
фермента менялась
у самок по сравнению
с самцами. Характер
изменений в
активности
фермента у
самцов и самок
мог быть как
одно-, так и
разнонаправленным
и зависел от
времени, через
которое проводилось
исследование,
дозы этанола,
стадии полового
цикла и отдела,
в котором
определялась
активность
ФМСФ-КП.
3.2.3. Активность
карбоксипептидазы
М в тканях самцов
крыс
а) Определение
активности
карбоксипептидазы
М у интактных
самцов крыс
Полученные
данные о распределении
активности
КПМ в тканях
самцов крыс
представлены
в таблице 17.
Таблица
17. Активность
КПМ в тканях
самцов в норме
(нмоль продукта,
образовавшегося
за 1 мин инкубации
на 1 мг белка,
M±m, n=6ё8).
| Гипоталамус |
Стриатум |
| 0,131±0,014 |
0,069±0,014 |
Половых
отличий в активности
КПМ в гипоталамусе
и стриатуме
в норме не
обнаружено.
Вероятно, КПМ
в исследованных
отделах не
вовлекается
в формирование
половых отличий
в уровне нейропептидов.
б) Активность
карбоксипептидазы
М при внутрибрюшинном
введении
физиологического
раствора в
тканях самцов
Влияние
внутрибрюшинного
введения физраствора
обнаружено
только через
0,5 часа после
воздействия
в гипоталамусе,
где активность
КПМ была на 24%
ниже, чем у интактных
животных (рис.
6).
У самок
через 0,5 часа
после инъекции,
в отличие от
самцов активность
КПМ в гипоталамусе
относительно
нормы не менялась.
Однако в стриатуме
у самок на стадии
диэструса
наблюдалось
увеличение
активности
фермента, а в
проэструсе
– снижение
активности,
в то время как
у самцов и самок
на стадии эструса
активность
КПМ не менялась
по сравнению
с интактной
группой животных.
Через
4 часа после
введения
физиологического
раствора происходит
уменьшение
активности
фермента в
гипоталамусе
у самок на стадии
проэструса
и эструса, в
стриатуме
уменьшение
наблюдается
на стадии диэструса,
у самцов и самок
в проэструсе
и эструсе такие
изменения
отсутствуют
относительно
нормы.
Через
18 часов после
инъекции физраствора
изменений в
активности
КПМ у самцов
и самок не было
обнаружено.
Таким
образом, введение
физраствора
приводит к
более существенным
изменениям
в активности
фермента у
самок по сравнению
с самцами. Кроме
того, характер
этих изменений
различен: у
самцов введение
физраствора
приводило к
уменьшению
активности
КПМ только
через 0,5 часа
в гипоталамусе,
в то время как
у самок наблюдались
изменения в
активности
фермента как
в гипоталамусе,
так и в стриатуме
через 0,5 и 4 часа
после инъекции.
Однако через
18 часов после
воздействия
активность
КПМ не изменялась
у крыс обоего
пола. Отличия
в изменении
активности
фермента у
самцов и самок,
вероятно,
свидетельствуют
о различной
устойчивости
к стрессу особей
разного пола
[33].
в)
Исследование
активности
карбоксипептидазы
М при внутрибрюшинном
введении этанола
в тканях самцов
крыс
Через
0,5 часа после
введения этанола
в дозе 1 г/кг в
гипоталамусе
активность
КПМ была на 21%
выше, чем в контроле.
Через 18 часов
после инъекции
этилового
спирта в дозе
4 г/кг активность
фермента в
гипоталамусе
и стриатуме
была на 18-19% ниже,
чем в контроле.
Интересно
отметить, что
достоверных
отличий во
влиянии разных
доз этанола
на активность
КПМ не выявлено
(рис. 6).
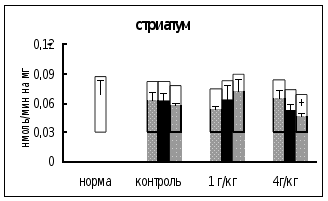

Рис. 6. Активность
КПМ при введении
физраствора
и этанола в
тканях самцов
крыс (нмоль
продукта,
образовавшегося
за 1 мин инкубации
на 1 мг белка,
M±m,
n=6ё8).
Влияния
времени на
активность
КПМ не обнаружено
(табл. 18).
Таким образом,
введение этанола
вызывало примерно
одинаковые
изменения
активности
КПМ в гипоталамусе
и стриатуме.
Интересно
отметить, что
в стриатуме
и гипоталамусе
отсутствовала
зависимость
активности
фермента от
дозы вводимого
этанола.
У самцов и
самок в диэструсе
через 0,5 часа
после введения
этанола происходит
увеличение
активности
КПМ в гипоталамусе,
а в проэструсе
–
Таблица 18.
Дисперсионный
анализ влияние
времени на
активность
КПМ (значения
отношения
Фишера FФ и
баллы экспериментальных
(временных)
подгрупп).
| Отдел |
Воздействие |
Fф |
Гипоталамус
|
Физраствор |
1,49 |
|
Этанол
1г/кг |
0,74 |
|
Этанол
4 г/кг |
1,33 |
Стриатум
|
Физраствор |
0,21 |
|
Этанол
1г/кг |
0,33 |
|
Этанол
4 г/кг |
1,13 |
снижение
активности
фермента относительно
контрольной
группы животных.
В стриатуме
только у самок
на стадии эструса
наблюдается
уменьшение
активности
КПМ, в остальных
случаях изменений
в активности
фермента не
происходит.
Через
4 часа после
инъекции этанола
в дозе 1 г/кг
активность
КПМ в гипоталамусе
и стриатуме
у самцов и в
гипоталамусе
у самок оставалась
неизменной.
В стриатуме
у самок на стадии
диэструса
введение этанола
вызывало увеличение,
а в проэструсе
уменьшение
активности
КПМ по отношению
к контрольным
животным.
Через
18 часов после
введения этанола
в дозе 1 г/кг у
самцов активность
КПМ в гипоталамусе
и стриатуме
не изменялась,
у самок в стриатуме
и гипоталамусе
на стадии диэструса,
а в последнем
отделе и в эструсе
активность
фермента уменьшалась
относительно
контроля.
Через
0,5 и 4 часа после
внутрибрюшинного
введения этилового
спирта (доза
4 г на кг) в гипоталамусе
у особей разного
пола изменений
в активности
КПМ не было
обнаружено,
в стриатуме
у самцов активность
фермента также
оставалась
на прежнем
уровне, однако
у самок через
0,5 часа в проэструсе
наблюдалось
увеличение
активности,
а в эструсе –
снижение, через
4 часа на стадии
диэструса
активность
КПМ возрастала
по сравнению
с контрольными
цифрами.
Через
18 часов после
инъекции этилового
спирта в дозе
4 г/кг в гипоталамусе
и стриатуме
у самцов наблюдалось
снижение активности
КПМ, в то время
как у самок
изменения
обнаруживались
только в стриатуме
на стадии диэструса,
где активность
фермента
увеличивалась
относительно
контрольной
группы животных.
Таким
образом, введение
этанола приводит
к более существенным
изменениям
в активности
КПМ у самок,
чем у самцов.
Причем изменения
активности
фермента у
самцов и самок
могли быть как
одно-, так и
разнонаправленными,
что в свою очередь,
определялось
дозой вводимого
этанола, стадией
эстрального
цикла, в которой
находится
животное, отделом,
в котором
определяется
активность
фермента и
временем, через
которое проводилось
исследование.
ГЛАВА 4. ОБСУЖДЕНИЕ
РЕЗУЛЬТАТОВ
Проблема
алкоголизма
на протяжении
долгого времени
остается и,
видимо, еще
долго будет
оставаться
актуальной
для человечества
в социальном,
медицинском
плане и даже
в аспекте сохранения
здорового
генофонда
людей. Отсюда
понятен интерес
к этой проблеме
специалистов
разных профилей,
в том числе
биохимиков.
Данные экспериментальных
исследований
и клинические
наблюдения
не позволяют
сделать однозначный
вывод о том,
какой пол более
устойчив к
действию этанола.
Однако считается
бесспорным,
что алкоголизм
у женщин приводит
к нейроэндокринным
расстройствам,
нарушению
генеративных
функций и полового
цикла [64, 81]. Несмотря
на многочисленные
работы отечественных
и зарубежных
авторов, посвященных
изучению алкогольной
интоксикации,
патогенетический
механизм
вышеперечисленных
нарушений и
возможные пути
их лечения
изучены недостаточно
[81].
Известно,
что в этиологии
и патогенезе
алкоголизма
важную роль
играют такие
регуляторные
пептиды как
энкефалины,
β-эндорфин,
АКТГ, ДСИП,
нейротензин
и ряд других
[19, 61, 88]. Кроме того,
острая алкогольная
интоксикация
изменяет уровень
ГРФ и гонадотропинов
[87, 207, 231], которые
оказывают
существенное
воздействие
на функционирование
половой системы
[11].
Уровень
биологически
активных пептидов
зависит от
активности
ферментов,
участвующих
в их обмене
[14, 52]. Изучение
содержания
уровня того
или иного
нейропептида
в тканях не
дает достаточно
точных представлений
о динамических
процессах,
происходящих
в пептидэргической
системе при
острой алкогольной
интоксикации.
Более информативным
является изучение
процессов
синтеза и утилизации
нейропептидов
[19]. Поэтому изучение
активности
КПН, ФМСФ-КП и
КПМ при острой
алкогольной
интоксикации
представляет
значительный
интерес как
для понимания
биологической
роли самих
ферментов, так
и для понимания
роли регуляторных
пептидов в
этиологии и
патогенезе
алкоголизма.
Максимальная
активность
КПН у интактных
животных обоего
пола показана
в гипофизе, а
также в гипоталамусе
и стриатуме,
то есть в тех
отделах, которые
характеризуются
высоким уровнем
нейропептидов
[92]. Низкая активность
фермента выявлена
в надпочечниках
и гонадах. Полученные
данные о региональном
и тканевом
распределении
КПН хорошо
согласуются
с литературными
данными и
подтверждают
участие КПН
в процессинге
биологически
активных пептидов
[144, 233].
Наибольшая
активность
ФМСФ-КП отмечена
в гипофизе,
надпочечниках
и половых железах.
Установлено,
что яичники
продуцируют
многие нейропептиды,
в том числе
окситоцин,
релаксин,
инсулиноподобные
факторы роста,
эндорфины и
энкефалины
[20, 84, 85, 109]. В надпочечниках
синтезируется
достаточно
большое количество
мет-энкефалина,
однако активность
КПН в этом органе
невелика. Все
это позволяет
сделать предположение
о возможном
участии ФМСФ-КП,
наряду с КПН
в процессинге
биологически
активных пептидов.
Обнаружена
примерно одинаковая
активность
КПН и ФМСФ-КП
в гипоталамусе
и стриатуме,
некоторые
отличия в активности
ферментов в
гипофизе и
существенные
в надпочечниках
и гонадах, где
активность
ФМСФ-КП существенно
выше, чем КПН.
Высокая активность
ФМСФ-КП в половых
железах может,
вероятно, указывать
на причастность
этого фермента
не только к
обмену нейропептидов,
но и к катаболизму
белков, тем
более, что гонады
характеризуются
высоким уровнем
катаболизма
белка.
Следует
отметить, что
активность
обеих карбоксипептидаз
у самок, как
правило, выше,
чем у самцов.
Полученные
результаты
согласуются
с данными о
половых отличиях
в активности
ряда протеолитических
ферментов [44]
и уровне нейропептидов
[113, 132]. Не исключено,
что выявленные
различия связаны
с половыми
отличиями в
функционировании
ГГГС и ГГНС
[44].
Согласно
результатам
эксперимента
активность
КПН в тканях
интактных самок
крыс зависела
от стадии эстрального
цикла в гипофизе,
гипоталамусе,
стриатуме и
яичниках. Причем
наиболее высокая
активность
фермента
зафиксирована
в гипофизе на
стадии проэструса.
Известно, что
именно на этой
стадии регистрируется
наиболее высокий
уровень ФСГ,
ЛГ и пролактина
в гипофизе и
крови по сравнению
с другими стадиями
эстрального
цикла [11, 17]. Кроме
того, именно
в проэструсе
уровень эстрадиола
в крови выше,
чем в диэструсе
и эструсе [17].
Установлено,
что эстрадиол
вызывал увеличение
внутриклеточного
уровня КПН в
культуре клеток
передней доли
гипофиза –
GH4C1 [150].
Вероятно, повышение
уровня эстрадиола
на стадии проэструса,
может приводить
к увеличению
активности
фермента в
гипофизе. Эти
данные позволяют
предположить,
что КПН, вероятно,
участвует в
регуляции
уровня гонадотропных
гормонов в
гипофизе в ходе
эстрального
цикла, а активность
фермента,
по-видимому,
регулируется
уровнем половых
стероидных
гормонов в
организме.
Интересно
отметить, что
самая высокая
активность
аминопептидазо-В-подобных
ферментов,
которые наряду
с основными
карбоксипептидазами
могут участвовать
в биосинтезе
этих гормонов,
отмечается
также в проэструсе
[128].
В гипоталамусе
повышение
активности
КПН на стадии
эструса коррелирует
с увеличением
уровня опиоидных
пептидов, однако
не согласуется
с изменением
уровня люлиберина
и окситоцина
[11,106] в этом отделе
мозга и сыворотке
крови. Возможно,
что в обмене
этих нейропептидов
принимают
участие и другие
основные
карбоксипептидазы,
в частности
ФМСФ-КП.
Известно,
что у крыс и
мышей потребление
этанола значительно
уменьшается
в период эструса
[19, 45]. Возможно,
что более высокая
активность
КПН в стриатуме
на стадии эструса
приводит к
увеличению
концентрации
энкефалинов
в этом отделе
мозга. Предполагается,
что повышение
уровня мет-энкефалина
в стриатуме
соотносится
с реализацией
эйфоригенного
эффекта с
эмоционально
положительно
окрашенным
восприятием
[19], что, вероятно,
может приводить
к снижению
добровольного
потребления
этанола.
В
яичниках, где
обнаружены
циклические
изменения в
уровне ряда
нейропептидов
[18, 240], активность
КПН на стадии
проэструса
достоверно
выше, чем в
диэструсе, что
позволяет
предположить
возможность
вовлечения
фермента в
циклические
изменения
уровня биологически
активных пептидов
в этом органе.
Активность
ФМСФ-КП зависит
от стадии эстрального
цикла только
в яичниках, где
на стадии диэструса
она почти в 2
раза ниже по
сравнению с
проэструсом
и эструсом.
Именно в проэструсе
и эструсе происходит
разрыв и деградация
фолликула, а
затем развитие
прогестативного
тела [17], возможно,
что ФМСФ-КП
вовлекается
в эти процессы.
Отсутствие
изменений в
активности
ФМСФ-КП в других
исследованных
отделах, возможно,
указывает на
то, что в них
фермент участвует
в регуляции
тонической
секреции регуляторных
пептидов в ходе
эстрального
цикла, но, очевидно,
не влияет на
циклическую
секрецию гормонов.
Активность
КПМ в гипоталамусе
и стриатуме
у самок крыс
достоверно
не отличается
от активности
фермента у
самцов. Вероятно,
различный
уровень регуляторных
пептидов,
обнаруживаемый
у особей разного
пола в данных
отделах обусловлен
функционированием
других протеолитических
ферментов.
Кроме того,
активность
КПМ в гипоталамусе
и стриатуме
самок не зависит
от стадии эстрального
цикла. Возможно,
что в гипоталамусе
и стриатуме
КПМ участвует
в регуляции
базального
уровня биологически
активных пептидов,
но, вероятно,
не вовлекается
в циклические
изменения
уровня нейропептидов
в ходе полового
цикла. Отсутствие
достоверных
половых отличий
в активности
КПМ и зависимости
активности
фермента от
стадии эстрального
цикла, очевидно,
может свидетельствовать
о разной биологической
роли КПМ и ФМСФ-КП,
а также КПН
[27, 28, 29].
У самцов
крыс введение
физраствора
вызывало увеличение
активности
КПН. Увеличение
активности
фермента в
гипофизе коррелирует
с увеличением
уровня АКТГ
[19, 86], являющимся
важным компонентом
стресс реализующих
систем и является
специфичным
ответом на
стресс, которым,
по-видимому,
является
внутрибрюшинная
инъекция физраствора.
Эти данные
хорошо согласуются
с полученными
ранее [38].
У самок крыс
введение
физиологического
раствора приводило
к снижению
активности
КПН в гипофизе
через 0,5 и 4 часа
в проэструсе
и эструсе, такие
же изменения
регистрировались
в гипоталамусе
самцов и самок
крыс через 4
часа после
инъекции. Вероятно,
это связано
с особенностями
воздействия
внутрибрюшинной
инъекции физраствора,
при которой
в организм
поступает
дополнительное
количество
жидкости. Понижение
активности
КПН может
способствовать
ускорению
высвобождения
жидкости из
организма
благодаря
уменьшению
образования
вазопрессина
[72]. У самок обнаружено
снижение активности
КПН в надпочечниках,
чего не наблюдалось
у самцов. Вероятно,
это обусловлено
половыми отличиями
в ответной
реакции организма
на стресс [45].
Обнаруженное
уменьшение
активности
фермента в
надпочечниках
у самок может
являться косвенным
доказательством
включения
надпочечников
в ответ на стресс
[19, 86]. Полученные
нами данные
об изменении
активности
КПН у самок
крыс при внутрибрюшинном
введении физраствора
хорошо согласуются
с полученными
ранее по влиянию
инъекции оливкового
масла на активность
фермента у
самок мышей
[43].
Интересно
отметить, что
у самцов и самок
отсутствовали
изменения в
активности
КПН в гонадах,
что подтверждает
тезис о ведущей
роли ГГНС в
ответе на стресс
[19, 86]. Отсутствие
изменений в
активности
КПН во всех
исследуемых
органах у самок
крыс через 18
часов после
инъекции физраствора,
возможно,
свидетельствует
о более быстром
угасании
стресс-реакции,
по сравнению
с самцами.
У самок в
гипофизе после
введения
физиологического
раствора активность
ФМСФ-КП уменьшалась
на стадии эструса,
оставаясь на
прежнем уровне
на других стадиях
эстрального
цикла, в то время
как у самцов
наблюдалось
увеличение
активности
фермента в этом
отделе. У самцов
введение физраствора
вызывает изменение
активности
ФМСФ-КП также
в гипоталамусе
через 0,5 часа
после воздействия,
а у самок – и в
других исследованных
отделах. Принимая
во внимание
то, что уровень
нейропептидов
зависит от
активности
ферментов их
обмена, можно
предположить,
что выявленные
половые отличия
в изменении
активности
ФМСФ-КП способствуют
различной
секреции биологически
активных пептидов
у самцов и самок
при стрессе
[30, 33].
Наиболее
значительно
активность
ФМСФ-КП при
введении физраствора
изменялась
в яичниках,
причем в подавляющем
большинстве
случаев она
увеличивалась.
Не исключено,
что ФМСФ-КП
может вовлекаться
в процессинг
регуляторных
пептидов при
стрессе и/или
в деградацию
избытка нейропептидов,
которые образуются
в ответ на стресс.
Кроме того, эти
данные, возможно,
могут частично
объяснить
нарушения
эстрального
цикла, прекращение
овуляции под
действием
стресса [61, 81, 86].
Интересно
отметить, что
на стадии диэструса
в большинстве
отделов после
введения физраствора
активность
ФМСФ-КП увеличивалась,
а в эструсе,
напротив, снижалась.
Так как этот
фермент, по
всей видимости,
вовлекается
в процессинг
нейропептидов,
а, следовательно,
может определять
их уровень, от
чего, в свою
очередь, зависит
устойчивость
организма к
стрессу, можно
предположить,
что эти результаты
указывают на
различную
устойчивость
к стрессирующему
воздействию
крыс на разных
стадиях эстрального
цикла [45].
Следует
отметить, что
активность
обоих ферментов
у самок изменялась
более существенно,
чем у самцов,
что хорошо
согласуется
с имеющимися
в литературе
сведениями
о том, что ГГНС
самок более
подвержена
воздействию
стресса, чем
самцов [6].
Введение
физраствора
приводит к
снижению активности
КПМ в гипоталамусе
через 4 часа
после воздействия
у самок крыс
на стадии проэструса
и эструса и
через 0,5 часа
у самцов. Известно,
что α-неоэндорфин,
динорфин 1-13 в
качестве С-концевой
аминокислоты
содержат лизин
[72], следовательно,
они могут выступать
в качестве
субстратов
для КПМ [123, 248], которая
локализуется
на внешней
стороне плазматической
мембраны [123, 248].
Выявленное
уменьшение
активности
КПМ, возможно
приводит к
замедлению
разрушения
этих пептидов,
обладающих
способностью
проявлять
седативное
действие, снижать
исследовательскую
активность
[19, 72]. Что коррелирует
с данными о
снижении подвижности
крыс в тесте
“открытое поле”
через 4 часа
после инъекции
физраствора
и частичном
восстановлении
активности
через 24 часа
после воздействия
[38]. В стриатуме
через 0,5 часа
после инъекции
активность
КПМ на стадии
диэструса
повышалась,
а в проэструсе
снижалась;
через 4 часа
снижение активности
наблюдалось
только в диэструсе.
Известно, что
КПМ участвует
в модуляции
и инактивации
нейропептидов,
тем самым, влияя
на их уровень
в организме,
от которого
во многом зависит
устойчивость
к стрессу. Поэтому
разнонаправленные
изменения
активности
КПМ в стриатуме
у самок могут
свидетельствовать,
о различной
устойчивости
к стрессу самок
крыс на разных
стадиях эстрального
цикла [45]. Отсутствие
изменений в
активности
фермента после
инъекции физраствора
у самцов и их
наличие у самок,
по-видимому,
свидетельствует
о различной
устойчивости
крыс разного
пола к стрессирующему
воздействию
[2].
Введение
этанола приводит
к увеличению
активности
КПН в гипофизе
на стадии эструса
(доза 1 г на кг)
и диэструса
(доза 4 г/кг), что
согласуется
с представлениями
об активации
ГГНС и увеличении
секреции и
образования
АКТГ, β-эндорфина,
пролактина
при острой
алкогольной
интоксикации
[19, 86]. Однако в
проэструсе
и через 4 часа
после инъекции
этанола в диэструсе
активность
КПН была ниже
по сравнению
с контрольными
животными.
Вероятно,
разнонаправленные
изменения в
активности
КПН обусловлены
различным
физиологическим,
а, следовательно,
и гормональным
статусом самок
крыс на разных
стадиях эстрального
цикла [21, 60]. Принимая
во внимание
возможное
участие КПН
в биосинтезе
гонадотропных
гормонов [23],
становятся
понятными
нарушения
полового цикла
за счет изменений
в активности
КПН, которые
приводят к
изменению
уровня гонадотропинов.
Особенно пагубным,
вероятно, является
снижение активности
КПН на стадии
проэструса
по сравнению
с контрольными
и интактными
группами животных,
когда активность
фермента, напротив,
по результатам
нашего эксперимента
в норме увеличивается.
У самок
введение этанола
приводило к
увеличению
активности
КПН в гипоталамусе
через 0,5 часа
в диэструсе
и эструсе и
через 4 часа в
диэструсе, что
также свидетельствует
об увеличении
активности
ГГНС при острой
алкогольной
интоксикации
и, в частности,
коррелирует
с данными о
возрастании
концентрации
β-эндорфина
в гипоталамусе,
что связывают
с проявлением
эмоционально
позитивных
свойств этанола
[19]. Однако введение
этанола в дозе
4 г/кг приводит
к снижению
активности
фермента в
эструсе через
4 часа и в диэструсе
через 18 часов,
что, вероятно,
ведет к уменьшению
синтеза β-эндорфина
и проявлению
эмоционально
негативных
свойств этанола
в больших дозах
[19]. В проэструсе,
когда в организме
фиксируется
высокий уровень
эстрадиола,
изменения
активности
КПН отсутствовали.
Эти данные
подтверждаются
сведениями
о снижении
уровня опиоидных
пептидов в
гипоталамусе
овариоэктомированных
самок при совместном
введении этанола
и эстрадиола
[107], что, по-видимому,
свидетельствует
о возможной
модификации
ответной реакции
опиоидэргической
системы на
действие этанола
эстрадиолом
[107].
У самцов
в гипоталамусе
через 0,5 и 4 часа
после инъекции
этанола наблюдается
повышение
активности
КПН, которое
может быть
связано с увеличением
образования
КРФ, β-эндорфина
при острой
алкогольной
интоксикации
[19, 86]. Однако через
18 часов после
внутрибрюшинного
введения этанола
происходит
снижение активности
КПН по отношению
к контрольной
группе животных,
что, возможно,
является результатом
действия
компенсаторных
механизмов,
направленных
на нормализацию
функционального
состояния
пептидэргических
систем гипоталамуса,
а, следовательно,
гипофиза и
периферических
желез внутренней
секреции.
Введение
этанола самцам
вызывало в
большинстве
случаев менее
существенные
изменения
активности
КПН в гипофизе
и гипоталамусе
по сравнению
с самками, что
согласуется
с данными о
более существенном
изменении
уровня плазматических
гонадотропинов,
АКТГ и кортикостероидов
у самок по сравнению
с самцами [217, 231].
В стриатуме
у самцов через
18 часов после
введения этанола
в дозе 1 г/кг и
через 0,5 часа
в дозе 4 г/кг
обнаруживалось
повышение
активности
КПН, что согласуется
с данными об
увеличении
содержания
мет-энкефалина
[241], ДСИП в стриатуме
[22]. Считается,
что увеличение
уровня метэнкефалина
в стриатуме
соотносится
с реализацией
эйфоригенного
эффекта, а ДСИП
приписывают,
в том числе
антистрессорные,
анксиолитические
свойства. Вероятно,
именно такое
действие этанола
при однократном
введении и
связано с развитием
влечения к
этанолу, особенно
у предрасположенных
к алкоголизму
индивидуумов
[19].
Однако
через 4 часа
после инъекции
этанола в любой
из двух доз
происходило
снижение активности
КПН в стриатуме
у самцов, подобные
изменения
наблюдались
также у самок
на стадии эструса.
Это, возможно,
указывает на
то, что в образование
энкефалинов,
ДСИП могут
вовлекаться
другие карбоксипептидазы,
в том числе и
ФМСФ-КП.
Введение
этанола самкам
крыс в дозе 1
г/кг на стадии
диэструса и
эструса приводит
к увеличению
активности
КПН в надпочечниках,
что согласуется
с данными об
активации ГГНС
при острой
алкогольной
интоксикации
[19]. При инъекции
этанола в дозе
4 г/кг у самок
в проэструсе
и самцов происходит
увеличение
активности
фермента через
0,5 часа после
инъекции и
снижение активности
через 4 часа.
Наши результаты
согласуются
с данными Беляева
Н.А. и соавт. об
усиленном
образовании
энкефалинов
в промежутке
между 15 и 60 минутами
после внутрибрюшинного
введения этанола
и об угнетении
синтеза через
более длительный
промежуток
времени [15]. Что,
вероятно, является
результатом
действия
компенсаторных
механизмов,
направленных
на нормализацию
функционального
состояния
энкефалиновой
системы надпочечников.
Введение
этанола в дозе
1 г/кг приводит
к возрастанию
активности
КПН в яичниках
у самок на стадии
диэструса через
4 часа после
инъекции, в
дозе 4 г/кг – к
увеличению
активности
КПН в диэструсе
через 0,5 часа
и проэструсе
через 4 часа и
к уменьшению
активности
фермента в
эструсе через
18 часов после
инъекции – все
это, вероятно,
приводит к
нарушению
синтеза биологически
активных пептидов
в яичниках в
ходе эстрального
цикла.
В половых
железах самцов
через 0,5 часа
после введения
этанола в любой
из двух доз
активность
КПН достоверно
уменьшается
по сравнению
с контролем.
Однако через
4 и 18 часов активность
фермента достоверно
не отличается
от таковой у
животных контрольной
группы. Вероятно,
это связано
с тем, что этанол
способен вызывать
значительное
снижение уровня
тестостерона
[98], экзогенное
введение которого
приводит к
увеличению
активности
КПН в семенниках
[78]. В то же время,
после однократной
инъекции алкоголя
уровень тестостерона
достаточно
быстро нормализуется
[98]. Следовательно,
снижение уровня
тестостерона
и возвращение
его к исходным
значениям,
вызванные
инъекцией
этанола, по-видимому,
объясняет
происходящие
изменения в
активности
КПН.
Известно,
что введение
этанола является
стрессом для
самцов и самок
[19, 88], об этом свидетельствуют
сходные изменения
активности
КПН при введении
этанола и физраствора
в гипофизе по
сравнению с
интактными
животными.
Однако необходимо
заметить, что
введение этанола
в дозе 1г/кг в
гипофизе на
стадии эструса,
в гипоталамусе
и в стриатуме
и инъекция
этанола в дозе
4 г/кг в стриатуме
не приводит
к изменению
активности
КПН относительно
нормы, хотя при
введении
физиологического
раствора сдвиги
в активности
фермента наблюдались.
Это, вероятно,
можно объяснить
тем, что этанол
в определенных
условиях может
выступать в
роли антистрессорного
фактора. Результаты
нашего эксперимента
указывают на
то, что меньшая
доза этанола
нормализует
активность
фермента в
большем числе
органов. Эти
данные находят
свое подтверждение
в литературе,
где приводятся
сведения о том,
что более выраженный
анксиолитический,
антистрессорный
эффект присущ
малым дозам
этанола, а при
увеличении
дозы этанола
начинает преобладать
депрессивный,
наркотический
компонент [19].
Интересно
отметить, что
введение этанола
в дозе 1 г/кг у
самок на стадии
эструса не
вызывает изменения
активности
КПН относительно
нормы, а в надпочечниках
она повышается.
Это, вероятно,
связано с тем,
что в гипофизе
и надпочечниках
синтезируются
качественно
разные пептиды
в ответ на острую
алкогольную
интоксикацию:
из гипофиза
в кровяное
русло в числе
прочих нейропептидов
поступает АКТГ
[158, 230], который
способствует
развитию
стресс-реакции
в организме,
а из