Механизмы реализации путей гибели клетки
Рис.3. Нейтрофильный
гранулоцит
Цитоплазма
нейтрофилов
при окраске
по Романовскому
- Гимзе окрашивается
слабооксифильно,
в ней видна
очень мелкая
зернистость
розово-фиолетового
цвета (окрашивается
кислыми и основными
красками), поэтому
называется
нейгрофильной
или гетерофильной.
В поверхностном
слое цитоплазмы
зернистость
и органеллы
отсутствуют.
Здесь расположены
гранулы гликогена,
актиновые
филаменты и
микротрубочки,
обеспечивающие
образование
псевдоподий
для движения
клетки. Сокращение
актиновых
филаментов
обеспечивает
передвижение
клетки по
соединительной
ткани.
Во внутренней
части цитоплазмы
расположены
органеллы
(аппарат Гольджи,
гранулярный
эндоплазматический
ретикулум,
единичные
митохондрии),
видна зернистость.
Число зерен
в каждом нейтрофиле
варьирует и
составляет
50-200.
В нейтрофилах
можно различить
два типа гранул:
специфические
и азурофильные,
окруженные
одинарной
мембраной.
Специфические
гранулы, более
светлые, мелкие
и многочисленные,
составляют
80-90 % всех гранул.
Их размер около
0,2 мкм, они
электронно-прозрачны,
но могут содержать
кристаллоид;
содержат
бактериостатические
и бактерицидные
вещества - лизоцим
(муромидаза)
и щелочную
фосфатазу, а
также белок
лактоферрин.
Лактоферрин
связывает ионы
железа, что
способствует
склеиванию
бактерий
(бактериальная
мультипликация).
Он также инициирует
отрицательную
обратную связь,
обеспечивая
торможение
продукции
нейтрофилов
в костном мозге.
Азурофильные
гранулы более
крупные (~ 0,4 мкм),
окрашиваются
в фиолетово-красный
цвет; их количество
составляет
10-20 % всей популяции
гранул. Они
являются первичными
лизосомами,
имеют электронно-плотную
сердцевину,
содержат
лизосомальные
ферменты (кислая
фосфатаза,
р-глюкуронидаза
и др.) и миелопероксидазу.
Миелопероксидаза
из перекиси
водорода продуцирует
молекулярный
кислород, обладающий
бактерицидным
действием.
Азурофильные
гранулы в процессе
дифференцировки
нейтрофилов
в костном мозге
появляются
раньше, поэтому
называются
первичными
в отличие от
вторичных -
специфических.
Основная функция
нейтрофилов
- фагоцитоз
микроорганизмов,
поэтому их
называют микрофагами.
В процессе
фагоцитоза
бактерий сначала
(в течение 0,5-1 мин)
с образующейся
фагосомой
(захваченная
бактерия) сливаются
специфические
гранулы, ферменты
которой убивают
бактерию, при
этом образуется
комплекс, состоящий
из фагосомы
и специфической
гранулы. Позднее
с этим комплексом
сливается
лизосома,
гидролитические
ферменты которой
переваривают
микроорганизмы.
В очаге воспаления
убитые бактерии
и погибшие
нейтрофилы
образуют гной.
Фагоцитоз
усиливается
при опсонизации
с помощью
иммуноглобулинов
(Ig) или комплемента
плазмы. Это так
называемый
рецепторопосредованный
фагоцитоз. Если
у человека
имеются антитела
IgG для конкретного
вида бактерий,
то бактерия
обволакивается
этим специфическим
IgG, имеющим специальную
область Fc, которая
распознается
Fc-рецептором
на плазмолемме
нейтрофила
и присоединяется
к нему. Образующееся
соединение
[IgG - Fc-рецептор]
на поверхности
нейтрофила
запускает
фагоцитоз. В
популяции
нейтрофилов
здоровых людей
в возрасте
18-45 лет фагоцитирующие
клетки составляют
69-99 %. Этот показатель
называют фагоцитарной
активностью.
Фагоцитарный
индекс - другой
показатель,
которым оценивается
число частиц,
поглощенных
одной клеткой.
Для нейтрофилов
он равен 12-23.
Продолжительность
жизни нейтрофилов
составляет
5-9 суток.
Эозинофилы
(оксифильные
или ацидофильные
лейкоциты,
эозинофилы).
Количество
эозинофилов
в крови составляет
0,02 - 0,3 ¦ 10*/л, или 0,5-5 % от
общего числа
лейкоцитов
(рис.4). Их диаметр
в мазке крови
12-14 мкм, в капле
свежей крови
- 9-10 мкм. Ядро
эозинофилов
имеет, как правило,
2 сегмента,
соединенных
перемычкой.
В цитоплазме
расположены
органеллы -
аппарат Гольджи
(около ядра),
немногочисленные
митохондрии,
актиновые
филаменты в
кортексе цитоплазмы
под плазмолеммой
и гранулы. Среди
гранул различают
азурофильные
(первичные) и
эозинофильные
(вторичные),
являющиеся
модифицированными
лизосомами.
Они электронно-плотные,
содержат
гидролитические
ферменты (см.
рис.70, Б в приложении).
Специфические
эозинофильные
гранулы заполняют
почти всю цитоплазму,
имеют размер
0,6-1 мкм. Характерно
наличие в центре
гранулы кристаллоида,
который содержит
главный основной
белок, богатый
аргинином (что
обусловливает
оксифилию
гранул), лизосомные
гидролитические
ферменты, пероксидазу
и другие белки
- эозинофильный
катионный
белок, гистаминазу.
Электронно
- микроскопически
в экваториальной
плоскости
эозинофильных
гранул выявляются
единичные или
множественные
кристаллоидные
структуры,
имеющие пластинчатое
строение, погруженные
в тонкозернистый
матрикс гранулы.
Кристаллоиды
эозинофильных
гранул содержат
главный основной
белок, который
участвует в
антипаразитарной
функции эозинофилов.
Плазмолемма
имеет рецепторы:
Fc-рецептор для
иммуноглобулина
Е (IgE) (участвует
в аллергических
реакциях), для
IgG и igM, а также С3
- и С4-рецепторы.
Эозинофилы
являются подвижными
клетками и
способны к
фагоцитозу,
однако их
фагоцитарная
активность
ниже, чем у
нейтрофилов.
Эозинофилы
обладают
положительным
хемотаксисом
к гистамшу,
выделяемому
тучными клетками
(особенно при
воспалении
и аллергических
реакциях), к
лимфокинам,
выделяемым
стимулированными
Т-лимфоцитами,
и иммунным
комплексам,
состоящим из
антигенов и
антител.
Рис.4. Эозинофильный
гранулоцит
Установлена
роль эозинофилов
в реакциях на
чужеродный
белок, в аллергических
и анафилактических
реакциях, где
они участвуют
в метаболизме
гистамина,
вырабатываемого
тучными клетками.
Гистамин повышает
проницаемость
сосудов, вызывает
развитие отека
тканей; в больших
дозах может
вызвать шок
со смертельным
исходом.
Эозинофилы
способствуют
снижению содержания
гистамина в
тканях различными
путями. Они
разрушают
гистамин с
помощью фермента
гистаминазы,
фагоцитируют
гистаминсодержащие
гранулы тучных
клеток, адсорбируют
гистамин на
плазмолемме,
связывая его
с помощью рецепторов,
и, наконец,
вырабатывают
фактор, тормозящий
дегрануляцию
и освобождение
гистамина из
тучных клеток.
Специфической
функцией эозинофилов
является
антипаразитарная.
При паразитарных
заболеваниях
(гельминтозы,
шистосомоз
и др.) наблюдается
резкое увеличение
числа эозинофилов
- до 90 % от общего
числа лейкоцитов.
Эозинофилы
убивают личинки
паразитов,
поступившие
в кровь или
органы (например,
в слизистую
оболочку кишки).
Они привлекаются
в очаги воспаления
хемотаксическими
факторами и
прилипают к
паразитам
благодаря
наличию на них
обволакивающих
компонентов
комплемента.
При этом происходят
дегрануляция
эозинофилов
и выделение
главного основного
белка, оказывающего
антипаразитарное
действие.
Таким образом,
эозинофилы
являются первой
линией защиты
против паразитов.
Они участвуют
в убийстве этих
агентов при
выделении
содержимого
гранул после
активации
антителами
и комплементом.
Активация
сочетается
со слиянием
гранул, их
выделением,
повышением
скорости метаболизма
и экспрессией
рецепторов
Fc и комплемента.
Эозинофилы
находятся в
периферической
крови менее
12 ч и потом переходят
в ткани. Их мишенями
являются такие
органы, как
кожа, легкие
и гастроинтестинальный
тракт. Изменение
содержания
эозинофилов
может наблюдаться
под действием
медиаторов
и гормонов:
например, при
стресс-реакции
отмечается
падение числа
эозинофилов
в крови, обусловленное
увеличением
содержания
гормонов
надпочечников.
Базофилы
(базофильные
лейкоциты, или
базофилы).
Количество
базофилов в
крови составляет
0-0,06 109/л, или 0-1 % от общего
числа лейкоцитов.
Их диаметр в
мазке крови
равен 11-12 мкм, в
капле свежей
крови - около
9 мкм (рис.5). Ядра
базофилов
сегментированы,
содержат 2-3 дольки;
в цитоплазме
выявляются
все виды органелл
- эндоплазматическая
сеть, рибосомы,
аппарат Гольджи,
митохондрии,
актиновые
филаменты.
Характерно
наличие специфических
крупных метахроматических
гранул, часто
закрывающих
ядро, размеры
которых варьируют
от 0,5 до 1,2 мкм.

Рис.5. Базофильный
гранулоцит.
Базофилы
опосредуют
воспаление
и секретируют
эозинофильный
хемотаксический
фактор. Гранулы
содержат
протеогликаны,
ГАГ (в том числе
гепарин), вазоактивный
гистамин, нейтральные
протеазы и
другие энзимы.
Как и нейтрофилы,
базофилы образуют
биологически
активные метаболиты
арахидоновой
кислоты - лейкотриены,
простагландины.
Часть гранул
представляет
собой модифицированные
лизосомы.
Дегрануляция
базофилов
происходит
в реакциях
гиперчувствительности
немедленного
типа (например,
при астме,
анафилаксии,
сыпи, которая
может ассоциироваться
с покраснением
кожи). Пусковым
механизмом
анафилактической
дегрануляции
является IgE-рецептор
для иммуноглобулина
Е. Метахромазия
обусловлена
наличием гепарина
- кислого
гликозаминогликана.
Базофилы образуются
в костном мозге.
Они так же, как
и нейтрофилы,
находятся в
крови около
1-2 суток. При
электронно-микроскопическом
исследовании
видны окружающая
гранулы мембрана
и кристаллическая
область. Гранулы
неоднородны
по электронной
плотности.
Помимо специфических
гранул, в базофилах
содержатся
и азурофильные
гранулы (лизосомы).
Базофилы так
же, как и тучные
клетки соединительной
ткани, выделяя
гепарин и гистамин,
участвуют в
регуляции
процессов
свертывания
крови и проницаемости
сосудов. Базофилы
участвуют в
иммунологических
реакциях организма,
в частности
в реакциях
аллергического
характера.
2.2.2 Агранулярные
лейкоциты
К этой группе
лейкоцитов
относятся
лимфоциты и
моноциты. В
отличие от
гранулоцитов
они не содержат
в цитоплазме
специфической
зернистости,
а их ядра не
сегментированы.
Т-, В, О - и
NK-лимфоциты
(lymphocytus). В крови взрослых
людей они составляют
20-35% от общего
числа лейкоцитов
A,0-4,0109/л). Величина
лимфоцитов
в мазке крови
значительно
варьирует - от
4,5 до 10 мкм. Среди
них различают
малые лимфоциты
(диаметром
4,5-6 мкм), средние
(диаметром 7-10
мкм) и большие
(диаметром 10
мкм и более).
Большие лимфоциты
встречаются
в крови новорожденных
и детей, у взрослых
они отсутствуют.
Для всех видов
лимфоцитов
характерно
наличие интенсивно
окрашенного
ядра округлой
или бобовидной
формы, содержащего
компактный
гетерохроматин,
и относительно
узкого ободка
базофильной
цитоплазмы.
В цитоплазме
некоторых
лимфоцитов
содержится
небольшое
количество
азурофильных
гранул (лизосомы).
Малые лимфоциты
составляют
большую часть
(85-90 %) всех лимфоцитов
крови человека.
При электронной
микроскопии
в их ядрах выявляются
небольшие
впячивания;
гетерохроматин
расположен
преимущественно
по периферии
ядра. В цитоплазме
обнаруживаются
везикулы, лизосомы,
свободные
рибосомы, полисомы,
митохондрии,
аппарат Гольджи,
центриоли,
небольшое
количество
элементов
гранулярной
эндоплазматической
сети (рис.6).
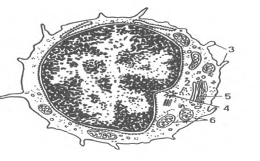
Рис.6. Ультрамикроскопическое
строение лимфоцита
(схема по Н.А.
Юриной, Л.С.
Румянцевой).
I - ядро; 2 - рибосомы;
3 - микроворсинки;
4 - центриоль;
5 - аппарат Гольджи;
6 - митохондрии.
Среди малых
лимфоцитов
различают
светлые и темные.
Малые темные
лимфоциты
меньше светлых,
имеют более
плотное ядро,
более узкий
ободок базофильной
цитоплазмы,
обладающей
высокой электронной
плотностью.
В цитоплазме
расположено
большое количество
рибосом. Средние
лимфоциты
составляют
около 10-12 % лимфоцитов
крови человека.
Ядра этих клеток
округлые, иногда
бобовидные
с пальцевидным
впячиванием
ядерной оболочки.
Хроматин более
рыхлый, ядрышко
хорошо выражено.
В цитоплазме
расположены
удлиненные
канальцы гранулярной
эндоплазматической
сети, элементы
агранулярной
сети, свободные
рибосомы и
полисомы, лизосомы.
Центросома
и аппарат Гольджи
расположены
рядом с областью
инвагинации
кариолеммы.
Кроме типичных
лимфоцитов,
в крови человека
в небольшом
количестве
могут встречаться
лимфоплазмоциты
(около 1-2 %), которые
отличаются
концентрическим
расположением
вокруг ядра
канальцев
гранулярной
эндоплазматической
сети.
Основной
функцией лимфоцитов
является участие
в иммунных
реакциях. Однако
популяция
лимфоцитов
гетерогенна
по характеристике
поверхностных
рецепторов
и роли в реакциях
иммунитета.
Среди лимфоцитов
различают три
основных
функциональных
класса: В - лимфоциты,
Т-лимфоциты
и нулевые лимфоциты.
В-лимфоциты
впервые были
обнаружены
в фабрициевой
сумке птиц
(bursa Fabricius), поэтому
и получили
соответствующее
название. Они
образуются
у эмбриона
человека из
стволовых
клеток - в печени
и костном мозге,
а у взрослого
- в костном мозге.
В-лимфоциты
составляют
около 30 % циркулирующих
лимфоцитов.
Их главная
функция - участие
в выработке
антител, т.е.
обеспечение
гуморального
иммунитета.
Плазмолемма
В - лимфоцитов
содержит множество
иммуноглобулиновых
рецепторов.
При действии
антигенов
В-лимфоциты
способны к
пролиферации
и дифференцировке
в плазмоциты
- клетки, способные
синтезировать
и секретировать
защитные белки
- иммуноглобулины
(Ig), которые поступают
в кровь, обеспечивая
гуморальный
иммунитет.
Т-лимфоциты,
или тимусзависимые
лимфоциты,
образуются
из стволовых
клеток костного
мозга, а созревают
в тимусе (вилочковая
железа), что и
обусловило
их название.
Они преобладают
в популяции
лимфоцитов,
составляя около
70 % циркулирующих
лимфоцитов.
Для Т-клеток,
в отличие от
В-лимфоцитов,
характерен
низкий уровень
поверхностных
иммуноглобулиновых
рецепторов
в плазмолемме.
Но Т-клетки
имеют специфические
рецепторы,
способные
распознавать
и связывать
антигены, участвовать
в иммунных
реакциях. Основными
функциями
Т-лимфоцитов
являются обеспечение
реакций клеточного
иммунитета
и регуляция
гуморального
иммунитета
(стимуляция
или подавление
дифференцировки
В-лимфоцитов).
Т-лимфоциты
способны к
выработке
лимфокинов,
которые регулируют
деятельность
В-лимфоцитов
и других клеток
в иммунных
реакциях. Среди
Т-лимфоцитов
выявлено несколько
функциональных
групп: Т-хелперы,
Т-супрессоры,
Т-киллеры.
Т-хелперы
(от англ.
helper - помощник)
- их главной
функцией является
усиление адаптивного
иммунного
ответа (рис.7).
Активируют
Т-киллеры,
В-лимфоциты,
моноциты,
NK-клетки,
презентируя
им фрагменты
чужеродного
антигена
при прямом
контакте, а
также гуморально,
выделяя цитокины.
Основным
фенотипическим
признаком
Т-хелперов
служит наличие
на поверхности
клетки молекулы
CD4.
Т-хелперы распознают
антигены при
взаимодействии
их Т-клеточного
рецептора (TCR)
с антигеном,
связанным с
молекулами
главного комплекса
гистосовместимости
2 класса (MHC-II).
Выделяют несколько
подтипов Т-хелперов:
Т-хелперы
0 (Th0) - "наивные"
недифференцированные
Т-хелперы; Т-хелперы
1 (Th1) - преимущественно
способствуют
развитию клеточного
иммунного
ответа, активируя
Т-киллеры; основной
выделяемый
цитокин - интерферон-гамма;
Т-хелперы
2 (Th2) - активируют
В-лимфоциты,
способствуя
развитию гуморального
иммунного
ответа; продуцируют
интерлейкины
4, 5 и 13;
Т-хелперы
3 (Т-reg, Т-регуляторы,
Т-супрессоры)
- экспрессируют
на поверхности
молекулы CD25 и
Foxp3, секретируют
интерлейкин-10
и трансформирующий
фактор роста-beta
(TGF-beta) и супрессируют
иммунный ответ:
Т-хелперы
17 (Th17)
- подтип Т-хелперов,
который характеризуется
продуцирует
в больших количествах
провоспалительный
цитокин - IL-17. Показана
роль Th17-клеток
в развитии
аутоиммуной
патологии.
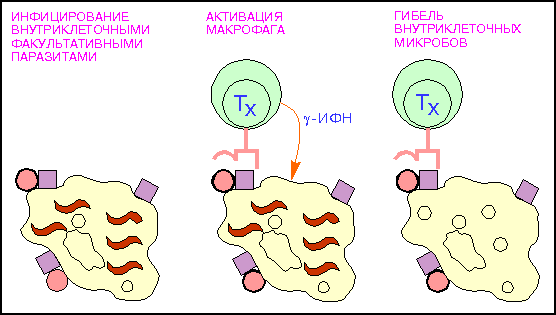
Рис.7:
Активация
макрофагов
Т - хелпетами
(кружки - поверхностный
микробный
антиген; красные
квадраты - молекулы
MHC
класса II, волнистые
линии - внутриклеточные
паразиты.).
Регуляторные
Т-лимфоциты,
Т-супрессоры
(англ.
regulatory T cells, suppressor T cells, Treg)
- центральные
регуляторы
иммунного
ответа. Основная
их функция -
контролировать
силу и продолжительность
иммунного
ответа через
регуляцию
функции Т-эффекторных
клеткок (Т-хелперов
и Т-цитотоксических
клеток).
Эти клетки
экспрессируют
FOXP3 - транскрипционный
фактор, регулирующий
транскрипцию
генов, ответственных
за дифференцировку
Т-клеток и экспрессию
цитокинов
и других факторов,
участвующих
в супрессии
иммунного
ответа. Часто
эти клетки так
и обозначают,
как FOXP3+ регуляторные
Т-клетки (FOXP3+ Treg
cells). Кроме того,
важным маркером
Т-регуляторных
клеток является
экспрессия
на их поверхности
рецептора
к цитокину
IL-2
- CD25,
соответственно
это обозначают
как CD25+ клетки.
Помимо этих
основных маркёров
Treg клетки на своей
мембране
экспрессируют
CD62L,
различные
изоформы
мембрано-связанной
фосфатазы
CD45.
Различают
несколько
разных типов
регуляторных
Т-клеток: естественные
Т-регуляторные
клетки (T-reg1) и
индуцибельные
Т-регуляторные
клетки (iT-reg). Индуцибельные
Т-регуляторные
клетки образуются
под влиянием
различных
факторов на
периферии,
например, в
региональных
лимфатических
узлах.
Для супрессии
иммуного ответа
Тreg клетки выделяют
цитокины:
TGF-beta, IL-10,
IFNgamma, IL-35, а также
экспрессируют
на своей поверхности
рецептор
CTLA-4. Существуют
несколько
механизмов
супрессии:
прямой, при
непосредственном
контакте между
клетками, и
дистантный,
осуществляющийся
на расстоянии
- например, через
растворимые
цитокины. Мишенями
действия Тreg
клеток являются
как Т-эффекторные
клетки, так и
дендритные
клетки, ответственные
за презентацию
антигена
и активацию
Т-клеток. При
дистантном
механизме
цитокины, выделяемые
Тreg клетками,
например,
трансформирующий
ростовой фактор
бета (TGF-beta), связываются
со своими рецепторами
на поверхности
Т-эффекторных
клеток и ингибирует
их активацию,
тем самым супрессируя
иммунный ответ.
Важным механизмом
также служит
захват IL-2 при
помощи CD25 - рецептора
к IL-2 и секвестрация
рецептора у
эффекторных
Т-клеток, что
препятствует
активации после
связывания
комплекса MHC с
антигеном, так
как известно,
что IL-2 является
основным аутокринным
стимулирующим
фактором,
поддерживающим
диффернцировку
и клональную
экспансию
Т-клеток.
Тreg клетки,
взаимодействуя
с рецептором
CD86 на дендритных
клетках при
помощи CTLA-4, способны
ингибировать
функцию активации
дендритными
клетками Т-клеток.
При прямом
механизме
супрессии Treg
взаимодействуют
с эффекторными
Т-клетками и
гранзим B действует
через перфорины,
образующие
канал, вызывая
апоптоз
в этих клетках,
тем самым элиминируя
активные Т-клетки.
Цитотоксические
Т-лимфоциты
непосредственно
контактируют
с чужеродными
клетками и
разрушают их.
Клеточный
иммунитет
опосредован
цитотоксическими
Т-лимфоцитами
и Т-хелперами.
Многие микроорганизмы
живут внутри
клеток в недосягаемости
для гуморальных
антител.
Чтобы справиться
с внутриклеточными
паразитами,
возникла обособленная
система приобретенного
имунитета,
основанная
на функционировании
отдельной
субпопуляции
лимфоцитов,
а именно, цитотоксических
T-лимфоцитов
(T-киллеров). Эти
клетки отличаются
очень широкой
специфичностью.
Поскольку
T-лимфоциты
должны взаимодействовать
с содержащими
паразитов
клетками, они
могут узнать
антиген
только в том
случае, если
он экспрессирован
на поверхности
инфицированной
клетки. Как и
B-лимфоциты,
каждая T-клетка
имеет специфический
рецептор, который
распознает
этот антиген.
(Рецептор
T-лимфоцита
структурно
отличается
от молекулы
мембраного
иммуноглобулина
- рецептора
B-лимфоцитов).
При этом T-лимфоциты
узнают антиген
на поверхности
клетки в комплексе
с клеточным
маркером: молекулами
MHC
класса I. В процессе
распознавания
поверхностного
антигена
цитотоксический
T-лимфоцит вступает
в теснейший
контакт со
своей мишенью
и уничтожает
ее до начала
репликации.
Кроме того, он
продуцирует
гамма-интерферон,
который ограничивает
проникновение
вируса в соседние
клетки, особенно
в тех случаях,
когда вирус
является слабым
индуктором
альфа-интерферона
и бета-интерферона
Цитотоксические
T-лимфоциты
относятся к
субпопуляции
T8
(или Ly2)
и представляют
популяцию
T-эффекторов
и играют важнейшую
роль в уничтожении
клеток, зараженных
вирусами, бактериями,
а возможно,
участвуют и
в предполагаемом
надзоре за
появлением
опухолевых
клеток.
Большинство
цитотоксических
T-клеток (Tц) относится
к субпопуляции
CD8+
и распознает
антиген, презентированный
в ассоциации
с молекулами
MHC
класса I, но
меньшая их
часть (примерно
10%), относящаяся
к субпопуляции
CD4+,
способна распознавать
антиген в ассоциации
с молекулами
MHC
класса II.
Для активации
и поражения
мишени Tц обладают
несколькими
механизмами
воздействия.
Один из них -
это передача
сигналов при
непосредственном
клеточном
контакте через
поверхностные
структуры,
другой - непрямая
сигнализация
с помощью цитокинов.
Кроме того в
цитоплазме
многих цитотоксических
клеток обнаружены
гранулы с белками,
высвобождение
которых вблизи
цитоплазматической
мембраны
клетки-мишени
вызывает ее
повреждение.
Цитотоксические
T-лимфоциты
развиваются
из предшественников.
Предшественники
цитотоксических
клеток активируются
комплексом
антигена и
молекул MHC
класса I, размножаются
и созревают
под действием
IL-2,
а также еще
плохо идентифицированных
факторов
дифференцировки,
продуцируемых
T-хелперами.
Нулевые
лимфоциты не
имеют поверхностных
маркеров на
плазмолемме,
характерных
для В - и Т-лимфоцитов.
Их расценивают
как резервную
популяцию
недифференцированных
лимфоцитов.
В настоящее
время оценка
иммунного
статуса организма
в клинике проводится
с помощью
иммунологических
и иммуноморфологических
методов выявления
различных видов
лимфоцитов.
Продолжительность
жизни лимфоцитов
варьирует от
нескольких
недель до нескольких
лет. Т-лимфоциты
являются
"долгоживущими"
(месяцы и годы)
клетками, а
В-лимфоциты
относятся к
"короткоживущим"
(недели и месяцы).
Для Т-лимфоцитов
характерно
явление рециркуляции,
т.е. выход из
крови в ткани
и возвращение
по лимфатическим
путям снова
в кровь. Таким
образом они
осуществляют
иммунологический
надзор за состоянием
всех органов,
быстро реагируя
на внедрение
чужеродных
агентов. Среди
клеток, имеющих
морфологию
малых лимфоцитов,
следует назвать
циркулирующие
стволовые
клетки крови
(СКК), которые
поступают в
кровь из костного
мозга. Впервые
эти клетки были
описаны А.А.
Максимовым
и обозначены
им как "подвижный
мезенхимный
резерв". Из СКК,
поступающих
в кроветворные
органы, дифференцируются
различные
клетки крови,
а из СКК, поступающих
в соединительную
ткань, - тучные
клетки, фибробласты
и др.
Моноциты.
Система мононуклеарных
фагоцитов
(СМФ).
В капле свежей
крови эти клетки
лишь немного
крупнее других
лейкоцитов
(9-12 мкм), в мазке
крови они сильно
распластываются
по стеклу и
размер их достигает
18-20 мкм. В крови
человека количество
моноцитов
колеблется
в пределах 6-8
% от общего числа
лейкоцитов.
Ядра моноцитов
разнообразной
и изменчивой
конфигурации:
встречаются
бобовидные,
подковообразные,
редко - дольчатые
ядра с многочисленными
выступами и
углублениями.
Гетерохроматин
рассеян мелкими
зернами по
всему ядру, но
обычно в больших
количествах
он располагается
под ядерной
мембраной. В
ядре моноцита
содержится
одно или несколько
маленьких
ядрышек (рис.8).
Рис.8. Моноцит.
Цитоплазма
моноцитов менее
базофильна,
чем цитоплазма
лимфоцитов.
При окраске
по методу
Романовского
- Гимзы она имеет
бледно-голубой
цвет, но по периферии
окрашивается
несколько
темнее, чем
около ядра; в
ней содержится
различное
количество
очень мелких
азурофильных
зерен (лизосом).
Характерны
наличие пальцеобразных
выростов цитоплазмы
и образование
фагоцитарных
вакуолей. В
цитоплазме
расположено
множество
пиноцитозных
везикул. Имеются
короткие канальцы
гранулярной
эндоплазматической
сети, а также
небольшие по
размеру митохондрии.
Моноциты относятся
к макрофагической
системе организма,
или к так называемой
мононуклеарной
фагоцитарной
системе (МФС).
Клетки этой
системы характеризуются
происхождением
из промоноцитов
костного мозга,
способностью
прикрепляться
к поверхности
стекла, активностью
пиноцитоза
и иммунного
фагоцитоза,
наличием на
мембране рецепторов
для иммуноглобулинов
и комплемента.
Моноциты
циркулирующей
крови представляют
собой подвижный
пул относительно
незрелых клеток,
находящихся
на пути из костного
мозга в ткани.
Время пребывания
моноцитов в
крови варьирует
от 36 до 104 ч. Моноциты,
выселяющиеся
в ткани, превращаются
в макрофаги,
при этом у них
появляются
большое количество
лизосом, фагосом,
фаголизосом.
Из крови
в ткани за 1 ч
уходит 7,0-106 моноцитов.
В тканях моноциты
дифференцируются
в органо - и
тканеспецифичные
макрофаги.
Внесосудистый
пул моноцитов
в 25 раз превышает
циркулирующий.
Система
мононуклеарных
фагоцитов
является центральной,
объединяющей
различные типы
клеток, участвующих
в защитных
реакциях организма.
Макрофагам
принадлежит
важнейшая роль
в процессах
фагоцитоза.
Они удаляют
из организма
отмирающие
клетки, остатки
разрушенных
клеток, денатурированный
белок, бактерии
и комплексы
антиген-антитело.
Макрофаги
участвуют в
регуляции
кроветворения,
иммунном ответе,
гемостазе,
метаболизме
липидов и железа.
Содержание
моноцитов в
крови в норме
отражено в
табл.2.
Таблица
3.
Содержание
лимфоцитов
(абсолютное
и относительное
- процентное
количество)
в крови в норме
| Возраст |
Предел
колебаний,
10 /л |
Моноциты,
% |
| 12мес |
0,05-1,1 |
2-7 |
| 4 года |
0-0,8 |
2-7 |
| 10 лет |
0-0,8 |
1-6 |
| 21 год |
0-0,8 |
1-8 |
| Взрослые |
а-0,8 |
1-8 |
Моноцитоз
- увеличение
числа моноцитов
в крови (>0,8109/л) -
сопровождает
целый ряд заболеваний
(табл.1.28). При
туберкулезе
появление
моноцитоза
считается
доказательством
активного
распространения
туберкулезного
процесса. При
этом важным
показателем
является отношение
абсолютного
числа моноцитов
к лимфоцитам,
которое в норме
составляет
0,3-1,0. Это отношение
бывает более
1,0 в активную
фазу заболевания
и снижается
при выздоровлении,
что позволяет
оценить течение
туберкулеза.
При септических
эндокардитах,
вялотекущем
сепсисе возможен
значительный
моноцитоз,
который нередко
встречается
в отсутствие
лейкоцитоза.
Относительный
или абсолютный
моноцитоз
отмечается
у 50 % больных с
системными
васкулитами.
Кратковременный
моноцитоз может
развиться у
больных с острыми
инфекциями
в период реконвалесценции.
Моноцитопения
- уменьшение
числа моноцитов
(< 0,09109/л). При гипоплазии
кроветворения
количество
моноцитов в
крови снижено.
2.3 Постклеточные
структуры
2.3.1 Эритроциты
Эритроциты,
или красные
кровяные тельца,
человека и
млекопитающих
представляют
собой безъядерные
клетки, утратившие
в процессе фило
- и онтогенеза
ядро и большинство
органелл. Эритроциты
являются
высокодифференцированными
постклеточными
структурами,
неспособными
к делению.
Функции
эритроцитов
осуществляются
в сосудистом
русле, которое
они в норме
никогда не
покидают:
1) дыхательная
- транспортировка
кислорода и
углекислоты.
Эта функция
обеспечивается
благодаря тому,
что эритроциты
заполнены
железосодержащим
кислород -
связывающим
пигментом -
гемоглобином
(составляет
33% их массы), который
определяет
их цвет (желтоватый
у отдельных
элементов и
красный у их
массы)
2) Регуляторные
и защитные
функции обеспечиваются
благодаря
способности
эритроцитов
переносить
на своей поверхности
ряд биологически
активных веществ,
в том числе
иммуноглобулины,
компоненты
комплемента,
иммунные комплексы.
3). Кроме того,
эритроциты
участвуют в
транспорте
аминокислот,
антител, токсинов
и ряда лекарственных
веществ, адсорбируя
их на поверхности
плазмолеммы.
Форма и
строение.
Популяция
эритроцитов
неоднородна
по форме и размерам
(рис.9). В нормальной
крови человека
основную массу
(80-90 %) составляют
эритроциты
двояковогнутой
формы - дискоциты.
Кроме того,
имеются планоциты
(с плоской
поверхностью)
и стареющие
формы эритроцитов
- шиловидные
эритроциты,
или эхиноциты
(~ 6 %), куполообразные,
или стоматоциты
(~ 1-3 %), и шаровидные,
или сфероциты
(~ 1 %)
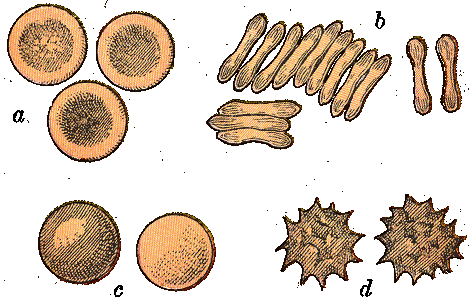
Рис.9. Формы
эритроцитов.
Средняя
продолжительность
жизни эритроцитов
составляет
около 120 дней.
В организме
ежедневно
разрушается
около 200 млн
эритроцитов.
Процесс старения
эритроцитов
идет двумя
путями - кренированием
(образование
зубцов на
плазмолемме)
или путем инвагинации
участков плазмолеммы.
При кренировании
образуются
эхиноциты с
различной
степенью формирования
выростов плазмолеммы,
впоследствии
отпадающих,
при этом формируется
эритроцит в
виде микросфероцита.
При инвагинации
плазмолеммы
эритроцита
образуются
стоматоциты,
конечной стадией
которых также
является
микросфероцип.
Одним из проявлений
процессов
старения эритроцитов
является их
гемолиз, сопровождающийся
выхождением
гемоглобина;
при этом в крови
обнаруживаются
"тени" (оболочки)
эритроцитов.
Обязательной
составной
частью популяции
эритроцитов
являются их
молодые формы
A - 5 %, называемые
ретикулоцитами,
или полихроматофильными
эритроцитами.
В них сохраняются
рибосомы и
эндоплазматическая
сеть, формирующие
зернистые и
сетчатые структуры
(substantia granulofilamentosa), которые
выявляются
при специальной
суправитальной
окраске. При
обычной гематологической
окраске азур
П-эозином они
в отличие от
основной массы
эритроцитов,
окрашивающихся
в оранжево-розовый
цвет (оксифилия),
проявляют
полихроматофилию
и окрашиваются
в серо-голубой
цвет.
При заболеваниях
могут появляться
аномальные
формы эритроцитов,
что чаще всего
обусловлено
изменением
структуры
гемоглобина
(Но). Замена даже
одной аминокислоты
в молекуле НЬ
может быть
причиной изменения
формы эритроцитов.
В качестве
примера можно
привести появление
эритроцитов
серповидной
формы при
серповидно-клеточной
анемии, когда
у больного
имеет место
генетическое
повреждение
в р-цепи гемоглобина.
Процесс нарушения
формы эритроцитов
при заболеваниях
получил название
пойкилоцитоз.
кровь
клетка эритроцит
тромбоцит
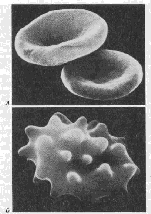
Рис.10.
А. Нормальные
эритроциты
в форме двояковогнутого
диска.
Б. Сморщенные
эритроциты
в гипертоническом
солевом растворе
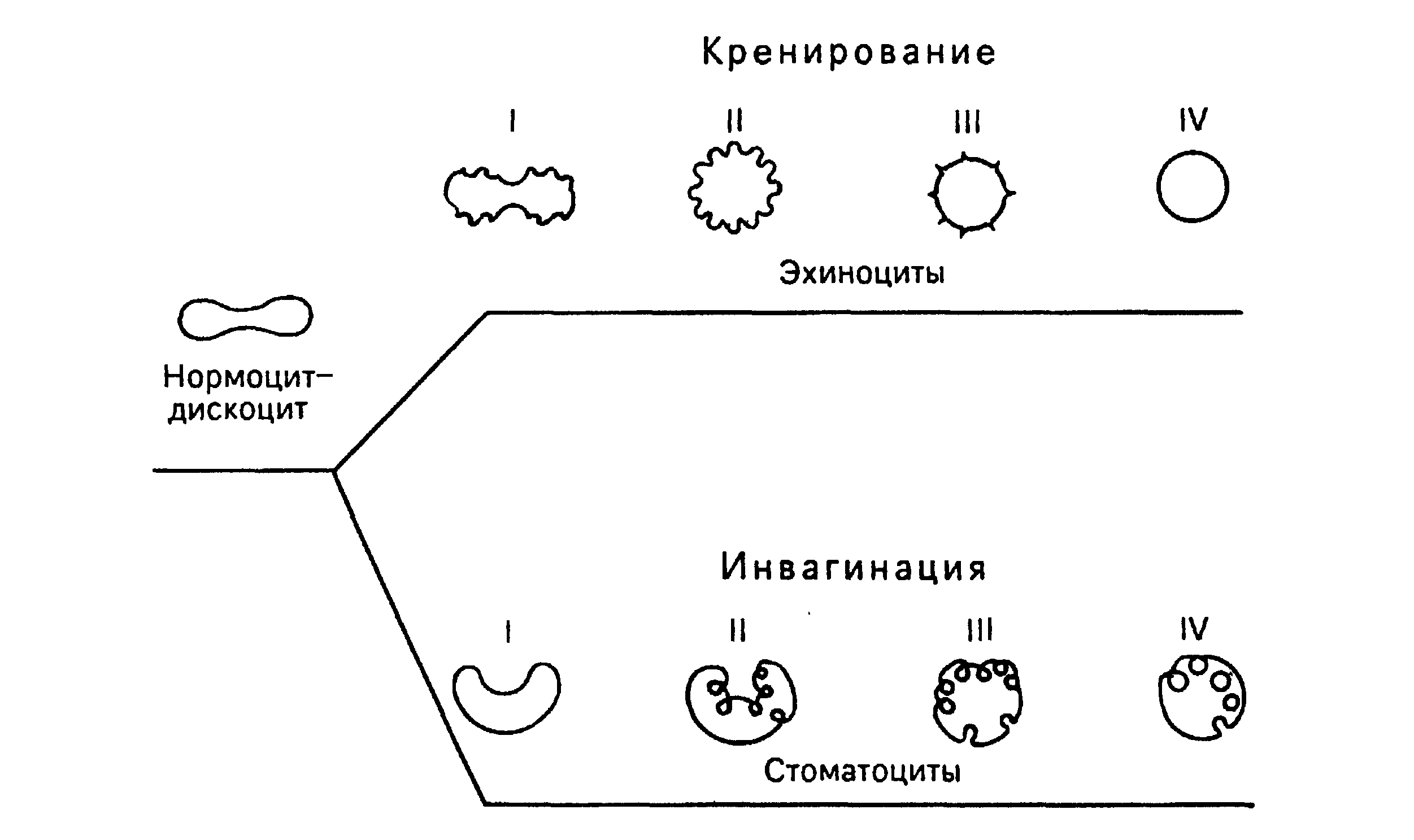
Рис.11. Изменение
формы эритроцитов
в процессе
старения (схема).
I, II, III, IV - стадии развития
эхиноцитов
и стоматоцитов
(по Т. Фуджии).
Размеры
эритроцитов
в нормальной
крови также
варьируют.
Большинство
эритроцитов
(~ 75 %) имеют диаметр
около 7,5 мкм и
называются
нормоцитами.
Остальная часть
эритроцитов
представлена
микроцитами
(~ 12,5 %) и макроцитами
( - 12,5 %). Микроциты
имеют диаметр
<7,5 мкм, а макроциты
>7,5 мкм. Изменение
размеров эритроцитов
встречается
при заболеваниях
крови и называется
анизоцитозом.
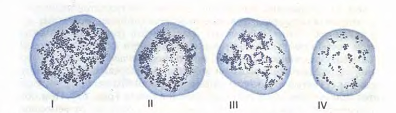
Рис.12. Ретикулоциты
(по Г.А. Алексееву
и И.А. Кассирскому).
Зернисто-сетчатая
субстанция
имеет вид клубка
(I), отдельных
нитей, в виде
розетки (II, III), зернышек
(IV).
Большинство
липидных молекул,
содержащих
холин (фосфатидилхолин,
сфингомиелин),
расположены
во внешнем слое
плазмолеммы,
а липиды, несущие
на конце аминогруппу
(фосфатидилсерин,
фосфатидилэтаноламин),
лежат во внутреннем
слое. Часть
липидов (~ 5 %) наружного
слоя соединены
с молекулами
олигосахаров
и называются
гликолипидами.
Распространены
мембранные
гликопротеины
- гликофорины.
С ними связывают
антигенные
различия между
группами крови
человека.
В плазмолемме
эритроцита
идентифицировано
15 главных белков
с молекулярной
массой 15-250 КД.
Более 60 % всех
белков составляют
примембранный
белок спектрин,
мембранные
белки - гликофорин
и полоса спектрин
составляет
25 % массы всех
мембранных
и примембранных
белков эритроцита,
является белком
цитоскелета,
связанным с
цитоплазматической
стороной плазмолеммы,
участвует в
поддержании
двояковогнутой
формы эритроцита
Молекула спектрина
имеет вид палочки
длиной 100 нм,
состоящей из
2 полипептидных
цепей: а-спектрина
B40 КД) и р-спектрина
B20 КД). Концы
сформированных
из них тетрамеров
связаны с короткими
актиновыми
филаментами
цитоплазмы
и белком полосы
4.1, образуя "узловой
комплекс"
(рис.13).
Цитоскелетный
белок полосы
4.1, связывающий
спектрин и
актин, одновременно
соединяется
с белком гликофорином.
На внутренней
цитоплазматической
поверхности
плазмолеммы
образуется
гибкая сетевидная
структура,
которая поддерживает
форму эритроцита
и противостоит
давлению при
прохождении
его через тонкий
капилляр (см.
рис.14).
Доказано,
что при наследственной
аномалии спектрина
эритроциты
имеют сферическую
форму. При
недостаточности
спектрина в
условиях анемии
эритроциты
также принимают
сферическую
форму. Соединение
спектринового
цитоскелета
с плазмолеммой
обеспечивает
внутриклеточный
белок анкирин.
Анкирин связывает
спектрин с
трансмембранным
белком плазмолеммы
(полоса 3). Гликофорин
- трансмембранный
белок C0 КД), который
пронизывает
плазмолемму
в виде одиночной
спирали, и его
большая часть
выступает на
наружной поверхности
эритроцита,
где к нему
присоединены
15 отдельных
цепей олигосахаридов,
которые в сумме
составляют
60 % массы гликофорина
и несут отрицательные
заряды.
Рис.13. Цитоскелет
фибробласта
и эритроцит
Гликофорины
относятся к
классу мембранных
гликопротеинов,
которые выполняют
рецепторные
функции. Гликофорины
обнаружены
только в эритроцитах.
Полоса 3 представляет
собой-трансмембранный
гликопротеид
A00 КД), полипептидная
цепь которого
много раз пересекает
бислой липидов.
Этот гликопротеид
участвует в
обмене О2 и
СО2, которые
связывают
гемоглобин
- основной белок
цитоплазмы
эритроцита.
Эритроциты
в легких отдают
СО2 путем замены
анионов НСО"
на СГ. Белок
полосы 3 обеспечивает
этим анионам
трансмембранный
проход через
гидрофильные
"поры", окруженные
гидрофобными
липидными
зонами. Таким
образом формируются
водные ионные
каналы.
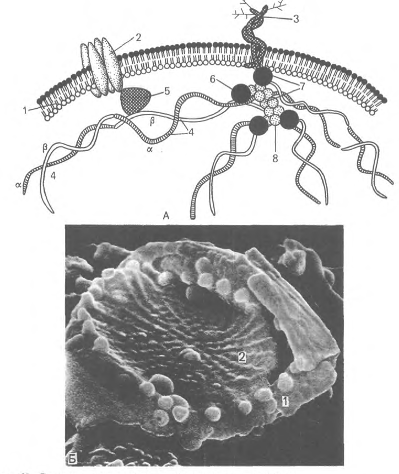
Рис.14. Строение
плазмолеммы
и цитоскелета
эритроцита.
А - схема: 1 - плазмолемма;
2 - белок полосы
3; 3 - гликофорин;
4 - сттектрин
{а - и р - цепи); 5 -
анкирин; 6 - белок
полосы 4.1; 7 - узловой
комплекс; 8 - актин;
Б - плазмолемма
и цитоскелет
эритроцита
в сканирующем
электронном
микроскопе.
- плазмолемма:
2 - сеть спектрина.
Олигосахариды
гликолипидов
и гликопротеидов
образуют гликокаликс.
Они определяют
антигенный
состав эритроцитов,
т.е. наличие в
них агглютиногенов.
На поверхности
эритроцитов
выявлены
агглютиногены
А и В, в состав
которых входят
полисахариды,
содержащие
амнносахара
и глюкуроновую
кислоту. Они
обеспечивают
агглютинацию
(склеивание)
эритроцитов
под влиянием
соответствующих
белков плазмы
крови - а - и
р-агглютининов,
находящихся
в составе фракции
у-глобулинов.
По содержанию
агглютиногенов
и агглютининов
различают 4
группы крови:
в крови А (0) группы
отсутствуют
агглютиногсны
А и В, но имеются
а - и р-агтлютинины;
в крови А (П) группы
имеются агглютиноген
А и р-агглютинин;
в крови В (Ш) группы
содержатся
В-агглютиноген
и а-агглютинин;
в крови AB (IV) группы
имеются агглютиногены
А и В и нет агглютининов.
При переливании
крови для
предотвращения
гемолиза (разрушение
эритроцитов)
нельзя допускать
вливания реципиентам
эритроцитов
с агглютиногенами
А или В, имеющим
а - или р-агглютинины.
Поэтому лица
с (0) A группой крови
являются
универсальными
донорами, т.е.
их кровь может
быть перелита
всем людям