Сорбционные свойства мха по отношению к микроорганизмам и тяжелым металлам
2.
ЭКСПЕРИМЕНТАЛЬНАЯ
ЧАСТЬ
2.1.
Методы исследований
2.1.1.
Получение
микробной
суспензии
Питательный
агар, который
готовится
согласно прописи,
заливают
предварительно
по 5-10 мл в пробирки,
которые оставляют
наклонными
в специальном
штативе до
полного застывания
среды. Бактериологической
петлей отбирают
клетки микроорганизмов
и вводят петлю
в пробирку
со скошенным
агаром до дна.
Слегка касаясь
бактериологической
петлей поверхности
среды, проводят
от дна пробирки
вверх зигзагообразную
линию, тем самым,
засевая культуру
микроорганизмов.
После посева
пробирки помещают
в термостат
(30С) на
1 сутки (по истечению
этого срока
пробирки извлекают
из термостата)
и заливают в
них по 2.0-3.0 мл
физиологического
раствора (ФР).
Осторожно
отделяют микробную
культуру от
агара постепенным
встряхиванием
и покачиванием
пробирки.
Полученную
суспензию
хранят в холодильнике.
2.1.2. Определение
количества
жизнеспособных
клеток методом
высева на плотную
среду
Микробную
суспензию
разводят в
стерильном
физиологическом
растворе, при
этом используя
один и тот же
коэффициент
разведения.
Посев осуществляют
из 5-ого, 6-ого и
7-ого разведений
перенося 0, 1 мл
суспензии на
поверхность
питательного
агара в чашках
Петри. Затем
суспензию
равномерно
распределяют
шпателем по
питательному
агару. Высев
из каждого
разведения
осуществляют
стерильной
пипеткой. После
посева чашки
помещают в
термостат
(30С) на
сутки.
Количество
жизнеспособных
клеток в 1 мл
суспензии
рассчитывают
по следующей
формуле:
M=a * 10z/
V; (
2.1 )
|
|
|
|
|
|
|
БГТУ
02.00.ПЗ
|
|
|
|
|
|
|
| Изм. |
Кол.уч. |
Лист |
№ док. |
Подпись |
Дата
|
| Разраб. |
Ковалевич
А.
|
|
|
Экспериментальная
часть |
Стадия |
Лист |
Листов |
| Пров. |
|
|
|
|
|
|
1 |
18 |
| Консульт. |
|
|
|
БГТУ 7140607 2004
|
| Н.контр. |
|
|
|
| Утв. |
|
|
|
где M –
количество
клеток в 1 мл
исходной суспензии;
а - количество
колоний, которые
выросли на
чашках Петри;
Z
- порядковый
номер разведения
суспензии;
V – объем
суспензии,
взятой для
высева на чашку
Петри, мл.
Величину оптической
плотности
измеряют с
помощью фотоколориметра
ФЭК-56М. Для измерения
светорассеяния
выбирают светофильтр,
который обеспечивает
максимум пропускания
света данной
суспензией.
В результате
опытов получили,
что максимум
пропускания
света обеспечивает
длина волны
540 нм.
2.1.3 . Изучение
сорбции металлов
мхом
Для эксперимента
на аналитических
весах взвешивают
образцы мха
массой 200+0,5 мг
и помещают их
в стеклянные
флаконы с
привинчивающимися
крышками объемом
100мл. Затем в эти
же флаконы
заливают по
50 мл раствора
металла различной
концентрации
(для эксперимента
были выбраны
следующие
концентрации
металлов: 0,1;
0,02;0,005; 0,0001; 0,00002; 0,00001 моль/л),
которые готовят
путем последовательного
разведения
исходного
раствора соли
металла (0,1 моль/л).
Флаконы закрывают
и оставляют
на 24 часа при
комнатной
температуре
(18+2С) при
периодическом
перемешивании.
После чего мох
из суспензии
отфильтровывают
через бумажный
фильтр в колбы
для титрования
и титруют по
следующим
методикам.
2.1.3.1. Определение
меди комплексонометрическим
методом
В качестве
источника меди
использовали
сульфат меди.
Ионы меди образуют
с ЭДТА комплексы
голубого цвета
с константой
устойчивости
6,3*1018 (ионная сила
0,1: 20 С).
Анализируемый
раствор разбавляют
водой до метки
в мерной колбе.
Равновесные
растворы с
исходной
концентрацией
0,100 моль/л после
фильтрования
в количестве
48 мл разбавляют
водой в мерной
колбе до 100 мл.
После перемешивания
отбирают пипеткой
аликвотную
часть раствора
в коническую
колбу, прибавляют
20 мл дистиллированной
воды, 5 мл буферного
раствора, на
кончике металлического
шпателя 20-30 мг
индикаторной
смеси, растворяют
ее и титруют
раствором ЭДТА
0,0500 М до изменения
окраски из
зеленовато-желтого
цвета в чисто-фиолетовую.
Измеряют объем
ЭДТА и вводят
1 каплю 2 М раствора
NH4ОН, если
цвет раствора
остается фиолетовым,
титрование
прекращают;
если от добавления
аммиака окраска
изменилась
в желтую или
желто-зеленую,
продолжают
титрование
раствором ЭДТА
до устойчивой
фиолетовой
окраски.
В качестве
буферного
раствора используют
ацетатный буфер
(ацетат аммония,
50% раствор) с pH6.
Титрование
ведут на холоду
(при комнатной
температуре
18+2С).
В качестве
металлоиндикатора
используют
мурексид (смесь
с хлоридом
натрия в соотношении
1:100).
Массу определяемого
вещества рассчитывают
по формуле
(2.2.):
m= (V1*Vж*c1*M)/(V2*1000)
( 2.2 )
где – V1
– объем раствора
ЭДТА, пошедшего
на титрование;
V2
- объем анализируемого
равновесного
раствора (аликвотная
часть);
c1
- молярная
концентрация
ЭДТА;
M – молярная
масса определяемого
вещества;
Vж
- объем мерной
колбы, из которой
отбирали аликвотную
часть.
2.1.3.2. Определение
кадмия комплексонометрическим
методом
В качестве
источника
кадмия в работе
использовали
ацетат кадмия.
Отбирают аликвотную
часть анализируемого
раствора из
мерной колбы
вместимостью
100 мл, прибавляют
2-3 мл буферного
раствора с pH
10 (аммиачный
буферный раствор:
67г NH4Cl и
570 мл 25%-ного NH3
в 1 л раствора),
15 мл воды, перемешивают
и прибавляют
на кончике
шпателя 20-30 мг
смеси индикатора
эриохромового
черного Т и
хлорида натрия.
Перемешивают
до полного
растворения
индикаторной
смеси и титруют
раствором ЭДТА
0,0500 М до изменения
окраски раствора
из винно-красной
в голубую.
Массу определяемого
вещества рассчитывают
по вышеуказанной
формуле (2.2).
2.1.4. Определение
кинетики сорбции
металлов мхом
В стеклянные
флаконы помещают
навески по
200+0,5 мг мха, взвешенные
на аналитических
весах. Добавляют
по 50 мл раствора
металла 0,02 моль/л
и тщательно
перемешивают.
Через 5, 10, 20, 30, 60 и 120 мин
мох отфильтровывают
из анализируемых
растворов.
Фильтраты меди
и кадмия оттитровывают
раствором ЭДТА
по вышеописанной
методике.
2.1.5. Изучение
сорбции металлов
микроорганизмами
В мерную колбу
на 50 мл сначала
добавляют 1 мл
микробной
суспензии,
затем доводят
объем до метки
исследуемым
раствором
металла.
После этого
вливают содержимое
мерной колбы
во флаконы на
100 мл с привинчивающимися
крышками. Флаконы
оставляют на
24 часа, по истечении
которых растворы
центрифугируют
при 8000 об/мин в
течение 10 минут.
Далее раствор,
отделенный
от микроорганизмов,
оттитровывают
раствором ЭДТА
по вышеописанной
методике.
2.1.6. Определение
кинетики сорбции
металлов
микроорганизмами
В мерную колбу
на 50 мл сначала
добавляют 1 мл
микробной
суспензии,
затем доводят
объем до метки
исследуемым
раствором
металла. После
этого вливают
содержимое
мерной колбы
во флаконы на
100 мл с привинчивающимися
крышками.
Через 5, 10, 20, 30, 60 и 120 мин
отфильтровывают
культуру
микроорганизмов
на микробном
фильтре и фильтраты
оттитровывают
раствором ЭДТА.
2.1.7. Изучение
сорбции металлов
в системе
мох-суспензия
микроорганизмов
В стеклянные
флаконы помещают
пробы мха 200+0,5
мг предварительно
взвешенные
на аналитических
весах. Потом
в эти же стеклянные
флаконы добавляют
50 мл раствора
металла различной
концентрации.
И затем добавляют
1 мл микробной
суспензии.
После этого
систему при
периодическом
перемешивании
оставляют на
24 часа. Через
сутки исследуемые
растворы
отфильтровывают
на микробном
фильтре и титруют
раствором ЭДТА
по методикам
указанным в
пп. 2.1.3.1. и 2.1.3.2..
2.1.8. Определение
кинетики сорбции
металлов
микроорганизмами,
адсорбированными
на мхе
В стеклянные
флаконы с
привинчивающимися
крышками помещают
навески мха
массой 200+0,5 мг,
1 мл микробной
суспензии и
50 мл раствора
металла 0,02 моль/л.
Через 5, 10, 20, 30, 60, 120 мин
культуру
микроорганизмов
отфильтровывают
через микробный
фильтр и фильтраты
оттитровывают
раствором ЭДТА.
2.1.9. Получение
кривой выживаемости
микроорганизмов
Выживаемость
микроорганизмов
изучают посевом
их на чашки
Петри с питательным
агаром. Микробную
суспензию
используют
после обработки
ее металлами
в опыте по изучению
сорбции металлов
микроорганизмами.
2.1.10. Изучение
адсорбции
микроорганизмов
мхом
В мерную колбу
на 50 мл сначала
добавляют 1 мл
микробной
суспензии и
доводят объем
до метки дистиллированной
водой. Затем
переливают
раствор микробной
суспензии в
качальную колбу
и добавляют
навески мха
массой 200+0,5 мг.
Все колбы ставят
на качалку на
2 часа. Измеряют
оптическую
плотность и
делают высев
на жизнеспособность.
Результаты
представлены
в таблице 2.8.
2.2. Результаты
исследований
и их обсуждение
В качестве
сорбента-носителя
микроорганизмов
использовался
мох из класса
мхи (Мusci) подкласса
сфагновые,
семейства
сфагновые,
Sphagnum cuspidatum.
Данный вид мха
был выбран в
связи с тем,
что он обладает
значительным
ареалом распространения
в нашей республике.
В качестве
микроорганизмов,
способных к
поглощению
тяжелых металлов,
изучались
Pseudomonas aeroginosa
B7. Это прямые
или слегка
изогнутые
палочки, размером
0,5-1 мкм. Граммотрицательные,
обладают
подвижностью
за счет одного
полярного
жгутика, тип
дыхания - аэробы,
метаболизм
чисто дыхательного
типа с использованием
кислорода как
конечного
акцептора
электронов,
данные бактерии
могут выделять
в среду сине-зеленый
пигмент. Данные
бактерии широко
распространены,
так, например,
они часто встречаются
при гнойных
инфекциях в
медицинских
учреждениях.
Полученные
экспериментальные
данные в опыте
по изучению
сорбции металлов
мхом (2.1.3.) сведены
в таблицу 2.1. и
представлены
в виде изотерм
сорбции на
рисунках 2.1. и
2.2..
Таблица 2.1
Данные ионообменной
сорбции металлов
мхом
| Навеска
мха, г |
Исходная
концентрация
соли металла,
моль/л |
Объем
аликвоты, мл |
Объем
ЭДТА 0,05 моль/л
пошедшего на
титрование,
мл |
Равновесная
концентрация
соли металла,
моль/л |
Количество
сорбированного
металла, мг-экв/г |
| Сульфат
меди, CuSO4 |
|
0,2012
|
0,1
|
10
|
9,85
|
0,09855
|
0,72
|
|
0,1998
|
0,1
|
10
|
9,86
|
0,09863
|
0,68
|
|
0,2001
|
0,02
|
10
|
3,73
|
0,01865
|
0,67
|
|
0,2020
|
0,02
|
10
|
3,74
|
0,01868
|
0,66
|
|
0,1995
|
0,005
|
25
|
1,95
|
0,00389
|
0,55
|
|
0,1987
|
0,005
|
25
|
1,99
|
0,00397
|
0,51
|
| Ацетат
кадмия, Cd(CH3COO)2 |
|
0,2013
|
0,1
|
10
|
9,86
|
0,09864
|
0,69
|
|
0,2210
|
0,1
|
10
|
9,87
|
0,09871
|
0,66
|
|
0,1899
|
0,02
|
10
|
3,75
|
0,01876
|
0,62
|
|
0,2430
|
0,02
|
10
|
3,76
|
0,01880
|
0,60
|
|
0,2150
|
0,005
|
25
|
1,93
|
0,00386
|
0,57
|
|
0,2000
|
0,005
|
25
|
1,95
|
0,00390
|
0,55
|
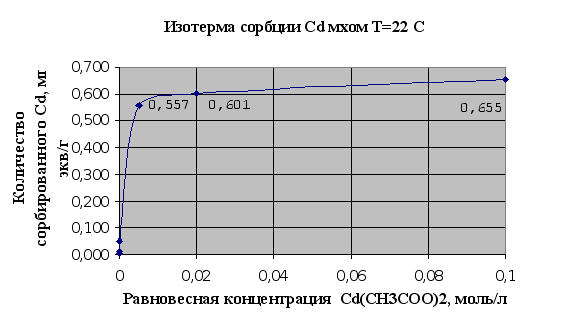
Рис.2.1.
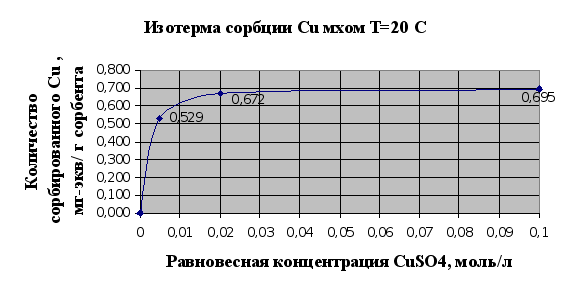
Рис.2.2.
Изотермы сорбции
– это кривые,
показывающие
зависимость
количества
сорбированного
вещества (мг-экв)
в расчете на
1 г сорбента от
равновесной
концентрации
этого вещества
в моль/л.
Полученные
результаты
полностью
соответствуют
существующим
сведениям об
ионообменной
емкости мха,
которая по
литературным
сведениям
считается
равной 1мг-экв/г.
На основании
представленных
рис.2.1. и 2.2. можно
говорить, что
мох является
хорошим природным
ионообменником
и обладает
хорошими сорбционными
свойствами
по отношению
к тяжелым металлам,
это достигается
наличием в
структуре мха
таких веществ
как полиурониды
(полисахариды,
содержащие
карбоксильную
группу в 6-пложении
пиранового
или ангидроглюкозного
цикла) и пектина.
Сравнивания
результаты
сорбции ионов
меди и ионов
кадмия можно
сделать вывод,
что из исследованных
тяжелых металлов
лучше сорбируется
мхом медь (Cu),
чем кадмий
(Cd). Это может
быть связано
в первую очередь
с тем, что ионы
меди лучше
удерживаются
карбоксильными
группами мха
в составе клеточной
стенки мха,
которые и отвечают
в основном за
ионообменную
активность
мха.
Полученные
экспериментальные
данные в опыте
по изучению
кинетики сорбции
металлов мхом
(2.1.4.) сведены в
таблицу 2.2. и
представлены
в виде кинетических
кривых сорбции
на рисунках
2.3 и 2.4..
Таблица 2.2
Данные по кинетике
сорбции металлов
мхом
| Время,
мин |
Навеска
мха, г |
Исходная
концентрация
соли металла,
моль/л |
Объем
аликвоты, мл |
Объем
ЭДТА 0,05 моль/л
пошедшего на
титрование,
мл |
Равновесная
концентрация
соли металла,
моль/л |
Количество
сорбированного
металла, мг-экв/г |
| Ацетат
кадмия, Cd(CH3COO)2 |
|
5
|
0,2014
|
0,02
|
10
|
3,99
|
0,01997
|
0,01
|
|
10
|
0,2218
|
0,02
|
10
|
3,94
|
0,01972
|
0,14
|
|
20
|
0,1899
|
0,02
|
10
|
3,92
|
0,01958
|
0,21
|
|
30
|
0,2434
|
0,02
|
10
|
3,86
|
0,01931
|
0,35
|
|
60
|
0,2156
|
0,02
|
10
|
3,81
|
0,01903
|
0,49
|
|
120
|
0,2213
|
0,02
|
10
|
3,81
|
0,01903
|
0,49
|
| Сульфат
меди, CuSO4 |
|
5
|
0,2266
|
0,02
|
10
|
3,82
|
0,01912
|
0,44
|
|
10
|
0,2312
|
0,02
|
10
|
3,80
|
0,01901
|
0,50
|
|
20
|
0,1899
|
0,02
|
10
|
3,77
|
0,01885
|
0,57
|
|
30
|
0,2001
|
0,02
|
10
|
3,75
|
0,01874
|
0,63
|
|
60
|
0,2166
|
0,02
|
10
|
3,73
|
0,01863
|
0,69
|
|
120
|
0,1959
|
0,02
|
10
|
3,73
|
0,01863
|
0,69
|
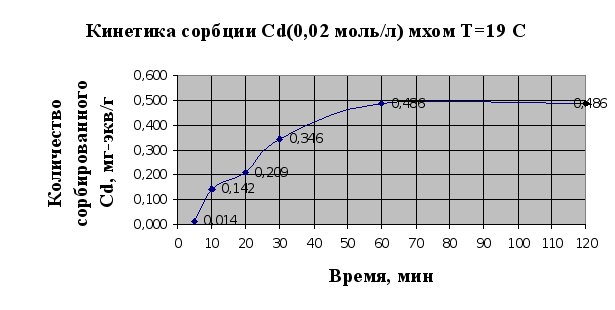 Рис.2.3.
Рис.2.3.
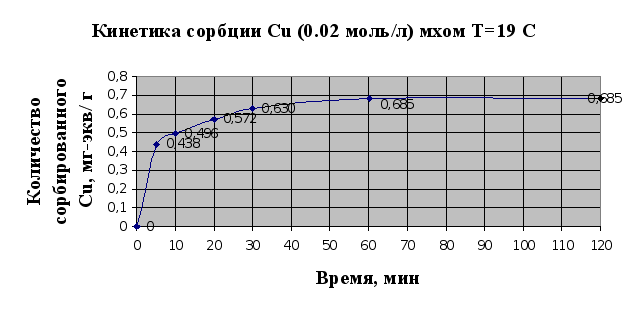 Рис.2.4.
Рис.2.4.
Под кинетическими
кривыми сорбции
принято понимать
кривые, показывающие
зависимость
количества
сорбированного
вещества (ионов
металла) от
времени проведения
сорбции, t,
мин.
По виду кинетических
кривых можно
говорить о том,
что в системе
«мох-раствор
металла» достаточно
быстро устанавливается
равновесное
состояние
(рис.2.3, 2.4.). Так, уже
через полчаса
сорбируется
91% ионов меди
и 72% кадмия. Также
по виду кривой
2.3. можно говорить
о присутствии
у мха двух активных
центров связывания
ионов металла,
об этом свидетельствуют
две точки перегиба
на кривой, т.е.
основной вклад
в сорбцию вносит
ионообменная
сорбция, а не
физическая,
т.к. в случае
физической
сорбции точек
перегиба бы
не было.
Результаты
изучения сорбции
металлов
микроорганизмами
(2.1.5.) сведены в
таблицу 2.3. и
представлены
в виде изотерм
сорбции металлов
на рис.2.5.и 2.6..
Таблица 2.3
Данные по сорбции
металлов
микроорганизмами
| Навеска
мха, г |
Исходная
концентрация
соли металла,
моль/л |
Объем
аликвоты, мл |
Объем
ЭДТА 0,05 моль/л
пошедшего на
титрование,
мл |
Равновесная
концентрация
соли металла,
моль/л |
Количество
сорбированного
металла, мг-экв/мл |
Количество
сорбированного
металла мг-экв/см3
плотно
упакованных
клеток
|
| Ацетат кадмия,
Cd(CH3COO)2 |
|
0,1945
|
0,1
|
10
|
9,98
|
0,09979
|
0,11
|
8,0046
|
|
0,2230
|
0,1
|
10
|
9,99
|
0,09986
|
0,08
|
5,6172
|
|
0,1981
|
0,02
|
10
|
3,96
|
0,01979
|
0,11
|
7,5130
|
|
0,2054
|
0,02
|
10
|
3,97
|
0,01986
|
0,07
|
4,9151
|
|
0,1980
|
0,005
|
25
|
2,38
|
0,00476
|
0,12
|
8,4258
|
|
0,1996
|
0,005
|
25
|
2,40
|
0,00480
|
0,10
|
7,0215
|
Продолжение
таблицы 2.3
| Сульфат
меди, CuSO4 |
|
0,2032
|
0,1
|
10
|
9,93
|
0,09933
|
0,33
|
23,1711
|
|
0,1975
|
0,1
|
10
|
9,94
|
0,09941
|
0,29
|
20,3625
|
|
0,1987
|
0,02
|
10
|
3,89
|
0,01947
|
0,27
|
18,6071
|
|
0,2005
|
0,02
|
10
|
3,90
|
0,01948
|
0,26
|
18,2560
|
|
0,2400
|
0,005
|
25
|
2,24
|
0,00449
|
0,25
|
17,6943
|
|
0,2265
|
0,005
|
25
|
2,26
|
0,00451
|
0,24
|
16,8517
|
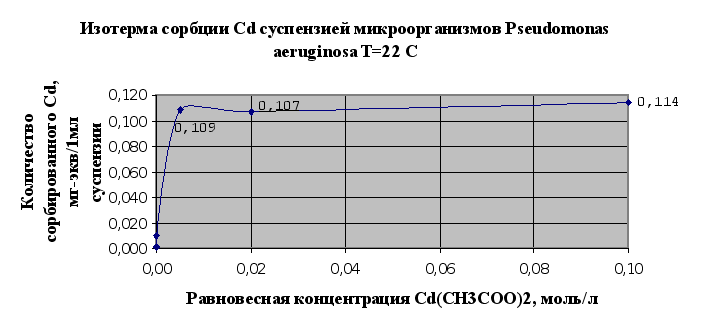 Рис.2.5.
Рис.2.5.
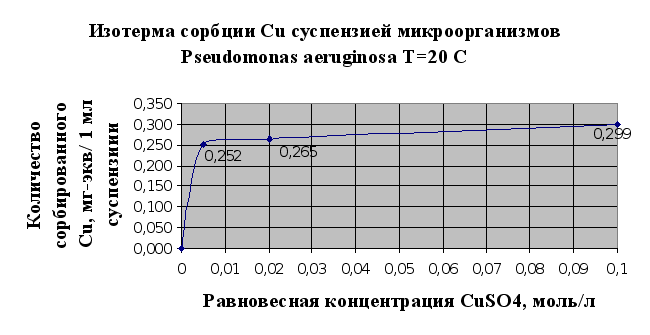 Рис. 2.6.
Рис. 2.6.
Основываясь
на результатах
эксперимента
можно говорить
о том, что исследуемый
штам микроорганизмов
Pseudomonas aeruginosa
В7 обладает
сорбционными
свойствами
по отношению
к тяжелым металлам.
Так, по отношению
к кадмию в результате
исследований
(п.2.1.5) сорбционная
емкость микроорганизмов
– 0,114 мг-экв/мл
суспензии, по
меди – 0,29 мг-экв/мл
суспензии.
Однако стоит
отметить, что
в настоящее
время существуют
более эффективные
формы микроорганизмов,
которые используются
для биосорбции
металлов из
растворов, в
том числе и
штаммы данного
рода. Из исследованных
тяжелых металлов
лучше сорбируется
мхом и микроорганизмами
медь (Cu), чем
кадмий (Cd)
(см. рис.2.5 и 2.6.) Можно
сделать предположение
о том, что это
связано в первую
очередь с тем,
что в небольших
количествах
медь является
одним из важнейших
биогенных
элементов,
необходимых
для развития
микроорганизмов
и наряду с сорбцией
имеет место
утилизация
микроорганизмами
ионов меди.
Результаты
изучения кинетики
сорбции микроорганизмами
ионов металлов
сведены в таблицу
2.4. и представлены
в виде кинетических
кривых.
Таблица 2.4
Данные по кинетике
сорбции металлов
микроорганизмами
| Время,
мин |
Навеска
мха, г |
Исходная
концентрация
соли металла,
моль/л |
Объем
аликвоты, мл |
Объем
ЭДТА 0,05 моль/л
пошедшего на
титрование,
мл |
Равновесная
концентрация
соли металла,
моль/л |
Количество
сорбированного
металла, мг-экв/мл |
Количество
сорбированного
металла мг-экв/см3
плотно упакованных
клеток |
|
Ацетат
кадмия, Cd(CH3COO)2
|
|
5
|
0,1874
|
0,02
|
10
|
4,00
|
0,01999
|
0,01
|
0,3511
|
|
10
|
0,1755
|
0,02
|
10
|
3,98
|
0,01990
|
0,05
|
3,3703
|
|
20
|
0,2100
|
0,02
|
10
|
3,98
|
0,01988
|
0,06
|
4,3534
|
|
30
|
0,1990
|
0,02
|
10
|
3,97
|
0,01985
|
0,07
|
5,1257
|
|
60
|
0,1980
|
0,02
|
10
|
3,96
|
0,01982
|
0,09
|
6,2492
|
|
120
|
0,1996
|
0,02
|
10
|
3,96
|
0,01981
|
0,10
|
6,7407
|
|
Сульфат
меди, CuSO4
|
|
5
|
0,1955
|
0,02
|
10
|
3,97
|
0,01985
|
0,07
|
5,1959
|
|
10
|
0,2230
|
0,02
|
10
|
3,96
|
0,01978
|
0,11
|
7,5833
|
|
20
|
0,1906
|
0,02
|
10
|
3,94
|
0,01971
|
0,15
|
10,2515
|
|
30
|
0,2054
|
0,02
|
10
|
3,93
|
0,01964
|
0,18
|
12,4281
|
|
60
|
0,1980
|
0,02
|
10
|
3,90
|
0,01949
|
0,26
|
17,9751
|
|
120
|
0,1996
|
0,02
|
10
|
3,90
|
0,01949
|
0,26
|
17,9751
|
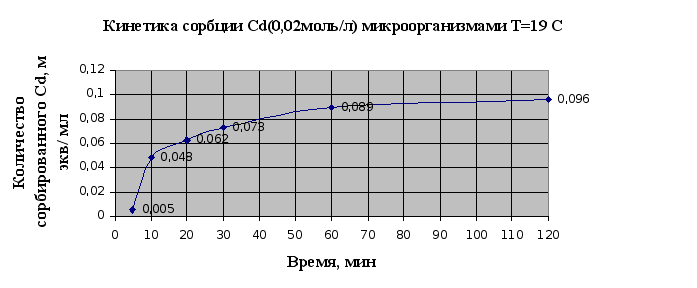
Рис. 2.7.
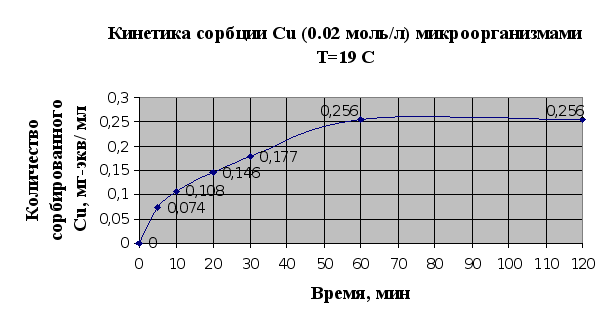
Рис.2.8.
По виду кинетических
кривых сорбции
можно говорить,
что основной
вклад в сорбцию
ионов металлов
микроорганизмами
вносит физическая
сорбция, чтобы
говорить о
ионообменной
сорбции необходимы
дополнительные
исследования.
Равновесное
состояние
устанавливается
в течение часа.
Также можно
сказать, что
сорбция меди
идет быстрее.
Полученные
результаты
в экспериментах
по изучению
сорбции металлов
в системе
мох-суспензия
микроорганизмов
(п.2.1.6.) сведены в
таблицу 2.5. и
представлены
в виде изотерм
сорбции на рис.
2.9.и 2.10..
Таблица 2.5
Данные по сорбции
металлов в
системе мох-суспензия
микроорганизмов
| Навеска
мха, г |
Исходная
концентрация
соли металла,
моль/л |
Объем
аликвоты, мл |
Объем
ЭДТА 0,05 моль/л
пошедшего на
титрование,
мл |
Равновесная
концентрация
соли металла,
моль/л |
Количество
сорбированного
металла, мг-экв/г |
|
Ацетат
кадмия, Cd(CH3COO)
|
|
0,2156
|
0,1
|
10
|
9,84
|
0,09842
|
0,80
|
|
0,2643
|
0,1
|
10
|
9,85
|
0,09850
|
0,76
|
|
0,1986
|
0,02
|
10
|
3,69
|
0,01846
|
0,77
|
|
0,1921
|
0,02
|
10
|
3,70
|
0,01850
|
0,75
|
|
0,1896
|
0,005
|
25
|
1,73
|
0,00346
|
0,77
|
|
0,1955
|
0,005
|
25
|
1,71
|
0,00342
|
0,79
|
|
Сульфат
меди, CuSO4
|
|
0,2000
|
0,1
|
10
|
9,80
|
0,09805
|
0,97
|
|
0,1955
|
0,1
|
10
|
9,81
|
0,09811
|
0,94
|
|
0,1970
|
0,02
|
10
|
3,63
|
0,01816
|
0,92
|
|
0,1979
|
0,02
|
10
|
3,64
|
0,01819
|
0,90
|
|
0,2053
|
0,005
|
25
|
1,62
|
0,00323
|
0,88
|
|
0,1990
|
0,005
|
25
|
1,61
|
0,00322
|
0,89
|
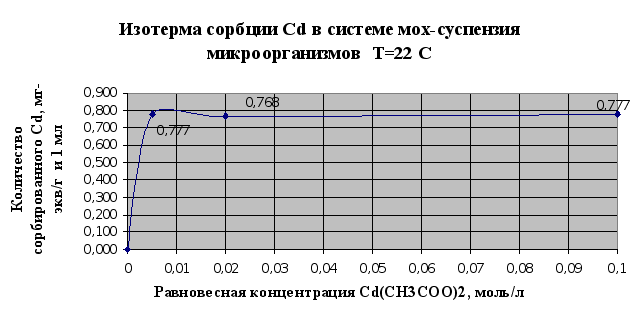
Рис. 2.9
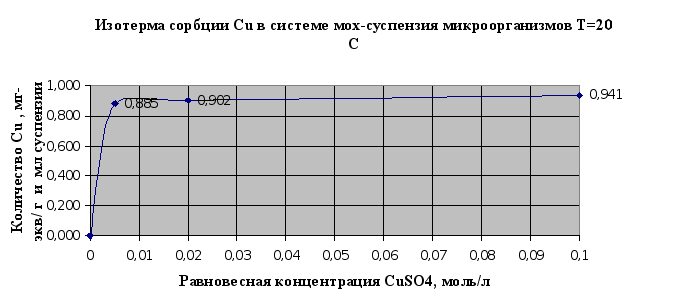 Рис.2.10.
Рис.2.10.
По результатам
этого эксперимента
можно сделать
вывод, что совместное
использование
мха и микроорганизмов
значительно
повышает
эффективность
биосорбции
и улучшает
поглощение
тяжелых металлов
из растворов
этих металлов.
Так, если мхом
сорбируется
0,655 мг-экв(кадмия
)/г, то при совместном
использовании
мха и микроорганизмов-
0,777 мг-экв/г и мл.
Таким образом,
эффективность
сорбции увеличивается
на 16% . При аналогичном
сравнивании
результатов
сорбции по
ионам меди
эффективность
увеличивается
на 26%.
Экспериментальные
данные по изучению
кинетики сорбции
металлов
микроорганизмами,
адсорбированными
на мхе сведены
в таблицу 2.6. и
представлены
в виде кинетических
зависимостей
концентрации
металла от
времени на рис.
2.11. и 2.12..
Таблица 2.6.
Данные по кинетике
сорбции металла
в системе
мох-суспензия
микроорганизмов
| Время,
мин |
Навеска
мха, г |
Исходная
концентрация
соли металла,
моль/л |
Объем
аликвоты, мл |
Объем
ЭДТА 0,05 моль/л
пошедшего на
титрование,
мл |
Равновесная
концентрация
соли металла,
моль/л |
Количество
сорбированного
металла, мг-экв/г |
| Ацетат
кадмия, Сd(CH3COO)2 |
|
5
|
0,2251
|
0,02
|
10
|
3,95
|
0,01975
|
0,13
|
|
10
|
0,2643
|
0,02
|
10
|
3,95
|
0,01974
|
0,13
|
|
20
|
0,1986
|
0,02
|
10
|
3,93
|
0,01965
|
0,18
|
|
30
|
0,1921
|
0,02
|
10
|
3,93
|
0,01965
|
0,18
|
|
60
|
0,1896
|
0,02
|
10
|
3,69
|
0,01845
|
0,78
|
|
120
|
0,1955
|
0,02
|
10
|
3,69
|
0,01845
|
0,78
|
| Сульфат
меди, CuSO4 |
|
5
|
0,2312
|
0,02
|
10
|
3,79
|
0,01897
|
0,52
|
|
10
|
0,2087
|
0,02
|
10
|
3,79
|
0,01897
|
0,52
|
|
20
|
0,1982
|
0,02
|
10
|
3,79
|
0,01895
|
0,52
|
|
30
|
0,19
|
0,02
|
10
|
3,75
|
0,01873
|
0,64
|
|
60
|
0,191
|
0,02
|
10
|
3,68
|
0,01841
|
0,79
|
|
120
|
0,24
|
0,02
|
10
|
3,67
|
0,01833
|
0,83
|
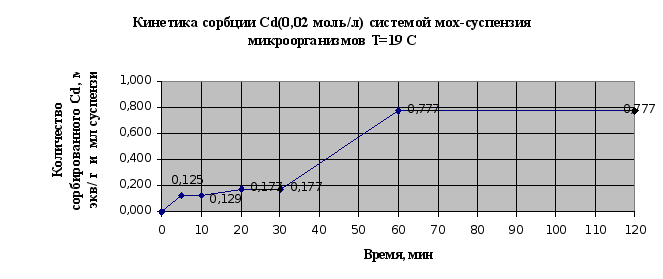 Рис.2.11.
Рис.2.11.
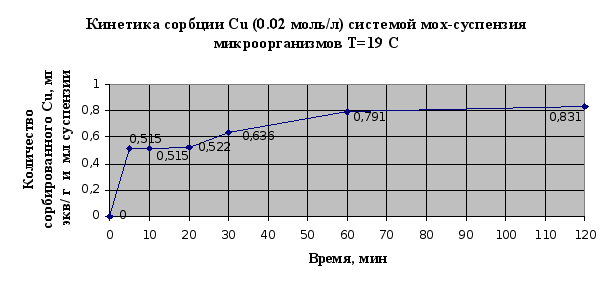 Рис.2.12.
Рис.2.12.
По результатам
эксперимента
можно сделать
следующие
выводы: в системе
быстро наступает
равновесное
состояние, так
уже через 60 мин
сорбируется
95% ионов меди,
и 97% ионов кадмия;
наличие на
кинетических
кривых двух
точек перегиба
свидетельствует
о наличие у мха
двух активных
центров связывания
и значимости
ионообменной
сорбции в суммарном
процессе.
Результаты
эксперимента
по получению
кривых выживаемости
микроорганизмов
Pseudomonas aeruginosa
(2.1.9.) представлены
на рис. 2.13. и 2.14..
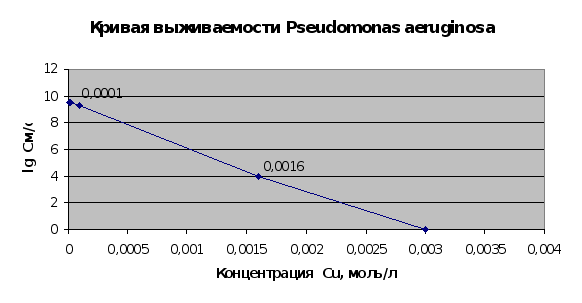
Рис. 2.13.
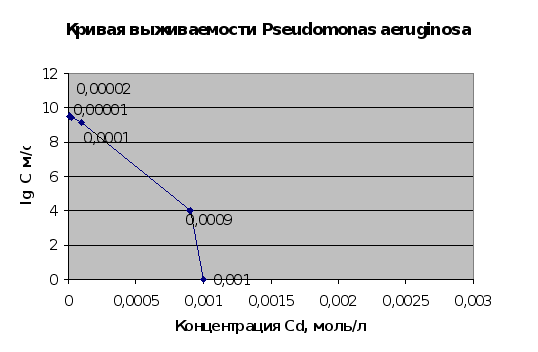 Рис.2.14.
Рис.2.14.
Результаты
данного эксперимента
полностью
соответствуют
литературным
сведениям о
выживаемости
микроорганизмов
при воздействии
на них ионов
тяжелых металлов
[5,7]. Сопоставляя
результаты
этого эксперимента
и эксперимента
по изучению
сорбции металлов
микроорганизмами
(пп.2.1.5. и 2.1.6.) можно
говорить о том,
что сорбция
ведется и мертвой
культурой, что
подтверждает
физический
характер сорбции
при использовании
микроорганизмов.
Результаты
изучения адсорбции
микроорганизмов
мхом (п.2.1.10.) сведены
в таблицу 2.7..
Таблица 2.7
| Концентрация
микробной
суспензии
после разведения
ее до 50мл, кл/мл |
Оптическая
плотность
(D)
разбавленной
суспензии до
опыта |
Оптическая
плотность
(D)
суспензии
после проведения
опыта |
Концентрация
микробной
суспензии
после проведения
эксперимента,
кл/мл
(рис.2.15.)
|
Фактическая
концентрация,
определенная
путем высева
на агаризованную
среду, кл/мл |
|
6,8*107
|
0,092 |
0,073 |
5,07*107
|
4,5*107
|
|
6,8*107
|
0,092 |
0,069 |
5,07*107
|
5*107
|
|
6,8*107
|
0,092 |
0,071 |
5,07*107
|
4*107
|
Согласно результатам
этого эксперимента
можно говорить
о том, что мох
губительно
воздействует
на микроорганизмы
так, в результате
исследований
(п.2.1.10) концентрация
микроорганизмов
снизилась с
6,8*107 до 5,07*107 кл/мл.
Данные свойства
мха могут в
дальнейшем
найти применение
в медицине, при
использовании
мха как энтеросорбента.
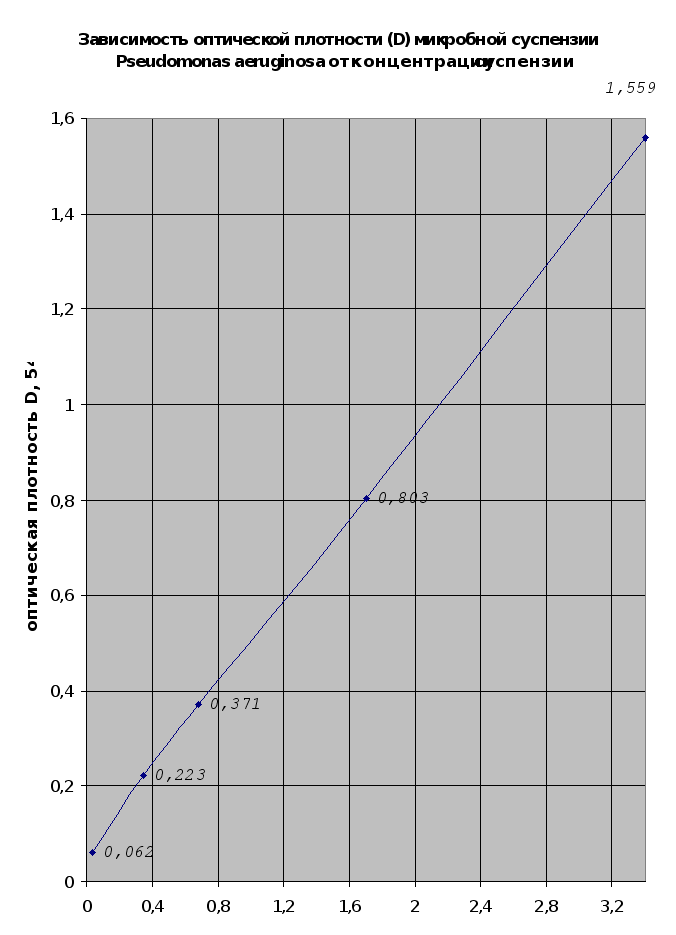
Концентрация
микробной
суспензии,
кл/мл*109
Рис. 2.15.
Можно сделать
следующие
выводы по итогам
исследований:
Мох является
хорошим природным
ионообменником
и обладает
хорошими
сорбционными
свойствами
по отношению
к тяжелым металлам,
это достигается
наличием в
структуре мха
таких веществ
как полиурониды
(полисахариды,
содержащие
карбоксильную
группу в 6-пложении
пиранового
или ангидроглюкозного
цикла) и пектина.
Ионообменная
емкость мха
по меди 0,7 мг-экв/г,
по кадмию 0,65
мг-экв/г.
Мох оказывает
губительное
воздействие
на микроорганизмы.
Исследуемый
штам микроорганизмов
Pseudomonas aeruginosa
В7 обладает
сорбционными
свойствами
по отношению
к тяжелым металлам.
Так, по отношению
к кадмию в
результате
исследований
(п.2.1.5) сорбционная
емкость микроорганизмов
– 0,114 мг-экв/мл
суспензии, по
меди – 0,29 мг-экв/мл
суспензии.
По виду кинетических
кривых сорбции,
согласно современным
представлениям
о механизме
процесса сорбции
можно сделать
вывод, что в
исследованных
гетерогенных
системах достаточно
быстро устанавливается
равновесное
состояние.
Совместное
использование
мха и микроорганизмов
значительно
повышает
эффективность
биосорбции
и улучшает
поглощение
тяжелых металлов
из растворов
этих металлов.
2.3. Статистическая
обработка
2.3.1. Расчет статистической
ошибки определения
сорбции микроорганизмов
мхом
n:=3 i:= 1..n
X1:=0.073 X2:=0.069
X3:=0.071- объем
раствора ЭДТА
пошедшего на
титрование;
X:=0.071 – среднее
значение;
S:=0.0006
t:=3.14
D:=0.0015
Z:=0.103
2.3.2. Расчет статистической
ошибки определения
концентрации
металлов путем
титрования
Рассчитаем
ошибку в опыте
по изучению
сорбции меди
мхом (п.2.1.3) для
исходной концентрации
0,1 моль/л (табл.2.1):
n:=3 i:= 1..n
X1:=9.85 X2:=9.86
X3:9.84 - объем
раствора ЭДТА
пошедшего на
титрование;
X:=9.85– среднее
значение;
S:=0.0007
D:=0.002
Z:=0.109
1. АНАЛИТИЧЕСКИЙ
ОБЗОР
В настоящее
время тяжелые
металлы относятся
к приоритетным
загрязняющим
веществам,
наблюдения
за которыми
обязательны
во всех средах.
Так как дипломная
работа посвящена
изучению
сорбционных
свойств мха
по отношению
к тяжелым
металлам,
рассмотрим,
что же принято
относить к
понятию тяжелые
металлы.
Тяжелые
металлы
Понятие
тяжелые металлы,
характеризующее
широкую группу
загрязняющих
веществ, получило
в последнее
время значительное
распространение.
В различных
научных и
прикладных
работах авторы
по-разному
трактуют значение
этого термина.
В связи с этим
количество
элементов,
относимых к
группе тяжелых
металлов,
изменяется
в широких
пределах. В
качестве
критериев
принадлежности
используются
многочисленные
характеристики:
атомная масса,
плотность,
токсичность,
распространенность
в природной
среде, степень
вовлеченности
в природные
и техногенные
циклы. В некоторых
случаях под
определение
тяжелых металлов
попадают
элементы,
относящиеся
к хрупким
(например,
висмут) или
металлоидам
(например,
мышьяк).
В работах,
посвященных
проблемам
загрязнения
окружающей
природной
среды и экологического
мониторинга,
на сегодняшний
день к тяжелым
металлам относят
более 40 металлов
периодической
системы Д.И.
Менделеева
с атомной массой
свыше 50 атомных
единиц: V, Cr, Mn, Fe, Co,
Ni, Cu, Zn, Mo, Cd, Sn, Hg, Pb, Bi и др. При
этом немаловажную
роль в категорировании
тяжелых металлов
играют следующие
условия: их
высокая токсичность
для живых
организмов
в относительно
низких концентрациях,
а также способность
к биоаккумуляции
и биомагнификации.
Практически
все металлы,
попадающие
под это определение
(за исключением
свинца, ртути,
кадмия и висмута,
биологическая
роль которых
на настоящий
момент не ясна),
активно участвуют
в биологических
процессах,
входят в состав
многих ферментов.
По классификации
Н.Реймерса,
тяжелыми следует
считать металлы
с плотностью
более 8 г/см3.
Таким образом,
к тяжелым
металлам
относятся
Pb, Cu, Zn, Ni, Cd, Co, Sb,
|