Задание №1.
Основные свойства природных газов. Уравнение состояния реальных газов.
Природные углеводородные газы представляют собой смесь предельных УВ вида Сn
Н2
n
+2
. Основным компонентом является метан СН4
, содержание которого в природных газах достигает 98%. Наряду с метаном в состав природных газов входят более тяжелые УВ, а также неуглеводородные компоненты: азот N, углекислый газ СО2
, сероводород H2
S, гелий Не, аргон Аг.
Природные газы подразделяют на следующие группы.
1. Газ, добываемый из чисто газовых месторождений и представляющий собой сухой газ, свободный от тяжелых УВ.
2. Газы, добываемые вместе с нефтью (растворенные или попутные газы). Это физические смеси сухого газа, пропан-бутановой фракции (жирного газа) и газового бензина.
3. Газы, добываемые из газоконденсатных месторождений,— смесь сухого газа и жидкого углеводородного конденсата. Углеводородный конденсат состоит из большого числа тяжелых УВ (С5
+ высш., С6
+ высш. и т.д.), из которых можно выделить бензиновые, лигроиновые, керосиновые, а иногда и более тяжелые масляные фракции.
4. Газы газогидратных залежей.
Компонентный состав и свойства отдельных компонентов природного газа приведены в таблице 1.
Таблица 1. Основные свойства компонентов природных газов в стандартных условиях.
| Свойства |
Обозна чение |
СН1
|
С2
Н6
|
С3
Н8
|
i-С4
Н10
|
n-С4
Н10
|
Молекулярная
масса
Объём 1 кг газа,
м
Плотность по
воздуху
Масса 1 м3
газа,
кг
Критическое
давление, МПа
Критическая
температура, К
|
М
22,4
М
М
28,97
М
22,4
ркр
Ткр
|
16,04
1,40
0,554
0,714
4,58
191
|
30,07
0,74
1,038
1,35
4,86
305
|
44,10
0,508
1,522
1,97
4,34
370
|
58,12
0,385
2,006
2,85
3,82
407
|
58,12
0,385
2,006
2,85
3,57
425
|
Во многих случаях состав природных углеводородных газов определяется не полностью, а лишь до бутана (С4
Н10
) или гексана (С6
Н14
) включительно, а все остальные компоненты объединяются в остаток (или псевдокомпонент) С5
+ высш., С7
+ высш.
Газ, в составе которого тяжелые УВ (С3
, С4
) составляют не более 75 г/м3
, называют сухим. При содержании тяжелых УВ более 150 г/м3
газ называют жирным.
Газовые смеси характеризуются массовыми или молярными концентрациями компонентов. Для характеристики газовой смеси необходимо знать ее среднюю молекулярную массу, среднюю плотность в килограммах на кубический метр или относительную плотность по воздуху.
Молекулярная масса М природного газа:
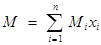 , ,
где М – молекулярная масса i-го компонента; xi
– объемное содержание i-го компонента, доли ед.
Для реальных газов обычно М=16 – 20.
Плотность газа ρг
рассчитывается по формуле:
 , ,
где Vм
– объем 1 моля газа при стандартных условиях.
Обычно ρг
находится в пределах 0,73 – 1,0 кг/м3
.
Плотность газа в значительной степени зависит от давления и температуры, и поэтому для практического применения этот показатель неудобен. Чаще пользуются относительной плотностью газа по воздуху ρг.в.
, равной отношению плотности газа ρг
к плотности воздуха ρв
, взятой при тех же давлении и температуре:
ρг.в.
= ρг
/ ρв
,
Если ρг
и ρв
определяются при стандартных условиях, то ρв
= 1,293 кг/м3
и ρг.в.
= ρг
/ 1,293.
Плотность нефтяных газов колеблется от 0,554 (для метана) до 2,006 (для бутана) и выше.
Вязкость газа характеризует силы взаимодействия между молекулами газа, которые преодолеваются при его движении. Она увеличивается при повышении температуры, давления и содержания углеводородных компонентов. Однако при давлениях выше 3МПа увеличение температуры вызывает понижение вязкости газа.
Вязкость нефтяного газа незначительна и при 0о
С составляет 0,000131 пз; вязкость воздуха при 0о
С равна 0,000172 пз.
Уравнения состояния газов используются для определения многих физических свойств природных газов. Уравнением состояния называется аналитическая зависимость между параметрами газа, описывающая поведение газа. Такими параметрами являются давление, объем и температура.
Состояние идеальных газов в условиях высоких давления и температуры определяется уравнением Клапейрона — Менделеева:
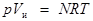 , ,
где р — давление; Vи
— объем идеального газа, N— число киломолей газа; R— универсальная газовая постоянная; Т — температура.
Идеальным называется газ, силами взаимодействия между молекулами которого пренебрегают. Реальные углеводородные газы не подчиняются законам идеальных газов. Поэтому уравнение Клапейрона—Менделеева для реальных газов записывается в виде:
pV = ZNRT,
где Z— коэффициент сверхсжимаемости реальных газов, зависящий от давления, температуры и состава газа и характеризующий степень отклонения реального газа от закона для идеальных газов.
Коэффициент сверхсжимаемости Zреальных газов — это отношение объемов равного числа молей реального Vи идеального Vи
газов при одинаковых термобарических условиях (т. е. при одинаковых давлении и температуре):
Z=V/Vи
Значения коэффициентов сверхсжимаемости наиболее надежно могут быть определены на основе лабораторных исследований пластовых проб газов. При отсутствии таких исследований (как это чаще всего бывает на практике) прибегают к расчетному методу оценки Zпо графику Г. Брауна (рис.1). Для пользования графиком необходимо знать так называемые приведенные псевдокритическое давление и псевдокритическую температуру. Критической называется такая температура, выше которой газ не может быть превращен в жидкость ни при каком давлении. Критическим давлением называется давление, соответствующее критической точке перехода газа в жидкое состояние.
С приближением значений давления и температуры к критическим свойства газовой и жидкой фаз становятся одинаковыми, поверхность раздела между ними исчезает и плотности их уравниваются.
С появлением в системе двух и более компонентов в закономерностях фазовых изменений возникают особенности, отличающие их поведение от поведения однокомпонентного газа. Не останавливаясь на подробностях, следует отметить, что критическая температура смеси находится между критическими температурами компонентов, а критическое давление смеси всегда выше, чем критическое давление любого компонента.
Для определения коэффициента сверхсжимаемости Z реальных газов, представляющих собой многокомпонентную смесь, находят средние из значений критических давлений и температур каждого компонента. Эти средние называются псевдокритическим давлением pп.кр.
и псевдокритической температурой Тп.кр.
Они определяются из соотношений:
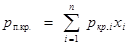 ; ;  ; ;
где ркр.
и Ткр.
– критические давления и температура i-го компонента; xi
– доля i-го компонента в объеме смеси (в долях единицы).
Приведенные псевдокритические давление и температура, необходимые для пользования графиком Брауна, представляют собой псевдокритические значения, приведенные к конкретным давлению и температуре (к пластовым, стандартным или каким-либо другим условиям):
Рпр.
= р/рп.кр.
; Тпр.
= Т/Тп.кр.
;
где р и Т – конкретные давления и температура, для которых определяется Z.
Коэффициент сверхсжимаемости Z обязательно используется при подсчете запасов газа для правильного определения изменения объема газа при переходе от пластовых условий к поверхностным, при прогнозировании изменения давления в газовой залежи и при решении других задач.

Рис. 1. Графики зависимости коэффициента сверхсжимаемости Z углеводородного газа от приведенных псевдокритических давления рпр.
и температуры Тпр.
(по Г.Брауну).
Задание №2.
Задача:
Определить плотность и относительную плотность данной смеси по воздуху.
Дано: состав газа
| название |
формула |
Объемное содержание
Хi
,%
|
Молекулярная масса
Mi
, кг
|
| метан |
СН4
|
80 |
16,04 |
| этан |
С2
Н6
|
7 |
30,07 |
| пропан |
С3
Н8
|
3 |
44,1 |
| изобутан |
С4
Н10
|
3 |
58,12 |
| Н-бутан |
С4
Н10
|
1,5 |
58,12 |
| изопентан |
С5
Н12
|
1 |
72,15 |
| Н-пентан |
С5
Н12
|
0,4 |
72,15 |
| гексан |
С6
Н14
|
2 |
86,18 |
| азот |
N2
|
2,1 |
28,01 |
Решение.
Плотность газовой смеси ρсм
– масса m единицы объема V или отношение молекулярной массы М к объему моля Vм
ρсм
= m / V = М / Vм
=М / 22,4 кг/м3
Молекулярная масса М – отношение массы молекулы вещества к 1/12 массы атома изотопа углерода 12
С.
Молекулярная масса природного газа (газовой смеси)
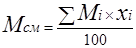 , где , где
Мi
– молекулярная масса i-того компонента смеси;
хi
– объемное содержание i- того компонента.
Относительная плотность природного газа ρотн
(по воздуху) – отношение плотности смеси ρсм
к плотности воздуха ρв
, взятых при одинаковых температуре и давлении (при стандартных условиях: t = 0 °С, Р = 0,1013 МПа):

При стандартных условиях ρв
= 1,293 кг/м3
Найдем общую молекулярную массу газовой смеси:

=22,197кг


Ответ: ρсм
= 0,991 кг/м3
; ρотн
= 0,766 кг/м3
.
Задание №3.
Задача:
Определить коэффициент сверхсжимаемости для газа.
Дано: состав газа
| Состав газа |
формула |
Объемное содержание хi
, % |
Критическая температура , К |
Критическое давление , МПа |
Рср
МПа
|
Тср
°
С
|
| Метан |
СН4
|
62 |
191 |
4,58 |
8 |
35
|
| Этан |
С2
Н6
|
15 |
305 |
4,86 |
| Пропан |
С3
Н8
|
10 |
370 |
4,34 |
| Азот |
N2
|
10 |
124,9 |
3,46 |
| углекислота |
CO2
|
3 |
304,1 |
7,50 |
Решение.
Коэффициент сверхсжимаемости реальных газов – это отношение объемов равного числа молей реального и идеального газов при одинаковых термобарических условиях:
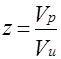
Наиболее достоверные значения коэффициентов сверхсжимаемости получаются на основе лабораторных исследований пластовых проб газов. В случае отсутствия этих исследований прибегают к расчетному методу оценки по графику Г. Брауна. Для использования графика необходимо знать приведенное псевдокритическое давление Рпр и приведенную псевдокритическую температуру Тпр данного газа.
При известном компонентном составе рассчитывают псевдокритические (средние критические) давление и температуру:
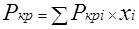
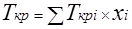
Затем находят приведенные псевдокритические давление и температуру при данных давлении Р и температуре Т.
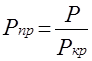
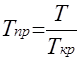

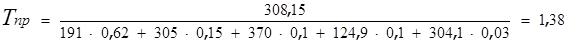
По кривым Р.Брауна (рис. 1) находим коэффициент сжимаемости Z , который составляет ≈ 0,78.
Ответ: Z ≈ 0,78.
Литература.
1. Гиматудинов Ш.К. Физика нефтяного и газового пласта. Изд. «Недра». М. 1971г.
2. Гиматудинов Ш.К., Ширковский А.И. Физика нефтяного и газового пласта. Изд. «Недра». М. 1982г.
3. Котяхов Ф.И. Физика нефтяного и газового коллектора. Изд. «Недра». М. 1997г.
4. Мирзаджанзаде А.Х., Аметов И.М., Ковалев А.Г. Физика нефтяного и газового пласта. Изд. «Недра». М. 1982г.
|