Компьютерные технологии при изучении темы:
«Молекулярные перегруппировки»
ОГЛАВЛЕНИЕ
Введение
Литературный обзор
1.
Значение и место темы «Молекулярные перегруппировки» в курсе органической химии
2.
Цели и задачи изучения темы «Молекулярные перегруппировки» в курсе органической химии
3.
Дидактические подходы при изучении темы «Молекулярные перегруппировки»
4.
Психолого-педагогические основы формирования у учащихся научных понятий
5.
Использование электронно - дидактических средств в обучении химии
Экспериментальная часть
1.
Теоретическая поддержка темы «Молекулярные перегруппировки»
2.
Обобщающая таблица по теме «Молекулярные перегруппировки»
3.
Использование тестов для оценки знаний
Обсуждение результатов
Выводы
Литература
Приложение
Введение
В Государственной программе развития образования России на 2005-2010 годы отмечается, что в условиях быстроизменяющегося мира и увеличения потоков информации фундаментальные предметные знания являются обязательной, но не достаточной целью образования. Обучающиеся должны не просто овладеть суммой знаний, умений и навыков, на что направлена система российского образования. Гораздо важнее и сложнее привить учащимся умение самостоятельно добывать, анализировать, структурировать и эффективно использовать информацию для максимальной самореализации и полезного участия в жизни общества.
В свете современных задач гуманизации, инновации, технологизации, интеграции и дифференциации образования принципиально важное значение приобрела проводимая реформа общеобразовательной школы [1]. Так, в 2000 году Министерство образования РФ разработало «Национальную доктрину образования» (основополагающий государственный документ, утвержденный федеральным законом и устанавливающий приоритет образования в государственной политике, стратегию и основные направления его развития) [2], одной из задач которой является обновление содержания образования.
В современном мире большое внимание уделяется преподаванию школьного курса химии, выпускаются разнообразные журналы, газеты, методическая литература, справочники, энциклопедии, учебники, задачники, а также множество научно-популярной литературы, включая продукцию по изучению химии с использованием современных компьютерных технологий. Все это способствует увеличению эффективности процесса обучения и что немаловажно повышению профессиональной подготовки учителей. Электронно-вычислительная техника позволяет проводить дистанционное обучение с помощью средств мультимедиа. Для создания мультимедийных курсов и программ необходимы теоретическая и методическая поддержки.
В ряде школ введен курс углубленного изучения химии, что повлекло открытие специализированных классов, в которых количество часов, отведенных на изучение химии, увеличено. В связи с этим в таких школах в курс химии введены такие темы, которые ранее учащиеся изучали недостаточно полно или совсем не изучались.
Важным звеном в профессиональном становлении будущих учителей, в формировании учительских качеств является педагогическая практика (ПП). Значимость практической подготовки для будущих учителей отмечали в своих трудах Н.К. Крупская, А.С. Макаренко, Н.И. Пирогов, С.Т. Шацкий и др. Вопросы формирования системы общепедагогических знаний, умений и навыков у студентов в процессе практики, определения ее теоретических основ, структуры, функций и места в системе профессиональной подготовки исследовались О.А. Абдуллиной, Н.Н. Загрязкиной, А.И. Пискуновым, В.А. Сластениным, И.Ф. Харламовым, А.И. Щербаковым и др. Различные аспекты профессиональной подготовки в период практики и подготовки к ней студентов освещены в работах К.И. Аманкулова, А.И. Балабаевой, З.Н. Бекбаевой, Л.В. Бориковой, Н.И. Бостанджиевой, Ш.К. Жантлеуовой, В.И. Загвязинского, Г.М. Коджаспировой, Н.В. Кузьминой, А.А. Леонтьева, В.К. Розова и др.
Итогом пятилетнего обучения в высшем учебном заведении является педагогическая практика в школе. Студент, готовясь к практике обязан знать свой предмет не только в рамках школьной программы, а в рамках расширенного, углубленного курса химии, поскольку дифференцированное обучение, согласно вышеупомянутой доктрине (1) может и должна осуществляется в базовой школе при изучении основных курсов, а в частности химии, предполагающей достижение учащимися всего класса различных уровней усвоения знаний. Что происходит не за счет сокращения объема учебной информации для одних школьников и расширения для других (все они получают полноценный объем учебной информации), а путем предъявления разных требований к ее усвоению. Т. е. все учащиеся должны овладеть обязательным базовым уровнем, а желающие, способные, интересующиеся предметом школьники могут превзойти этот уровень. При этом необходимо учитывать, что успешное решение поставленных задач обучения и воспитания молодого поколения во многом зависит от учителя, его профессионального мастерства, интеллекта, культуры. Одной из таких тем, способствующих повышению профессиональной подготовки студента как специалиста и как преподавателя является тема: «Молекулярные перегруппировки». Т. е. владея, знаниями по данной теме можно не только расширить свои профессиональные качества как будущий педагог, но и как специалист в области органической химии. А именно, знания по данной теме позволяют сравнительно легко ориентироваться как в области получения различных соединений посредством перегруппировок, так и в области их применения. В этом и состоит практическая значимость данной работы.
Таким образом, целью
данной работы являлось:
- попытка собрать воедино и привести в систему основной материал, относящийся к изучению молекулярных перегруппировок, разбросанный по разным учебным источникам (теоретическая поддержка курса);
- максимально облегчить его изучение за счет уточнения, уплотнения и формализации основных понятий по данной теме;
- помочь студентам рационально и быстро усвоить данный учебный материал с помощью современных средств обучения (обучающе- контролирующей программы, таблиц по данной теме);
- на базе вышеуказанного материала и конструктора тестов (КТ), предназначенного для создания и наполнения Накопителя тестовых заданий и формирования семейства тестов на его основе, разработка фрагментов обучающе-контролирующей программы по теме «Молекулярные перегруппировки».
- апробировать результаты настоящих исследований в образовательных учреждениях КБР (школа - Вуз).
Задачи данной работы
– разработка теоретической поддержки темы, обучающе-контролирующей программы.
Таким образом, объектом исследования
служит изучение молекулярных перегруппировок и тестирования, как метода контроля усвоенных знаний.
Предметом
исследований являются разнообразные молекулярные перегруппировки, предусмотренные программой.
Литературный обзор
1.Значение и место темы «Молекулярные перегруппировки» в курсе органической химии
Химия - наука изучающая состав, свойства и превращения веществ, а также явления, которые сопровождают эти превращения. Одно из первых определений химии как науки дал русский ученый М.В. Ломоносов: «Химическая наука рассматривает свойства и изменения тел... состав тел... объясняет причину того, что с веществами при химических превращениях происходит». По Менделееву, химия — это учение об элементах и их соединениях. Химия сегодня - это продукты и лекарства, горючее и одежда, удобрения и краски, анализ и синтез, организация производства и контроль качества его продукции, подготовка питьевой воды и обезвреживание стоков, экологический мониторинг и создание безопасной среды обитания человека. В ней широко применяются математические методы, используются расчеты и моделирование процессов на электронно-вычислительных машинах. Повсюду, куда бы мы не обратили свой взор, нас окружают предметы и изделия, изготовленные из веществ и материалов, которые получены на химических заводах и фабриках. Создание новых материалов, которые не требовали бы больших затрат в материальном, экологическом и временном отношениях, но в тоже время обладающих комплексом полезных свойств, - это существенная необходимость нашей современности. Учитывая эти обстоятельства, вопрос об изучении молекулярных перегруппировок становится все более целесообразным, поскольку перегруппировки имеют большие преимущества при получении ценных веществ по сравнению с другими методами синтеза. Так, например, при синтезе фенолкетонов с помощью перегруппировки Фриса можно зачастую обеспечить более высокие выходы конечного продукта, нежели по реакции Фриделя – Крафтса. Все знают, что моторное топливо является немаловажным и широко используемым сырьем, соответственно его получают в огромных количествах. А это обеспечивается с помощью реакций изомеризации парафиновых углеводородов. В качестве примеров можно также привести бензидиновую перегруппировку, которая используется в производстве азокрасителей, например бензидина, толидина, дианизидина; перегруппировку Вагнера- Мейервейна , которая широко используется в промышленности при получении камферы из α- пинена; изоборнилацетата из камфена, а также, терпенофенолов- промежуточных продуктов в синтезе кедрола, санталидола и некоторых других душистых веществ; перегруппировка Арбузова, которая имеет огромное значение в синтетической химии и роль которой будет рассмотрена ниже.
Изучение химии в школе- основа для формирования ряда мировоззренческих идей:
-о материальном единстве всех веществ окружающего мира;
-об обусловленности свойств веществ их составом и строением;
-о познаваемости химических явлений.
Изучение химии не только способствует познанию природы, но и вооружает человека знаниями, необходимыми для практической деятельности, в том числе для развития материального производства.
Изучение органической химии должно обеспечить:
-развитие личности обучающихся, их памяти, наблюдательности, способности к вербальному выражению результатов наблюдений, ассоциативного и аналитического мышления, аккуратности и собранности;
- формирование системы химических знаний (важнейших фактов, понятий, законов, теорий и языка науки) как компонента естественнонаучной картины мира;
- выработка у учащихся понимания общественной потребности в развитии химии, формирование у них отношения к химии как возможной области будущей практической деятельности;
- формирование грамотного поведения, навыков безопасного обращения с веществами в повседневной жизни.
Содержание химического образования на основном этапе призвано обеспечить формирование у учащихся представлений о многообразии веществ, зависимости свойств веществ от их строения, материальном единстве и генетической взаимосвязи органических и неорганических веществ, роли химии в познании явлений жизни, развития материального производства, решении экологических проблем.
Знание основ органической химии является обязательной составной частью школьного курса химии. В настоящее время органическая химия является наиболее крупным разделом химических наук, одной из самых обширных областей современного естествознания, а её успехи позволяют говорить о ведущей роли в создании материальной культуры общества.
На современном этапе органическая химия испытывает поистине революционные преобразования благодаря технической революции и использованию быстродействующих ЭВМ. Использование ЭВМ открыло неограниченные возможности синтеза и установления структуры органических веществ, позволило во многих случаях выяснить механизмы реакций, что, в свою очередь, увеличило предсказательную способность органической химии при объяснении свойств и химических превращений органических соединений. [3]
Из выше изложенного, не трудно сделать вывод, что органическая химия была и остается одной из наиболее крупных разделов химической науки. Поэтому органическая химия является обязательной составной частью школьного курса.
Молекулярные перегруппировки имеют важное значение с точки зрения получения различных соединений посредством внутримолекулярных или межмолекулярных взаимодействий.
2. Цели и задачи изучения темы «Молекулярные перегруппировки»
При изучении темы «Молекулярные перегруппировки», как при изучении любой другой темы, возникает необходимость в правильном выборе цели и задач [4].
Цель – это осознанное представление конечного результата определенной деятельности, которая направляет и регулирует действия. Четко сформулированная цель приводит к достижению нужного результата. [5]
При изучении темы «Молекулярные перегруппировки» мы ставим перед собой следующие цели:
- системное раскрытие содержания данной темы;
- усвоение основных понятий по данному разделу;
- формирование у учащихся экологических и мировоззренческих знаний.
-ознакомление с основными особенностями каждой перегруппировки
Основные задачи изучения темы «Молекулярные перегруппировки»:
- грамотное и доступное преподнесение материала по теме;
- обобщение и закрепление знаний учащихся;
- умение наблюдать химические явления;
- развитие интеллектуальных способностей и формирование абстрактного мышления. [4]
3. Дидактические подходы при изучении темы «Молекулярные перегруппировки»
Дидактика – область педагогики, разрабатывающая общую теорию образования и обучения и занимающаяся содержанием образования, закономерностями процесса обучения, методами, средствами и организационными формами обучения. [6]
В дидактике, как и в теории обучения и образования, исследуются закономерности учебного процесса, протекающего в условиях учебно-воспитательного учреждения под руководством преподавателя; пути повышения эффективности средств и методов обучения, а также те организационные формы, в которых протекает обучение. Дидактика отвечает на вопросы: Чему учить? Как учить? Где учить? В каких организационных формах? [7].
В общем виде процесс обучения представляет собой процесс управления, т.е. воздействия на педагогическую систему, организацию знаний. Для успешного его осуществления в педагогической науке разрабатываются модели, способствующие оптимальному управлению в педагогических системах. К ним относятся специальные методы (методики) и технологии обучения. В.П. Беспалько дает следующее определение педагогической технологии: Педагогическая технология – это систематичное воплощение на практике заранее спроецированного учебно-воспитательного процесса[1]. Отличием педагогических технологий от любых других является то, что они способствуют более эффективному обучению за счет повышения интереса и мотивации к нему у учащихся. В настоящее время существует множество психолого-педагогических технологий, различающихся по целям, задачам, структуре: методики ускоренного обучения (например, 25-й кадр для изучения иностранных языков; метод быстрого обучения навыкам машинописи), групповое обучение, обучающие игры, тестовые задание и др.
Многие из них используются не только в образовательном процессе, но и в других сферах. С развитием информационных технологий большими темпами идет становление системы дистанционного образования – обучения через сеть Интернет, что открывает широкие возможности применению новейших психолого-педагогических методик. Чтобы раскрыть специфику учебной работы по каждому предмету из дидактики стали формироваться такие особые педагогические дисциплины, которые называются частными методиками. В случае химии, частная дисциплина, занимающаяся раскрытием специфики данного предмета называется методика преподавания химии, которая разрабатывает дидактические подходы к изучению отдельных тем химии(8).
Рассмотрим наиболее часто используемые дидактические подходы при изучении темы «Молекулярные перегруппировки».
В последнее время большой популярностью стали пользоваться в химическом образовании тесты и тестовые задания. Важным качеством тестов и тестовых заданий является их технологичность, то есть возможность с помощью тестов быстро и объективно выявить знания, оценить их качество, а также выявить пробелы и недостатки.
Широко используются для дидактических целей таблицы, схемы, диаграммы и графики. Таблицы и схемы используют на любом дидактическом этапе урока – для изучения нового материала, при совершенствовании и закреплении знаний, а также при проверке знаний.
На таблице может быть изображена графическая модель кристаллической решетки, или молекулы, справочная таблица, производственная установка. Таблицы и схемы в любой момент могут быть представлены учащимся и в этом их главная ценность. [7]
Из вышеизложенного, не трудно сделать вывод, что использование различных дидактических подходов, при изучении органической химии, облегчает процесс восприятия и воспроизведения учебного материала.
4. Психолого-педагогические подходы при изучении темы «Молекулярные перегруппировки»
В общем виде процесс обучения представляет собой процесс управления, т.е. воздействия на педагогическую систему, организацию знаний(9). Для успешного его осуществления в педагогической науке разрабатываются модели, способствующие оптимальному управлению в педагогических системах. Когда педагог строит воздействие на ребенка, он должен учитывать множество параметров: эмоционально-психологическое состояние, общий уровень культурного и возрастного развития, сформированность отношений, духовное и интеллектуальное развитие и др. В итоге на основе внешних проявлений формируется первоначальное представление о личности ребенка, которое во многом определяет характер педагогического воздействия.
Методика отбора и изучения понятий школьного курса химии строится с опорой на психологию и дидактику. Развивающее обучение и развивающий характер научных понятий как дидактических единиц стали общепризнанными. Это потребовало большего учета человеческого фактора, усиления межсубъектных отношений между учителем и учащимися в процессе формирования научных понятий, для чего важно знать индивидуально-личностный характер и механизм их усвоения каждым учеником, внутреннюю структуру понятийной деятельности и способностей учащихся. [9]
Усвоение понятий и развитие психики учащихся в обучении - классическая проблема педагогической психологии. Подлинное усвоение понятий в химии, как и в психологии должно рассматриваться как свободная и творческая оперирование ими. Оно достигается управлением умственной деятельности учащихся. Это предполагает обязательную опору учителя предметника на педагогическую психологию, на ее учение о мышлении в понятиях, основы которых, заложили основоположники советской психологии Л.С. Выгодский, П.П. Блонский, С.Л. Рубинштейн. [9,10]
В осуществлении всеобщего обучения и всестороннего развития личности необходимо учитывать индивидуально – психологические особенности учащихся и типологию их обучаемости, поскольку индивидуальное мышление именно через понятия как продукты общественно – исторического развития приобретает социальное значение. Т. е. необходимо уделить внимание взаимодействие педагога и учащихся в высоком значении этого слова, что предполагает нечто большее, чем взаимное влияние друг на друга. Для осуществления взаимодействия необходимо принятие собеседниками друг друга как равноправных субъектов этого общения, что на практике в системе “учитель- ученик” встречается не так часто. Педагогическое воздействие, выступающее как короткий миг общения или продолжительное влияние, обеспечивает реализацию функций в соответствии с воспитательной целью. При анализе педагогического воздействия следует исходить из его назначения как начального момента взаимодействия учителя с учеником. Иными словами, основное назначение педагогического воздействия заключается в переводе ученика на позицию субъекта, отдающего себе отчет в собственной жизни. Реализация этих функций педагогического воздействия обеспечивается педагогической технологией, которая научно обосновывает профессиональный выбор воздействия педагога на ребёнка в его взаимодействии с миром, формирует у него отношение к этому миру. Сущность педагогической технологии выявляется через систему необходимых и достаточных элементов, связанных между собой и имеющих внутреннюю логику.
Развивающее обучение и педагогика сотрудничества дают большой выигрыш в формировании необходимой для общества личности ученика, но и проигрыш в учебном времени. Поэтому психологи решают вопрос об интенсификации развивающего обучения и умственной деятельности, учитывая при этом, что интенсивное развитие мышления – характерная особенность школьного возраста. К важным факторам интенсификации психологии относят структурирование материала, свертывание действий, способность мыслить свернутыми структурами. [8]
В условиях интенсивного развития общества и его системы образования особое значение приобретает проблема интенсификации обучения. В последнее время выявлены научные предпосылки и некоторые факторы интенсификации обучения.
Л.В. Занков разработал принципы обучения, направленные на достижение общего развития школьников, а именно:
-Принцип обучения на высоком уровне трудности.
-Принцип ведущей роли теоретических знаний в начальном обучении.
-Принцип обучения быстрым темпом.
-Принцип систематической, целенаправленной работы над общим развитием всех учащихся, в том числе слабых.
Заключая этот вопрос, следует отметить, что использовать достижения педагогической психологии в обучении химии следует с обязательной поправкой на специфику предмета, на особенности химического познания.(10)
5. Применение электронно-дидактических средств в обучении химии
XXI век - век бурного роста информационных технологий. Информация играет решающую роль в решении многих проблем, связанных не только с познавательной, но и технологической, творческой, политической, социальной деятельностью человека [11].
В связи с этим применение современных информационных технологий стало неотъемлемой частью учебного процесса во многих высших и средних образовательных учреждениях. Потенциал, который предоставляют современные технологии для образования, невозможно переоценить. Информационное обеспечение обучающихся и педагогов, возможность свободного доступа к необходимой учебной, научной, культурной и любой другой информации — необходимое условие свободного развития личности.
Психолого-педагогическим аспектам этого вопроса посвящены работы Андреева А. А., Габай Т. В., Ляудис В. Я., Марахович Н. В., Машбиц Е. И., Скибицкого Э. Г., Филиппова Е. А., Фокина Ю. Г., Холиной Л. И., Цикина В. А. и других(12)
Новейшие технологии, имеют следующие преимущества:
-способствуют повышению мотивации обучения;
-являются источником информации, стимулируют самообразование, формируют навыки самостоятельной, сосредоточенной деятельности;
-повышают информативность, интенсивность, результативность образования;
-способствуют его диверсификации, использованию игрового и скоростного обучения.
Все более заметное место в научно-методическом обеспечении курса органической химии начинают занимать электронно-дидактические средства. Если «электронные учебники» первого поколения выполняли в основном информационные и иллюстративные функции, то современные «электронные учебники» являются уже средствами обучающего и контролирующего типов. [13.]
Обучающая часть включает набор упражнений, проектируемые проблемные ситуации, прогнозируемые ответы и возможные затруднения учащихся, комментарии и рекомендации по поиску правильных ответов.
Успешность усвоения материала обучающей части проверяется ее контролирующим фрагментом, в котором в качестве контрольно измерительных материалов использованы также тестовые задания в закрытой форме с множественным выбором ответа.
Электронный учебник является многоуровневым. Первый – низший – базовый уровень содержит основные понятия, определения и иллюстрации определений и понятий. Второй – основной уровень – должен содержать подробное изложение всех вопросов учебной программы курса. Наконец, третий уровень включает углубленное изложение отдельных вопросов для студентов, которые желают расширить свои знания в данном вопросе. При этом обучаемый сам выбирает уровень сложности изложения учебного материала.
Рассмотрим некоторые особенности структуры электронного учебника:
Изложение материалов в учебнике должно быть таковым, чтобы выделить различные по важности части учебного материала, т.е. определения, схемы, выводы, рисунки, таблицы и т.д. Все это реализуется в режиме гипертекста.
Необходимо в динамическом режиме иллюстрировать учебный материал конкретными примерами с помощью средств мультипликации и видеотехники.
Материал в учебнике должен излагаться «прерывисто». Каждый раздел учебника должен завершаться контрольными вопросами, с помощью которых реализуется обратная связь в процессе обучения.
Необходимо использовать проблемное изложение учебного материала, при котором обучаемый самостоятельно выбирает из предложенных вариантов направление решения учебной проблемы. При этом он как бы становится соавтором учебника
В настоящее время разработана и широко используется блочная структура электронного учебника. Информационный блок (основной) содержит изложенный в сжатой форме учебный материал (основные понятия, определения, модели молекул, графики, схемы превращений). Каждый раздел информационного блока заканчивается контрольными вопросами, которые фиксируют переход от данного раздела учебного материала, а также позволяют обучаемому выяснить насколько глубоко он усвоил материал. В результате функционирует постоянная обратная связь обучаемого с компьютером.
В режиме диалога обучаемого с компьютером функционирует блок «Упражнения». Здесь учащийся может закрепить знания, полученные при работе с информационным блоком.
Справедливости ради необходимо отметить, что при продолжительной эксплуатации компьютера вредное влияние на здоровье пользователя могут оказать повышенное зрительное напряжение, психологическая перегрузка, длительное неизменное положение тела, электромагнитное излучение и т.д. [13]
Поэтому при работе с компьютером учащимся следует строго соблюдать существующие санитарно-гигиенические нормы, а также рекомендовать им при первых признаках усталости выполнять специальные упражнения для снятия утомления с глаз, плечевого пояса и рук, а также улучшения мозгового кровообращения.
На основании вышесказанного можно сделать вывод о том, что информационные технологии служат эффективным средством, позволяющим привлечь широкий круг школьников, увлеченных компьютерной техникой, к решению задач, объединяющих ряд различных научных дисциплин. [14]
Экспериментальная часть
Теоретическая поддержка темы «Молекулярные перегруппировки»
1. Молекулярные перегруппировки, их определение
В подавляющем большинстве случаев при органических реакциях затрагиваются и претерпевают изменения лишь отдельные участки реагирующих молекул. Вследствии этого группы атомов – радикалы- в неизменном виде переходят из одной молекулы в другую, подобно тому как переходят из молекулы в молекулу атомы элементов.
Это явление, замеченное еще во времена теории радикалов, имело и имеет чрезвычайно важное значение для установления строения молекул с помощью химических методов исследования. В настоящее время, однако, известно довольно большое число реакций, при которых происходит изменение строения непосредственно не затрагиваемых участков молекул.
Такие реакции называются молекулярными перегруппировками.
2. Классификация перегруппировок
Молекулярные перегруппировки классифицируют в соответствии с :
1
. насыщенностью систем, в которых протекает перегруппировка:
-в ароматических системах
-в алифатических системах
2. природой уходящей группы:
- анионотропные
- катионотропные
- прототропные
- сигматропные
3. со стереоспецифичностью перегруппировок:
- стереоспецифичные
- нестереоспецифичные
4. природой мигрирующей группы:
- электрофильные
- нуклеофильные
5 изменениями, происходящими в структуре исходного соединения:
-сопровождающиеся изомеризацией
- не сопровождающиеся изомеризацией
6. миграцией от определенного атома к другому атому:
- С-С
- N-С
- С-N
- О-С
- С-О.
7. .характером взаимодействий, в ходе перегруппировок:
- внутримолекулярные (интро-)
- межмолекулярные (интер-)
8 .дополнительными реакциями, протекающими в ходе перегруппировок:
- сопровождающиеся протеканием побочных реакций
- без побочных реакций
3. Перегруппировки в алифатическом ряду
Нуклеофильные перегруппировки в алифатическом ряду.
К нуклеофильным (или анионотропным) перегруппировкам относятся такие перегруппировки, в ходе которых происходит миграция группы, имеющий избыток электронов, к атому, несущему положительный заряд.
Рассмотрим их подробней.
Перегруппировка Бекмана
(1886г.)
1. Общие представление о перегруппировки.
Перегруппировка Бекмана является нуклеофильной, внутримолекулярной, стереоспецефичной.
2. Механизм перегруппировки.
Превращение кетоксимов в амиды кислот, протекает по SN1 механизму, в присутствии PCI5; POCI3; H2SO4; HCI; т.е. кислоты Льюиса и все протонные кислоты.
К атому азота мигрирует группа R, находящаяся в анти- положении к группе –ОН, т.е.

т.е. происходит разрыв N-O связи с одновременной миграцией анти- расположенной к группе –OH, т.е.

например: 2-хлор-5-нитробензофеноксимов при действии щелочи легко отщепляет HCI, образуя изоксазольный цикл
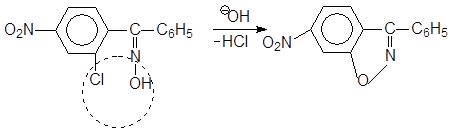
т.е. в этом изомере –ОН группа и CI замещенное бензойное кольцо находится в цис- положении. Механизм перегруппировки следующий:
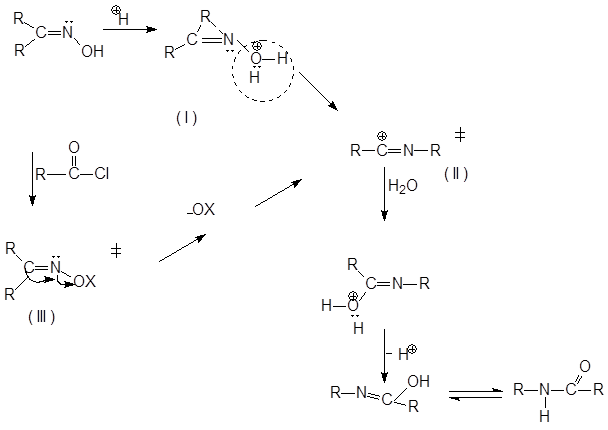
В присутствии сильных кислот перегруппировка протекает путем протонирования оксима с образованием соединения (I), с последующим отщеплением воды и образования катиона (II), при действии хлорангидридов образуются промежуточные эфиры (Ш) в которых ОХ хорошо уходящая группа, образуется промежуточное соединение (II).
Ш превращается в II без кислот в нейтральных растворителях, чем сильнее кислота ХОН, тем быстрее происходит перегруппировка. Отщепление НОН и миграция R одновременно (интрамолекулярно).
Эта реакция первого порядка, ускоряется полярными растворителями
и облегчается при возрастании кислотности реакционной среды, облучение на него не действует.
4. Доказательство стереоспецифичности
Система C=N является жесткой и подвижность её ограничена, то атака будет происходить легче со стороны, в которой нет заместителя.
Атака радикала R будет затруднена стерическими факторами, т.е. у атома азота находится Н-О-Х (хорошо уходящая группа):

Атака будет происходить со стороны заместителя R у атома N2, т.к. не имеется других заместителей. На основании этого можем сделать вывод, что реакция является стереоспецифичной.
Бензильная перегруппировка
Либих (1838 – 1839г
)
Общие сведения о перегруппиро
вке
Бензильная перегруппировка основана на превращении α- дикетонов под действием щелочей в α- оксикислоты[14]
Бензильная перегруппировка является нуклеофильной, интрамолекулярной, не стереоспецифической, протекает без изомеризации в алифатическом ряду с миграцией от одного атома углерода к другому атому углерода.
Механизм перегруппировки.

Впервые она была описана Ю.Либихом в 1838 году на примере бензила, который при нагревании со спиртовой щелочью превращается в бензиловую кислоту:

1.Первая стадия перегруппировки – это процесс превращения бензила (I) под действием щелочи в калиевую соль бензиловой кислоты (II). Ввиду большей электроотрицательности атома кислорода на нем сосредотачивается вся электронная плотность, за счет чего на атоме углерода возникает частичный положительный заряд. Если данное соединение провзаимодействует с щелочью, то образуется неустойчивое соединение – калиевая соль бензиловой кислоты. Данный процесс (переход от I к II) можно охарактеризовать как нуклеофильное бимолекулярное присоединение, т.к. эта стадия является лимитирующей, то основание, являющееся нукклеофилом, атакует электрофильный центр с разрывом двойной связи.
Таким образом происходит присоединение по карбонильной группе. А скорость будет описываться кинетическим уравнением 2 порядка:
V = к ·[бензил]· [ОН-]
2.Вторая стадия данной перегруппировки - это гетеролитический отрыв фенильного радикала с дальнейшим присоединением его к соседнему атому углерода, несущему дефицит электронной плотности. В результате того, что разрыв и образование новой связи происходят синхронно (одновременно), этот процесс является внутримолекулярным (интрамолекулярным).
3.Третьей стадией является стадия протонизации, за счет чего открытый анион стабилизируется и образуется бензиловая кислота (IV), т.е. происходит специфический катализ.
Таким образом, по предмету данная перегруппировка называется: превращение бензила под действием щелочи в бензиловую кислоту.
РЕТРОПИНАКОЛИНОВАЯ ПЕРЕГРУППИРОВКА
1.Общие сведения о перегруппировке.
Ретропинаколиновая перегруппировка основана на образовании двух третичных атомов углерода из одного четвертичного. Данная перегруппировка является нуклеофильной, интрамолекулярной, стереоспецифической, протекает с изомеризацией в алифатическом ряду с миграцией от атома углерода к другому атому углерода.В 1901 г. Н. Д. Зелинский при дегидратации кислотой пинаколинового спирта вместо ожидаемого 2,2-диметилбутена-З получил 2,3-диметилбутен-2:


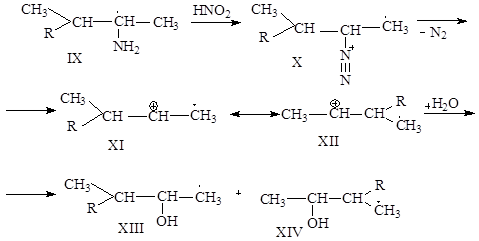
Поскольку здесь, в противоположность пинаколиновой перегруппировке, скелет из пинаколинового превращается в симметричный, как у пинакона, перегруппировки этого типа называются ретропинаколиновыми или иногда перегруппировками Вагнера - Меервейна, так как первой разъясненной перегруппировкой этого типа была открытая Е. Е. Вагнером в 1899 г. перегруппировка пинена в хлористый борнил, впоследствии (1910 г.) подробно изученная Меервейном и сопоставленная им с простейшими примерами этого типа перегруппировок.(15)
Доказательства стереоспецифичности перегруппировки.
На гетеролитический и, более того, ионный характер этих перегруппировок указывает то, что они протекают гораздо быстрее в сольватирующих растворителях с высокой диэлектрической проницаемостью. Как и для разных типов пинаколиновых перегруппировок, покидающая молекулу группа может быть не только гидроксилом, но и галогеном, азотом алифатического диазония и сложноэфирной группой, например тозилатной..
Нельзя считать доказанным, что во всех ретропинаколиновых перегруппировках не фигурирует свободный карбкатион: стереохимическое течение реакции известно не везде. Напротив, во многих случаях вполне вероятны равновесия, подобные XI«XII. Некоторым аргументом в пользу участия свободного катиона может служить то, что в большинстве случаев результаты перегруппировки указывают на предпочтительное направление реакции в сторону образования более устойчивого карбкатиона, т. е. с более компенсированным положительным зарядом. Так, из катионов II и III более устойчив последний, так как его положительный заряд подавляется +I-эффектом трех алкильных групп, тогда как в катионе II ,+I-эффектом всего одной трет-бутильной группы. Вообще по этой причине карбкатионы с зарядом на третичном углероде устойчивее катионов с зарядом на вторичном, а последние устойчивее карбкатионов типа -СН2+. Однако в случае R = C6H5 формулы XI и XII предложено заменить на XV - промежуточное соединение - фенониевый катион с равновероятным раскрытием цикла при действии на него воды и образованием соединений XIII и XIV.

Понятие о фенониевом катионе впервые ввел Крам с целью объяснить стереоспецифическое поведение в ретропинаколиновои перегруппировке двух диастереоизомеров З-фенил-2-бутилтозилата.

При ацетолизе трео-стереоизомер XVI полностью рацемизуется, а эритро-стереоизомер XVII превращается в ацетат, сохраняющий в полной мере оптическую активность. Крам постулирует образование в качестве промежуточных форм в течение перегруппировки структур XVIII и XIX, включающих фенониевый катион, привязанный симметрично к обоим углеродным атомам - стартовому и финишному.
Углеродный атом ароматического кольца, связанный первоначально со стартовым атомом С, в трехчленной промежуточной форме стал тетраэдрическим. Значит, плоскость бензольного кольца стала перпендикулярной к плоскости чертежа. Положительный заряд финишного атома С теперь рассредоточен в триаде углеродных атомов трехчлена, а следовательно, и по всем атомам бензольного цикла, что, по Краму, снижает энергетический уровень этой переходной формы и тем самым ускоряет реакцию.
Разрыв под действием уксусной кислоты гипотетического трехчленного катиона в случае трео-изомера XVI, имеющего плоскость симметрии, должен вести к рацемату, так как разрыв равновероятен слева и справа (или, иначе, две симметричные молекулы при реакции не могут дать одну оптически активную форму, но лишь рацемат). Напротив, в случае эритро-изомера XVII ацетолиз несимметричной трехчленной структуры, с какой бы стороны ни шла атака уксусной кислоты, приводит к исходной конфигурации.
Следует обратить внимание на то, что и замыкание в трехчленный Никл с удалением тозилат-аниона, и разрыв трехчленного цикла с возвращением фенониевого катиона в бензоидную форму происходит с вальденовским обращением. В. Хюккель, оспаривающий трактовку Крама и самое существование фенониевого катиона, и трехчленного цикла, указывает, что стереоспецифичность рассматриваемой реакции можно объяснить просто переменой местами фенильной группы с тозилатной (или с заменяющей ее ацетатной) с двумя вальденовскими обращениями:

Здесь ОА обозначает как уходящий тозилат-анион, так и вступающий (в опытах Крама) ацетат-анион.
Само собой разумеется, что в условиях реакции ацетат XVIa может перегруппировываться снова в ацетат XVI, так что рацемизацию обусловливают оба процесса XVI«XVIa.
Возражения Хюккеля основательны, и широко распространенная, ныне концепция фенониевого иона как промежуточной формы в перегруппировках не может считаться, бесспорно принятой в науке.
Реакции, где мигрирует ароматическая группа, а не алкил или водород, по мнению сторонников гипотезы фенониевого катиона, протекают в сотни и тысячи раз быстрее именно благодаря относительно низкому энергетическому уровню фенониевого катиона с его рассредоточенным по многим атомам положительным карбониевым зарядом. Возражение Хюккеля в этом случае состоит в том, что структуры типа XVIII и XIX по существу являются «классическими» и никак не могут рассматриваться как переходное состояние, а скорость реакции определяется только энергетическим уровнем переходного состояния. В самом деле, стабильные катионы подобного типа мы встречали, например, в виде

при описании реакции Фриделя - Крафтса. Таким образом, структуры XVIII и XIX отделены от начальных и конечных продуктов реакции энергетическими барьерами, которые и определяют константу скорости превращений исходного XVI в промежуточный продукт и последнего в продукт XVIa и соответственно XVII в промежуточный продукт и далее - в XVIIa. Конечно, можно выдвинуть контрвозражение, что если оба переходных состояния, отделяющие промежуточный продукт, близки к нему по геометрии и структуре, то они и энергетически близки. Тогда энергетические барьеры, отделяющие промежуточный продукт, невысоки, а следовательно, энергетический уровень этого продукта все же приблизительно определяет скорость реакции (постулат Хэммонда).
В 1967 г. Олах описал эксперимент, который, казалось бы, непосредственно доказывает существование фенониевых ионов по крайней мере в некоторых случаях. Оказалось, что п-(2'-хлорэтил) -анизол, растворенный в избытке SbF5 при - 80 °С, дает острый одиночный пик (синглет) в спектре ЯМР в области метиленовых протонов. Это означает, что обе метиленовые группы становятся эквивалентными после удаления хлор-аниона, т. е. после образования карбониевого иона:
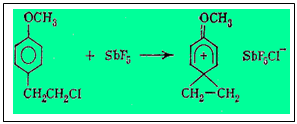
Если бы метиленовые группы были неэквивалентны, то в спектре ЯМР в этой области было бы два триплета, относящихся к разным метиленовым группам. Однако на деле эти данные не исключают быстрой обратимой изомеризации «неклассического» карбкатиона, т. е. равновесия типа:

При этом скорость взаимопревращений классических карбкатионов должна быть настолько велика, чтобы ЯМР не мог уловить каждый карбкатион как отдельную частицу.
Сопоставляя теоретические соображения Хюккеля и экспериментальные данные Брауна, можно сказать, что «неклассический» катион правильнее представлять не как самостоятельно существующую частицу и не как сумму резонирующих «классических» катионов, а как переходное состояние перегруппировки, которое находится не в минимуме, а в максимуме потенциальной кривой (на вершине барьера, разделяющего два переходящих друг в друга «классических» катиона I и II).
Альдегидо - кетонная перегруппировка
1.Общие сведения о перегруппировке
Альдегидо- кетонная перегруппировка основана на превращении альдегидов в изомерные кетоны, сопровождающаяся обменом водорода альдегидной группы на соседний углеводородный радикал под действием протонных кислот (кислот Льюиса, серной и т. д. )

Альдегидо- кетонная перегруппировка является нуклеофильной, интрамолекулярной, стереоспецифической, протекает с миграцией от атома углерода к другому атому улерода (от С-С) , с изомеризацией в насыщенных системах.(16)
2.Механизм перегруппировки.
Механизм превращения альдегидов в кетоны сходен с механизмом ретропинаколиновой перегруппировки и может быть представлен следующей схемой:

1.Благодаря неподеленной паре электронов на атоме кислорода альдегиды обладают основными свойствами и реагируют с кислотами.
При взаимодействии с протонными кислотами альдегиды (I) присоединяют протон, вследствии чего образуется σ – связь ОН(II.) В результате возрастает электрофильность углеродного атома карбонильной группы(17).
2.Т.к. α- углеродный атом в соединении (II) связан с радикалом, который за счет резонансных факторов, эффекта гиперконьюгации, имеет неподеленную пару, то данная пара начинает выступать в качестве нуклеофила. При этом начинает образовываться связь между радикалом, находящимся у α- углеродного атома и карбкатионным углеродом, при этом одновременно происходит разрыхление связи между α- углеродным атомом и радикалом при нем. В результате образуется неустойчивое соединение (III).
3.В результате происходит образование вторичного катиона на α- углеродном атоме (IV).В дальнейшем происходит регенирация протона с образованием соединения (V),которое по правилу Эльтекова- Эйленмеера является неустойчивым, т.к. образуется система, в которой у одного атома углерода находятся двойная связь и гетероатом, несущий неспаренную пару электронов.
4.Таким образом, соединение (V), вследствии своей неустойчивости изомеризуется с образованием кетона.
Пинаколиновая перегруппировка
1.Общие сведения о пергруппировке.
Катализируемая минеральными кислотами перегруппировка 1, 2- диолов называется пинаколиновой перегруппировкой (18). Данная перегруппировка является нуклеофильной, интрамолекулярной, протекает без изомеризации в алифатическом ряду с миграцией от атома углерода к другому атому углерода. Движущей силой реакции является отщепление молекулярного азота, а содействующим фактором - легкий отрыв протона от кислорода, что в итоге приводит к стабильной молекуле.
2.Механизм перегруппировки.

Многочисленные исследования различных замещенных гликолей и 1,2- аминоспиртов показали, что мигрирующая группа (Н, алкил, арил, галоген) выполняет роль нуклеофильного реагента, атакуя (+) заряженный атом углерода, возникающий после отщепления одного из протонированных гидроксилов.(19)
При этом установлено, что перескакивающий заместитель подходит к атому углерода всегда со стороны, противоположной положению потерянного гидроксила. Это означает, что в карбкатионе вращение С-С- связи отсутствует, вероятно, вследствии сильного донорно- акцепторного взаимодействия оставшегося –ОН с носителем (+)- заряда. Мигрирующая группа (Н, СН3, С6Н5 и др.) в переходном состоянии связана с обоими атомами углерода трехцентровой связью. Второй гидроксид- ион, сыграв свою активную роль стабилизатора карбкатиона вновь возвращается к своему (С1) атому углерода, но уже в виде протонированой С=О- группы.
Перегруппировка требует энергетических затрат на разрыв одной сигма- связи (С1- R) и перераспределение электроной плотности между химическими связями. Установлено, что результат перегруппировки для несимметрично замещенных гликолей сильно зависит от конформации заместителей и всей молекулы в целом.
На основании выше сказанного можно сделать вывод, что рассмотренная перегруппировка является нуклеофильной, стереоспецифической, внутримолекулярной.
Расчленение на стадии здесь дано искусственно, для ясности.
Подробно изучено, какие радикалы в этой перегруппировке легче мигрируют. В порядке легкости миграции радикалы располагаются в следующий ряд:
п-CH3OC6H4 > п-CH3C6H4 > п-ClC6H4 > Алкилы > H
Общий вывод таков: легче мигрирует радикал, в наибольшей степени рассредоточивающий положительный заряд, появившийся в системе в результате отрыва -ОН, или, другими словами, легче мигрирует радикал, наиболее способный подвергнуться электрофильной атаке. То обстоятельство, что начальным моментом перегруппировки является отрыв гидроксильного аниона и образование карбониевого катиона (в переходном состоянии тотчас рассредоточивающего свой заряд между С, от которого оторван гидроксил, соседним С скелета и ключевым С мигрирующей R'-группы), доказывается следующими аналогиями:
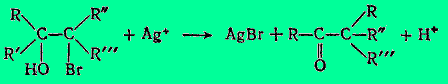
(Здесь даны только исходный бромгидрин и конечный пинаколин; механизм, очевидно, тот же.)
Еще одна аналогичная перегруппировка - «окислительное дезаминирование» Мак-Кензи:

Движущей силой реакции является отщепление молекулярного азота, а содействующим фактором - легкий отрыв протона от кислорода, что в итоге приводит к стабильной молекуле.
Общий механизм реакции можно выразить одной схемой синхронного превращения:

3.Доказательства стереохимического течения перегруппировки.
На примере окислительного дезаминирования впервые установлено и стереохимическое течение перегруппировки пинаколинового типа. Мигрирующий радикал R', конечно, если с углеродом, несущим гидроксил, связан асимметрический атом этого радикала, сохраняет свою (правую или левую) конфигурацию. Группировка же вокруг углеродного атома, к которому мигрирует R', претерпевает вальденовское обращение (что можно констатировать, конечно, только если исходный аминоспирт был выделен в стереохимически индивидуальной форме). Все это безусловно доказывает, что промежуточный карбкатион не появляется в свободном состоянии: карбкатионы имеют плоскую конфигурацию, и когда они фигурируют как промежуточные стадии реакции, т. е. когда реакции разыгрываются по механизму SN1, обычно происходит полная или далеко идущая рацемизация.
Таким образом, стереохимическое течение пинаколиновых перегруппировок такое же, как в реакциях SN2. Это как бы SN2.-замещение групп ОН или Вг (в окислительном дезаминировании - диазониевой группы N2+) у несущего эти группы углеродного атома на радикал R' от соседнего углерода.
В первых двух случаях выведению групп ОН и Вг благоприятствует действие Н+ или ZnCl2 (льюисова кислота) и Ag+, в третьем случае перегруппировке содействует самопроизвольный распад непрочного алифатического диазония. Пинаколиновой перегруппировке содействует также +T-эффект гидроксила, благодаря которому реализуется превращение спиртовой группы пинакона в кетонную группу пинаколина. Следует еще пояснить формулы IV и IX. Они изображают переходное состояние, в котором R' еще не оторвался от материнского углерода, но уже начал связываться с углеродом, принимающим мигрирующую группу. Оба эти углерода и R' связаны трехцентровыми электронными орбиталями. Если R' = Н, то речь идет о гидридном перемещении. Следует, однако, напомнить, что, по данным Тиффено, Орехова и Бахманна, водород мигрирует труднее, чем алкилы или арилы.
В отношении радикала R' процесс должен рассматриваться как электрофильное замещение связанной с ним группы:
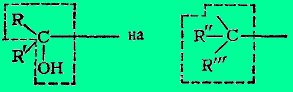
4.Применение перегруппировки.
Пинаколиновые перегруппировки многократно использовались для изменения структуры алициклов, расширения или сужения цикла. Например:
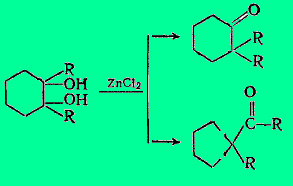
Н. Д. Зелинский и Н. И. Шуйкин осуществили следующий синтез спиранового кетона:

Направление реакций в сторону образования производного циклогексанона или циклопентильного кетона зависит, в частности, от характера R, но также и от стереохимии цикла.
Поскольку перегруппировка происходит с вальденовским обращением у принимающего углерода, мигрирующий радикал должен поступать со стороны, противоположной уходящей группе (НО, Вг, N2+ в приведенных выше примерах). В случае фиксированного в цикле пространственного расположения этих групп по отношению к остающемуся гидроксилу, углеродному радикалу и СН2-группе цикла геометрический фактор сказывается и иногда направляет реакцию по-разному. Пример: {picture8} Пинаколиновая перегруппировка проходит только для цис-аминоспирта (диазотированного азотистой кислотой): транс-аминоспирт сохраняет свой скелет
Перегруппировка Демьянова
1.Общие сведения о перегруппировке.
Перегруппировка Демьянова относится к перегруппировке в ненасыщенных системах, основанной на расширении или сужении цикла на один атом углерода при превращении алициклических или гетероциклических первичных аминов в спирты под действием азотистой кислоты (20). Данная перегруппировка является внутримолекулярной ( интра- ), т.е. разрыв старых связей и образование новых происходит синхронно; является нуклеофильной; протекает с миграцией от атома углерода к другому атому углерода (от С-С); протекает с участием карбкатиона.
При рассмотрении перегруппировки Демьянова следует учитывать устойчивость циклов, то есть то, что шестичленные и пятичленные циклы энергетически наиболее устойчивы чем трехчленные, четырехчленные и т.д. Поэтому при рассмотрении расширения или сужения циклов в результате перегруппировки следует иметь в виду теорию устойчивости циклов.
Так, например, при действии азотистой кислоты на циклогексилметиламин (I) образуется смесь циклогексилкарбинола I(III) и циклогептанола (смесь изоборнеона) (IV).
Эта же смесь спиртов образуется и при действии азотистой кислоты на циклогептиламин (II):

2.Механизм перегруппировки.
Механизм перегруппировки Демьянова аналогичен механизму пинаколиновой и ретропинаколиновой перегруппировок.
Так, образование циклогексилкарбинола при действии азотистой кислоты на циклогексилметиламин (I) может быть объяснено следующей схемой:

Однако карбониевый ион (V) может претерпевать перегруппировку типа ретропинаколиновой, в результате чего возникает карбониевый катион (VI), а из него- циклогептанол:

Т.е. пара электронов как нуклеофил атакует атом углерода, на котором находится недостаток электронной плотности, причем образование новой связи и разрыв старой происходит синхронно, т. е. перегруппировка является внутримолекулярной.
При действии азотистой кислоты на циклогептиламин образуется карбониевый катион (VI), который реагирует с водой, дает циклогептанол:
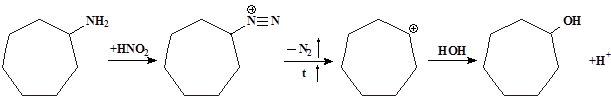
А претерпевая перегруппировку типа пинаколиновой, образует карбониевый ион (V), и из него циклогексилкарбинол:

3.Побочные реакции.
Перегруппировка Демьянова может сопровождаться образованием олефинов за счет отщепления протона от карбониевых ионов (V), (VI) или (VII):

Реагирует ли азотистая кислота с циклогексилметиламином или циклогептиламином, в реакционной смеси устанавливается равновесие между карбониевыми ионами 5 и 6. Это является причиной образования одинаковой смеси спиртов в обоих случаях. Таким образом, в данной перегруппировке побочная реакция-образование циклических олефинов.
Сужение и расширение циклов наблюдается не только при реакции олефинов с азотистой кислотой, но и в других случаях, когда образуются карбониевые ионы.
Н.Я.Демьянов и Н.М .Кижнер установили, что при действии бромистоводородной кислоты на циклопропилкарбинол образуется циклопропилбромметан и бромциклобутан, из циклобутанола при действии бромистоводородной кислоты получается циклопропилкарбинол:

Перегруппировка Наметкина.
1.Общие сведения о перегруппировке.
Переход α-метилкамфена в 4-метилизоборнеол в условиях кислотного катализа называется перегруппировкой Наметкина, иначе ее называют камфеновой перегруппировкой второго рода. Данная перегруппировка наблюдается в ряду терпенов.(21)
2.Механизм перегруппировки.
Камфеновая перегруппировка второго рода была открыта Наметкиным и Брюсовой.

Механизм перегруппировки Наметкина заключается в изомеризации углеродного скелета по типу ретропинаколиновой или, при обратном процессе, - пинаколиновой перегруппировки.
Рассмотрим механизм:
1.К α-метилкамфену (I) идет присоединение воды по двойной связи в соответствии с правилом Марковникова (II).
2.Дальнейшая протонизация дает оксониевый ион (III). Как известно, вода – это хорошо уходящая группа. Вследствие этого, соединение (III) превращается в открытый карбкатион (IV).
3.Затем собственно здесь начинается перегруппировка: атака нуклеофила (пары электронов) по положительному реакционному центру. То есть миграция группы, имеющей избыток электронов (÷СН3) к атому, несущему положительный заряд (карбкатион), стабилизация карбкатиона, одновременный уход ÷СН3 группы и атака его по карбкатиону обуславливает тот факт, что данная перегруппировка является внутримолекулярной (интрамолекулярной).
4. В месте ухода÷СН3 группы появляется новый реакционный центр, который может сразу перейти в конечный продукт (4-метилиззоборнеол), либо сразу при взаимодействии с водой, либо претерпевающий перегруппировку (VII).
Таким образом, перегруппировка Наметкина является нуклеофильной, внутримолекулярной перегруппировкой.
3.Зависимость продуктов перегруппировки от различных факторов.
Состав и структура продуктов камфеновой перегруппировки определяется относительной скоростью ряда параллельных изомеризации. Например, для производных борнеола (VII) возможны: 1,2-гидридный сдвиг (а), 142-миграция группы СН3 (б), перемещение мостика (в) и сужение алицикла (г). Однако в основном реализуется путь (г), поскольку в случае (а) образуется менее стабильный вторичный карбкатион (IX), путь (б) запрещен Бредта правилом, по пути (в) получается термодинамически невыгодный четырехчленный цикл:

Карбкатион X может далее элиминировать протон, присоединить нуклеофил или претерпеть перегруппировку, например 1,2-сдвиг мостиковой группы СН3. Камфеновую перегруппировку применяют для синтеза различных производных терпенового ряда, например, камфоры из о-пинена, изоборнилацетата из камфена. Камфеновая перегруппировка I рода открыта Е. Е. Вагнером в 1899, II рода - С. С. Наметкиным в 1924.
Перегруппировка Вагнера –Меервейна
1.Общие сведения о перегруппировке.
Перегруппировка Вагнера –Меервейна является нуклеофильной, интрамолекулярной, стереоспецифической, протекает в ненасыщенной системе без изомеризации с миграцией от атома углерода к другому атому углерода. (22)
Перегруппировки Вагнера-Меервейна, общее название реакций, протекающих с 1,2-миграцией группы R(H, алкил или алициклич. фрагмент, арил, ацил, алкоксикарбонил и др.) к карбкатионному центру, возникающему в молекуле при нуклеофильном замещении, присоединении к кратной связи или элиминировании:

где Х-уходящая группа, например ОН, Nj, Hal, Y~ -внешний нуклеофил, Е+ - электрофильный агент, например Н + , AlkCO + .
Перегруппировку Вагнера-Меервейна относят к секстетным перегруппировкам и подразделяют на пинаколиповые и ретропинаколиновые перегруппировки. Родственной этой перегруппировке является Демьянова перегруппировка.
Перегруппировку Вагнера-Меервейна претерпевают, как правило, углеводороды и их производные, имеющие разветвленный углеродный скелет. В ряду алициклических соединений часто сопровождается расширением или сужением цикла. С данной перегруппировкой конкурируют другие реакции карбкатионов-фрагментация, депротонирование, присоединение нуклеофила. Протеканию перегруппировки способствуют увеличение диэлектрической проницаемости растрителя и уменьшение его основности, а также прочное связывание уходящего аниона, напр. в виде комплексных анионов А1С14-, SbClg.
2. Механизм перегруппировки
.
Примером перегруппировки Вагнера –Меервейна является превращение борнеола в камфен под действием катализаторов кислотного характера, это камфеновые перегруппировки I рода; изомеризация, сопровождающая дегидратацию спиртов, например уравнение 1; превращение камфолитовой кислоты в изо-лаунолевую (2). камфолитовой кислоты в изо-лаунолевую (2).

3.Применение.
Перегруппировку Вагнера-Меервейна используют в промышленности, например при получении камфоры из пинена, изоборнилацетата из камфена, а также терпенофенолов - промежуточных продуктов в синтезе кедрола, санталидола и некоторых других душистых веществ. пинена, изоборнилацетата из камфена, а также терпенофенолов - промежуточных продуктов в синтезе кедрола, санталидола и некоторых других душистых веществ.
Перегруппировка Вагнера-Меервейна открыта Е.Е. Вагнером в 1899 при исследовании превращения бициклических терпенов, подробно изучены X. Меервейном в 1910-1927.
Перегруппировка Курциуса
1.Общие понятия о перегруппировке.
Перегруппировка Курциуса основана на термическом разложении азидов карбоновых кислот в щелочной среде в изоционаты (23).
Данная перегруппировка является интрамолекулярной, стереоспецифической, нуклеофильной, протекает без изомеризации, с миграцией от атома углерода к атому азота в алифатическом ряду.
2.Механизм перегруппировки
.
При нагревании азидов кислот происходит перегруппировка, механизм которой можно представить следующей схемой:

1.На первой стадии от молекулы азида(1) отщепляется азот, образуя при этом неустойчивое соединение (2)
2.Промежуточное неустойчивое соединение, образующееся сразу вслед за отщеплением молекулы азота, содержит атом азота с секстетом электронов, т. е., незаполненной (вакантной) орбиталью. Такие атомы электрофильны наподобие катионов, хотя формально они нейтральны. Они близки в этом отношении к атому углерода в карбенах и могут быть названы карбеноидными.
3.Далее алкил в этом промежуточном соединении мигрирует к азоту вместе с парой электронов связи, и они заполняют вакантную орбиталь азота. При этом на атоме азота не возникает отрицательного заряда, поскольку одновременно свободная пара электронов азота образует связь с углеродом, и образуется молекула алкилизоционата (эфира изоциановой кислоты(3)):
4.При дальнейшем гидролизе изоционата получаем алкилкарбоминовую кислоту (4), которая распадается с получением амина(5) и углекислого газа.
Само удаление молекулы азота из азида может тоже происходить одновременно или почти одновременно с начинающейся перегруппировкой, так что « карбеноидная молекула» ни на момент не существует в свободном состоянии.
Реакции Шмидта
1.Общие сведения о перегруппировке
.
Перегруппировка Шмидта основана на превращении карбоновых кислот или их эфиров в изоционаты под действием азотистоводородной кислоты.
Перегруппировка Шмидта является нуклеофильной, интрамолекулярной, протекает без изомеризации с миграцией от атома углерода к атому азота в насыщенных системах, является не стереоспецифической.
2.Механизм перегруппировки(24)

1.Так как азотоводородная кислота содержит электронодефицитный атом азота, а на атоме кислорода гидроксильной группы имеется избыток электронной плотности, то происходит присоединение протона водорода с образованием соединения содержащего ион оксония(1)
2. Далее происходит отщепление молекулы воды с образованием карбкатиона (2).
3. К карбкатиону присоединяется азотистоводородная кислота, после чего образуется неустойчивое соединение (3).
4. Так как азот хорошая уходящая группа, то происходит отщепление азота с образованием неустойчивого соединения (4), которое изомеризуется с образованием изоционата(5). Как промежуточного соединения.
5.Реакция завершается гидратацией изоцианата, приводящей к карбаминовой кислоте, которая претерпевает самопроизвольное декарбоксилирование с образованием амина(6)
4.Если реакцию проводить в спиртовом, а не в водном растворе (азотистая кислота получается при этом из амилнитрита и хлористого водорода), то получаются уретаны(7)
3.Доказательства механизма перегруппировки.
Стадией, лимитирующей скорость реакции, является отщепление N2 от соединения(3), однако вполне вероятно, что отщепление N2 и миграция R происходят одновременно, т. е. здесь мы сталкиваемся со случаем внутреннего замещения по механизму SN1. Можно поэтому ожидать, что чем сильнее выражены электронодонорные свойства R, тем выше должна быть скорость реакции; это предположение было подтверждено при изучении скорости разложения кислот, содержащих в ядре электронодонорные заместители. В реакции азиды образуются при действии на гидразид нитрита натрия и кислоты; если реакцию проводить в спиртовом, а не в водном растворе (азотистая кислота получается при этом из амилнитрита и хлористого водорода), то получаются уретаны. В перегруппировках, протекающих с изменением углеродного скелета, мигрирующая группа сохраняет свою конфигурацию. Другая общая особенность таких реакций состоит в том, что если проводить перегруппировку двух различных, но очень сходных соединений в одном растворе, то не удается наблюдать образования смешанных продуктов. Это свидетельствует о том, что группа N в процессе миграции никогда не освобождается, т, е. все эти перегруппировки являются внутримолекулярными.
Изомеризация парафиновых углеводородов.
1.Общие сведения о перегруппировке.
При действии на парафиновые углеводороды катализаторов кислотного характера, подобно серной кислоте или смеси галоидного алюминия и соответствующего галоидоводорода , происходит изомеризация с образованием более разветвленного парафинового углеводорода, например:

Данная перегруппировка является нуклеофильной, интрамолекулярной, происходит с изомеризацией в алифатическом ряду с миграцией от атома углерода к другому атому углерода.
2.Механизм перегруппировки.
Изомеризация н- бутана в изобутан происходит только в присутствии следов олефина, кислорода или воды.
Эти примеси участвуют в первоначальном образовании небольших количеств вторичного н- бромистого бутила по одной из схем:

Подтверждением схемы б) служит тот факт, что при реакции бромистого алюминия с кислородом образуется бром.
То, что в реакции в) каталитическая активность связана главным образом не с гидроксилом, а с атомом брома вытекает из наблюдения, согласно которому соединение, хотя и обменивает дейтерий на водород н-бутана, но скорость этого обмена не пропорциональна скорости изомеризации.
После первоначального образования вторичного н- бромистого бутила реакция изомеризации протекает как цепной процесс с участием карбониевых ионов.
Механизм перегруппировки можно представить следующей схемой:

1.На первой стадии происходит взаимодействие бромистого алюминия с 2-бромбутаном (1), в результате чего образуется соединение (2), содержащий карбкатион.
2.Так как бром отошел вместе с парой электронов, то на атоме углерода возникает недостаток электронной плотности. Метильная группа , находящаяся в конце цепи вместе с парой электронов атакует атом углерода, на котором имеется недостаток электронной плотности, образуя при этом неустойчивое соединение (3).
3.В связи с большой активностью каркатиона он стремиться стабилизироваться за счет присоединения водорода от бутана, находящегося в реакционной смеси, в результате чего образуется изобутан (4) и карбониевый катион, т.е. идет цепной процесс(25).
3.Применение перегруппировки.
Данная перегруппировка имеет большое значение, так как с помощью реакций изомеризации парафиновых углеводородов можно получать ценное моторное топливо
Перегруппировка Вольфа
1.Общие сведения о перегруппировке
Перегруппировка Вольфа основана на превращении диазометилкетонов под действием воды, спиртов, аммиака, аминов в производные кислот в присутствии окиси серебра.
Перегруппировка является нуклеофильной, интрамолекулярной, стереоспецифической, протекает без изомеризации в насыщенных системах с миграцией от атома углерода к другому атому углерода.
Эта перегруппировка рассматривается отдельно от истинных карбкатионных перегруппировок, поскольку она включает миграцию к незаряженному, хотя и электронодифицитному атому углерода, а не к положительно заряженному атому углерода.
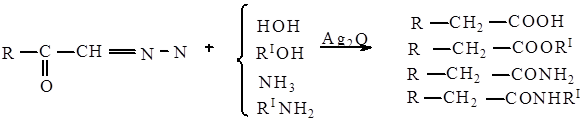
2.Механизм перегруппировки.

1. При отщеплении от диазометилкетона (1) азота под влиянием катализатора или температуры образуется промежуточный бирадикал(2)- карбен.
2. Карбен (2) претерпевает перегруппировку: так как кислород более электроотрицателен чем углерод, то он оттягивает на себя электронную плотность, мезомерно передавая это воздействие на радикал, вследствие чего на радикале возникает недостаток электронной плотности.
3.В связи с этим он может отакавать электронодифицитный атом углерода. Так как образующееся соединение (3) неустойчиво, оно переходит в кетен (4).
4.Образующийся кетен очень реакционноспособен, поэтому легко дает производные кислот.(5).
3.Побочные реакции.
Бирадикал-карбен (2) может претерпевать и иную перегруппировку в зависимости от того какими реагентами действовать на диазометилкетон. Так при действии на диазометилкетон водой и муравьиной кислотой в отсутствии катализатора в качестве побочного продукта образуются оксиметилкетоны:

Это происходит за счет того, что карбен присоединяет атом, имеющий заполненную валентную оболочку.
Образование в качестве промежуточного соединения кетена, а не оксиметилкетона было доказано тем, что удалось выделить промежуточно- образующийся кетен.
4.Доказательства правильности механизма перегруппировки
.
Превращение карбонильной группы диазометилкетона в карбоксильную, с несомненностью установлено следующим циклом реакции, проведенных с применением радиоактивного углерода:
Если третичный радикал, связанный с карбоксильной группой диазометил-кетон, содержит ассиметричный атом углерода, то перегруппировка Вольфа протекает с сохранением конфигурации.
Если ассиметричный атом не третичный, а вторичный, перегруппировка протекает с рацемизацией, что, по-видимому, обусловлено предварительной таутомеризацией диазометилкетона на поверхности катализатора.
Электрофильные перегруппировки в алифатическом ряду
К электрофильным
(или катионотропным) перегруппировкам относятся такие перегруппировки, в ходе которых происходит миграция группы, имеющей недостаток электронов, к атому, несущему отрицательный заряд или неподеленную электронную пару (30, 31). Рассмотрим их подробней.
Перегруппировка Стевенса
1.Общие сведения о перегруппировке
Перегруппировка Стевенса основана на миграции структурного фрагмента от атома азота четвертичной аммонийной соли под действием основания к соседнему углеродному атому.
Перегруппировка Стевенса является нуклеофильной, интрамолекулярной, стереоспецифической, протекает без изомеризации в алифатическом ряду, с миграцией структурного фрагмента от атома азота к атому углерода.
Впервые реакция была изучена на следующем примере:

2.Общая схема и механизм перегруппировки
Общая схема перегруппировки:

Перегруппировка изучена в случае таких четвертичных аммонийных солей, у которых:
R- 1. ацетил
2. бензоил
3. замещенный бензоил
4. винил
 5. фенил 5. фенил
R- 1.бензил
2. замещенный бензил
3.α- фенилэтил
4.бензилгидрил
5.9- ференил
6.фенацил
   Механизм можно представить следующей схемой: Механизм можно представить следующей схемой:

1.На первой стадии при действии на соединение (I) иона гидроксила, происходит образование хорошей уходящей группы- воды.
2.Вследствии того, что α- водородный атом в соединении (I) является подвижным, происходит отрыв воды и образование карбаниона(III).Так как на атоме азота имеется недостаток электронной плотности , он оттягивает на себя пар электронов, тем самым создавая недостаток электронной плотности на радикале, вследствии чего он может атаковать карбанион.
3.Далее происходит одновременное разрыхление связи между радикалом и атомом азота и образование между радикалом и карбанионом, следствием чего является образование конечного продукта- амина (IV)
3.Влияние заместителей на протекание перегруппировки.
 Заместители в радикале ׳R(бензил) увеличивают скорость перегруппировки по мере возрастания их электронооттягивающей способности: Заместители в радикале ׳R(бензил) увеличивают скорость перегруппировки по мере возрастания их электронооттягивающей способности:
Заместители в радикале R, наоборот, замедляют реакцию по мере возрастания их электронооттягивающих свойств
4.Возможности протекания перегруппировки с сульфониевыми соединениями:
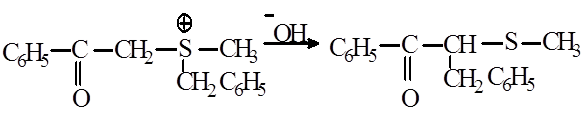
Перегруппировка Арбузова
1. Общие сведения о перегруппировке.
Перегруппировка Арбузова- это превращение полных эфиров кислот трехвалентного Р под действием алкилирующих или арилирующих реагентов в фосфорильные соединения с образованием связи С-Р.
Перегруппировка Арбузова является нуклеофильной, интрамолекулярной, протекает без изомеризации, с миграцией от атома улерода к атому кислорода в алифатических системах, не стереоспецифическая.
2.Механизм перегруппировки.

1 1.На первой стадии происходит органического галогенида к эфиру трехвалентного фосфора с образованием промежуточного квазифосфониевого соединения типа (1). Первая стадия_ бимолекулярное, нуклеофильное замещение второго порядка.
2Далее происходит разрыв связи углерода с кислородом с образованием эфира фосфористой кислоты и галогеналкила.
3.Влияние структуры исходного эфира трехвалентного фосфора и галогенсодержащего реагента на легкость (и возможность) протекания перегруппировки.
В процессе длительного изучения реакций Арбузова были сформулированы обобщения, связывающие влияние структуры исходного эфира трехвалентного фосфора и галогенсодержащего реагента на легкость (и возможность) протекания между ними реакции. Активность производного трехвалентного фосфора зависит от величины электронной плотности (подвижности неподеленной электронной пары) на атоме фосфора. Электронодонорные заместители у атома фосфора, увеличивая электронную плотность на нем, повышают реакционную способность этих соединений с галогенсодержащими соединениями, относящимися к группе электрофильных реагентов. Электроноакцепторные заместители, снижая электронную плотность на атоме фосфора, будут затруднять протекание реакции. В некоторых случаях низкую активность эфира трехвалентного фосфора в реакции Арбузова можно компенсировать повышенной активностью галогенопроизводного.
Если в производном P(III) наряду с атомом фосфора имеется еще один центр алкилирования, реакция протекает неоднозначно. Так, в случае тиоэфиров Р(III) взаимодействие с галоидными алкилами осуществляется в двух направлениях: по схеме реакции Арбузова и с замещением алктиольной группы у трехвалентного фосфора на атом галогена. Это объяснялось возможностью конкурирующего алкилирования атомов фосфора и серы на первой стадии реакции
В течение нескольких десятков лет в литературе дискутировался вопрос о соотношении этих направлений. По последним данным превалирует направление по схеме реакции Арбузова, тогда как направление с сохранением координации атома фосфора является незначительным.
4.Различные продукты реакции, образующиеся при использовании разных реагентов
.
Если вводимый в реакцию алкилгалогенид идентичен образующемуся, его берут в каталитических количествах, в других случаях - в избытке.
В реакцию вступают фосфиты (R'O)3P, фосфониты RP(OR')2, фосфиниты R2P(OR'), а также их производные, содержащие хотя бы одну группу OR'. Заместители у атома Р, понижающие его нуклеофильность, уменьшают реакц. способность соединения. Так, галогенфосфиты реагируют обычно только в присутствии кислот Льюиса. Ариловые эфиры вступают в реакцию с трудом, при этом удается выделить промежуточно образующееся квазифосфониевое соединение типа I.
Триметилфосфит и другие метиловые эфиры в присутствии кислот Льюиса дают те же продукты, которые образовались бы в реакции Арбузова, например:

В качестве алкилирующих и арилирующих агентов в реакции Арбузова могут участвовать алкил- и алкиленгалогениды, галогенпроизводные гетероциклические соединения, галогенкарбонильные соединения, ангидриды карбоновых кислот. При применении галогенарилов и галогенгетероциклических соединений реакцию Арбузова обычно проводят в условиях фотохимической активации (через стадию образования комплекса с переносом заряда).
Винилгалогениды вступают в реакцию Арбузова с трудом, однако в этом случае реакция катализируется NiCl2, что позволяет получать некоторые винилфосфорильные соединения. Для синтеза соединения, содержащих алкильные заместители в положении, используют реакцию триалкилфосфитов с 1-нитро-1-алкеном: положении, используют реакцию триалкилфосфитов с 1-нитро-1-алкеном:

Геминальные и другие дигалогеналканы в зависимости от соотношения реагентов образуют различные соединения:

Четыреххлористый углерод образует как трихлорметильные фосфорильные соединений [например, (RO)2P(O)CC13], так и дихлорметилендифосфорильные [напр., (RO)2P(O)—CC12—(O)P(OR)2]; реакция ускоряется пероксидами или УФ-облучением.
Вицинальные галогенпроизводные, содержащие хотя бы у одного атома С два электроноакцепторных заместителя, с полными фосфитами реагируют не по схеме реакции Арбузова:

Перфторолефины взаимод. с триалкилфосфитами с образованием в качестве промежуточных соединений фосфоранов:

Реагенты, молекулы которых содержат электрофильные атомы Н, Hal, S, N и другие, вступают в реакции, родственные реакции Арбузова , в этом случае связь С—Р не образуется, например:

Полные тиолфосфиты обычно взаимодействуют с алкилгалогенидами и галогенациламинами не по схеме реакции Арбузова . Промежуточно здесь образуются не квазифосфониевые, а квазисульфониевые соединения, распадающиеся до галогентиофосфитов, например:

Реакции Арбузова широко используют для получения соединений со связью С—Р, в том числе пестицидов, лекарственных препаратов, экстрагентов и др. Реакция открыта А. Е. Арбузовым в 1905.
5.Возможность протекания перегруппировки по другому направлению.
В некоторых случаях гомолитический механизм может направлять процесс по схеме реакции Арбузова, тогда как в обычных условиях взаимодействие протекает в другом направлении. Так, хлорацетон как a-галогенкарбонильное соединение в обычных условиях реагирует с триалкилфосфитами по схеме реакции Перкова с образованием диалкилизопропенилфосфата. При фотолизе смеси хлорацетона с триалкилфосфитом протекает реакция Арбузова с образованием ацетонилфосфоната.
Это еще один удачный пример применения гомолитической реакции Арбузова для синтеза функционально замещенных фосфорорганических соединений.
Галоген альдегиды и галогенкетоны в зависимости от строения реагентов и условий протекания реакции образуют винилфосфаты (Перкова реакция)или галогенкетоны в зависимости от строения реагентов и условий протекания реакции образуют винилфосфаты (Перкова реакция)или кетофосфонаты: кетофосфонаты:

Ацилгалогениды в р-ции с триалкилфосфитами образуют кетофосфонаты кетофосфонаты
Выводы
Таким образом, универсальность реакции Арбузова (как ее классического варианта, так и новых видов) состоит в том, что она может быть осуществлена с широким выбором электрофильных реагентов в условиях гетеро- и гомолитического взаимодействия. Не исключается возможность протекания реакции по двум механизмам в одном процессе. Предпочтение тому или иному варианту реакции Арбузова отдают с учетом конкретных препаративных целей. Эта реакция принесла всемирное признание ее автору, дала ключ к пониманию структуры органических соединений фосфора и тем самым подтвердила плодотворность основных положений теории химического строения А.М. Бутлерова.
Значение новых идей в науке проверяется временем. Прошедшие десятилетия не состарили реакцию Арбузова. Наоборот, в химии фосфорорганических соединений, которая своим становлением и развитием во многом обязана этой реакции, в настоящее время нет другого столь универсального метода синтеза. И хотя химия органических соединений фосфора располагает широким арсеналом синтетических методов (в том числе и приводящих к образованию новых фосфоруглеродных связей), тем не менее реакция Арбузова продолжает оставаться важнейшей.
Реакция Арбузова позволяет вводить фосфорсодержащий заместитель с различным числом фосфоруглеродных связей в другие органические молекулы. Можно сказать и по-другому: с помощью этой реакции мы получаем возможность вводить к атому фосфора самые различные фрагменты органических молекул. Если же в последних имеются функциональные группы или кратные связи, то такие соединения могут явиться исходными для дальнейших синтезов. Направления дальнейших химических превращений будут определяться природой функциональных групп, фосфорсодержащего заместителя и их взаимным влиянием. Вот в чем уникальность и неисчерпаемые синтетические возможности реакции Арбузова.
Перегруппировка Виттига.
1.Общие сведения о перегруппировке.
Перегруппировка Виттига заключается в превращении простых эфиров при металлировании или другом аналогичном воздействии в спирты с перемещением одной алкильной группы в a - положение другой. Только такие группы, как бензил или аллил, образующие достаточно устойчивые анионы, т.е. способные легко подвергаться металлированию, вызывают миграцию.
Приведем пример:

Перегруппировка Виттига является электрофильной,внутримолекулярной, стереоспецифической, протекает без изомеризации, с миграцией от атома углерола к другому атому углерода в насыщенных системах.
2.Механиз перегруппировки.
1.Перегруппировка Виттига происходит в результате обработки эфиров фениллитием. Первая стадия процесса состоит в замещении a - водородного атома бензильной или другой реакционноспособной алкильной группы на литий. (см. Схему перегруппировки стадия I)
2.Виттиг предположил, что в металлическом производном либо уже имеется, либо легко образуется карбанион, к отрицательному центру, которого перемещается в виде электрофильного остатка другая алкильная группа, имеющая только шесть электронов в оболочке с главным квантовым числом 2. (см. Схему перегруппировки стадия II)
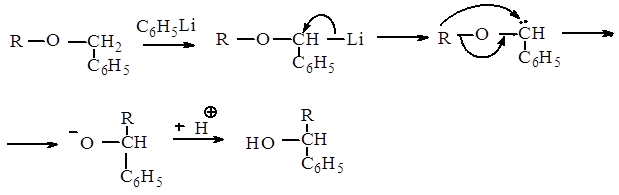
3.Доказательства механизма перегруппировки и ее стереоспецифичности.
Хаузер и Кантор проводили эту же реакцию путем обработки эфиров амидом калия в жидком аммиаке с последующим добавлением этилового эфира. Условия этой реакции соответствуют предложенному Виттигом механизму реакции. Были получены некоторые качественные данные по относительным скоростям миграции различных алкильных групп. В случае 9-флуорениловых эфиров Виттиг наблюдали следующую последовательность скоростей: аллил, бензил> метил, этил> фенил. Из исследования Хаузера и Кантора следует, что втор-бутил> трет–бутил. Тот факт, что в ряду простых ненасыщенных алкильных групп неопептильная и трет-бутильная группы обладают относительно низкими скоростями миграции, указывает на согласованное изменение связей с мигрирующей группой. Мигрирующая группа перемещается от ониевого атома к углеродному атому, т.е. от центра, предрасположенного к потере катиона, к углеродному центру, способному сохранять отрицательный заряд и реагировать в форме аниона, это доказывает механизм реакции. Причем при введении в систему щелочи, скорость увеличивается, т.е. при наличии щелочи полностью образуется анионный центр,- это подтверждает двух стадийный механизм реакции. Это же может служить доказательством стереоспецифичности перегруппировки.
4. Доказательства электрофильности перегруппировки.
Электрофильность перегруппировки доказывается следующим образом. При рассмотрении II-стадии (т.е. непосредственно самой перегруппировка), мы видим, что наличие С6Н5- группы позволяет стабилизировать карбанион образующийся на II-стадии – который является нуклеофильной составляющей реакции. Электрофильная составляющая образуется за счет сдвига электронной плотности к атому кислорода. (-ониевый атом) Таким образом, мигрирующая группа выступает в качестве электрофильной составляющей. А так как атака происходит именно этой группой, то мы можем сказать, что данная перегруппировка является электрофильной.
Перегруппировки в ароматическом ряду.
Известно большое число примеров ароматических соединений, у которых атомы или группы атомов, связанные с азотом или кислородом заместителя, под действием кислот переходят в орто- или пара- положение ароматического кольца. Реакции такого рода называются ароматическими перегруппировками.
Электрофильные перегруппировки в ароматическом ряду
Ароматическими электрофильными
перегруппировками называются такие перегруппировки, в ходе которых мигрирующая группа переходит из боковой цепи в ароматическое ядро как электрофильная частица(32).
Рассмотрим некоторые из них
Перегруппировка Фриса.
1.Общие сведения о перегруппировке
Перегруппировка Фриса, превращение сложных эфиров фенолов в орто- или пара-ацилфенолы под действием к-т Льюиса, напр.:

Перегруппировка Фриса проводят в органическом растворителе (обычно в PhNO2, PhCl, CS2, Cl2CHCHCl2) или в его отсутствие (обычно, когда требуется нагревание св. 70 0C).
В качестве кислоты Льюиса обычно используют AlCl3 (в стехиометрическом или несколько большем количестве), реже - TiCl4, SnCl4, FeCl3, ZnCl2- В некоторых случаях хорошие результаты дает применение безводного HF.
Перегруппировка Фриса является электрофильной, протекает с миграцией от атома кислорода к атому углерода в ароматических системах без изомеризации не стереоспецифично, вопрос об интрамолекулярности или об интермолекулярности не решен однозначно.
2.Влияние заместителей на протекание перегруппировки.
В реакцию вступают эфиры одно- и многоатомных фенолов алифатических и ароматических карбоновых кислот. В качестве заместителей в ароматическом ядре могут присутствовать AIk, OAIk, RC(O), Hal и др. Присутствие мета-ориентирующего заместителя обычно препятствует перегруппировка Фриса .Алкильные группы в орто-положении и пара(мета)-положении способствуют миграции ацильной группы в основном соотв. в пара- и орто-положение. Нередко в жестких условиях наблюдается миграция алкильных заместителей, что обусловлено каталитическим действием кислоты Льюиса.
Низкие температуры (25-60 0C) способствуют образованию па-ра-ацилфенолов, более высокие - орто-производных (например, при 25 0C из м-крезилацегата образуется 80% пара-ацильного производного, а при 165 0C - 95% орто-замещенного продукта). Выходы конечных продуктов и соотношение образующихся изомеров колеблются в очень широких пределах и зависят как от строения сложного эфира, так и условий проведения реакцции.
3.Механизм перегруппировки.
Механизм перегруппировка Фриса до конца не выяснен. Предполагают, что перегруппировка идет целиком по межмолекулярному или внутримолекулярному механизму, либо частично по тому и другому пути. Как и в Фриделя - Крафтса реакции вначале между субстратом и кислотой Льюиса образуется комплекс типа
R(ArO)C =
Перегруппировку Фриса можно осуществлять также при действии УФ облучения в отсутствие катализатора (так называется фотоперегруппировка Фриса). В этом случае р-ция идет по радикальному механизму (вначале образуется радикальная пара [ArO· ·COR], стабилизированная клеткой растворителя).
При действии трифторметансульфокислоты на арилбензоаты перегруппировка Фриса протекает обратимо (достигается равновесие). При нагревании пара-ацилфенолов (конечных продуктов перегруппировка Фриса) с H2
SO4
или H3
PO4
образуются с хорошим выходом соответствующие сложные эфиры фенолов.
4.Реакции подобные перегруппировке Фриса
.
В реакцию, подобную перегруппировка Фриса, вступают эфиры сульфокислот, например:

5.Применение перегруппировки.
Перегруппировка Фриса широко используют в синтезе фенолкетонов. Она имеет определенные преимущества перед реакцией Фриделя -Крафтса, в частности, зачастую обеспечивает более высокие выходы конечных продуктов. Перегруппировка открыта К. Фрисом и Ж. Финком в 1908.
Перегруппировка Кляйзена аллилариловых эфиров
1.Общие сведения о перегруппировки.
Термическая перегруппировка аллилфениловых в аллилфенолы с образованием С-аллильных производных носит название перегруппировки Кляйзена(33).
Перегруппировка Кляйзена является электрофильной, интрамолекулярной, нестереоспецифичной, протекает с миграцией от атома углерода к другому атому углерода в ароматических системах без изомеризации.
В 1912 году Л.Кляйзен открыл эту интересную и своеобразную перегруппировку аллиловых эфиров фенолов в аллилфенолы, которая стала прототипом для многих родственных сигматропных перегруппировок.
2.Механизм перегруппировки.
Аллиловый эфир фенола при нагревании до 200-220оС превращается в орто-аллилфенол, т.е. аллильная группа мигрирует в орто-положение бензольного кольца.

Если оба орто-положения заняты заместителями, то аллильная группа перемещается в пара-положение:

Установлено, что и орто- и пара-перегруппировки являются внутримолекулярными реакциями первого порядка, которые сопровождаются инверсией мигрирующей аллильной группы, т.е. аллильная группа присоединяется к бензольному кольцу своим  -углеродным атомом. -углеродным атомом.

Из этого следует, что переходное состояние перегруппировки Кляйзена должно быть циклическим шестизвенным. Такое переходное состояние включает шесть  -электронов и является ароматическим, что составляет движущую силу этой термической перегруппировки. На последней стадии происходит изомеризация циклогексадиенона в о-аллилфенол. Эта стадия полностью аналогична изомеризации кетона в енольную форму. -электронов и является ароматическим, что составляет движущую силу этой термической перегруппировки. На последней стадии происходит изомеризация циклогексадиенона в о-аллилфенол. Эта стадия полностью аналогична изомеризации кетона в енольную форму.

2,4-Циклогексадиенон является интермедиатом перегруппировки аллилариловых эфиров. Такой интермедиат может быть выделен при перегруппировке аллилового эфира 2,6-диметилфенола, когда аллильная группа мигрирует в пара-положение, поскольку енолизация кетона в фенол в этом случае не может происходить из орто-положения. Конечным результатом двух последовательных миграций аллильной группы является сохранение структуры мигрирующей группы.

Кроме того, при проведении перегруппировки в присутствии малеинового ангидрида 2,4-циклогексадиенон улавливается в виде аддукта диенового синтеза.
Миграция аллильной группы характерна не только для аллиловых эфиров фенолов. Аллиловые эфиры енолов также подвергаются аллильной перегруппировке. Например, аллилвиниловые эфиры в результате миграции аллильной группы превращаются в  , , -ненасыщенные карбонильные соединения. -ненасыщенные карбонильные соединения.

Диазоамино – аминоазоперегруппировка
1. Общие сведения о перегруппировке.
Диазоамино- аминоазоперегруппировка является электрофильной, не стереоспецифичной, интеомолекулярной в ароматическом ряду.
2. Механизм перегруппировки и доказательства интермолекулярности перегруппировки.
Диазоаминобепзол, образующийся из хлористого фенилдиазония и анилина, превращается при нагревании с солянокислым анилином в n
-аминоазобензол.

При этом группа С6
Н5
—N2
мигрирует от азотного атома к n
-углеродному атому бензольного кольца. Из диазоаминотолуола

в котором n
-положение занято, в присутствии солянокислогоn
-толуидина образуется с небольшим выходом 4',5-диметил-2-аминоазобензол:

в котором мигрирующая группа С7
Н7
—N2
—находится в орто-положении к аминогруппе.
При нагревании диазоамипотолуола с солянокислыми анилином или о
-толуидином мигрирующая группа СН3
С6
Н4
— N2
—вступает в ядра анилина или о
-толуидина, к результате чего образуются 4-метил-4'-амииоазобен-зол или 3,4'-диметил-4-аминоазобензол;

Эти данные показывают, что перегруппировка протекает интермолекулярно.
При изучении кинетики перегруппировки было установлено, что скорость превращения диазоаминобензола пропорциональна концентрации солянокислого анилина; если же вместо солянокислого анилина брать другие соли анилина, то скорость процесса меняется в зависимости от силы вязанной анилином кислоты. Из этого следует, что в перегруппировке участвует свободная кислота.
Если нагревать диазоамииобснзол в кислой среде с добавлением  β-паф-тола, то удается выделить анилин и продукт азосочетапия хлористого фснил-диазопия с (β-нафтолом (бензолазонафтол) с выходом 90% от теории. β-паф-тола, то удается выделить анилин и продукт азосочетапия хлористого фснил-диазопия с (β-нафтолом (бензолазонафтол) с выходом 90% от теории.
С другой стороны, было найдено, что реакция хлористого фенил-диазония с анилином в нейтральной, слабо щелочной или слабо кислой среде протекает по двум независимым направлениям, одно из которых приводит к образованию диазоаминобензола, а другое n
-аминоазобензола. Повышение кислотности благоприятствует второму направлению, которое становится единственным при достижении определенной концентрация* кислоты.
Все эти факты приводят к выводу, что диазоамино-аминоазо перегруп-пировка протекает через стадию образования хлористого арилдиазония и свободного амина, которые затем вступают в реакцию азосочетания;

Перегруппировка нитрозаминов.
1.Общие сведения о перегруппировке.
Перегруппировка нитрозаминов, протекает при их обработке их кислотами(соляной и бромистоводородной) и приводит к образованию изомеров и и перходу нитрозогруппы в ароматическое кольцо.
Перегруппировка является электрофильной, интермолекулярной, протекает с миграцией от атома азота к атому углерода в ароматическом ряду без изомеризации н стереоспецифично.
2.Механизм перегруппировки
.
Перегруппировка имеет интермолекулярный характер и протекает по следующей схеме:

1.Вначале под действием кислоты происходит расщепление нитрозамина на вторичный амин и нитрозилгалогенид.
2. На второй стадии перегруппировки нитрозилгалогенид нитрозирует амин в ядро.
3.Доказательства интермолекулярного характера перегруппировки.
Экспериментальные данные подтверждают интермолекулярный механизм перегруппировки. Так, в некоторых случаях, когда выход продукта перегруппировки был низок, он мог быть повышен добавлением в реакционную смесь азотистокислого натрия. Наоборот, при проведении перегруппировки в присутствии мочевины С нитрозированнные вещества вовсе не образуются; получаются лишь вторичные амины.
При перегруппировке нитрозогруппа может войти и в другую молекулу. Так, например, при действии на N-нитрозо-N-метиланилин спиртовым хлористым водородом в присутствии диметиланилина образуются диметиланилин и п-нитрозодиметиланилин.
Нуклеофильные перегруппировки в ароматическом ряду
Ароматическими нуклеофльными перегруппировками
называются такие перегруппировки, в ходе которых мигрирующая группа переходит из боковой цепи в ароматическое ядро как нуклеофильная частица с электронной парой, которой она была связана в боковой цепи.
Рассмотрим некоторые из них.
Перегруппировка Соммелета.
1. Общие сведения о перегруппировке.
Перегруппировка Соммелета является нуклеофильной, интермолекулярной, не стереоспецифической, протекает в ароматических системах.
При действии сильных нуклеофильных агентов на бензил триалкил аммониевые соединения происходит перегруппировка, наблюдаемая Соммелетом, в ходе которой триалкиламмониевая группа присоединяется к ортоуглеродному атому бензольного кольца при помощи α-углеродного атома одной из алкильных групп.
Четвертичные аммониевые соли, имеющие достаточно подвижный α-водородный атом, при действии сильных оснований (NaOH, LiC6
H5
) теряют этот водород в виде протона, причем образуется илид, который и подвергается электрофильной перегруппировке.
2.Механизм перегруппировки.
Перегруппировка Соммлета происходит в том случае, если в схеме R - алкилы. Ее течение таково:

Под действием основания происходит отрыв ионом гидроксила α–водородного атома в исходном соединении, в результате чего образуется карбанион. У атома углерода, непосредственно связанного с ароматическим ядром в результате отрыва водородного атома образуется пара электронов,и на этот атом углерода происходит перенос протона. Этот же атом углерода оттягивает на себя за счет заместителя триалкиламмониевой группы электронную плотность в ароматическом ядре и этим способствует перегруппировке триалкиламмониевой группы к ортоуглеродному атому бензольного ядра при помощи α–углеродного атома одной из алкильных групп. За чсет индуктивного эффекта триалкиламмониевой группы происходит присоединение именно в орто положение.
Использование заместителей в ароматическом ядре замедляют реакцию по мере возрастания электроноакцепторных (электронооттягивающих) свойств. Это понятно, т.к. электронооттягивающие заместители, оттягивая свободную электронную пару в карбанионе затрудняют миграцию триалкиламмониевой группы. Перегруппировка Соммелета является интрамолекулярной (внутримолекулярной), т.к. мигрирующая группа не способна вступать в ароматическое ядро других молекул. Попытки обнаружить продукты обмена между двумя четвертичными аммониевыми солями были безрезультатны. Увеличение полярности растворителя будет способствовать стабилизации 2 стадии реакции и тем самым улучшать перегруппировку.
Данная перегруппировка сходна с перегруппировкой Стевенса. Имеются даже доказательства, что эти перегруппировки могут идти параллельно.
Перегруппировка Бамбергера
1.Определение и общие сведения о перегрупировке.
Перегруппировка Бамбергера - это перегруппировка гидроксиламинов под действием разбавленной серной кислоты в п-аминофенолы. Перегруппировка гидроксиламинов является нуклеофильной, интермолекулярной, протекает с миграцией от атома углерода к атому азота, в ароматической системе.
2.Развитие представлений о механизме перегрупировки.
Вопрос о механизме данной перегруппировки вызвал противоречивые толкования. Бамбергер рассматривал их как «межмолекулярные процессы» с промежуточным образованием соединения одновалентного азота. Для этого он провел широкое сравнительное исследование продуктов, из арилгидроксиламинов и соответствующих арилазидов при отщеплении последними азота. Он обнаружил, что состав продуктов обоих реакций в общем один и тот же, что заставило его предположить существование одинакового промежуточного продукта, а именно соединения одновалентного азота.
Дьюар классифицировал эту перегруппировку как внутримолекулярную и электрофильную, основываясь на своей теории «π - комплекса», но эти предположения не являются действительными.
Современная точка зрения сформулирована Юкавой и она состоит в том, что перегруппировка гидроксиламинов является межмолекулярной, нуклеофильной реакцией и не имеет ничего общего с теорией «π – комплекса»
3. Механизм перегруппировки гидроксил амина.
Рассмотрим механизм данной перегруппировки:

1.На первой стадии реакции к гидроксиламину присоединяется протон и образуется оксониевый катион(1)
2.Так как вода хорошая уходящая группа, она отщепляется и образует катион (2),у которого углеродный атом в п - положении имеет частичный положительный заряд.
3.Катион (2) реагирует с молекулой нуклеофильного реагента с образованием неустойчивого соединения (3). Продукт представленный формулой (3), имеет заряд карбониевого иона, который может находиться не только п-положении, как показано на схеме, но и орто-положении, так что, используя для карбониевого иона различные валентные структуры, можно объяснить в общем случае образование орто- и пара- продуктов.
4.В соединении (3) путем перехода протона от п-углеродного атома к атому азота получается изомерный конечный продукт.
4. Побочные реакции в перегрупировке в присутствии различных нуклиафильных реагентов
.
В качестве нуклеофила может выступать не только отщепившаяся молекула воды, но и другие нуклеофильные реагенты, находящиеся в реакционной смеси. Например

Появление в конечном веществе вместо гидроксила других групп показывает, что перегруппировка является интермолекулярным процессом. Так как источником этих групп служат нуклеофильные молекулы – этиловый спирт, метиловый спирт, анион хлора, фенол, анилин – то, необходимо предположить, что в ходе перегруппировки образуется электрофильное промежуточное соединение (2), что и было доказано Бамбергером.
Вторая и третья стадия схемы отображают образование карбониевого иона, которое затем присоединяет нуклеофильный реагент в положение отличное от первоначального. Это форма мономолекулярного нуклеофильного замещения с перегруппировкой SN1. Допустимо, что при некоторых обстоятельствах обе стадии сливаются в одну, что соответствует SN2 механизму. Механизм в этом случае можно выразить так:
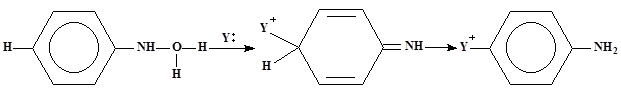
Наиболее вероятен механизм SN1
5. Варианты протекания перегрупировки в случае когда пара-положение занято.
Если пара-положение занято, то в присутствии соляной кислоты получаются хиноидные структуры:

Которые при гидролизе дают хиноны:
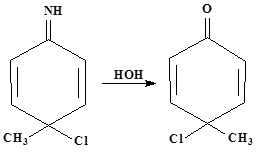
Образование соединения (4) не возможно, так как вместо водорода в пара-положении стоит метильная группа.
Перегруппировка нитроаминов.
1.Общие сведения о перегруппировке
.
Перегруппировка арилнитроаминов, протекает при их обработке водными растворами сильных кислот или соляной кислоты в сред органического растворителя и приводит к образованию главным образом о-нитроанилина (34).
Перегруппировка является нуклеофильной, может протекать как по интрамолекулярному, так и по интермолекулярному механизму, протекает с миграцией от атома азота к атому углерода.
2.Механизм перегруппировки.
Были высказаны три предположения о механизме реакции. Согласно первому предположению перегруппировка протекает по интрамолекулярному механизму- реакция 2. Согласно второму предположению по интемолекулярному механизму- реакция 1.Согласно третьей гипотезе все три реакции протекают одновременно и независимо друг от друга.

Механизм перегруппировки, ели учитывать только интермолекулярную реакцию(3), можно представить следующей схемой

Бензидиновая перегруппировка.
1.Общие сведения о пергруппировке.
Превращение гидразобензола в 4, 4- диаминобифенил, названный бензидином, под действием сильных кислот было открыто в 1845 году Н.Н. Зининым.
Это превращение впоследствии получило название бензидиновой перегруппировки. В настоящее время этим термином объединяют целую группу родственных перегруппировок, приводящих к образованию смеси орто- и пара-изомерных производных диаминодифенила.
При перегруппировке самого гидразобензола получается смесь диаминов, содержащая 70 % бензидина и 30% 2, 4- диаминобифенила.
2.Механизм перегруппировки.
Значительное влияние на направление перегруппировки гидрозобензола оказывает заместитель, они играли бы еще большую роль, если бы эти перегруппировки не были очень жесткими, в них часто происходит отщепление заместителя, препятствующие перегруппировке.

H2
CO3,
СО2
Н – легко отщепляются, хуже – Cl, CH3
– COO, аклоксильный радикал OR , а также - NRCOC3
, NR2
, алкильные радикалы не относящиеся вообще.
Вопросами о механизме бензидиновой перегруппировки стали интересоваться в начале нашего столетия. Необходимо было объяснить каким образом молекула гидробензола может «вывернуться на изнанку»,не распадаясь на части:
Одновременно в результате орто –миграции образуется 2,4 диаминодифенил:

Если в молекуле исходного гидразобензола одно или обе пара положения заняты заместителями, то образуется орто и пара семидины.

Сначала перегруппировка бензидиновая предполагала, что она протекает с разрывом связи N-Nи образованием2-х радикалов или ионов.
3.Доказательства интрамолекулярности.
В настоящее время точно установлено, что перегруппировка носит интра характер (внутренний). Доказательством послужило то, что при перегруппировки 2–метил–2'-этоксигидразобензола, содержащего радиактивный углерод С* в метильной, группе не образуется свободный радикал, О- CH3
C6
H4
-NH, т.к. иначе они могли бы реагировать друг с другом давая радиохимически активных ортотолидин.
На самом деле реакция не протекает таким образом.
При изучении перегруппировки 2,2-диметоксигидразобензола и 2,2’- диэтоксигидразобензола образуются соединения следующего строения:
Скорость бензидиновой перегруппировки пропорциональна концентрации С6
H5
–NH-NH-C6
H5
и пропорционально квадрату концентрации Н + :
V=  [C6
H5
NH –NH- C6
H 5
] * [H+
]2 [C6
H5
NH –NH- C6
H 5
] * [H+
]2
Таким образом механизм бензидиновой перегруппировки можно представить следующим образом :

После присоединения 2-х протонов к молекуле гидразобензола (I) и образование катиона (II) связь между N-Nначинает разрываться, е- пара смещается в сторону одного из атомов азота, одновременно образуется связь между пара углеродными атомами бензольных ядер (III), затем связь N-Nразрывается с одновременным образованием связи С-С и последующим удалением 2-х протонов через хиноиндную структуру, таким образом получается бензидин (V)
Обобщающая таблица по теме «Молекулярные перегруппировки»
| Перегруппировки
|
| В ароматическом ряду
|
В алифатическом ряду
|
| Нуклеофильные
|
Изомеризация
|
| Миграция от атома
|
Интермолекуляр.
|
Интрамолекул.
|
Интрамолекул.
|
| С-С
|
1.Ацилоиновая
|
1.Наметкина
2.Изомеризация
парафиновых у.в
.
|
1.Альдегидо-кетонная
|
с изомери-зацией |
| 1.Соммелета
|
3.Пинаколиновая
4.Бензильная
5.Демьянова
6.Вольфа
|
2.Ретропинако-линовая
3.Вагнера
|
Без изомери-зации
|
| N-
С
|
1.Семидиновая
2.Гидроксиламинов
|
1.Бензидиновая
2.Нитроаминов
|
1.Бекмена
|
| С
-N
|
1.Гофмана*
2.Лосеня
3.Курциуса
4.Шми
дта
|
| Электрофильные
|
| О-С
|
1.Фриса
|
| N-C
|
1.Диазоамино-
Аминоазо
2.Алкилкиланилинов
3.Нитрозаминовая
4.Ортона
|
1.Стивенса
|
| С-С
|
1.Фаворского
2.Кляйзена
|
1.Виттига
|
| С-О
|
1.Арбузова
|
| Не стереоспецифические
|
Стереоспецифические
|
.
Знак *
означает, что данные перегруппировки могут протекать как в алифатических, так и в ароматических системах.
3. Использование тестов для оценки знаний
В последнее время большой популярностью стали пользоваться в химическом образовании тесты и тестовые задания. Важным качеством тестов и тестовых заданий является их технологичность, то есть возможность с помощью тестов быстро и объективно выявить знания, оценить их качество, а также выявить пробелы и недостатки.
Открытая форма
тестового задания подразумевает, что, прочитав вопрос, экзаменуемый должен дать ответ, набрав его на клавиатуре.
Закрытая форма
подразумевает, что экзаменуемый выбирает правильный ответ из предложенного списка.
Форма на упорядочение
подразумевает, что предложенные задания экзаменуемый должен расставить в определенном порядке, т.е. упорядочить
Форма на соответствие
подразумевает, что экзаменуемый понятиям из одного списка должен найти соответствующие понятия из другого списка. Например, в одном списке находятся изображения химических формул и их надо сопоставить с названиями, которые находятся в другом списке
Обсуждение результатов
Образовательная ситуация сегодня определяется не только обсуждением и разработкой вечных педагогических проблем, но и постановкой новых задач, характерных именно для нашего времени. Одной из таких задач является создание новых учебников, включая и электронные, содержащие современный фактический материал, базирующийся на возможностях мультимедиа, новых методических и дидактических подходах при изучении школьного курса химии. [1]
В связи с этим нами была проведена определенная работа, целями которой являлись:
- разработать теоретическую, методическую и дидактическую поддержки к теме «Молекулярные перегруппировки», в соответствии с программой спецкурса по теоретическим основам органической химии для студентов четвертого курса химического факультета; для элективного курса по органической химии с целью подготовки школьников, входящих в сборную команду КБР, участвующих во всероссийских и международных олимпиадах; для подготовки молодых учителей к педагогической практике; для учителей, с целью повышения профессиональной подготовки.
- создать обучающе- контролирующую программу по теме «Молекулярные перегруппировки» на основе конструктора тестов представляющего собой базу данных специальной структуры рекомендованной Министерством образования РФ для внедрения в образовательный процесс.
Реализация первой цели базировалось на принципах уточнения и замены устаревших понятий, методических и дидактических подходов при изучении данной темы, разумной формализации и управления учебного материала. Это способствовало лучшему усвоению учебного материала.
Отбор учебного материала проводился путем классификации по степени сложности и логической взаимосвязи между отдельными типами перегруппировок.
По нашему мнению рассмотрение темы "Молекулярные перегруппировки " должно идти согласно следующему плану:
1. Определение молекулярных перегруппировок.
2. Классификация перегруппировок согласно:
-насыщенности систем;
-механизма перегруппировки;
-изменения углеродного скелета;
-переходу от одного атома к другому;
-стереоспецифичности
3. Рассмотрение каждой из 32 перегруппировок в соответствии со всеми этими особенностями.
4. Применение перегруппировок.
Этот план нашел свое отражение в созданной нами теоретической поддержке темы. При ее создании были проработаны различные учебники по органической химии.
Анализ издаваемой в последние годы учебной показал, что иногда в них отсутствует единая энциклопедическая химическая терминология по теме «Молекулярные перегруппировки», нет однозначного определения понятию молекулярные перегруппировки.
Проведя анализ учебников для высших школ (Кери Р., Р. Сантберг – «Углубленный курс органической химии»; О. А. Реутов «Теоретические основы органической химии»; К. Ингольд «Теоретические основы органической химии»; А. С. Днепровский, Т. И. Темникова «Теоретические основы органической химии»; Сайкс П. «Механизмы реакции в органической химии»), мы сделали вывод, что наиболее полным, современным и приемлемым будет определение перегруппировок, которое дается в учебнике [35].
В качестве дидактического материала нами была составлена обобщающая таблица (смотри экспериментальную часть), в которой в кратком, наглядном, удобном для восприятия и компактном виде представлена классификация перегруппировок по различным признакам.
Отметим, что все материалы представленные в данной работе, включая таблицу, являются открытыми системами, которые могут дополняться с учетом изменения объема и содержания изучаемой дисциплины, а также с учетом творческого замысла преподавателя.
Данный материал в достаточной степени формализован; это дает возможность использовать его при создании обучающе-контролирующих программ для ПЭВМ, а также проводить тестовый контроль и самоконтроль знаний.
Весь материал теоретической поддержки занесен на магнитный диск и представляет собой обучающую часть разработанной нами программы.
Разработанные в дипломной работе тестовые задания были включены в контролирующую часть программы (Конструктор тестов), созданную на базе адаптивной среды тестирования (АСТ). АСТ в настоящее время широко внедряется Центром тестирования при Федеральном агенстве образования РФ при создании тестовых заданий для ЕГЭ.
Конструктор тестов предназначен для создания и наполнения «накопителя тестовых заданий» и формирования семейства тестов на его основе.
С помощью мастера тестовых заданий, встроенного в Конструктор тестов, разработанные нами тестовые задания были занесены в «накопитель тестовых заданий». «Накопитель тестовых заданий» представляет собой базу данных специальной структуры, используемой для хранения информации о форме и содержании тестовых заданий, параметрах генерации тестов и способов оценивания результатов тестирования. Встроенный в мастер тестовых заданий генератор тестов определяет значения параметров, на основе которых динамически, в процессе тестирования, формируются тесты из тестовых заданий, содержащихся в НТЗ.
Контролирующая часть программы состоит из 153 тестовых заданий.
Первые 41 тестов составлены в закрытой форме, которая подразумевает, что экзаменуемый выбирает правильный ответ из предложенного списка. Такая форма ответа позволяет учащемуся однозначно понять составителя тестов и сэкономить время на ответ.
В тестах 42- 144 используется открытая форма тестового задания, которая подразумевает, что, прочитав вопрос, экзаменуемый должен дать ответ, набрав его на клавиатуре. Этот тест дает однозначный ответ на знание основных определений.
В тестах 145- 153 использован принцип тестов сличения. Здесь задания представлены в двух столбцах, информационно тесно связанных между собой. Они позволяют проверить ассоциативные знания о взаимосвязи между формулами и названиями соединений.
Данная программа построена таким образом, что учитель может быстро провести проверку и дообучение по данной теме. При этом обучаемый с помощью ПЭВМ также может реализовать самоконтроль своих знаний по теме. В тоже время, представленный информационный материал позволяет обучаемому быстро проверить себя, выяснить основные ошибки, а также получить дополнительную информацию и повторить весь материал.
Программа занесена на магнитный диск, что позволяет ее тиражировать.
Программа также предусматривает получение распечаток как контролирующих, так и информационных кадров. Эти распечатки могут быть использованы в качестве тестовых заданий в сельских школах, не оснащенных компьютерными классами.
Апробирование нашего программного продукта мы проводили среди студентов 4 курса химического факультета КБГУ специализации .
"Органическая химия".
В контрольной группе (студенты химического факультета ) – 23 человека – занятия проводились по общепринятой схеме, согласно традиционному методу обучения.
В экспериментальной группе – 19 человек – тему «Молекулярные перегруппировки» изучали по предложенной нами методике.
Оценка усвоения пройденного материала учащимися контрольной и экспериментальной групп проводилась методом тестирования с использованием адаптивной среды тестирования АСТ, широко внедряемой Министерством образования РФ. Результаты тестирования приведены на диаграмме 1.
Как видно из диаграммы 1, средний балл в контрольной группе составляет 3,2, тогда как в экспериментальной группе эта цифра несколько выше – 3,7. Распределение баллов говорит об усвоении знаний: большинство учеников экспериментального класса усвоили тему на «хорошо» и «отлично».
Проведенный эксперимент свидетельствует о преимуществах и более высоких результатах, который дает использование предложенной нами методики.
 рис.1 Результаты тестирования в контрольной (А) экспериментальной (Б) группах. рис.1 Результаты тестирования в контрольной (А) экспериментальной (Б) группах.
Выводы
1. На основании анализа учебной литературы для высших учебных заведений отобран материал для теоретической поддержки темы "Молекулярные перегруппировки".
2. Разработана методическая и дидактическая поддержки к теме ". Молекулярные перегруппировки".
3. Проведена формализация и уплотнение учебного материала по теме " Молекулярные перегруппировки".
4. Составлена таблица классификация молекулярных перегруппировок
6. Составлен фрагмент обучающе-контролирующей программы " Молекулярные перегруппировки"..
7. С психолого-педагогической точки зрения было выявлено:
- эффективность обучения при использовании таблиц, а также обучающе-контролирующих программ на их основе выше, чем при традиционном бучении;
- знания, полученные на таких уроках, прочнее тех, которые получены при традиционном методе обучения.
8. Разработанные нами материал теоретической поддержки, а также фрагмент обучающе-контролирующей программы были опробованы при изучении курса органической химии со студентами 4-го курса химического факультета КБГУ специализации "Органическая химия" и показали эффективность их использования.
Литература
1. Национальная доктрина образования.
2. Пак М.С.,
Алгоритмика при изучении химии. М.: Гуманит. Изд. центр Владос, 2000. с.6, 24.
3.Цветков Л.А.,Преподавание органической химии в средней школе: Пособие для учителя. – М.: Просвещение, 1988
4. Несмеянов А. Н.,Начало органической химии в 2-х книгах. М., 1974.
5. Философский энциклопедический словарь. М.: ИНФРА ., М, 1998.
6. Зайцев О.С. ,
Методика обучения химии. М.: Гуманитарный издательский центр ВЛАДОС, 1999.
7. Льюис Майкл. Химия: Школьный курс в 100 таблицах.М.: Мир, 1987.
8. Кирюшкин Д.М., Полосин В.С. ∕∕
Методика обучения химии. Учебное пособие для студентов пед. ин-тов. – М.: Просвещение, 1970.
9. Кузнецова Н.Э. ,
Формирование системных понятий в обучении химии. М.: Просвещение, 1989.
10. Чернобельская Г.М. ,
Основы методики обучения химии. М.: Просвещение, 1987.
11. Щукина Г.И. ,
Активизация познавательной деятельности учащихся в учебном процессе. М.: Просвещение, 1980.
12. Выгодский Л.С. ,
Избранные психологические исследования. М.: Издательство АПН РСФСР, 1966
13. Применение электронно-дидактических средств в обучении химии // Химия в школе. – 2004г.-№5.-с.37.
14. Компьютерная технология обучения химии: достоинства и недостатки // Химия в школе. – 2001.-№6.-с.35.
15. Применение электронно-дидактических средств в обучении химии // Химия в школе. – 2004г.-№5.-с.37.
16.Егоров А.Ф.Основные направления информации университета./Информационные технологии в учебном процессе университета. Сборник научных трудов. РХТУ им. Д.И.Менделеева.-М., 2000, с. 5.
17. Выгодский Л.С. ,
Избранные психологические исследования. М.: Издательство АПН РСФСР, 1966
18. LiebigJ. , Lieb. Ann.,v. 25, № 27, 1963.
19. Зелинский Н.Д., Шуйкин Н.И.// ЖРХО,V. 61, № 2245, 1988
20.. Демьянов Н., Лушников М.// ЖРХО, V. 35, № 26, 1976
21. Демьянов Н., Дояренко М.// Ber.,V. 41 , № 43, 1954
22. Ingold G. //Ann. Repts on Progress Chem. V. 25, № 134, 1969
23.. Бутлеров А. М.// ЖРХО, V. 6, № 158, 1958
24. Марковников В. В. //ЖРФХО, V. 25, № 1028. 1967
25. Наметкин С. С.. Брюсова Л.Я.// Lieb. Ann. V. 459, № 144, 1977: Наметкин С. С., Шаврыгина А. И.// ЖОХ, V. 4, № 847,1954
26. Вагнер Е.// ЖРФХО, V. 31, № 680, 1989
27. HofmannA. //Ber. , V. 15, № 407, 1935
28. Кижнер Н. М.// ЖРХО,V. 25, № 20,1988
29. Beeck O. , Otwos J. W. , Stevenson D. P. //Chem. Phys. V. 16, № 255, 1948
30. Хюккель В.// Теоретические основы органической химии, ИЛ, т. 2, М., 1955
31. Данилов С.Н. //Механизм молекулярных перегруппировок. Сб. «Проблемы механизма органической реакции», изд. АН УССР, Киев, 1953, стр. 247
32. Сб. «Органические реакции» под ред. Адамса, ИЛ, т. 1, 1948, стр. 455
33. Сб. «Органические реакции» под ред. Адамса, ИЛ, т. 2, 1950, стр. 7
34. Химия нитро- и нитрозогрупп, пер. с англ., т. 1, М., 1972
35. Реутов В. И. , Механизмы реакции в органической химии, М. 1966
Приложение
Тестовые контролирующие задания по теме «Молекулярные перегруппировки»
Раздел 1.
Пергруппировкам соответствуют номера из таблицы:
Перегруп-
пировки
|
Нуклеоф.
E
|
Электроф.
Nu
|
Интер-молек. |
Интра-молек. |
Стерео-спец. |
С изоме-ризацией |
С-С |
С-О |
О-С |
N-C |
C-N |
В алифа-тическом
ряду
|
1 |
3 |
5 |
7 |
9 |
11 |
13 |
15 |
17 |
19 |
21 |
| В арома-тическом ряду |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
22 |
1.Ацилоиновой перегруппировке соответствуют номера из таблицы:
1)2,8,14,12,10+
2)1,7,13,11,9
3)2,8,12,14
2.Перегруппировке Наметкина соотв. номера из таблицы:
1)7,1,11,13+
2)8,2,12,14
3)7,3,11
3.Перегруппировке изомеризации парафиновых углеводородов соответствуют номера из таблицы:
1)1,7,11,13+
2)2,8,11,18
3)1,6,11,21
4.Альдегидо-кетонной перегруппировке соотв. номера из таблицы:
1)1,7,9,11,13+
2)2,8,11,18
3)1,6,11,17
Раздел 2.(два правильных ответа)
1.К нуклеофильным интрамолекулярным перегруппировкам относятся:
1)Соммелета +
2)Нитроаминов+
3)Семидиновая
4)Гидроксиламинов
2.
1)Алкиланилиновая+
2)Нитрозаминовая+
3)Арбузова
4)Виттига
3.
1)Шмидта+
2)Ретропинаколиновая+
3)Гидроксиламинов
4)Алкиланилиновая
Раздел 3(два правильных ответа)
1.К электрофильным интермолекулярным перегруппировкам относятся:
1)Диазоамино-аминоазо+
2)Ортона+
3)Семидиновая
4)Шмидта
2.
1)Алкиланилиновая+
2)Нитрозаминовая+
3)Арбузова
4)Виттига
3.
1)Фриса+
2)Алкиланилиновая+
3)Ретропинаколиновая
4)Бекмана
Раздел 4(один правильный ответ)
1. К нуклеофильным перегруппировкам, сопровождающимся изомеризацией относятся:
1)Наметкина+
2)Курциуса
3)Шмидта
4)Бекмана
2.
1)Альдегидо-кетонная+
2)Вагнера
3)Пинаколиновая
4)Вольфа
3.
1)Изомеризация парафиновых углеводородов+
2)Гофмана
3)Демьянова
4)Бекмана
Раздел 5
Установить соответствие между названиями перегруппировок и их механизмами:
1.
1)пинаколиновая

2)ретропинаколиновая

3)альдегидо-кетонная

2.
1)ацилоиновая

2)Альдегидо-кетонная

3)бензильная

Раздел 6. Впишите правильный ответ.
1. Катализируемая минеральными кислотами или кислотами Льюиса перегруппировка 1,2-диолов в кетоны называется ……
Ответ: пинаколиновой
1. Перегруппировка, протекающая при действии на вторичные, третичные, двутретичные спирты минеральных кислот, их хлорангидридов или кислот Льюиса, называется …… перегруппировкой
Ответ: пинаколиновой
2. Перегруппировка, протекающая с образованием двух соседних третичных атомов углерода из одного четвертичного и одного вторичного называется ……
Ответ: ретропинаколиновой
2. Перегруппировка пинена в хлористый борнил относится к …….. перегруппировкам.
Ответ: ретропинаколиновым
2. Перегруппировка 3,3-диметилбутанола-2 в 2,3-диметилбутен-2 относится к …….. перегруппировкам.
Ответ: ретропинаколиновой
3. Превращение альдегида в изомерный кетон под действием концентрированной серной кислоты в спиртовом растворе называется …….. перегруппировкой
Ответ: альдегидо-кетонной
3. разбавленных минеральных к-т (~100°С), кислот Льюиса – соли Hg+2
(~100°С); ZnCl2
(~350°С); PX5
(в бензоле ~20°С), AlCl3
(~0°С).
Ответ: альдегидо-кетонной
|