Кафедра: «Органическая химия»
Реферат на тему:
«Металлорганические соединения»
Выполнил: Авдеев В. Ю. II-ИТ-3
Проверил: Моисеев И. К.
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
I
ГРУППЫ
Общая формула органических соединений щелочных металлов R
—Ме
Алкильные соединения натрия, калия, рубидия и цезия
— бесцветные кристаллические вещества, нерастворимые в органических растворителях и разлагающиеся без плавления при нагревании; на воздухе самовоспламеняются, дают растворы в диметилцинке, проводят электрический ток. Из известных металлорганических соединений они наиболее активны, взаимодействуют со всеми органическими соединениями, за исключением парафиновых углеводородов.
Литийорганические соединения растворяются в органических растворителях и образуют растворы, не проводящие электрический ток. Они перегоняются или сублимируются при нагревании, на воздухе самовоспламеняются.
Литийалкилы могут быть приготовлены в эфире, бензоле или циклогексане тем же способом, что и реактивы Гриньяра:
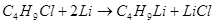
В этой реакции лучше применять хлористые алкилы, так как бромиды и особенно йодиды взаимодействуют с уже образовавшимся литийорганическим соединением по реакции Вюрца.
Литийорганические соединения могут быть также получены из бутиллития обменной реакцией:

Формула R — Li не соответствует истинному, значительно более сложному строению этих соединении. В обычных растворителях они существуют в виде тетрамеров или гексамеров. Активность их падает с увеличением ассоциации. Поэтому электронодонорные растворители увеличивают их активность.
Кроме литийалкилов известны и другие органические полилитиевые соединения, например , , . .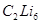 Это твердые хрупкие вещества. При действии на них воды образуются углеводороды.
Это твердые хрупкие вещества. При действии на них воды образуются углеводороды.
Литийалкилы часто применяются в органическом синтезе вместо реактивовГриньяра благодаря большей реакционноспособности.
НАТРИИОРГАНИЧЕСКИЕ
СОЕДИНЕНИЯ -
органические соединения, содержащие связь  . .
Название натрийорганические соединения строится из названия органического радикала и слова «натрий» — этилнатрий, бензилнатрий. Натрийорганические соединения — твердые ассоциированные вещества, содержащие сильно поляризованные связи 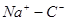 ;нерастворимы в инертных растворителях, при нагревании разлагаются не плавясь, на воздухе самовоспламеняются. ;нерастворимы в инертных растворителях, при нагревании разлагаются не плавясь, на воздухе самовоспламеняются.
Своеобразным типом натрийорганические соединения. являются ионнопостроенные продукты присоединения натрия к ароматическим углеводородам, образующиеся в среде некоторых простых эфиров (лучшая среда — диметоксиэтан). Сильно крашенные растворы этих соединений электропроводны и парамагнитны в них присутствуют солъватированные растворителем катионы металла и анион-радикалы углеводорода, например  . .
Олефины, по меньшей мере дважды арилированные при двойной связи, присоединяют натрий по одному из двух типов:
1)
(«нормальное» присоединение)
2)
(«димеризующее» присоединение, если один из атомов двойной связи неарилирован).
По химическими свойствам натрийорганические соединения. весьма сходны с литий органическими соединениями,
однако значительно превосходят их по активности. Все работы с натрийорганические соединения следует проводить в атмосфере инертного газа (азот, агон). Соединениями, содержащими подвижный атом водорода, натрийорганические соединения. немедленно разлагаются; двуокисью углерода — карбоксилируются до солей соответствующих карбоновых кислот. Вследствие исключительной реакционной способности натрийорганические соединения карбоксилирование часто осложняется побочными процессами.
Важнейшими способами получения натрийорганических соединений являются:
а) Нагревание натрия с ртутьорганическими соединениями (обычно в среде петролейного эфира); это практически единственный способ синтеза индивидуальных натрийорганических соединений: 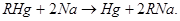
б) В ряде случаев удается получать натрийорганические соединения. из галогенарилов (алкилов) и Na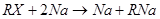 (X, как правило, С1); синтез, особенно в жирном ряду, осложняется реакцией Вюрца. (X, как правило, С1); синтез, особенно в жирном ряду, осложняется реакцией Вюрца.
в) Исключительное значение для синтеза натрийорганических соединений. имеет металлирование,
приводящее к замене радикала R(по Шорыгину): RH + R'Na — R'H + RNa. Исходя из относительно доступных натрийорганических соединених.
Одним из способов получения натрийорганических соединений является расщепление простых эфиров (гл. обр. ароматических и жирноароматических) натрием (Шорыгин):

Расщепление проводят нагреванием эфиров с натрием или действием Na в жидком  . .
д) В ряде случаев, когда в радикале R имеются особо благоприятные условия для рассредоточения избыточной электронной плотности, кроме методов «б» и «в», пригодно также непосредственное замещение водорода натрием (обычно в жидком аммиаке), напр.: (С6
Н5
)3
СН + Na(NaNH2
) (С6
H5
)3
СNa + 1
/2H2
(NH3
). Получаемые этим методом натрийорганические соединения, в отличие от обычных натрийалкилов (-арилов), имеют глубокую окраску, растворимы в эфире, более стабильны и менее реакционноспособны. Типичным соединением этого типа является бензилнатрий. К этой же группе реакций примыкают также образование циклопентадиенилнатрия, в котором устойчивый анион циклопентадиенилия обладает ароматическими свойствами: С6
Н5
+ Na (С6
H5
)3
СNa + 1
/2H2
(NH3
). Получаемые этим методом натрийорганические соединения, в отличие от обычных натрийалкилов (-арилов), имеют глубокую окраску, растворимы в эфире, более стабильны и менее реакционноспособны. Типичным соединением этого типа является бензилнатрий. К этой же группе реакций примыкают также образование циклопентадиенилнатрия, в котором устойчивый анион циклопентадиенилия обладает ароматическими свойствами: С6
Н5
+ Na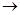 С6
Н5
Na + С6
Н5
Na +  и образование ацетиленидов. и образование ацетиленидов.
Реакции натрийорганических соединений с карбонильными соединениями, эфирами, неорганическими соединениями и т. п. аналогичны соответствующим реакциям литийорганических соединений, но проходят более энергично. Натрийорганические соединения применяют в качестве алкилирующих агентов (обычно в тех случаях, когда реакционная способность реактивов Гриньяра и литийалкилов оказывается недостаточной).
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ ЭЛЕМЕНТОВ
II
ГРУППЫ
Органические производные кальция, стронция и бария изучены сравнительно мало. Большое значение имеют только соединения магния.
Магнийорганические соединения
При приготовлении магнийорганических соединений (реактив Гриньяра) необходима абсолютная сухость всех материалов. Рекомендуется проводить реакции в атмосфере азота.
Очень важную роль играет растворитель. В смеси йодистого этила магния при комнатной температуре реакция не идет *. Однако в присутствии простых эфиров галогеналкилы и магний реагируют легко с образованием эфиратов: RMgX • 2(С2Н5,)2О.
Эфираты хорошо растворимы, и это дает возможность галогеналкилам проникать к поверхности металла, которая в иных условиях обволакивается металлорганическим соединением.
Для приготовления реагентов Гриньяра могут быть также использованны другие донорные растворители, особенно тетрагидрофурап, а также третичные амины.
Образованию магнийорганических соединении при взаимодействии магния с галогеналкилами предшествует возникновение ионном пары:
Реакции с хлористыми алкилами обычно трудно инициируются, но дают лучшие выходы. Иодиды реагируют наиболее легко, но дают наименьшие выходы. Чаще всего используются бромиды.
Первичные галогеналкилы дают лучшие выходы, чем вторичные, а последние, в свою очередь, лучшие выходы, чем третичные.
В растворах гриньяровских реагентов обычно имеет место равновесие

В синтезах, осуществляемых с реактивами Гриньяра, участвуют как простые, так и смешанные магнийорганические соединения.
Разработаны способы проведения магнийорганических синтезов и без применения растворителей.
 Синтез спиртов осуществляется действием металлорганических, в частности магнийорганических, соединений на альдегиды, кетоны и сложные эфиры. Впервые такой синтез с применением цинкорганических соединений был осуществлен А. М. Бутлеровым и его учениками А. М. Зайцевым и Е. Е. Вагнером. Синтез спиртов с помощью магнийорганических соединений, разработанный В. Гриньяром, проходит по следующей общей схеме. В альдегидах, кетонах и сложных эфирах имеется карбонильная группа, в которой электронное облако смещено к атому кислорода, что условно изображают так: Синтез спиртов осуществляется действием металлорганических, в частности магнийорганических, соединений на альдегиды, кетоны и сложные эфиры. Впервые такой синтез с применением цинкорганических соединений был осуществлен А. М. Бутлеровым и его учениками А. М. Зайцевым и Е. Е. Вагнером. Синтез спиртов с помощью магнийорганических соединений, разработанный В. Гриньяром, проходит по следующей общей схеме. В альдегидах, кетонах и сложных эфирах имеется карбонильная группа, в которой электронное облако смещено к атому кислорода, что условно изображают так:
Благодаря этому смещению у атома углерода возникает некоторый положительный заряд, а у атома кислорода — дробный отрицательный заряд. В магнийгалогеналкиле R — MgBr остаток R ведет себя как нуклеофильная частица, легко присоединяющаяся к углеродному атому карбонильной группы. Реакция проходит по схеме
Полученное соединение (магнийбромалкоголят) легко гидролизуется с образованием соответствующего спирта:

Синтезы по этой схеме с муравьиным альдегидом приводят к первичным спиртам:
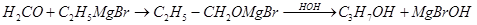
Со всеми другими альдегидами образуются вторичные спирты:

Взаимодействием магнийгалогеналкилов с кетонами получают третичные спирты:

Взаимодействие магнийгалогеналкилов со сложными эфирами (кроме эфиров муравьиной кислоты) также приводит к третичным спиртам, причем с большим выходом, чем из кетонов. Сложные эфиры муравьиной кислоты в этих условиях образуют вторичные спирты. Реакция идет в две стадии: сначала, как обычно, происходит присоединение магнийорганического соединения по группе >С = О, а затем в реакцию вступает новая молекула магнийгалогеналкила. При этом алкил последнего становится на место эфирной группы — OR:

ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ ЭЛЕМЕНТОВ
III
ГРУППЫ
Борорганические соединения
известны полные в которых все валентности бора замещены органическими радикалами, и неполные, в которых одна или две валентности замещены галогеном, алкоксигруппой и другими. Алифатические триалкилборины R3
B — бесцветные жидкости, крайне чувствительные к кислороду (триметилбор — газ при комнатной температурере); низшие члены ряда самовоспламеняются на воздухе. Ароматические борорганические соединения известны и алкилборные кислоты — твердые вещества. В таблице приведены физические свойства важнейших борорганических соединений.
| Формула |
Т. пл., °С |
Т. кип., °С* |
Плотность,г/см?
|
| (СНз)зВ |
-153 |
-21,8 |
0,625 (-100°) |
| (С2
Н5
)3
В |
—92,9 |
95 |
0,6961 (23°) |
| (С8
Н5
)3
В |
— |
53 (18 мм
)
|
0,7745 (20°) |
| (С3
Н7
)3
В |
-65.5 |
164,5 |
0,7204 (25°) |
(изо-С4
Н9
) В В |
— |
188 |
0,7380 (25°) |
 |
142 |
203° (15 лип) |
— |
| (а-С10
Н7
)3
В |
203 |
— |
— |
| С2
Н5
ВСl3
|
50,8 |
— |
  |
40 (су б л.) |
— |
— |
 |
216 |
— |
— |
 |
31,5 |
129 |
— |
 * Т. шт. при 760 мм
рт.ст.,
кроме особо оговоренных. * Т. шт. при 760 мм
рт.ст.,
кроме особо оговоренных.
 Триалкилборины с сильными электронодонорными соединениями образуют комплексные соединения различной устойчивости. С органическими соединениями Li образуются прочные комплексные ионы типа Триалкилборины с сильными электронодонорными соединениями образуют комплексные соединения различной устойчивости. С органическими соединениями Li образуются прочные комплексные ионы типа 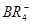 Окисление R3
B приводит к эфирам диалкил- и алкил-борных кислот; при действии брома или хлора органические радикалы замещаются галогеном. Реакции, обратная диспропорционированию: Окисление R3
B приводит к эфирам диалкил- и алкил-борных кислот; при действии брома или хлора органические радикалы замещаются галогеном. Реакции, обратная диспропорционированию:  , идет только при нагревании; напротив, для , идет только при нагревании; напротив, для  чрезвычайно легко (-60°) происходит диспропорционирование. RBC1 чрезвычайно легко (-60°) происходит диспропорционирование. RBC1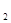 , могут быть получены также по реакции , могут быть получены также по реакции  .При нагревании R3
B способны обмениваться радикалами с алкильными производными др. элементов. Гидрирование R3
B может служить способом получения гидридов бора и, в частности, диборана: .При нагревании R3
B способны обмениваться радикалами с алкильными производными др. элементов. Гидрирование R3
B может служить способом получения гидридов бора и, в частности, диборана: . В2
Н6
с R3
B; образует равновесные смеси алкилдиборанов Rn
B2
H6-
n
(п=
1-4), состав которых определяется соотношением исходных веществ. Алкилдибораны легко диспропорционируются. Алкилборные кислоты слабее Н3
ВО3
, арилборные — несколько сильнее. Получают их обычно окислением R3
B в RB(OR)2
с последующим гидролизом последних, неполным алкилированием (RO)3
B и (ROBO)3
, гидролизом RBС12
. Алкил- и арилборные кислоты легко дают при нагревании соответствующие циклические бороксины (RBO)3
; с HgCl2
или HgO образуются ртутьорганические соединения. Диалкилборные кислоты нейтральны по лакмусу. Пиролиз (200°) комплексов диборана и алкилдиборанов с аммиаком (или аминами) приводит к «неорганическому бензолу» — бора золу: . В2
Н6
с R3
B; образует равновесные смеси алкилдиборанов Rn
B2
H6-
n
(п=
1-4), состав которых определяется соотношением исходных веществ. Алкилдибораны легко диспропорционируются. Алкилборные кислоты слабее Н3
ВО3
, арилборные — несколько сильнее. Получают их обычно окислением R3
B в RB(OR)2
с последующим гидролизом последних, неполным алкилированием (RO)3
B и (ROBO)3
, гидролизом RBС12
. Алкил- и арилборные кислоты легко дают при нагревании соответствующие циклические бороксины (RBO)3
; с HgCl2
или HgO образуются ртутьорганические соединения. Диалкилборные кислоты нейтральны по лакмусу. Пиролиз (200°) комплексов диборана и алкилдиборанов с аммиаком (или аминами) приводит к «неорганическому бензолу» — бора золу:
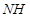   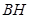  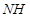
И его алкильным производным. Борорганические соединения
известны могут быть получены несколькими способами: 1)Алкилированием галогенидов бора, эфиров борной и метаборной кислот, магний-, цинк-, алюминийорганическими соединениями; конечными продуктами являются триалкилборины R3
В (бортриалкилы), однако во многих случаях реакция может быть остановлена на стадии образования алкилгалогеноборинов или соответственно эфиров алкилборных кислот.
2) Взаимодействием ртутьорганических соединений с ВНа13
; реакции используется обычно для получения ароматических производных типа АгВНа12
и Аг2
ВНа1. R3
B получают также из алюминийтриалкилов R3
Al и алкилбороксинов (R3
BO)3
.
3)Присоединением диборана к олефинам с образованием R3
В; олефины с внутренней двойной связью дают те же продукты, что и а-олефины.В2
Н6
замещает водород в бензоле (100°) с образованием (С6
Н5
)3
В.
4)Взаимодействием бензола с ВС13
с образованием 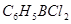 последний и последний и 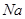 с хлорбензолом дает с хлорбензолом дает 
Борорганические соединения
известны применяют главным образом для получения гидридов бора, служащих сырьем для производства высококалорийных топлив для реактивных двигателей; R3
B и некоторые другие Борорганические соединения
применяются в качестве катализаторов полимеризации ненасыщенных соединений; комплексные соединения типа NaB(С6
H5
)4
используются в аналитической химии для осаждения ионов К, Рb, Cs, NH4
.
Соединения алюминия
.
Алюминийалкилы более активно реагируют с водой, кислородом и т. д., органические соединения других элементов третьей группы. Химические свойства соединений элементо II группы. Алкилзамещенные гидроксида алюминия не существуют. Триалкильные производные алюминия могут быть получены различными способами:
1)обработкой алюминий-магниевого сплава алкилгалогенидами:

2)непосредственным взаимодействием алюминия с водородом и олефином (К. Циглер):

Алюминийалкилы - вязкие бесцветные жидкости; низшие члены гомологического ряда ассоциированы (димеры).
Алюминийалкилы быстро окисляются на воздухе, бурно реагируют с водой, часто с воспламенением, многие из них самопроизвольно загораются. Наиболее новое и важное применение алюминийтриалкилов — использование их в качестве катализаторов при полимеризации олефинов.
Триэтилалюминий
реагирует с этиленом при 100—120 С с образованием смеси различных соединений алюминия, дающих при гидролизе смесь н-углеводородов с четным числом атомов углерода в молекуле: С с образованием смеси различных соединений алюминия, дающих при гидролизе смесь н-углеводородов с четным числом атомов углерода в молекуле:
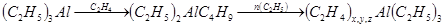
Трипропилалюминий
с этиленом диет углеводороды с нечетным числом углеродных атомов.
Этим способом получают полиэтилен с молекулярной массой 5000 — 3000000. Свойства полиэтилена, полученного при низком давлении, отличаются от свойств полиэтилена, полученного при высоком давлении. При более высоких температурах (200 С и выше) триалкилалюминий реагирует с олефинами иначе. В зависимости от условии реакции образуются димеры или полимеры, триалкилалюминий регенерируется, играя роль катализатора: С и выше) триалкилалюминий реагирует с олефинами иначе. В зависимости от условии реакции образуются димеры или полимеры, триалкилалюминий регенерируется, играя роль катализатора:
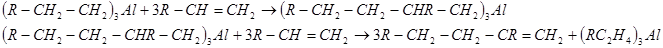 Таким путем из 1-бутена получают 2-этил-1-гексен — исходный продукт в синтезе n-ксилола. Таким путем из 1-бутена получают 2-этил-1-гексен — исходный продукт в синтезе n-ксилола.
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ ЭЛЕМЕНТОВ
IV
ГРУППЫ
Органические соединения кремния, германия, олова и свинца являются аналогами соединений углерода. Однако, за исключением тетраалкильных соединений, в которых элемент окружен углеводородными радикалами, сходство с чисто углеродными соединениями только формальное. В отличие от металлорганических соединений первых трех групп соединения IV группы электрононасыщены. Они не реагируют с кетонами и не присоединяют галогены или кислород. Кремнийалкилы достаточно стойки, и при их хлорировании замещение при атомах углерода происходит без разрыва кремнийуглеродных связей. Атомы элементов это группы могут соединяться между собой, образуя цепи небольшой длины. Четырехвалентные атомы имеют тетраэдрическое положение валентностей. При наличии в соединениях асимметричных атомов кремния, германия и олова они могут быть разделены на оптические формы.
Кремнийорганические соединения.
Кремний расположен в периодической системе непосредственно под углеродом. Поэтому можно было бы ожидать существования кремниевых аналогов всех соединений углерода. Однако, поскольку валентные электроны кремния находятся дальше от ядра и связаны с ним менее прочно, в атоме углерода, кремний является более электронодонорным, или «металлическим», элементом по сравнению с углеродом. Поэтому кремний не образует многих типов соединений, известных для углерода. Свойства кремниевых аналогов заметно отличаются от свойств соединений углерода. Энергия связи Si—Si меньше, чем связи С—С, на 125,6 кДж/моль, а энергия связи Si—О выше энергии связи С—О на 92,1 кДж/моль. Атом кремния имеет свободные d-орбитали и может их использовать образования связи. Если в соседстве с атомом кремния находится атом заполненными р-орбиталями, то возможно перекрывание их с d-орбиталями кремния (
d
-, р
- взаимодействие):

Благодаря такому взаимодействию укорачивается связь Si—X и уменьшается
полярность. Соединения с кратными связями типа Si = Si, Si = C,Si = O, Si = S в обычных условиях не существуют.
Номенклатура
. Названия кремнийорганических соединений несколько отличаются от названий других элементорганических соединений и чисто углеродистых соединений.
1.Соединения кремния общей формулы 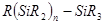 , где R — органические радикалы, водород, алкокси-
или арилокси-
группы, называются как производные силана
(SiH4
): , где R — органические радикалы, водород, алкокси-
или арилокси-
группы, называются как производные силана
(SiH4
):
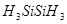 дисилан дисилан
 тетраметилсилан тетраметилсилан
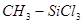 метилдихлорсилан метилдихлорсилан
 диметилдихлорсилан диметилдихлорсилан
 диметилдиэтоксисилан диметилдиэтоксисилан
2.Кремнийорганические соединения, содержащие группы Si — О, называются силоксанами:
 гексаметилдисилоксан гексаметилдисилоксан
 октаметилтрисилоксан октаметилтрисилоксан
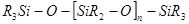 полисилоксан полисилоксан
3.Кремнмйорганические соединения, содержащие одну или несколько гидроксильных групп, связанных с атомом кремния, называют как производные силана, добавляя суффиксы -ил, -диол, -триол:
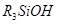 триалкилсиланол триалкилсиланол
 диалкилсиландиол диалкилсиландиол
 алкилсилантриол алкилсилантриол
4.Органические соединения кремния общей формулы  называют как производные силазана: называют как производные силазана:
 триметилсилазан триметилсилазан
 гексаметилдисилазан
гексаметилдисилазан
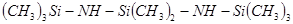 отктаметилтрисилазан отктаметилтрисилазан
5.Когда органической части молекулы имеется реакционная группа, не связанная с атомами кремния, соединения называют как соответствующие замещенные органические соединения, например 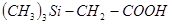  -триметилсилилуксусная кислота. -триметилсилилуксусная кислота.
Способы получения.
Для получения кремнийорганических соединений в качестве исходного вещества используются кремний (или его соединения с металлами) и четыреххлористый кремний.
1.Реагенты Гриньяра в эфирном растворе с тетрагалогенсиланами (а также тетраалкоксисиланами) дают частично или полностью замещенные силаны. Это наиболее гибкий и широко используемый общин способ получения:

2.Реакция алкилгалогенидов непосредственно с элементарным кремнием в присутствии твердого катализатора при нагревании дает смесь алкилсилангалогенидов с преобладанием диалкилдихлорсиланов:

Этот метод широко используется в промышленности для получения диметилдихлорсиланов и метилтрихлорсилана — промежуточных продуктов для синтеза кремнийорганических полимеров.
3.Алкены или алкины с монометилсиланом или другими соединениями, содержащими гидридную связь —Si—H, образуют алкильные или алкенильные соединения кремния без выделения водорода (присоединение кремния и водорода к двойной или тройной связям). Катализаторами служат пероксиды и платипохлористоводородная кислота и др.:

Физические и химические свойства.
Тетраалкилсиланы  обнаруживают большое сходство с углеводородами. Тетраметилсилан
обнаруживают большое сходство с углеводородами. Тетраметилсилан 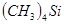 — прозрачная жидкость легче воды, т. кип. 26 °С. У тетраэтилсилана — прозрачная жидкость легче воды, т. кип. 26 °С. У тетраэтилсилана  т. кип. т. кип. 
При хлорировании метилхлорсиланов  (при нагревании на свету) образуется хлорметилхлорсиланы. Алкилхлорсиланы
обнаруживают только формальное сходство с хлоруглеводородами. Они гидролизуются водой, образуя соответствующие гидроксиды. (при нагревании на свету) образуется хлорметилхлорсиланы. Алкилхлорсиланы
обнаруживают только формальное сходство с хлоруглеводородами. Они гидролизуются водой, образуя соответствующие гидроксиды.
Гидролиз триалкилхлорсиланов в присутствии аммиака дает триалкилсиланол:

Силанолы
легко теряют воду и образуют силоксаны:
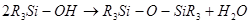
Часто эта реакция идет самопроизвольно, однако для более прочных соединений, таких, как трифенилсиланол, требуется щелочная среда.
Реакция триалкилхлорсиланов с безводным аммиаком или аминами дает силиламины
(слазаны), которые легко гидролизуются:

Силанолы не этерифицируются кислотами. При действии на силанолы хлорангидридов кислот получаются не эфиры, а хлорпроизводные, как что происходит и с третичными спиртами:
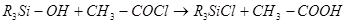
Получить ненасыщенные соединения при отщеплении воды от силанолов или HCI от алкилхлорсиланов не удалось.
Гидролизом диалкилдихлорсиланов 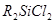 получают силандиолы,
нерастворимые в воде, но растворимые в водной щелочи: получают силандиолы,
нерастворимые в воде, но растворимые в водной щелочи:

Силандиолы легко теряют воду, образуя соединения, которые часто называют силиконами.
В результате межмолекулярного отщепления воды происходит конденсация многих молекул и в случае диметилсиландиола образуется бесцветное масло, представляющее собой смесь примерно равных количеств циклических полимеров (циклополисилоксанов) и линейных полимерных диолов:

В 1939 г. К. Л. Андрианов обратил внимание на возможность использования этих масел в качестве электроизоляционных материалов. Эти масла отличаются большой термической стойкостью (250 °G) и существенно не изменяют вязкости в интервале температур от -60 до +60 °С. Они применяются в качестве смазок специального назначения. При изменении условий приготовления и последующей обработки продукта может быть получен материал со свойствами, напоминающими каучук — силиконовый каучук, силастик. Силиконовый каучук, подвергнутый обработке окислителями, образует трехмерную структуру, аналогичную вулканизатам каучука. Силиконовые каучуки обладают высокими электроизоляционными качествами и большой термостойкостью и морозостойкостью. Они сохраняют эластичность в интервале температур от -60 до +200 °С. Прочность силиконовых каучуков на разрыв невелика — всего 20 — 30 кг/см" (2 — 3 МПа), в то время как прочность натурального и некоторых синтетических каучуков около 200 кг/см2
(20 МПа). Введение наполнителей (диоксид кремния) повышает прочность на разрыв до 120 кг/см" (12 МПа).
Алкилтрихлорсиланы
при гидролизе

образуют алкилсилантриолы
— вещества очень нестойкие: в момент образования они легко дегидратируются с образованием трехмерных полисилоксанов:
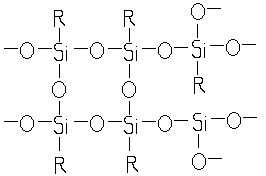
Полисилоксаны
— твердые, хрупкие неплавкие смолы, которые широко применяются в качестве термостойкого электроизоляционного материала; изоляция электрических проводов из алкилполисилоксанов выдерживает температуры до 300 °С. Использование такой изоляции позволяет уменьшить размеры и массу электродвигателей почти в два раза, что особенно важно в автоматике и реактивной технике. Все кремнийорганические материалы не смачиваются водой и сообщают материалам, которые они покрывают, гидрофобность. В последние годы кремнийорганические соединения получают все более широкое применение в органическом синтезе как промежуточные продукты. Триалкилсилильная группировка используется как «защитная группа», которая легко вводится в исходные продукты и легко удаляется из конечных продуктов.
Свинецорганические соединения
— соединения, в которых атом свинца связан с атомами углерода; известны следующих типов:R4
Pb, R3
РЬХ, R3
Pb-PbR3
, R2
PbX2
R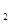 PbO, RPbX3
, PbO, RPbX3
, 
Наибольшее значение имеют R4
Pb. Для двухвалентного свинца известно всего два-три производных ароматического ряда: Аг2
РЬ.
Свинецорганические соединенияполучают:
1) Типа Alk4
Pb и Аг4
РЬ с помощью магний и литийорганических соединений:
2RMgX+ РЬХ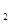 ,----> ,---->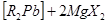

Часто реакция может быть остановлена на стадии гексаарилдиплумбана, а в некоторых случаях удавалось выделить и нестабильный диарилсвинец.
2) Взаимодействием сплава PbNaс галогеналкилами (технический способ получения тетраэтилсвинца):
4RbNa + 4RX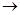 R4
Pb +4NaX +ЗРЬ R4
Pb +4NaX +ЗРЬ
3) С помощью ртутьорганических соединений, напр.:

это позволяет получить свинецорганические соединения с чувствительными к действию реактива Гриньяра заместителями (напр., NO2
, СOOR и др.).
4) Свинецорганические соединения с меньшим числом радикалов из свинецорганических соединений, содержащих четыре радикала:

Свинецорганические соединения менее устойчивы (термически, к действию света, окислителей и минеральных кислот), чем органические соединения олова, сурьмы и мышьяка. PbAlk4
— ядовитые жидкости, при нагревании разлагаются с выделением свинца и образованием свободных радикалов, судьба которых может быть различной:

РЬ (СН3
)4
часто используют как источник метильных радикалов. РЬАг4
— кристаллические вещества, более устойчивы термически, чем их алкильные аналоги, но легче расщепляются кислотами и галогенами. Свинецорганические соединения типа  в жирном ряду — жидкости, в ароматическом— кристаллические вещества. Они присоединяют галогены с разрывом РЬ — Pbсвязи и образованием R3
PbX— кристаллические плохо растворимых соединений, гидролизующихся с образованием слабых оснований R в жирном ряду — жидкости, в ароматическом— кристаллические вещества. Они присоединяют галогены с разрывом РЬ — Pbсвязи и образованием R3
PbX— кристаллические плохо растворимых соединений, гидролизующихся с образованием слабых оснований R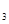 PbOH. Окиси типа R2
PbO — нерастворимые порошки, образующие соли с минеральными кислотами. В жидком NH3
свинецорганические соединения типа (R3
Pb)2
образуют R3
PbNa; соединения эти могут служить для синтеза: PbOH. Окиси типа R2
PbO — нерастворимые порошки, образующие соли с минеральными кислотами. В жидком NH3
свинецорганические соединения типа (R3
Pb)2
образуют R3
PbNa; соединения эти могут служить для синтеза:
R3
PbNa + R'X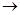 R R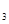 PbR'+NaX PbR'+NaX
Свинецорганические соединения, особенно жирного ряда, очень токсичны. Главное применение нашел тетраэтилсвинец
как антидетонационная добавка в легком моторном топливе.
|