Формально – кинетический анализ гипотез
Кинетический анализ гипотез – важный этап рациональной стратегии, предшествующий планированию кинетического эксперимента с целью дискриминации гипотез. Каждую гипотезу необходимо проанализировать с учётом различных сочетаний быстрых и медленных стадий (приближения квазистационарности, квазиравновесия, возможных лимитирующих стадий), с учётом различной структуры материальных балансов по катализатору, а также природы поверхности в случае гетерогенных катализаторов и состояния комплексов в растворе в случае гомогенного катализа комплексами металлов.
Стехиометрический анализ механизмов.
Теория маршрутов
Первый этап формально-кинетического анализа гипотез о механизме – стехиометрический анализ механизмов. Основой такого анализа является теория маршрутов Хориути-Тёмкина. Важность теории (или метода) маршрутов, позволяющей найти итоговые уравнения реакций, исходя из механизма процесса, а не только на основе материального баланса, видна из следующего примера.
Пример 1. Материальный баланс процесса описывается уравнением (1), а схема механизма – уравнениями (2 – 3):
 (1) (1)
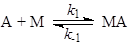 (2) (2)
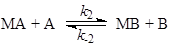 (3) (3)
 (4) (4)
где М – катализатор, МА и МВ – промежуточные вещества.
Если сложить стадии механизма (для стационарных или квазистационарных режимов), промежуточные вещества и катализатор исчезают и получается итоговое уравнение
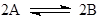 (5) (5)
С позиций стехиометрии и материального баланса уравнения (1) и (5) линейно зависимы. С позиций кинетических скорость реакции превращения А в В есть скорость по итоговому уравнению (5) и именно эта скорость R
, как разность скоростей в прямом (R
+
) и обратном (R
–
) направлениях (R
= R
+
– R
–
) соответствует механизму (2 – 4). При [А], [В] >> [М]Σ
и [М]Σ
>> [МА], [МВ] ([М]Σ
@ [М]) получаем для стационарного или квазистационарного режимов
 (6) (6)
При равновесии (R
+
= R
–
) из (6) получается константа равновесия реакции (5) К
= [А]2
/ [В]2
. Если возникает задача найти скорость прямой реакции, используя скорость обратной реакции и соотношение (7)
 , (7) , (7)
где DG
– изменение изобарно-изотермического (химического) потенциала для итогового уравнения в ходе реакции, то для записи DG
также следует использовать уравнение, вытекающее из механизма, в данном случае, уравнение (5). Соотношение (7) справедливо только для одномаршрутных реакций.
Напомним определения маршрута реакции. Маршрутом реакции называется такая последовательность стадий, входящих в механизм сложной реакции, которая при сложении уравнений стадий, умноженных на особые стехиометрические числа стадий ν
j
, даёт итоговое уравнение, не содержащее промежуточных веществ (интермедиатов) – важнейших участников механизма сложной реакции.
Маршрутом реакции называется также и вектор, компонентами которого являются стехиометрические числа стадий ν
j
. Для механизма (2 – 4) таким вектором являются набор из трёх компонент ν
2
= 1, ν
3
= 1, ν
4
= 1:  = (1, 1, 1). Другой набор стехиометрических чисел = (1, 1, 1). Другой набор стехиометрических чисел  = (0.5, 0.5, 0.5) даёт уравнение А = В, но как мы видели выше, такое итоговое уравнение противоречит кинетике стационарного процесса. = (0.5, 0.5, 0.5) даёт уравнение А = В, но как мы видели выше, такое итоговое уравнение противоречит кинетике стационарного процесса.
Число линейно-независимых маршрутов определяется по уравнению Хориути (8)
P
= S
– I
+ W
, (8)
где I
– общее число интермедиатов, W
– число независимых линейных законов сохранения (число линейных связей между интермедиатами) NI
= I
– W
. Очевидно, что NI
= rank BX
, где BX
– матрица стехиометрических коэффициентов для интермедиатов (BX
– блок стехиометрической матрицы механизма ВМ
).
Для каталитических реакций с одним типом катализатора (или активных центров) W
= 1, т.е. имеется один стехиометрический закон сохранения – материальный баланс по катализатору. В случае двух катализаторов, участвующих в механизме реакции, W
= 2.
Для нахождения векторов стехиометрических чисел  ,т.е. матрицы Г, решается система уравнений ,т.е. матрицы Г, решается система уравнений
 (9) (9)
Для решения системы (9) используем только линейно-независимые столбцы матрицы ВХ
и один вектор из матрицы Г
. Например, для двухмаршрутного каталитического процесса с катализатором М и первым интермедиатом Х1
имеем матрицу ВХ
(rank BX
= 2) S
= 4 и вектор 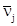 . .
 
Получим 2 уравнения:
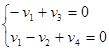 (10) (10)
Для решения системы двух уравнений с четырьмя неизвестными разделим переменные на независимые, значения которых задаём, и зависимые
 . (11) . (11)
При таком разделении системы уравнений следует проверить, чтобы определитель левой части D
≠ 0, иначе система не будет иметь решения. Для удобства нахождения значений ν
1
и ν
2
(при заданных ν
3
и ν
4
), систему (11) приводят к единичному базису (метод Жордано-Гаусса) так, чтобы каждое уравнение слева имело одно неизвестное. Так, сложив уравнения в системе (11), получим ν
2
= ν
3
+ ν
4
и система (11) примет вид (12)
 (12) (12)
Задавая ν
3
= 1 и ν
4
= 0, получим ν
1
= 1 и ν
2
= 1, т.е. 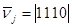 для первого маршрута. При ν
3
= 0 и ν
4
= 1 ν
1
= 0 и ν
2
= 1 и для первого маршрута. При ν
3
= 0 и ν
4
= 1 ν
1
= 0 и ν
2
= 1 и  для второго маршрута. При ν
3
= 0 и ν
4
= 0 все решения будут нулевыми. для второго маршрута. При ν
3
= 0 и ν
4
= 0 все решения будут нулевыми.
Пример 2. Рассмотрим пример нелинейного механизма.
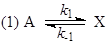 (13) (13)
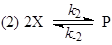
Здесь одно линейно-независимое промежуточное соединение Х
(NI
= 1), 2 стадии (S
= 2) и один маршрут Р
= 2 – 1 = 1. Матрицу стехиометрических коэффициентов интермедиатов ВХ
запишем вектором-строкой  . Поскольку . Поскольку  , умножим вектор-строку , умножим вектор-строку на вектор столбец на вектор столбец  . Получим одно уравнение . Получим одно уравнение
ν
1
– 2ν
2
= 0, (14)
которое имеет одно линейно-независимое решение. Задав ν
1
= 1, получим ν
2
= 0.5. При ν
1
= 2 ν
2
= 1 и т.д. Если при сложении стадий (1) и (2) (для исключения Х
из итогового уравнения) умножим стадии (1) и (2) на наборы 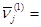 |1 0.5| или |1 0.5| или  |2 1|, получим итоговые уравнения, соответственно, маршрутов N
(1)
и N
(2)
: |2 1|, получим итоговые уравнения, соответственно, маршрутов N
(1)
и N
(2)
:
N
(1)
А = 1/2 Р
N
(2)
2А = Р
Очевидно, что ΔG
(Р)
(по маршруту N
(Р)
) определяется уравнением (15)
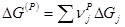 (15) (15)
В соответствии с уравнением (7) для ΔG
(Р)
и для ΔGj
получаем:
 (16) (16)
где  –скорости элементарной стадии в прямом и обратном направлениях. –скорости элементарной стадии в прямом и обратном направлениях.
Для маршрута N
(1)
:
 (17) (17)
Для маршрута N
(2)
:
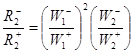 (18) (18)
Примем стадию (1) механизма (13) в качестве лимитирующей, а стадию (2) – квазиравновесной ( ). Тогда при равновесии брутто-процесса ( ). Тогда при равновесии брутто-процесса ( ) получим из уравнения (17) константу равновесия итогового уравнения для маршрута N
(1) ) получим из уравнения (17) константу равновесия итогового уравнения для маршрута N
(1)
 , ,
а из уравнения (18) – константу равновесия маршрута N
(2)
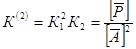 . .
Такие уравнения для К
(1)
и К
(2)
получим и в случае лимитирующей второй стадии.
Если кинетические уравнения получены экспериментально, итоговые уравнения выбираются уже не произвольно. Так, например, для механизма (13), если R
+
µ [A] (стадия (1) лимитирующая), итоговое уравнение, которое получится при равновесии, будет уравнением N
(1)
. Если R
+
µ [A]2
, итоговое уравнение N
(2)
. Поэтому для определения скорости R
-
по известной R
+
(и наоборот) следует использовать соответствующие кинетике итоговые уравнения. Таким образом, кинетика реакции в случае нелинейного механизма может ограничивать выбор маршрута.
Для обратимых стационарных и квазистационарных процессов с линейными механизмами нет ограничений при выборе базиса маршрутов и итоговых уравнений.. Однако итоговое уравнение, как мы видели в случае 2А = 2В, не должно противоречить кинетическому уравнению, следующему из механизма реакции. Для механизмов с необратимыми стадиями формально также можно использовать любые наборы  , включая и отрицательные ν
j
для необратимых стадий. Вместе с тем, в согласии с физическим смыслом целесообразно выбирать такие базисы маршрутов, чтобы и маршрут и скорость по маршруту относились к термодинамически и кинетически разрешенному направлению реакции (направление необратимых стадий). , включая и отрицательные ν
j
для необратимых стадий. Вместе с тем, в согласии с физическим смыслом целесообразно выбирать такие базисы маршрутов, чтобы и маршрут и скорость по маршруту относились к термодинамически и кинетически разрешенному направлению реакции (направление необратимых стадий).
Для нелинейных одномаршрутных механизмов, имеющих лимитирующую стадию, можно получить выражения для скорости лимитирующей стадии в прямом и обратном направлениях, но в этом случае выбор итогового уравнения будет определяться природой лимитирующей стадии.
Получив матрицу Г
, найдём итоговое уравнение, т.е. матрицу стехиометрических коэффициентов итоговых уравнений ВР
,
 или или 
и уравнения, связывающие скорости по веществу RN
и скорости по маршруту RP
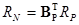 . .
Поскольку  , получим , получим  или или  .
Домножив обе части полученного матричного уравнения слева на В
N
, получим уравнение (19) .
Домножив обе части полученного матричного уравнения слева на В
N
, получим уравнение (19)
Г
RP
= Wj
, (19)
называемое условием стационарности стадий Хориути - Тёмкина. Это уравнение устанавливает связь между скоростью стадии и скоростью по маршруту и показывает, как стадии механизма перераспределяются по маршрутам. Кроме того, уравнение (19) можно использовать и для вывода уравнений для скоростей Ri
и RP
(аналогично методу Боденштейна), поскольку система (19) содержит S
уравнений и S
неизвестных (S
= NI
+ P
). Условие стационарности стадий (19) эквивалентно условию Боденштейна
 . (20) . (20)
Из (20) и (19) получаем уравнение (9), используемое для нахождения базиса маршрутов

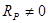  . .
Пример 3. Механизм гидрирования этилена (21) на поверхности твердого металлического катализатора опишем последовательностью четырех элементарных стадий:
 (21) (21)

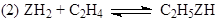



NI
= rankBX
= 2 (есть один закон сохранения,  ). Следовательно, P
= S
– NI
= 2. Найдем матрицу Г
. Для этого запишем систему уравнений ). Следовательно, P
= S
– NI
= 2. Найдем матрицу Г
. Для этого запишем систему уравнений  . Возьмем два независимых столбца (Z, ZH2
) (см. уравнения (10 – (12)) . Возьмем два независимых столбца (Z, ZH2
) (см. уравнения (10 – (12))
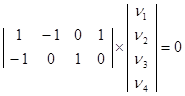
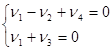  
Задавая n
3
и n
4
, получим два вектора n
j
для двух маршрутов, т.е. матрицу Г
:

Зная Г
, найдем BP
и итоговые уравнения маршрутов BP
= Г
T
BN
.

Итоговые уравнения для обоих маршрутов одинаковы
I) H2
+ C2
H4
= C2
H6
II) H2
+ C2
H4
= C2
H6
В этом случае
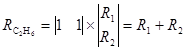
Поскольку стадия механизма (4) обратима, можно взять другую комбинацию маршрутов:


Получим другую матрицу BP
:

и новые итоговые уравнения:
I) H2
+ C2
H4
= C2
H6
II*
) 0 = 0
Второй маршрут (II*
) называют пустым маршрутом. Скорость реакции по пустому маршруту не равна нулю. Это скорость перехода интермедиатов:

по циклической последовательности стадий. Скорости  , ,  , ,  по пустому маршруту равны нулям. по пустому маршруту равны нулям.  , ,  , ,  . .
Ранг матрицы BP
, т.е. базис QP
итоговых уравнений, для маршрутов I и II равен 1 (QP
= rankBP
= 1). Во втором случае (I и II*
) число ненулевых итоговых уравнений равно QP
. Такой базис маршрутов называется “стехиометрическим базисом” маршрутов (число пустых маршрутов равно P
– QP
).
На данном множестве реагентов и продуктов мы имеем максимальный базис итоговых (брутто) реакций по стехиометрическому правилу Гиббса
 , (22) , (22)
где N
– общее число участников, Н
– атомная матрица. Сравнение Q
max
с базисом итоговых уравнений маршрутов QP
дает неравенство:
Q
max
≥ QP
, (23)
при этом, QP
≤ P
, Q
max
≥ P
.
В рассмотренном выше примере №1 Q
max
= 1, QP
= 1, Р
= 2.
Пример 4. Рассмотрим более сложный случай пятистадийного цепного процесса пиролиза этана.
(1) 
(2) 
(3) 
(4) 
(5) 

rankBX
= 3 P
= S
– NI
= 5 – 3 = 2
Произведение  дает три уравнения: дает три уравнения:

Возьмем n
4
и n
5
в качестве независимых переменных и преобразуем систему уравнений:

Определитель левой части D
¹ 0. Задавая n
4
= 1, n
5
= 0 и n
4
= 0, n
5
= 1, получаем матрицу Г
для Р
= 2 и матрицу BP
:
 
I) C2
H6
= C2
H4
+ H2
Q
P
= rankBP
= 2
II) 2C2
H6
= C2
H4
+ 2CH4
Q
max
= 2
Приближения квазистационарности и квазиравновесия
При выводе кинетических уравнений часто используют различные допущения о соотношениях скоростей стадий, поскольку скорости элементарных стадий могут сильно различаться по величине. Например, скорости стадий адсорбции и химических превращений на поверхности катализатора. Важное допущение – о наличии медленных и быстрых стадий. Быстрые обратимые стадии являются квазиравновесными (РЕ – preequilibrium), а допущение о наличии таких стадий – приближением квазиравновесия. В закрытых системах особенно для каталитических реакций используют допущение о квазистационарности концентраций интермедиатов (SS – steady - state, допущение Боденштейна). Критерии применимости этих допущений рассмотрены в учебном пособии О.Н. Тёмкина, К.Ю. Одинцова и Л.Г. Брука “Приближения квазистационарности и квазиравновесия в химической кинетике”, М., МИТХТ, 2001г. Здесь приведем условия реализации различных приближений для простой схемы:
 (24) (24)
Необходимым и достаточным условием реализации приближения Боденштейна (SS) является условие С
Х
<< С
А
(ΣС
Xi
<< C
A
). Из этого условия следует и условие
 (25) (25)
которое реализуется при  Условие SS может одновременно совпадать с условием квазиравновесия первой стадии (PE). Условие SS может одновременно совпадать с условием квазиравновесия первой стадии (PE).
Для одномаршрутных механизмов единственную медленную стадию (все остальные квазиравновесные) называют лимитирующей стадией. Критерием условия квазиравновесия для механизма (24) является соотношение (26)
 (26) (26)
Из анализа соотношений констант k
1
, k
-1
и k
2
, приводящих к ε
1
<<1 и ε
2
<<1, сделан вывод, что при значительном различии ki
(не менее, чем в 10 раз) имеется всего 6 вариантов соотношений констант и по 4 случая реализации режимов SS (ε
1
<<1) и РЕ (ε
2
<<1).
Таблица 1. Соотношения констант скорости и режимы протекания процесса (24).
| №
варианта
|
Соотношения ki
|
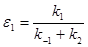
|

|
Режим
|
Лимитирующая стадия
|
| I
|
k
2
>>k
1
>>k
-1
|
<<1
|
>>1
|
SS
|
1
|
| II
|
k
2
>>k
-1
>>k
1
|
<<1
|
>>1
|
SS
|
1
|
| III
|
k
1
>>k
2
>>k
-1
|
>>1
|
<<1
|
PE *
|
2
|
| IV
|
k
1
>>k
-1
>>k
2
|
>>1
|
<<1
|
PE
|
2
|
| V
|
k
-1
>>k
2
>>k
1
|
<<1
|
<<1
|
SS, PE
|
2
|
| VI
|
k
-1
>>k
1
>>k
2
|
<<1
|
<<1
|
SS, PE
|
2
|
Как мы видим, сильными условиями
режима SS являются условия k
2
>>k
1
, k
-1
(I, II) и k
-1
>>k
1
(V, VI), делающие ε
1
<<1, в первом случае за счёт быстрого превращения Х, а во втором – за счёт очень маленькой К
1
= k
1
/ k
-1
.
Вариант III является режимом PE*
( ε
2
<<1), но при большой разнице констант. При десятикратном различии констант режим РЕ устанавливается позднее, чем в других случаях (при большом значении выхода продукта Р), по существу на завершающем этапе процесса.
Рассмотренные 6 крайних случаев полезно дополнить вариантами реализации режимов SS и РЕ при условии равенства (близости) констант. Случай близости всех констант k
1
≈ k
-1
≈ k
2
не соответствует критериям SS и РЕ – приближений. При попарном равенстве констант имеем ещё 5 случаев (таблица 2).
Таблица 2. Соотношения констант скоростей и режимы протекания процесса.
| №
варианта
|
Близкие константы
|
Соотношения ki
|

|

|
Режим
|
Лимитирующая стадия
|
| VII
|
k
1
≈ k
-1
|
k
2
>> k
1
≈ k
-1
|
<< 1
|
>> 1
|
SS
|
1
|
| VIII
|
k
1
≈ k
-1
|
k
2
>> k
1
≈ k
-1
|
≈ 1
|
<< 1
|
PE
|
2
|
| IX
|
k
2
≈ k
-1
|
k
1
<< k
-1
≈ k
2
|
<< 1
|
≈ 1
|
SS
|
1
|
| X
|
k
2
≈ k
-1
|
k
1
<< k
-1
≈ k
2
|
>> 1
|
<< 1
|
PE *
|
2
|
| XI
|
k
1
≈ k
2
|
k
-1
>> k
1
≈ k
2
|
<< 1
|
<< 1
|
SS, PE
|
2
|
*
Режим РЕ при k
1
/ k
-1
≥ 100
При близости констант k
2
и k
-1
также, как и в варианте III, режим не является строго квазиравновесным (соотношение С
Х
/ С
А
= α
не постоянно в ходе процесса). При равенстве k
1
= k
2
достигается режим квазистационарности в условиях квазиравновесия. Таким образом, приближение SS выполняется:
- при k
2
>> k
1
(I, II, V, VII, VIII, IX);
- при k
1
>>k
2
(VI);
- при k
1
≈ k
2
(XI).
Приближение РЕ выполняется:
- при k
2
>> k
1
(V);
- при k
1
>>k
2
(IV, VI, VIII и III, X при больших значениях k
1
/ k
–1
);
- при k
1
≈ k
2
(XI).
Экспериментальными критериями режима SS являются следующие:
1) С
Х
/ С
А
= α
<< 1 Проверяется экспериментально в результате анализа материального баланса, который должен выполняться с погрешностью эксперимента

2)  Соотношение легко проверяется экспериментально. Величина delta
Соотношение легко проверяется экспериментально. Величина delta

не должна превышать ошибки эксперимента на большом интервале времени при выходе продукта (на С
А
0
) до 70 – 90%.
3) В случае гомогенных каталитических реакций при  ошибка SS-приближения не превышает 1%. ошибка SS-приближения не превышает 1%.
4) В гетерогенном катализе в закрытой и открытой системах количество молей вещества в газе ( ) должно быть больше количества вещества на поверхности ( ) должно быть больше количества вещества на поверхности ( ): ):
 . .
В этом случае 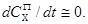
|